La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Grupo de Esclerosis Múltiple de la Sociedad Chilena de Neurología, Psiquiatría y Neurocirugía.
Durante el período de la vejez surge una gran paradoja entre la inmunodeficiencia, la inflamación crónica y la autoinmunidad. Los adultos mayores son susceptibles a presentar morbilidad y mortalidad por infecciones, dada la inmunodeficiencia de base, y además tienen un estado de inflamación crónica y mayor tendencia a desarrollar patología autoinmune. La inmunosenescencia es un estado que se caracteriza por profundos cambios en el sistema inmune, asociados con la edad, que se manifiestan principalmente por disminución y desrregulación de la respuesta inmune antígeno-específica o adquirida, con la consecuente pérdida de la habilidad para distinguir lo propio de lo ajeno. La respuesta inmune innata se mantiene relativamente conservada, hay algunas alteraciones, pero son mínimas.
La inmunidad adquirida se caracteriza por su carácter específico y por tener memoria, ser autolimitada y tolerante. La especificidad permite reconocer una amplia gama de antígenos y diferenciarlos de los propios; la capacidad de memoria garantiza una respuesta más rápida y eficaz frente a una segunda exposición al antígeno. La respuesta inmune tiene que ser autolimitada, de manera que, una vez eliminado el antígeno, esta respuesta inflamatoria vuelva a su estado basal; y también debe ser tolerante, es decir, reconocer y reaccionar frente a antígenos ajenos y no frente a antígenos propios. Por supuesto, cualquier alteración de estas características puede llevar al desarrollo de autoinmunidad.
Respecto a la especificidad, existe una amplia gama de linfocitos que tienen la capacidad de discriminar entre mil y cien mil millones de determinantes antigénicos distintos, es decir, el ser humano es capaz de reconocer una gran variedad de antígenos. Esta característica se altera durante la vejez, en la que disminuyen los linfocitos vírgenes periféricos, disminuye la diversidad y aumentan las células B y T de memoria por una expansión oligoclonal de estos linfocitos de memoria. La disminución de los linfocitos T vírgenes se debe principalmente a la involución del timo, que es el evento inicial en el envejecimiento del sistema inmune; el timo puede producir linfocitos de novo hasta los 40 años, pero después de esa edad el tejido tímico es reemplazado por tejido graso y conjuntivo y se interrumpe la producción de linfocitos T vírgenes, lo que lleva a una disminución de los linfocitos T productores y se mantienen sólo aquellos circulantes, que no han estado expuestos a los antígenos. Además, hay menos células progenitoras a nivel de médula ósea, con la consecuente disminución de linfocitos B.
Esta disminución de los linfocitos T periféricos conduce a un aumento de los linfocitos T de memoria, como mecanismo compensatorio, pero este aumento compensatorio, por desgracia, causa una acumulación de linfocitos T de memoria oligoclonales: no existe una variedad de linfocitos capaces de responder a distintos antígenos, porque las poblaciones de linfocitos T de memoria ya han sido estimuladas por un antígeno particular. Se ha descrito que lo anterior también se debe a un efecto acumulativo de infecciones virales persistentes, especialmente en personas portadoras de citomegalovirus, debido a la constante reactivación de linfocitos y a la activación de linfocitos T de memoria, los que al aumentar se tornan autorreactivos y dejan de responder a los mecanismos de control normal de la proliferación.
La disminución del número de linfocitos B se traduce en que disminuye el repertorio de antígenos que los linfocitos B reconocen, se altera la producción de inmunoglobulinas y la respuesta humoral y, al igual que lo que ocurre con los linfocitos T, se produce una expansión oligoclonal de linfocitos B, hecho que puede aumentar la incidencia de malignidad con la edad. El sistema inmune pierde su capacidad de especificidad al disminuir su número específico de linfocitos. Por otro lado, las características de la respuesta inmune de ser autolimitada (volver a su estado de reposo una vez eliminado el antígeno) y tolerante (es capaz de reconocer y no reaccionar frente a antígenos propios) también se alteran.
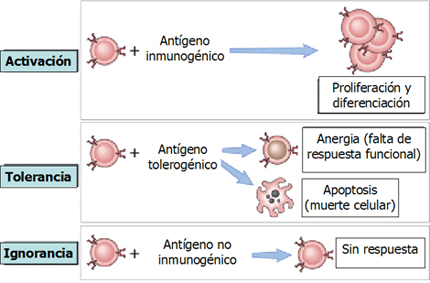
La activación normal de los linfocitos comienza con el reconocimiento del antígeno por el linfocito T (Fig. 1). Las células presentadoras de antígenos (CPA) presentan el antígeno frente a una serie de otras moléculas que coestimulan y llevan a la proliferación y diferenciación de los linfocitos. Cuando los linfocitos son expuestos a antígenos que no presentan moléculas coestimuladoras, se origina una respuesta de tolerancia y los linfocitos pasan a anergia, es decir, no responden desde el punto de vista funcional, no hay proliferación ni diferenciación, o van a apoptosis. Estos son mecanismos de control del sistema inmune a nivel periférico: el linfocito sólo se activa cuando se presentan las condiciones necesarias para que se active. Por otro lado, si los antígenos presentados no superan un umbral determinado, a pesar de su presentación por células presentadoras de antígenos, se origina ignorancia, por falta de respuesta de esta población linfocitaria. Todos estos son mecanismos de tolerancia.
Figura 1. Consecuencia del encuentro de linfocitos con antígenos
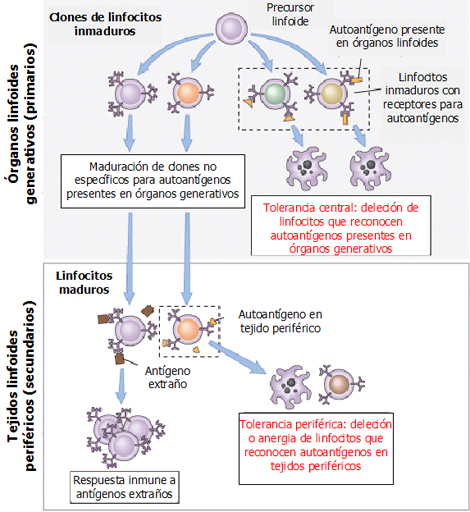
La tolerancia tiene lugar a nivel central y periférico (Fig. 2). A nivel central ocurre principalmente en el timo, pero en el adulto mayor no hay regulación tímica. En sujetos jóvenes, los precursores de linfocitos durante su maduración expresan receptores de antígenos que reconocerán los antígenos presentados en el timo; si estos linfocitos reconocen con fuerza antígenos propios presentados en el timo, el sistema los elimina, ya que serían linfocitos autorreactivos. Luego, sólo quedarían linfocitos capaces de reconocer antígenos presentados por moléculas MHC clase I y II, e incapaces de reconocer antígenos propios; estos son los linfocitos liberados a la periferia. En el sistema inmune periférico, el linfocito maduro, frente a un antígeno, puede inducir una respuesta antigénica cuando se dan todas las condiciones necesarias: puede proliferar y dar una respuesta inmune específica o puede ir a anergia y apoptosis a través de los mecanismos de tolerancia periférica.
Figura 2. Tolerancia central y periférica a antígenos propios
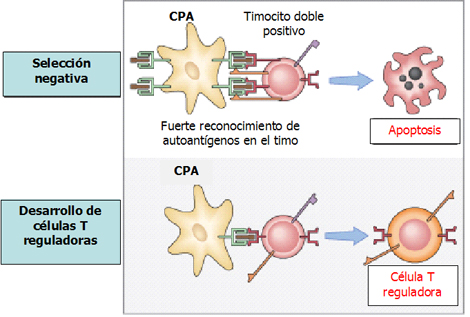
En la tolerancia central aparece en el timo una selección negativa, es decir, los linfocitos que reconocen con fuerza antígenos propios van a apoptosis y sólo quedan los que reconocen antígenos ajenos (Fig. 3). Además, en el timo se origina un grupo importante de linfocitos T reguladores, fundamentales en la regulación de la respuesta inmune tipo Th1 y Th2 y en la inducción de anergia a nivel periférico. Estos linfocitos también disminuyen con la edad, dada la involución del timo.
Figura 3. Tolerancia central de linfocitos T
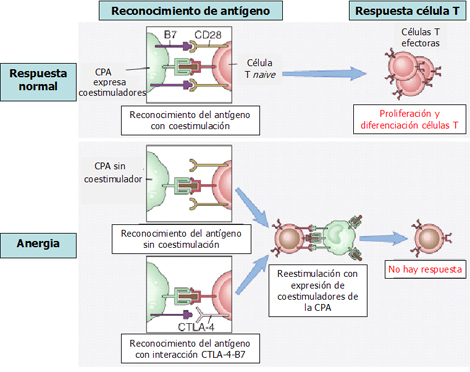
La anergia de los linfocitos T es un mecanismo de tolerancia periférica (Fig. 4). Normalmente la CPA presenta el antígeno a su receptor, que es reconocido por el linfocito T: para inducir una respuesta de proliferación y de diferenciación se necesita la coexpresión de las moléculas B7, por la célula presentadora de antígenos, y CD28, por el linfocito T; la ausencia de expresión de estas moléculas lleva a falta de respuesta y a anergia. Por otra parte, existe la posibilidad de que el linfocito, en vez de presentar el antígeno CD28, ya sea por las condiciones del ambiente o por las citoquinas que regulan la inflamación en ese momento, exprese una molécula llamada CTLA-4, que es inhibitoria. El CD28 estimularía y facilitaría la proliferación y diferenciación hacia la respuesta inmune; en cambio, la expresión de CTLA-4 conduce a inhibición de la respuesta inmune y a ausencia de respuesta, con inducción de apoptosis.
Figura 4. Anergia de linfocitos T
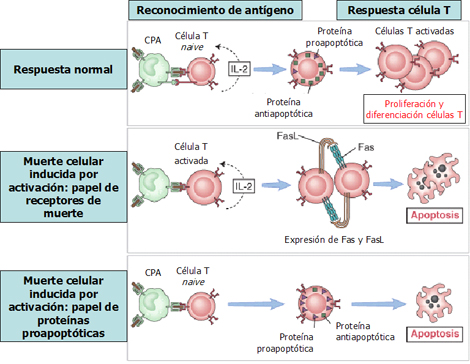
Otro mecanismo en la regulación del sistema inmune es la apoptosis inducida por activación. Una vez que el sistema induce una respuesta inmune, los linfocitos T activados deben volver al estado basal, de manera que la inflamación no continúe en forma crónica, una vez eliminado el antígeno. Una célula presentadora de antígeno (Fig. 5) presenta el antígeno en presencia de moléculas coestimuladoras; por lo tanto, estimula el linfocito T virgen o naive circulante en la periferia, que es capaz de reconocer el antígeno específico, pero que todavía no se ha estimulado, e induce proliferación y diferenciación. Cuando el linfocito T activado se vuelve a encontrar con una célula presentadora de antígeno, ésta induce la expresión de moléculas de superficie que inducen apoptosis, las llamadas Fas y ligando de Fas (FasL). La expresión de dichas moléculas induce apoptosis y muerte celular; por lo tanto, no sólo hay un control primario en el momento que el linfocito naive se expone por primera vez al antígeno, sino que también hay un control posterior, en que los linfocitos ya activados expresan moléculas de superficie que los llevan a la muerte celular si son activados de nuevo, para no perpetuar la inflamación. Los receptores de superficie o las proteínas intracelulares que alteran la expresión génica del linfocito pueden inducir la apoptosis.
Figura 5. Muerte de linfocitos T inducida por activación
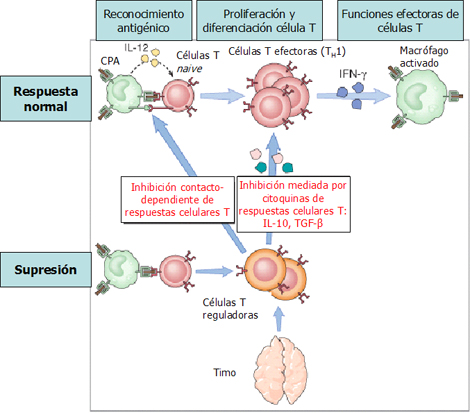
En el timo se produce una serie de linfocitos o células T reguladoras, que son liberadas en forma constante a la circulación y son muy importantes para regular el grado de inflamación que causa un antígeno. En la respuesta normal, el linfocito se activa y se induce el linfocito T efector (Fig. 6); en este caso se produce la inducción de una respuesta tipo Th1, una respuesta citotóxica que activa macrófagos e induce la actividad citolítica, fagocitosis y secreción de citoquinas, las que llevan a la destrucción celular. La presencia de otros linfocitos puede regular esta respuesta; en este caso son linfocitos reguladores secretados por el timo, que actúan mediante la secreción de interleuquinas (IL) antiinflamatorias, como la IL-10 y TGF-beta, importante en patologías autoinmunes, sobre todo en esclerosis múltiple. La mayor expresión de citoquinas antiinflamatorias contrarresta la respuesta tipo Th1. A su vez, es posible inducir la anergia e inhibir la respuesta simplemente por contacto de célula a célula, por medio de la expresión de receptores e inhibición de esa respuesta. En consecuencia, el papel del timo es fundamental en la regulación de la respuesta inmune.
Figura 6. Supresión de respuesta inmune mediada por linfocitos T
En el adulto mayor no hay timo, por lo que disminuye la secreción de linfocitos periféricos y de linfocitos reguladores. También disminuye la expresión del ligando o receptor de superficie CD28, que es la molécula coestimuladora necesaria para inducir la proliferación y diferenciación; por lo tanto, no debería haber activación ni proliferación de linfocitos, pero esto no es así, sino que se acumulan linfocitos T CD28 negativos, que llegan a constituir 80% a 90% de la población de CD8 en los adultos mayores. Estos linfocitos se hacen autorreactivos y pueden proliferar y diferenciarse en forma independiente de este ligando; y así se pierde otro mecanismo de regulación de la inflamación. A su vez, su respuesta proliferativa es menor, lo que se compensa con una capacidad citotóxica normal y resistencia a la apoptosis. Lo anterior los convierte en linfocitos autoreactivos, independientes de la presencia de un ligando coestimulador y no van a la muerte celular, lo que determina una permanente inducción de respuesta inmune y liberación de citoquinas inflamatorias, lo que explicaría la inflamación persistente que se observa en el adulto mayor y es una posible causa de los fenómenos de autoinmunidad.
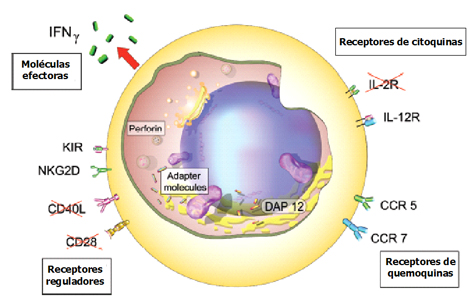
En los linfocitos senescentes se producen alteraciones en la expresión génica de receptores de superficie, citoquinas secretadas y sus receptores, moléculas efectoras y reguladores transcripcionales (Fig. 7). En cuanto a la alteración en la expresión de receptores en la superficie linfocitaria, cuando los linfocitos son activados expresan una serie de receptores de superficie, que son necesarios para la regulación de la sinapsis inmunológica, adherencia a endotelios, secreción de citoquinas y producción de la respuesta inmune. Con la edad no sólo se pierden las moléculas necesarias para la coestimulación CD28 y CD40, sino que además se expresan receptores propios de las células natural killer, presentes en la inmunidad innata; esto los lleva a ser linfocitos no antígeno específicos, por lo tanto responden a una serie de antígenos variados, como ocurre en la respuesta innata no específica, y son más autorreactivos. Por otra parte, las moléculas efectoras varían, tendiendo a secretar mayor cantidad de interferón gamma, perforinas y granzimas, citoquinas que se utilizan en la respuesta inmune innata y que tienden a aumentar el grado de destrucción celular. También cambia la expresión de receptores de citoquinas y de distintas quemoquinas.
Figura 7. Cambios funcionales y fenotípicos en linfocitos T senescentes
Como se ha dicho, con la edad el linfocito deja de ser un linfocito antígeno-específico, pierde la capacidad de ser tolerante y de inducir una respuesta autolimitada, lo que facilita la autoinmunidad y la inflamación crónica. En el sistema nervioso central (SNC) no sólo se observa esta alteración inmunitaria, sino que también cambian factores locales: se activa la microglia y los macrófagos, que aumentan su actividad fagocítica y la expresión de moléculas MHC II. En el cerebro joven no hay expresión de moléculas MCH I ni II, a menos que se active la microglia y los macrófagos; con la edad, esta expresión se torna más constante y, por tanto, aumenta la capacidad de los linfocitos de reconocer antígenos propios en el SNC. A su vez, aumenta la secreción de citoquinas proinflamatorias, que facilitan la rotura de la barrera hematoencefálica, la permeación de linfocitos y la activación de la respuesta inmune. Por lo tanto, hay mecanismos locales del tejido y del sistema inmune que favorecen una mayor activación con el envejecimiento.
En relación con esclerosis múltiple, no hay estudios anatomopatológicos que demuestren lo que sucede. En un modelo animal de encefalitis en ratones, que es el modelo animal de esclerosis múltiple, Teuscher y sus colaboradores comprobaron una asociación con el locus eae36 en el cromosoma 4 en ratones que padecen la enfermedad, después de las 12 semanas, que equivaldría en los seres humanos a una edad superior a 50 años (1); describieron una relación inmunogenética distinta entre los ratones que padecían la enfermedad en forma temprana y los que la sufrían en forma tardía (Teuscher C et al. eae36, a locus on mouse chromosome 4, controls susceptibility to experimental allergic encephalomyelitis in older mice and mice immunized in the winter. Genetics 2006; 172(2): 1147-1153).
Este es sólo un modelo animal y está muy lejos de ser extrapolable al hombre, pero da una idea de que las alteraciones del sistema inmune pueden ser reguladas también por locus genéticos que determinan un envejecimiento precoz del sistema inmune, como se ha visto en la artritis reumatoide. En pacientes con esta patología se ha demostrado un envejecimiento más precoz e intenso cuando se comparan con pacientes sanos de la misma edad, así que podría haber alguna relación de este tipo.







 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Grupo de Esclerosis Múltiple de la Sociedad Chilena de Neurología, Psiquiatría y Neurocirugía.
 Expositora:
Claudia Cárcamo[1]
Expositora:
Claudia Cárcamo[1]

Citación: Cárcamo C. Late-onset multiple sclerosis II. Medwave 2006 Sep;6(9):e2343 doi: 10.5867/medwave.2006.09.2343
Fecha de publicación: 1/10/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión