Monografía editada por:
The Foundation for Alternative Transfusion Practices
Hospital Clínico Universidad de Chile
Sociedad Chilena de Medicina Intensiva.
Aproximadamente dos tercios de las transfusiones son administradas en el perioperatorio (1). En 1988, el Panel de Consenso del Instituto Nacional de Salud de Estados Unidos (NIH) reportó que no existe información que respalde un criterio único de valor de hemoglobina menor de 10 g/dl para la transfusión perioperatoria y recomendó ahondar en el estudio de los criterios de transfusión perioperatoria. Muy pocos estudios prospectivos han investigado sobre este tema. Una revisión reciente sugiere que un valor de hemoglobina umbral de 8 g/dl debiera usarse en pacientes quirúrgicos sin factores de riesgo de isquemia de tejidos y un valor de 10 g/dl sería adecuado para aquéllos con factores de riesgo (2).
En pacientes pediátricos es muy escasa la información disponible con relación a criterios de transfusión y en general con respecto a alternativas a la sangre alogénica. Los niños tienen problemas especiales con relación a la terapia transfusional. Por ejemplo, poseen un volumen circulatorio pequeño con relación a las pérdidas quirúrgicas o por flebotomía y esta última es causa de anemia severa en lactantes prematuros.
De la totalidad de pacientes hospitalizados, los lactantes prematuros son los más frecuentemente transfundidos (3). Como en los adultos, los valores de hematocrito y hemoglobina son medidas inadecuadas de transporte de oxígeno, sin embargo son utilizados habitualmente en este sentido como argumento para determinar una transfusión de glóbulos rojos (4).
Existen dos tipos de anemia que se encuentran en el lactante prematuro. La primera es de inicio precoz y es secundaria a una gran pérdida por flebotomía que usualmente es tratada con transfusiones. La segunda es una epidemia en las UCI neonatales en Estados Unidos y es de inicio tardío, ocurre entre 4 y 12 semanas de vida y se caracteriza por una caída gradual de los hematocritos y un bajo recuento de reticulocitos.
En el año 1989 los prematuros de menos de 1500 gramos recibían 8 a 10 transfusiones en su hospitalización inicial; hoy día son reportadas dos transfusiones. Sin embargo, más de 90% de los niños con peso de nacimiento menor de 1 Kg son transfundidos con glóbulos rojos. En cambio, menos del 40% de aquellos que pesan más de 1,5 Kg reciben transfusiones de glóbulos rojos. Aún es una cifra importante y la mayor parte de las transfusiones en el neonato ocurren dentro de las primeras 3 ó 4 semanas de vida (5,6,7). En el futuro los estudios clínicos establecerán un nivel apropiado objetivo de hemoglobina para los infantes basados en medidas objetivas tales como la entrega de oxígeno tisular y el metabolismo aeróbico.
Después de varias décadas de debates todavía estamos esperando el estudio riguroso que proporcionará una guía racional para terapia de transfusión de todos los neonatos con anemia, ya sean ventilados o no. Las prácticas de transfusión varían mucho entre médicos al igual que entre instituciones y en los adultos. Existe una gran variabilidad de médico a médico y de institución a institución. Sin embargo, se ha podido observar una disminución en los valores de hemoglobina y hematocrito que gatillan una transfusión en lactantes prematuros (8).
En el Englewood Hospital de New Jersey, los niños de pretérmino manejados sin pautas de transfusión tenían en el pasado una alta probabilidad de recibir una transfusión. En 1999 se creó un solo estándar y fue capaz de reducir la transfusión en una UCI neonatal en más de un 50% en seis meses.
Hay diversos enfoques para limitar la cantidad de sangre que se extrae para pruebas de laboratorio. Se puede reducir la cantidad de sangre de las líneas arteriales o centrales antes de que la muestra se obtenga. El uso de circuito cerrado permite el retorno de la muestra inicial de espacio muerto y no afecta la precisión del examen. El uso de microtesteo al lado de la cama del paciente (point of care) en el que se toma una gota de sangre (100 microlitros) reduce significativamente la cantidad de sangre utilizada v/s un procedimiento analítico.
Un 25% de la sangre que se saca en una UCI neonatal es innecesaria. Un 40% de la sangre que se extrae es para análisis de gases sanguíneos y electrolitos que son repetidos a través del día a pesar de que ahora podemos obtener mucha información de manera no invasiva. Un menor umbral de transfusión, disminución en pérdidas por flebotomía y clampeo tardío del cordón en el parto se asocian con menor administración de transfusión (9, 10). Las pruebas de laboratorio en lote mediante el point of care (varias pruebas que se llevan a cabo simultáneamente) tienen también un significativo impacto en la pérdida de sangre en el neonato.
Con respecto al uso de eritropoyetina humana recombinante (rHuEPO) en neonatos, el ensayo multicéntrico de Shannon y colaboradores es destacable ya que demuestra en forma clara la disminución de transfusión asociada al uso de eritropoyetina en neonatos de pretérmino y por su adherencia a estrictas normas de transfusión (11). Este estudio publicó normas para neonatos sometidos a cirugía y muchos centros pediátricos las han adoptado (12, 13).
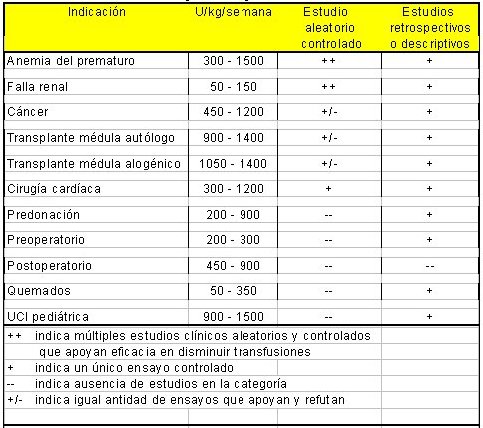
Más de 40 estudios sobre el uso de eritropoyetina para el tratamiento de la anemia en lactantes prematuros han sido publicados. Un metaanálisis de ensayos clínicos controlados halló solamente cuatro de alta calidad y concluyó que el uso de eritropoyetina disminuye el uso de transfusión de eritrocitos en un promedio de 11 ml/kg por neonato (14, 15, 16). El uso de la eritropoyetina debiera ser ya un estándar de cuidado universal en todos los neonatos de pretérmino (Tabla I).
Tabla 1. Eficacia de la eritropoyetina humana recombinante en pacientes pediátricos.
Como es común en los adultos, los niños han sido tratados con rHuEPO para tratar la anemia de la insuficiencia renal crónica. Los trabajos clínicos controlados soportan el uso de rHuEPO tanto en pacientes en hemodiálisis y peritoneodiálisis. Como también ocurre en los adultos, existe una serie de inhibidores de la eritropoyesis en los pacientes pediátricos con insuficiencia renal como las infecciones, el aluminio, la hipoplasia de la médula ósea, la hemólisis, el hipoparatiroidismo y la disminución de la disponibilidad de hierro (17, 18).
La absorción de las sales de hierro disminuye con los compuestos de calcio, el bicarbonato y los antiácidos. Es por esta razón que hemos usado hierro endovenoso en algunos pacientes a pesar de la ausencia de licencia o trabajos controlados que lo avalen.
La eritropoyetina ha sido usada con éxito en niños con tumores sólidos y con algo de eficacia en niños con enfermedad maligna hematológica. Los ensayos prospectivos controlados de rHuEPO en niños con tumores sólidos muestran una mayor efectividad de la eritropoyetina en aumentar el nivel de hemoglobina y a provocar una disminución significativa o una tendencia a la disminución del uso de transfusiones de hemoderivados (19, 20).
En estudios prospectivos sobre el uso de rHuEPO en trasplante de médula en adultos y en niños, la eritropoyetina acelera la recuperación del hematocrito y disminuye los requerimientos de transfusión en el trasplante alogénico, no así en el trasplante autólogo (21,22).
La emergencia quirúrgica más frecuente en neonatos de pretérmino es la enterocolitis necrotizante (23). En la enterocolitis la anemia es un problema frecuente asociada a sangrado por trombocitopenia, coagulación intravascular diseminada, anemia hemolítica y pérdida de sangre iatrogénica (6, 8, 24, 25). En la enterocolitis el sangrado puede ser intraluminal, intraperitoneal, intracraneal, y/o intrapulmonar (24). Los lactantes con enterocolitis comúnmente reciben concentrados plaquetarios, factores de coagulación y eritrocitos (24, 26).
La incidencia de trombocitopenia es de 65 a 90% en la enterocolitis y de 55 a 80% en la sepsis neonatal (26). La coagulación intravascular diseminada ocurre en 40% de lactantes prematuros con enterocolitis y en 17% de lactantes con septicemia. Habitualmente la coagulación intravascular diseminada es tratada con factores de coagulación (24, 27). Es frecuente la pérdida sanguínea asociada a la coagulación intravascular y a la trombocitopenia presentes en la enterocolitis necrotizante, sin embargo no existen ensayos clínicos de rHuEPO y/o hierro endovenoso en este grupo de pacientes.
Con respecto al umbral de transfusión no existen trabajos controlados que correlacionen bien el nivel de hemoglobina y la extracción de oxígeno en los tejidos en este grupo etáreo. Los cambios hemodinámicos con relación a la concentración de glóbulos rojos han sido recientemente estudiados.
En una cohorte de 38 neonatos de pretérmino (edad gestacional: 29,3, peso: 1.220 g), el gasto ventricular izquierdo se correlacionó negativamente con el hematocrito y positivamente con la edad postnatal tanto en neonatos con ductus cerrado o abierto. Un aumento de 10 puntos porcentuales de hematocrito se asoció a una disminución en el gasto ventricular izquierdo de –55(11) ml/kg/min. El promedio de transporte de glóbulos rojos fue de 132 (30) ml/kg/min. con una variabilidad intra-individual de un 20% (8,8%). El transporte de glóbulos rojos aumentó más frecuentemente con el aumento del gasto ventricular izquierdo que con aumentos en el hematocrito (28).
La correlación negativa entre gasto cardíaco y hematocrito se explica por variaciones en la viscosidad sanguínea y en la resistencia vascular, al igual que lo observado en lactantes con hiperviscosidad policitémica y en modelos animales, al disminuir estas variables se produce un aumento del volumen latido y de la frecuencia cardíaca (29, 30).
La recolección de la sangre del cordón umbilical en neonatos con diagnóstico prenatal de anomalías quirúrgicas ha sido usada con éxito para transfusión autóloga y requiere de una mayor investigación aleatoria y prospectiva (31).
La gran mayoría de los procedimientos quirúrgicos realizados en lactantes y niños están destinados a la reparación de malformaciones cardíacas congénitas. La transfusión sanguínea es frecuente en este grupo de pacientes. Existe un estudio que señala que el predictor más eficiente es la edad del paciente. Los niños de menos de un año de edad reciben 6 transfusiones versus 2 transfusiones en los mayores de 1 año (32).
Es nuestra experiencia en el Hospital Luis Calvo Mackenna que otro predictor lo constituye el peso del paciente, independiente de su edad. Se han pensado diversas alternativas para disminuir la exposición a la sangre alogénica, como por ejemplo disminución del tiempo de circulación extracorpórea, o la ejecución de procedimientos sin CEC (33). Aunque hemos vivido algunas excepciones, es indudable que el volumen de cebamiento del circuito de circulación extracorpórea determina la exposición a sangre alogénica en la mayoría de los niños con menos de 10 kg de peso corporal. Los procedimientos menos invasivos resultan con frecuencia en menor transfusión.
Desde fines de la década del 90 hemos podido apreciar los avances en los procedimientos a través de catéteres: septostomía auricular de Rashkind, embolización con coil de ductus y fístulas arteriovenosas, dilatación con balón de válvulas estenóticas y coartación de aorta, cierre de CIA o CIV mediante paraguas, colocación de stent en vasos sanguíneos, etc. eliminando, disminuyendo o retardando procedimientos quirúrgicos en lactantes y neonatos (34). Aunque no se ha demostrado un menor uso de transfusión, la ligadura del ductus arterioso mediante toracoscopía video asistida ha sido usada en prematuros de hasta 500 gramos de peso, resultando en menor trauma quirúrgico y en una recuperación más rápida (33).
En un estudio prospectivo de cirugía cardíaca sin sangre alogénica se usó eritropoyetina pre y postoperatoria en niños de 5,5 años de edad promedio programados para reparación en CEC. Todos los niños recibieron hierro oral y fueron asignados a tres grupos: alta dosis de EPO, dosis moderada de EPO y hierro solamente. Los circuitos de CEC fueron cebados con cristaloides y la totalidad de la sangre fue devuelta al paciente al terminar el bypass. La totalidad de los niños que recibieron dosis alta de EPO evitaron una transfusión alogénica versus 91% de los que recibieron dosis moderada y 69% de los que no recibieron EPO (35).
Existe un reporte de una reparación de un cortriatriatum en un lactante Testigo de Jehová de 5,3 kg de peso sin sangre alogénica. En este paciente se usó EPO en perioperatorio, priming claro, tubuladura angosta y recortada, y anestesia hipotensiva y en hipotermia (36).
Una serie no controlada de 14 niños Testigos de Jehová, mayores de 6 años, no se usó sangre alogénica en la reparación de defectos cardíacos congénitos. El hematocrito más bajo durante la CEC fue de 15% y el hematocrito postoperatorio más bajo fue de 16% (37).
El uso de hemofiltración convencional y modificada en conjunto con el rescate de la sangre en el circuito constituye una fuente importante de glóbulos rojos en el paciente pediátrico (50 a 150 ml de sangre con hematocrito de 52,7 +/- 9,7%) (38). En nuestra experiencia, revisada en 1998 en el instituto Salvecor, de 274 niños operados de cardiopatía congénita, en 148 no se usó sangre alogénica (edad: 88 +/- 50 meses; peso 26 +/- 13 kg). La cantidad de sangre autóloga usada del circuito de la CEC fue de 336 +/- 170 ml (13 +/- 5 ml/kg) (sin hemofiltrar). Los 126 niños transfundidos tenían edad 28 +/- 41 meses, peso 9 +/- 4 kg y diagnósticos similares.
En otros centros, la autotransfusión de la sangre drenada del mediastino ha sido utilizada con éxito en la cirugía cardíaca pediátrica y del adulto (39).
Las transfusiones son comunes en los pacientes quemados. Los pacientes pediátricos con quemaduras de un 60% o más frecuentemente reciben transfusiones de glóbulos rojos, plasma y plaquetas (40). En nuestro hospital, desde que se usa rutinariamente el hierro oral (5 mg/kg de peso de hierro elemental) en forma de sulfato ferroso, nutrición adecuada y vitaminas, usamos sangre alogénica solo en los grandes quemados.
Para la toma de injertos se usa la inflación previa con oxígeno entre dos torniquetes en la zona donante. Una vez tomado el injerto se aplican compresas con adrenalina. Esto, en conjunto con la monitorización no invasiva y la mínima flebotomía, disminuye la anemización en nuestros pacientes.
La injuria térmica se asocia a una disminución de los niveles plasmáticos de eritropoyetina, por lo tanto el uso de la rHuEPO puede ser capaz de disminuir el volumen de transfusión en los quemados (41). Aunque no existen estudios controlados, podemos citar reportes de casos adultos y pediátricos en los que se ha usado con éxito la rHuEPO evitando la transfusión de sangre alogénica (42, 43, 44).
El poner atención a todos los factores del perioperatorio y a la técnica quirúrgica puede disminuir en forma importante la hemorragia operatoria (45, 46, 47). La estrategia de conservación de sangre incluye aumento de masa globular, el cálculo de la pérdida estimada (todo cirujano debiera poseer una tabulación con estos datos), una revisión cuidadosa del criterio de transfusión para cada paciente (edad, patología concomitante, expectativa de vida, etc.), una simulación del procedimiento a realizar, el uso de instrumentos hemostáticos, el tiempo quirúrgico más breve posible y el uso del umbral de transfusión más bajo posible (46).
El desarrollo de instrumentos hemostáticos y específicos para cada procedimiento, que minimizan la pérdida de sangre, es un proceso continuo (47, 48). En cirugía ortopédica existen algunos estudios que demuestran que la anestesia hipotensiva, la hemodilución y el salvado de células son seguros y disminuyen tanto el sangrado como el uso de sangre alogénica en adolescentes (49). Existe una ausencia de estudios controlados en otros procedimientos quirúrgicos. A pesar del entusiasmo observado, la evaluación de la pérdida de sangre en procedimientos endoscópicos versus abiertos no ha sido realizada.
La hemodilución aguda normovolémica (HAN) consiste en la remoción de sangre total del paciente que se mezcla con anticoagulante (CPDA) inmediatamente previo al procedimiento quirúrgico. La HAN ha sido reportada extensamente en niños (50, 51, 52). Dependiendo del tamaño del paciente, se pueden extraer entre 1 y 4 unidades de sangre.
En nuestro centro este procedimiento se realiza de rutina en cirugía de escoliosis y cardíaca. Durante el proceso de donación el volumen circulante se mantiene mediante el uso de almidón 6% o cristaloides (Ringer lactato o suero fisiológico) (52).
Aunque la mayor parte de los estudios de HAN se realizan en adultos, existe un estudio controlado en adolescentes sometidos a cirugía de escoliosis que muestra que un 79% de los sujetos no hemodiluidos fue transfundido con sangre alogénica versus 37% de los hemodiluidos (53). Por desgracia, numerosos estudios de HAN no están adecuadamente planeados, usan controles históricos o no definen adecuadamente los criterios de transfusión.
En un metaanálisis de 24 estudios prospectivos y aleatorios de HAN en adultos encontró una menor probabilidad de exposición a sangre alogénica o a un menor número de unidades. Este metaanálisis excluyó pacientes menores de 18 años. En un análisis que incluyó sólo estudios con criterios estrictos de transfusión esta conclusión no pudo sostenerse (54). Esto ha motivado que exista una visión controvertida con respecto al tema, a pesar de que los que usamos HAN estemos convencidos de su eficacia.
Un comité de expertos del NIH (National Institute of Health) recomienda el uso de HAN (55), mientras que una conferencia de consenso del Colegio Médico de Edimburgo sobre transfusión autóloga no aconseja su implementación (56).
En niños, la plaquetoféresis y plasmaféresis aumentan la recolección de factores de coagulación en la técnica de HAN y permiten la fabricación de pegamento quirúrgico, sin embargo esta técnica no ha sido estudiada sistemáticaticamente (57). La modificación de la HAN usando almidón de bajo peso molecular emulsión de fluorocarbono ha logrado optimizar la HAN en adultos y podría estudiarse en niños (58, 59).
El uso de antifibrinolíticos como aprotinina y ácido tranexámico ha demostrado con claridad que reduce el sangrado en adultos y debiera estudiarse más a fondo en distintos tipos de cirugía en niños (60). Aunque no exista evidencia sólida que avale esta práctica en cirugía pediátrica, en nuestro centro usamos aprotinina 30.000 a 40.000 KIU/kg combinado con ácido tranexámico 100 mg/kg en cirugía cardíaca de alto riesgo como una TGA en un RN o una CIV o TOF en Testigos de Jehová.
Se han realizado muchos esfuerzos por minimizar el sangrado en los procedimientos ortopédicos pediátricos. Existen algunos reportes retrospectivos que avalan este esfuerzo (61). En un estudio retrospectivo de cirugía ortopédica del adolescente, el grupo que recibió rHuEPO tuvo hematocrito mayor y recibió menos transfusión alogénica (4 versus 24%) (62).
El uso de eritropoyetina en el preoperatorio combinada con HAN en cirugía de escoliosis es eficaz en reducir el requerimiento de sangre alogénica (63). En un estudio controlado, el uso combinado de hemodilución e hipotensión controlada disminuyó el sangrado y el uso de transfusión alogénica en cirugía de escoliosis (64). Un estudio bien diseñado, con controles históricos, demostró que el salvado de células y el uso de sangre autóloga disminuye la pérdida de sangre y los requerimientos transfusionales (65).
Se han investigado estrategias no quirúrgicas para pacientes víctimas de trauma con base en el Organ Injury Scaling (OIS), sistema de la Asociación Americana para la Cirugía del Trauma (66). La identificación de los mejores candidatos para cirugía puede disminuir en forma significativa el uso de sangre alogénica.
En una revisión retrospectiva de pacientes con trauma hepático cerrado, hemodinámicamente estables, incluyendo algunos niños, muestra que una estrategia no quirúrgica, bajo observación intensiva, resulta en menos cirugía, menor infección abdominal, hospitalización más breve y menos transfusiones (67).
En una serie de niños con trauma hepático cerrado, 22 de 27 pacientes calificaron para un manejo no quirúrgico (68). Solamente 4,5% del grupo no quirúrgico recibió transfusión de sangre alogénica. Tres de los cinco tratados quirúrgicamente recibieron transfusión. El manejo no operatorio del bazo roto se ha estudiado también en niños.
En un estudio turco, 56 niños reunieron criterio no operatorio y 28 fueron a cirugía (69). Sólo 57% de los pacientes en el grupo no operatorio requirió transfusión versus 100% en el grupo quirúrgico.
En los últimos 30 años hemos podido apreciar grandes avances en la terapia transfusional. Actualmente el riesgo infeccioso es muy bajo en Estados Unidos y en Europa. La tasa de VIH en aquel país es de 1:676.000 gracias al empleo de antígeno p24 y de NAT (1, 70). No podemos decir lo mismo del riesgo asociado al error, nuestra cualidad más humana (71).
Debido a las enormes diferencias en presupuestos de salud, las distancias se han acrecentado entre los países desarrollados y aquéllos en vías de desarrollo, y el riesgo infeccioso en Latinoamérica es al menos 1000 veces mayor. En esta región existen países cuyo pool de donantes tiene 10-20% de paludismo (72). Otros, como el nuestro, dejan sin tamizar un número significativo de unidades (73). En otros, el SIDA tiene una alta prevalencia (1). Además, se ha calculado que si en Latinoamérica se intentara realizar toda la lista de espera el déficit de unidades de sangre sería de 20 millones. En Estados Unidos, el déficit en los próximos 5 años será de varios millones de unidades.
En Europa, las costumbres licenciosas (dogging, drogadicción, promiscuidad), las migraciones mal controladas y el envejecimiento de la población permiten predecir un futuro oscuro para el pool de donantes.
El uso de técnicas de ahorro de sangre ya lleva varios años en la población adulta. Al revisar este tema en niños, es sorprendente la escasez de material de buena calidad (ensayos clínicos controlados). En el futuro se deberá emular en pacientes quirúrgicos, quemados, ortopedia, etc., lo realizado en el grupo de lactantes prematuros y de enfermos renales.
Debiera aumentar, en el futuro, la información sobre hemodilución aguda normovolémica e hipervolémica en niños. Esta técnica es simple, reproducible y de bajo costo de implementación (49). Existen nuevas soluciones coloidales que se están estudiando en pediatría y que prometen ventajas hemodinámicas y sobre el perfil de la coagulación (74).
Las máquinas de autotransfusión se han modernizado permitiendo el uso de campanas de 55 ml (Dideco) y otras la autotransfusión continua (CAT, Fresenius). Su alto costo de implementación e insumos es aún una gran limitante para su aplicación masiva. Sin embargo, en hospitales de alta complejidad (escoliosis, cardiovascular, trasplante) creemos que su uso está plenamente justificado.

 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Monografía editada por:
The Foundation for Alternative Transfusion Practices
Hospital Clínico Universidad de Chile
Sociedad Chilena de Medicina Intensiva.
 Expositor:
Italo Zamudio Villarroel[1]
Expositor:
Italo Zamudio Villarroel[1]

Citación: Zamudio I. Blood-saving techniques in pediatric surgical patients. Medwave 2004 Sep;4(8):e2249 doi: 10.5867/medwave.2004.08.2249
Fecha de publicación: 1/9/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión