La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán.
Edición científica: Dr. Luis Delpiano.
El tema de los jardines y salas cunas comenzó a tener importancia desde 1960, a nivel mundial, y desde la década de 1980, en Chile. Esto sucedió, como aparece textualmente en los libros, desde que la mujer “abandonó” el cuidado de los hijos en la casa, lo que creó la necesidad de que alguien los cuidara o educara desde una edad precoz.
Por lo tanto, las primeras salas cunas, para menores de dos años, y los jardines infantiles se generaron debido a factores sociales y económicos, ya estructurados en Europa y en los Estados Unidos en la década 1960 y en Chile aproximadamente desde 1975.
Con el tiempo, se observó que los niños que asistían a estas guarderías tenían mayor riesgo de infecciones, lo que se cuantificó en algunos trabajos que demostraron que el riesgo de infecciones respiratorias y gastrointestinales es 1,5 a 3 veces mayor (The Journal of Pediatrics 1991;118:509-14; The Journal of Pediatrics 1997;131:476-9; Pediatrics 1999;103:753-8). Además, hay un riesgo potencial de que estas infecciones se transmitan a los adultos y, por lo tanto, se diseminen a la comunidad, lo que se ha visto en el caso de la coqueluche y de todos los virus respiratorios (Infect Dis Clin NA, 1997:11:347-63).
Por otra parte, en varios reportes se concluye que en esta población existe un alto consumo de antimicrobianos, entre dos a tres veces mayor que en los niños criados en sus casas, y que todo esto conlleva un impacto económico y social, porque muchas veces las madres deben faltar a su trabajo, o simplemente abandonarlo, cuando el niño es muy enfermizo (Infections 1991;19:331-5; Pediatrics 1999;103:556-64).
Esta situación se explica por las características propias del huésped, especialmente la edad, ya que se trata de lactantes menores, que pierden la inmunidad pasiva traspasada por la madre entre los 6 y 12 meses de edad o por factores fisiológicos, como el hecho de no controlar esfínteres, muy importante en la diseminación de patologías entéricas.
Por último, está la dificultad para mantener la higiene a esta edad, en la que comparten secreciones respiratorias y besos, lo que constituye un problema importante en el momento de cortar la cadena de transmisión. Se ha demostrado que los niños de uno a tres años se llevan un juguete, o la mano a la boca cada tres minutos, para compartir luego estos objetos.
Otra serie de factores son los ambientales, como la cantidad de metros cuadrados por niño, la cercanía entre uno y otro, la contaminación causada por sus secreciones y excreciones, la calidad de los depósitos de pañales en las salas y en el baño, la presencia o ausencia de bacinicas y retretes apropiados, etc. Todos estos factores influyen en la eventual aparición de algún cuadro infeccioso.
En último término, están los factores propios del agente, dentro de los cuales siempre se debe evaluar la vía de diseminación del patógeno, la dosis infectiva y cuánto sobrevive el agente en el ambiente, ya que algunos virus sobreviven varios minutos en el ambiente, en manos o fomites.
Otro elemento a considerar es que muchos niños son portadores de virus. De hecho, hay lactantes menores, de entre cuatro y siete meses, que tienen rotavirus como parte de su flora por largo tiempo, de manera asintomática, y pueden transmitirlo a otros niños. Está el problema de las bacterias con resistencia variable, como S. pneumoniae, que en caso de una portación asintomática también son factible de transmisión a otro menor.
En cuanto a los patógenos transmitidos por vía respiratoria, en los niños que asisten a jardines y salas cunas, se ha descrito patologías por todos los virus conocidos: rinovirus, adenovirus, coronavirus, enterovirus, virus influenza, parainfluenza, virus respiratorio sincicial (VRS), varicela, parvovirus B 19, etc., y por las bacterias clásicas de la edad pediátrica, como S. pneumoniae, S. pyogenes, N. meningitidis, Bordetella pertussis, Haemophillus influenzae y Mycobacterium tuberculosis.
El hecho epidemiológico más significativo es que las infecciones respiratorias son dos a tres veces más frecuentes en los niños que asisten a guarderías que en los niños que se quedan en la casa; equivalen a 10% de las infecciones respiratorias de los niños menores de cuatro años, en los Estados Unidos.
La mayoría son infecciones autolimitadas y de etiología viral, con un modo de transmisión por gota grande que no llega a más de un metro, no aerosoliza a gran distancia y exige un contacto cercano, aunque también están descritas las infecciones que se transmiten por gota pequeña, como la varicela. Se sabe que en las guarderías, como son espacios cerrados con gran cercanía física y mucho contacto entre los niños, la tasa de ataque puede alcanzar al 100% de los menores.
Los virus, por lo general, reflejan la epidemiología de ese momento en la comunidad, de modo que son más frecuentes en la época invernal y se transmiten por inoculación directa de partículas infecciosas, pero no hay que olvidar que también hay transmisión desde los adultos, por dos mecanismos: rascarse la nariz en presencia de un resfrío oligosintomático y trabajar después con los menores, y estornudar sin mayor cuidado, porque de esa forma se expelen agentes hacia los niños.
También se ha descrito la importancia de la transmisión de Bordetella pertussis a lactantes no vacunados, con inmunidad deficiente o un programa de vacunación incompleto y, por otra parte, se ha comprobado que la etiología viral, según el virus, se asocia con la aparición posterior de otitis aguda en 10% a 30% de los casos; es importante en este aspecto la portación de los distintos agentes bacterianos, como Haemophillus influenzae y S. pneumoniae.
Con respecto a la forma de contagio de diferentes agentes patógenos, bacterianos y virales, en un estudio publicado en 2003 aparece la evidencia en detalle. Por ejemplo, la influenza se transmite por contacto directo, por gota grande, pero también se transmitiría por gota pequeña, por lo que un menor con influenza puede contagiar a muchos niños a su alrededor. El adenovirus se contagia por contacto directo, por gota mediana y pequeña. El virus respiratorio sincicial se transmite por contacto directo y por gota mediana, no pequeña, igual que el rinovirus, y además ambos se pueden transmitir por medio de objetos inanimados, como chupetes, juguetes y pañuelos no desechables (N Engl J Med 2003; 348:1256-66).
Se ha estudiado cuánto sobrevive el virus respiratorio sincicial en diferentes superficies animadas o inanimadas, y se ha determinado que en la piel sobrevive hasta 30 minutos; por lo tanto, si los cuidadores suenan a los niños, es muy probable que las partículas virales queden en sus manos y al tocar a otro menor, se las transmitan. En la ropa sobrevive por 30 a 40 minutos, en los pañuelos desechables puede estar hasta por una hora y, en los guantes, entre 90 y 120 minutos. Un virus que sobrevive en el ambiente es fácil de transmitir de un menor a otro.
La prevención es difícil, porque la medida más importante, igual que en el entorno nosocomial, es el lavado de las manos, y son pocas las modificaciones que se pueden realizar en las guarderías, especialmente entre los menores, que están tan cerca unos de otros. Otras medidas de consideración son las siguientes:
Como se sabe, la evidencia de grado 1 está dada por un estudio controlado, aleatorio, que no necesariamente se ha hecho en una sala cuna o jardín infantil, pero que tiene un peso metodológico importante. La evidencia de grado 2 corresponde a un trabajo controlado, pero no aleatorio; la de grado 3 es un informe importante descriptivo observacional; la de grado 4 está constituida por experiencias teóricas que sirven de aval, pero no hay estudios controlados en sala cuna; y la de grado 5 corresponde a recomendación de expertos.
En cuanto al virus respiratorio sincicial (VRS), la administración de Palivizumab corresponde a una evidencia de grado 1, especialmente en lactantes menores de riesgo como los prematuros, que deben quedar en sala cuna cuando las madres comienzan a trabajar. Lamentablemente, se usa muy poco, por su costo. En H. influenzae, la vacuna conjugada tiene evidencia de grado 1 y en los países que la han implementado, como lo hizo Chile en 1996, se ha demostrado una disminución significativa de las infecciones por el tipo b. Cabe desatacar que algunos países latinoamericanos aún no tienen un programa de vacunación contra el Haemophillus.
En cuanto a S. pneumoniae, los estadounidenses dicen que tendrían evidencia de grado 1, pero en Chile, por los serotipos que contiene esta vacuna, habría entre 45% y 55% de protección; es importante explicarles esto a los padres, al aplicarla a menores de sala cuna o jardines infantiles. En relación con S. pneumoniae resistente, la evidencia de grado 2 indica que la tasa de portación podría disminuir al reducir el consumo de antimicrobianos por los niños que asisten a guarderías. En cuanto a N. Meningitidis, la profilaxis con rifampicina u otro antimicrobiano está avalada por evidencia de grado 2, para prevenir brotes en guarderías
En parotiditis, sarampión, y rubéola, la vacuna está respaldada por evidencia de grado 2; no hay estudios aleatorios y controlados, porque sería poco ético hacerlos. Con respecto a varicela, la administración rutinaria de la vacuna constituye evidencia de tipo 1. Hasta el año 2003 se indicaba al año de edad, pero, en la actualidad, la evidencia señala que se debe retrasar su administración porque, si se administra a los 12 meses, hay reducción importante de los anticuerpos, de tal manera que, a los cuatro años de edad, entre 30% y 40% de estos niños tienen niveles no protectores y se han descrito brotes en niños vacunados. El empleo de vacunas para evitar brotes dentro de guarderías post exposición es una medida comprobada y se debe indicar hasta 72 horas después de que ha habido contacto, para evitar brotes o casos secundarios.
Para el virus influenza debe haber programas claros de vacunación de niños y personal. La Academia Americana de Pediatría (AAP), en 2003, indicó la vacuna para todo niño sano menor de dos años, en especial si asiste a una guardería; por lo tanto, ya no se administra sólo a niños con factores de riesgo. Esta práctica no se ha adoptado en Chile, porque exigiría aumentar casi al doble la cantidad de vacunas compradas.
En 1999 se publicó un estudio realizado en centros de cuidado, mediante cuestionarios recordatorios de 12 meses, en el que cada mes los padres comunicaban el estado de salud de sus hijos de tres a cinco años. Se siguieron 3.853 niños, y se logró la devolución de encuestas en un 79%. El análisis de regresión logística demostró que los niños que asistían a centros de cuidado tenían más tos nocturna y obstrucción nasal que los controles y que tenían un riesgo de resfrío común 17,4% mayor y de otitis media aguda un 32,4% mayor, con el consiguiente consumo de antimicrobianos. También existía más diagnóstico de asma y patología bronquial obstructiva, en menores de 2 años (Pediatrics 1999; 103:753-8).
En cuanto al riesgo de enfermar por VRS, en una revisión del 2003, que consistió en una búsqueda en MEDLINE, se encontró como factores de riesgo significativos el sexo masculino, ser menor de seis meses, nacimiento en invierno, el hacinamiento y la asistencia a sala cuna, de modo que dentro de lo posible, los menores con dos o tres factores de riesgo debieran evitar asistir a guarderías en época de brote de VRS en la comunidad, que comprende un período de 8 a 10 semanas. En esta revisión no se encontró evidencia suficiente para la raza, tabaquismo intradomiciliario, grado de educación materno y lactancia materna, pese a qué este se consideraba como un factor protector para VRS.
En relación con las bacterias, un estudio realizado en Francia entre 1999 y 2000, en niños de 6 a 36 meses, asistentes y no asistentes a guarderías, en los que se hizo un doble hisopado nasofaríngeo para cultivo, se encontró que eran portadores de S. pneumoniae el 54,7% de los que asistían a sala cuna y sólo 34% de los que no asistían, lo que fue significativo desde el punto de vista estadístico. El 55,8% de los que asistían a sala cuna portaba neumococo no sensible a penicilina versus 52,5% de los que no asistían, lo que no fue estadísticamente significativo, como sí lo fue la diferencia en la proporción de portadores de H. Influenzae, que era de 37,2% entre los niños que iban a guarderías y de 23,8% entre los que no lo hacían.
Con respecto a la exposición a antimicrobianos en los últimos tres meses, el grupo que asistía a guardería tenía un 41,3% de exposición, y el grupo que no asistía tenía un 47,4%, cifra muy similar; sin embargo, lo importante es que los niños que asisten a jardines infantiles tienen en mayor proporción S. pneumoniae y H. Influenzae (Pediatric Infectious Disease Journal 2003; 22:589-92).
Sobre la prevalencia de S. pneumoniae en Chile, la Dra. Olivia Trucco publicó en la Revista Chilena de Pediatría (1996; 67:195-9) un estudio realizado en Santiago para determinar los portadores en jardines infantiles de la JUNAEB, por hisopado nasofaríngeo. Se reclutaron 200 menores, con edades que fluctuaban entre los tres meses y los cuatro años; en 60,2% de ellos se aisló S. pneumoniae, de los cuales, 28,4% tenían cepas resistentes, cifra compuesta por 20,3 % con resistencia intermedia y 8,1% con resistencia absoluta, lo que concuerda con las cifras de neumococo resistente de tipo invasor en la comunidad menor de cinco años en Chile, que es la población más afectada por este patógeno. La frecuencia fue similar en menores y mayores de dos años.
De los patógenos transmitidos por vía entérica, dentro de los virus destaca el rotavirus, que es el más estudiado; otros virus son astrovirus, calicivirus, adenovirus entéricos, enterovirus y el virus de la hepatitis A, este último asociado fundamentalmente a brotes dentro de centros de cuidado. Las bacterias involucradas en estas infecciones son E. coli, Salmonella, Shigella, Campylobacter y Clostridium difficile, en algunas ocasiones.
Con el tiempo, la presencia de parásitos en los centros de cuidado ha disminuido, por lo que, actualmente, la costumbre de solicitar a los lactantes un examen parasitológico de deposiciones no tendría ninguna base científica y sólo aumentaría los costos de la familia; ejemplos de estos agentes son el Cryptosporidium y la Giardia lamblia.
La transmisión de los patógenos entéricos es fecal-oral, y se manifiestan clínicamente por un cuadro diarreico; los niños que asisten a centros de cuidado tienen tres veces más diarrea que los niños cuidados en casa. La mayoría de las veces la transmisión es persona a persona, y muy rara vez se han descrito brotes transmitidos por alimentos.
Es importante el número de susceptibles, el número de niños que son portadores asintomáticos, especialmente en cuanto al rotavirus, el grado de contaminación ambiental y la cantidad y manejo de los usuarios de pañales. En los jardines debe existir una normativa sobre cambio y eliminación de los pañales, que debe hacerse primero en una bolsa plástica individual, y sólo después de esto deben ser arrojados a un basurero que tenga tapa y se encuentre alejado de los menores, sin olvidar lavarse las manos antes y después del cambio.
En cuanto a la prevención de hepatitis A, existe evidencia grado 1 respecto a la vacunación de los contactos, por lo que si se produce un caso de hepatitis A en un jardín infantil, debe promoverse la administración de la vacuna en los niños que asisten a él. La profilaxis con inmunoglobulina a los contactos corresponde a evidencia grado 2, que es bastante antigua y no ha sido sometida a un estudio clínico aleatorio, y probablemente no lo será, porque existe la vacuna como método de prevención, aunque pueden ser colocadas ambas frente a un contacto con hepatitis A.
La exclusión por 7 días, que se usa mucho, corresponde a evidencia grado 5, porque no se ha estudiado qué impacto tiene la exclusión de niños con hepatitis respecto a la diseminación dentro del centro de cuidados. Quizás sería suficiente el lavado de manos y no sería necesario que el niño se ausentara por esto, sino por otros factores, como el compromiso del estado general.
Cuando se produce un brote de hepatitis A, la vacuna ha demostrado ser una estrategia de alta eficacia, con resultados superiores a la gammaglobulina. Es importante detectar de manera oportuna los brotes, para lo cual se requiere un médico o que el personal parvulario tenga información sobre las características de la hepatitis, siendo importante detectar todos los casos para instaurar medidas de prevención y recomendar la vacuna a quien corresponda.
La intervención, para que sea eficaz, debe ser realizada antes de 18 días del inicio del brote; si se realiza después de las cuatro semanas, el brote de hepatitis A puede durar hasta 8 meses. Es necesario que tenga una alta cobertura en los grupos afectados, para cortar la cadena de transmisión. Está demostrado que reduce la duración del brote epidémico, y está presente en la norma del Ministerio de Salud, por lo tanto, frente a un brote la primera dosis es gratuita, aunque la segunda dosis debe ser pagada por los padres, pero al menos se puede apelar al servicio de epidemiología del área para que los menores que están en presencia de un brote por hepatitis A sean vacunados.
Cada vez existen más guarderías que tienen animales, especialmente reptiles, los que son portadores de Salmonella no typhi, por lo que sería importante que hubiera una recomendación formal de exclusión de reptiles, como medida de prevención. Se han descrito diarreas por Salmonella no typhi en centros que tienen lagartos, iguanas y tortugas.
En otros patógenos, como shigella, rotavirus, calicivirus y enterovirus, la exclusión por diarrea aguda corresponde a evidencia grado 3 y el lavado de manos, a grado 2. El lavado de juguetes no ha sido estudiado como corresponde, con respecto a si es o no una medida importante de prevención y control. El uso de retretes versus bacinicas tampoco ha sido objeto de estudios para determinar qué es mejor, porque muchas veces no queda claro si la bacinica fue limpiada de manera adecuada, entre un niño y otro.
Con respecto a las medidas de control en casos de diarrea, en un estudio controlado, aleatorio, realizado en Australia, en el que se evaluó el impacto de entregar educación con respecto al lavado de manos sobre la presencia de diarrea en los menores, mediante una comunicación telefónica o escrita a la familia cada dos semanas, se encontró una diferencia estadísticamente significativa entre los centros intervenidos, en los que hubo 1,9 episodios de diarrea por niño/año, y el grupo control con 2,7 episodios, lo que significa que los cuadros diarreicos se redujeron en un 50% en los centros intervenidos, mediante educación mensual sobre lavado de manos, disposición de los pañales y uso de los baños. El impacto fue mayor en los mayores de 2 años, y cuando la adherencia al lavado de manos fue mayor, la reducción de las diarreas alcanzó al 66% (N. Meningitidis 2000;105;743-6).
Por lo tanto, si se educa y supervisa de manera permanente, se podría disminuir hasta en dos tercios los cuadros diarreicos en menores de salas cunas o jardines infantiles.
Como agentes causales, dentro de los virus destaca el Herpes simplex que produce gingivoestomatitis herpética y es de gran difusión en estos menores, y el virus Varicela-zoster. Las bacterias están representadas por el Streptoccocus pyogenes y el Staphyloccocus aureus, patógenos cutáneos que tienen una alta transmisión a esta edad; los parásitos, por Pediculus humanus capitis y corporis, el Molusco contagioso y el ácaro de la escabiosis; y los hongos, por los agentes que producen las tiñas de la cabeza y del cuerpo.
La prevención se hace mediante el lavado de manos. La exclusión, en el caso del impétigo corresponde a evidencia grado 3, por lo tanto podría implementarse como medida particular, pero no se ha demostrado que tenga una relevancia científica importante. En la gingivoestomatitis por virus Herpes simplex, la exclusión tiene una evidencia grado 5, pero la Academia Americana de Pediatría la recomienda formalmente por la dificultad para evitar la transmisión por besos y chupetes, lo que hace que, aunque no existe evidencia que lo demuestre, la difusión sea muy alta.
Lo mismo sucede con la sarna, sobre la cual no existen trabajos que demuestren que la exclusión tenga un impacto importante, pero la AAP la recomienda como una medida necesaria de control. En relación a pediculosis, no existen trabajos que avalen como medida de prevención eficaz el hábito de examinar a los niños todos los días, y al igual que en el caso de la tiña, se recomienda excluir a los menores y evitar compartir peinetas, lo que corresponde a evidencia tipo 5.
En suma, en el caso de las infecciones cutáneas no existen trabajos que demuestren cuál es la medida de prevención más eficaz, y en cuanto a la conjuntivitis purulenta, tampoco hay trabajos que avalen que la exclusión sea una medida de impacto importante. Quizás se deberían implementar otros programas de prevención.
En el caso del citomegalovirus, la saliva es una fuente de contagio, pero no tendría impacto clínico en niños inmunocompetentes, por lo que no existen medidas prácticas e importantes de prevención. Se ha comunicado la transmisión del virus Hepatitis B por mordedura humana. En las salas cunas los niños se muerden, y se han comunicado casos de hepatitis B transmitida en centros de cuidado por mordeduras de niño. El Herpes simplex también puede ser transmitido a través de la saliva, y no se ha reportado transmisión de VIH entre niños a este nivel.
Según la OMS, en el año 2010 todos los países deberían tener vacunados a sus menores contra la hepatitis B, que tiene una incidencia elevada en países europeos y desarrollados, aunque en Latinoamérica también ha ido en ascenso.
Muchos pediatras han trabajado en centros de cuidado, pero la mayoría se han dedicado a la morbilidad y al control de peso y talla y pocos han participado en programas estructurados de control de salud general de los menores que asisten al lugar.
En cambio, no son causa de exclusión la conjuntivitis no purulenta, el exantema sin fiebre, la infección por Parvovirus B19 en inmunocompetentes, la infección por Citomegalovirus, que tiene una alta portación a esta edad y la infección crónica por virus hepatitis B o VIH.
Entre otras medidas preventivas posiblemente útiles, está el uso de probióticos. En el año 2001 se publicó un estudio en el que se evaluó la relación entre la ingesta de leche con agregado de Lactobacillus GG y la presencia de infecciones en niños asistentes a centros de cuidado, en los que recibían 260 ml al día, en promedio. El estudio, que fue aleatorio, controlado y doble ciego, se prolongó por siete meses y fue realizado en 18 centros de Finlandia, incluyéndose 571 niños de 1 a 6 años de edad.
En este estudio se encontró que los niños que recibieron leche con Lactobacillus tuvieron menor ausentismo por causas infecciosas (4,9 versus 5,8 días) y presentaron una reducción del 17% de las infecciones respiratorias y de un 19% del consumo de antimicrobianos, en comparación con los otros niños (BMJ 2001;322:1-5).
Otro elemento importante es la prevención y control de la higiene y la salud dental. Este punto se puede revisar con más detalle en la exposición realizada por el Dr.Valderas y la Dra. Bächler, (http://www.medwave.cl/septiembre2004.act), en la que se destaca la importancia del control precoz y del manejo adecuado de los niños a esta edad, desde el punto de vista de higiene y alimentación.
Los siguientes datos corresponden a un trabajo desarrollado en conjunto con la Dra. Paola Kabalán y las internas Constanza Díaz y Andrea Pinto. Es un estudio realizado en el jardín infantil del hospital San Borja Arriarán, que tiene 140 menores de cuidado habitual, diseñado para determinar el costo de las infecciones respiratorias ocurridas entre Mayo y Agosto del 2004, mediante visitas trisemanales y encuestas a la madre sobre el gasto que ha ocasionado el diagnóstico y tratamiento de cada cuadro respiratorio.
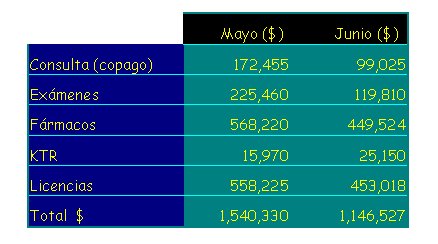
En la tabla I se muestran las cifras de Mayo y Junio, ya que los datos posteriores aún no han sido analizados, entre las cuales se incluyen los gastos por copago de consultas, exámenes, fármacos, kinesiterapia y licencias que paga hospital. Sumando ambos meses, se obtiene un costo total de $ 2.686.857. En estos 140 niños se comunicaron 69 eventos mórbidos respiratorios, lo que da un costo de $38.940 por cada infección respiratoria, y descontando las licencias médicas, el costo para la madre queda en $24.284. Esto, en el contexto de una población cuyo ingreso teórico no es mayor de $300.000 al mes, con un promedio de $182.000, habla de que cada infección respiratoria tiene un alto impacto.
Tabla I. Costo de infecciones respiratorias en Sala Cuna y Jardín Infantil HCSBA-2004 (n=140).
En las salas cunas y jardines infantiles se atienden menores que necesitan cambio de pañales o que se los ayude en el uso del baño, que exploran el ambiente con sus bocas, que controlan poco o nada sus secreciones y excreciones, que tienen sistemas inmunes inmaduros y que requieren contacto manual con las personas que los atienden. Además, en esos sitios los niños pequeños tienen contacto directo y frecuente con otros niños pequeños. Por lo tanto, los programas de cuidados infantiles que brindan asistencia a lactantes y niños pequeños deben prestar especial atención a las medidas para el control de las infecciones.

 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán.
Edición científica: Dr. Luis Delpiano.
 Expositor:
Luis Delpiano Méndez[1]
Expositor:
Luis Delpiano Méndez[1]

Citación: Delpiano L. Infections in children in nurseries and kindergartens. Medwave 2004 Nov;4(10):e2353 doi: 10.5867/medwave.2004.10.2353
Fecha de publicación: 1/11/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión