 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán.
Edición científica: Dr. Luis Delpiano.
Introducción
El virus respiratorio sincicial (VRS) es un agente causante de elevadas tasas de morbilidad durante los meses de invierno.
Este virus fue descubierto en la década de los 50 en Washington, D.C.. Estados Unidos, en chimpancés que desarrollaron cuadros respiratorios frente a la exposición a un agente citopático que exhibía altas tasas de ataque (casi 100% de los individuos resultaban infectados). Por este motivo, se le denominó CCA (chimpanzee coriza agent). Las personas que estuvieron en contacto con los chimpancés desarrollaron un cuadro leve de coriza y malestar general, menos grave que el observado en los animales (1).
En estudios posteriores se determinó que el agente aislado en estos pacientes podía formar sincicios similares a los observados en los chimpancés y, posteriormente, se demostró su presencia en grupos de niños y lactantes con infecciones de gravedad variable, que se presentaban epidemiológicamente como brotes en determinadas estaciones del año.
Patogenia
Se conoce dos subtipos de VRS: A y B, que pueden presentarse en el mismo período.
Sus principales glicoproteínas de superficie son la glicoproteína F, que tiene relación con la formación de sincicios y la penetración del virus a la célula, y la glicoproteína G, que está relacionada con la unión del virus a receptores de superficie de las células del hospedero.
La glicoproteína F se conserva en forma similar en los distintos subtipos; en cambio, la glicoproteína G presenta algunas diferencias estructurales. Ambas, junto con otras proteínas de este virus, desencadenan la respuesta inmunológica, que se basa principalmente en anticuerpos y linfocitos T.
Patogenia
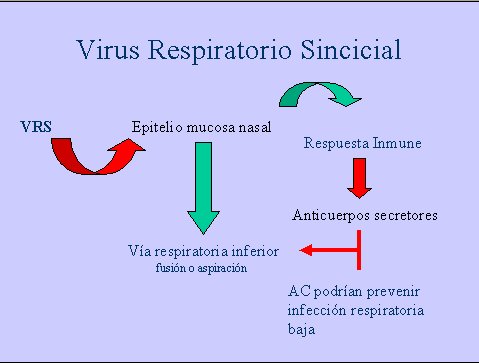
Cuando el VRS entra en contacto con el epitelio de la mucosa nasal, despierta la respuesta inmune y estimula la formación de anticuerpos secretores que impiden la fusión o aspiración hacia la vía respiratoria inferior. Si esto ocurre a pesar de todo, otros anticuerpos formados a nivel sistémico podrían prevenir una eventual infección respiratoria baja (Figura 1).
Figura 1.
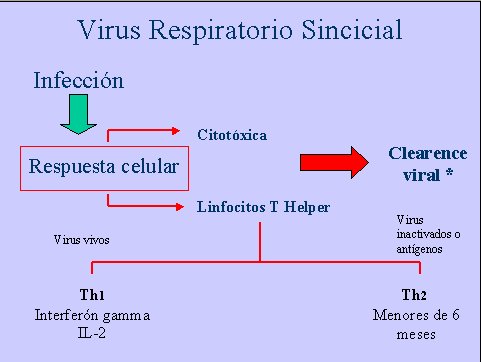
La infección produce una respuesta celular citotóxica y, en especial, mediada por linfocitos T helper, que son los encargados de producir el clearance viral. En estados de inmunosupresión, este clearance se altera y puede existir una excreción viral más prolongada que lo habitual.
Con respecto a los linfocitos T helper y las vacunas que se han implementado para el VRS, es importante saber que en el caso del virus vivo predomina una respuesta de tipo Th1, con una gran secreción de interferón gamma e interleuquina 2; en cambio, cuando se utilizan virus inactivados o antígenos virales, se desencadena una respuesta Th2, que es lo que se observa principalmente en los menores de seis meses (Figura 2).
Figura 2.
El interferón gamma se produce en grandes cantidades en los lactantes que cursan infecciones respiratorias por VRS y reducen la carga viral, el conteo de linfocitos y neutrófilos y los niveles de interleuquina 4 y 5 en el lavado broncoalveolar.
También se sabe que la administración de interferón gamma atenúa la infección en las células epiteliales humanas tipo 2 (células Hep-2 y A549); por lo tanto, su producción es importante en el desarrollo de la respuesta inmunológica y defensiva del hospedero.
El efecto citopático directo del virus genera una respuesta inflamatoria patológica del hospedero a nivel del tracto respiratorio, cuyos signos y síntomas constituyen el cuadro de bronquiolitis secundario a VRS.
Epidemiología
La infección por VRS es común, especialmente en determinados períodos del año (otoño e invierno). Entre 30% y 50% de los niños se infectan en el primer año de vida, cifra que llega casi al 100% en el tercer año, ya que han estado expuestos a dos o tres brotes cíclicos en la comunidad. La primoinfección es generalmente sintomática y causa escasa inmunidad.
Del total de niños que se enferman, 1% a 2% se hospitalizan; ésta es la primera causa de hospitalización en el primer año de vida. Al analizar los diagnósticos de egreso hospitalario en el periodo epidémico, se observa que 80% son bronquiolitis y 20%, neumonías. De los niños que se hospitalizan, 10% a 20% deben ingresar a Unidad de Cuidado Intensivo (UCI), con una mortalidad de 0,5% a 3%. En los Estados Unidos las hospitalizaciones alcanzan a cerca de 90.000 niños, con alrededor de 450 muertes anuales.
Cuadro clínico
El cuadro se caracteriza por tos, aumento de la frecuencia respiratoria, sibilancias, aumento del trabajo respiratorio, uso de la musculatura torácica accesoria, tiraje, aleteo nasal, dificultad para alimentarse y dormir y pausas respiratorias prolongadas o apnea, sobre todo en el lactante menor. También puede manifestarse por muerte súbita. Estudios de los registros de autopsias han demostrado que en 15% a 20% de los casos existe evidencia de infección por VRS.
Factores de riesgo de enfermedad por VRS
Es importante conocer los factores de riesgo, para tomar las correspondientes medidas de prevención. La lista incluye prematurez, enfermedad pulmonar crónica o displasia broncopulmonar, edad menor de seis meses, presencia de cardiopatías congénitas, presencia de hipertensión pulmonar, factores raciales asociados, uso de tratamiento inmunosupresor, fibrosis quística, inmunodeficiencias, enfermedades neurológicas, enfermedades metabólicas, hacinamiento, bajo nivel socioeconómico y tabaquismo materno.
Impacto del VRS
La infección por VRS incrementa la incidencia de sibilancias postbronquiolitis y está relacionada con hiperreactividad bronquial, alteración de la función pulmonar post viral y asma bronquial.
Los mecanismos asociados a hiperreactividad bronquial son anatómicos, en especial en niños pequeños; además, el daño citopático que se produce en la mucosa lleva a la exposición de receptores, lo que facilita la activación neurogénica de la musculatura lisa bronquial, y se desarrolla el broncoespasmo.
Las infecciones nosocomiales que ocurren en las unidades de cuidados intensivos neonatales son generalmente bacterianas, de manera que, frente a un niño con características sépticas, es lo primero que se sospecha; pero se podría tratar de una subvaloración de las infecciones virales y, en época invernal, puede haber brotes nosocomiales por este agente (2).
Estrategias de control
Inmunoprofilaxis para VRS
En un tiempo se recomendó la administración de inmunoglobulina intravenosa en dosis de 500 mg/kg, pero en un estudio publicado en 1993 se concluyó que no hubo un efecto beneficioso, lo que se atribuyó a la insuficiente cantidad de anticuerpos neutralizantes específicos antiVRS presentes en las preparaciones estándares. No se evidenció una respuesta satisfactoria sólo con utilización de inmunoglobulina intravenosa (3).
También está la posibilidad de hacer inmunoprofilaxis administrando anticuerpos de tipo policlonal, como RSV-IGIV Respigam, que es el que presenta mayor concentración de anticuerpos, o monoclonal, como Palivizumab.
RSV-IGIV Respigam (Respiratory Syncitial Virus Inmune Globuline Intravenous)
Respigam es un complejo policlonal que se infunde en tres horas, en dosis de 15 ml/kg. Puede producir sobrecarga de fluidos, es un producto hemoderivado y también aporta anticuerpos contra otros patógenos.
Hay tres estudios acerca del uso de Respigam. El primero se realizó en 249 pacientes, de los cuales 102 eran portadores de displasia broncopulmonar menores de 48 meses, 87 tenían cardiopatía congénita y eran también menores de 48 meses y 60 eran recién nacidos de pretérmino con menos de 35 semanas, que tenían menos de seis meses de edad en el momento del estudio. Todos ellos recibieron Respigam mensual en dosis de 750 mg/kg, 150 mg/kg o placebo, en forma aleatoria.
Se observó una disminución de 63% en las tasas de hospitalización en los niños que utilizaron el fármaco en dosis de 750 mg/kg; sin embargo, la FDA no la aprobó, debido a que hubo seis fallecimientos, cinco de ellos en pacientes portadores de cardiopatías congénitas (4).
El segundo estudio se realizó entre 1994 y 1995, y se caracterizó por ser aleatorio, multicéntrico y doble ciego. Entre los pacientes había casos de displasia broncopulmonar, de 24 meses de edad, y pretérminos menores de 35 semanas, que a la fecha tenían seis meses. Éstos recibieron 750 mg/kg de Respigam o placebo (albúmina). Se observó una disminución de 41% en las hospitalizaciones, en los niños que recibieron Respigam, efecto significativo, por lo que la FDA aprobó el uso del fármaco en pacientes de alto riesgo (5).
Por último, entre 1992 y 1995 se realizó un estudio con 416 niños menores de 48 meses, portadores de cardiopatía congénita, que recibieron 750 mg/kg o placebo. Si bien no se observó una disminución significativa en los niveles de hospitalización de todo el grupo, en los menores de seis meses sí hubo una diferencia significativa, ya que los que usaron el fármaco tuvieron una tasa de hospitalización de 24%, mientras que en el grupo que no lo utilizó, la cifra alcanzó sólo al 10%.
En los pacientes con cardiopatía congénita cianótica con shunt de derecha a izquierda, 28% de los que recibieron Respigam tuvieron episodios de cianosis y muerte en relación con la cirugía, en contraste con el 9% de los que no lo recibieron, diferencia que fue estadísticamente significativa. Por este motivo, su uso no está aprobado en pacientes con cardiopatía congénita (5).
Palivizumab
Palivizumab es un anticuerpo monoclonal tipo Ig G contra la glicoproteína F del VRS. Su administración es intramuscular y genera reacciones adversas mínimas, pero su costo es mayor.
La incidencia de hospitalización por VRS en prematuros en los Países Bajos, entre 1996 y 1999, fue de 7,2 % en los menores de 32 semanas y de 3,6% en los de 32 a 36 semanas. En España, los valores fluctuaron entre 13,4% y 13,1%, y en Italia se describió 14% en los menores de 2.500 gr, en comparación con 6% en la población general y 8,5% en los menores de 36 semanas, con un 4% en la población general.
La administración de Palimizumab quedó aprobada en 1998, y entre 1998 y 2002 se realizaron varios estudios para analizar el efecto de la no administración de este fármaco.
Entre 1998 y 1999, nueve centros de los Estados Unidos hicieron una revisión retrospectiva de niños menores de 35 semanas al nacer, que tenían menos de dos años de vida en el momento de recibir la primera dosis, lo que ocurrió en el período de mayor incidencia del VRS en los Estados Unidos. Se estudió un grupo de 1.839 niños, de los cuales 42 fueron hospitalizados y 2,3% tuvieron VRS confirmado; 23,8% debieron ingresar a UCI y 0,3% necesitaron ventilación mecánica (5).
Entre septiembre de 1999 y mayo del 2000, doce centros realizaron una revisión retrospectiva de 2.830 niños que habían recibido al menos una dosis de Palivizumab. Hubo 68 hospitalizaciones debidas a VRS, lo que determinó una admisión de 2,4%, similar al año anterior; 45,6% de los niños hospitalizados tuvieron enfermedad pulmonar crónica y sólo 0,4% necesitaron UCI.
Entre 2000 y 2001 se realizó un estudio prospectivo multicéntrico en 63 centros; participaron inicialmente 2.116 niños, pero sólo se obtuvo datos completos de 2.049 casos, de los cuales, el 98,3% eran recién nacidos pretérmino y 25,4% tuvieron una edad gestacional de 32 a 35 semanas. La cifra de hospitalización por VRS fue similar, 2,9%.
El último estudio es de tipo prospectivo y fue efectuado entre 2001 y 2002, en 116 centros que acumularon 5.091 niños, los que recibieron al menos una dosis de Palivizumab, con datos completos de 5.084. De ellos, sólo 1,5% fueron hospitalizados por VRS .
Profilaxis contra VRS
La Academia Estadounidense de Pediatría recomienda considerar la profilaxis con Palivizumab en los siguientes casos:
En un estudio prospectivo realizado en Israel y publicado en Pediatrics, se estudió a los pacientes cuyo motivo de ingreso fue bronquiolitis, en once UCI pediátricas, entre noviembre de 2000 y marzo de 2001. Se analizó las necesidades de ventilación mecánica, la mortalidad, los factores de riesgo, la prematurez, la enfermedad pulmonar crónica y la dependencia de oxígeno.
De 105 pacientes con bronquiolitis por VRS, 33 necesitaron ventilación mecánica; de ellos, 84% eran niños mayores de 32 semanas y 89% de ellos no tuvieron enfermedad pulmonar crónica. En 88% de los casos, los pacientes que necesitaron ventilación mecánica no tenían antecedente de enfermedad pulmonar crónica.
Sólo 16% eran menores de 32 semanas y sólo 9% de los pacientes necesitaron ventilación mecánica; fue el grupo de niños que cumplía con los criterios propuestos por la Academia Estadounidense de Pediatría.
La conclusión de este estudio fue que la mayoría de los lactantes hospitalizados por bronquiolitis por VRS, en ese período, fueron recién nacidos de término sin enfermedad pulmonar crónica; de modo que, en la mayoría de los casos, los lactantes admitidos en las UCI por esta patología no fueron candidatos a utilizar profilaxis por VRS.
Por lo tanto, la administración de profilaxis según las recomendaciones actuales podría no producir cambios significativos en la admisión a las UCI o en el número de niños que van a necesitar ventilación mecánica. Este trabajo plantea la necesidad de crear nuevas pautas para la administración de inmunoprofilaxis en el futuro (6).
VRS y vacunas
La infección por VRS determina una respuesta inmune con producción de anticuerpos, principalmente contra las glicoproteínas G y F. Estos anticuerpos ofrecen protección limitada, por lo que las reinfecciones son comunes, pero los altos niveles de anticuerpos circulantes podrían reducir el riesgo de presentar infecciones respiratorias bajas, de modo que los niveles de anticuerpos maternos podrían tener importancia en la protección de los lactantes pequeños contra esta enfermedad.
Las estrategias del desarrollo de vacunas han generado varias posibilidades:
El VRS, al entrar en contacto con la mucosa nasal, genera una respuesta inmune de anticuerpos y activación de linfocitos T helper, en especial Th1, que evitaría la producción de infección respiratoria baja mediante la acción del interferón gamma y la interleuquina 2. En el caso del virus inactivado, se produciría una respuesta tipo Th2 (Figura 3).
Figura 3.
Frente a la infección por VRS, los lactantes tienen una respuesta inmune escasa, por lo que presentan altos índices de reinfección hasta el tercer episodio; después de los nueve meses, la respuesta inmune es más adecuada.
La disminución de la tasa de infección respiratoria baja, en niños con múltiples infecciones, plantea que la protección con vacunas que despierten una respuesta inmune adecuada, será beneficiosa. Por lo tanto, entre los aspectos que hay que considerar al elaborar y utilizar una vacuna, están la respuesta inmune débil de los lactantes, además de la supresión de la respuesta inmune por los anticuerpos maternos circulantes.
Como dato anecdótico, uno de los primeros intentos de proteger con vacunas (1960, con una vacuna inactivada) causó una enfermedad mucho más grave en niños menores de dos años, por lo que se sospechó que se produjo un desequilibrio entre la respuesta inmunológica Th1 y la Th2.
En cuanto a la eficacia de la vacuna, el ideal es que ella actúe durante el brote sobre los subtipos circulantes (VRS A y B) y que despierte una respuesta inmune humoral, secretora y celular de magnitud suficiente para prevenir la enfermedad grave y disminuir las hospitalizaciones y muertes relacionadas con el VRS. Además, se pretende disminuir las complicaciones secundarias como otitis, sinusitis, sobreinfección bacteriana y uso inadecuado de antibióticos.
En cuanto a las estrategias de prevención con vacunas, se ha desarrollado las siguientes alternativas, que se analizarán a continuación:
Inmunización materna
Su objetivo es estimular la producción de anticuerpos maternos neutralizantes durante el segundo y tercer trimestre del embarazo, anticuerpos que pasarán a través de la placenta, por lo que el lactante tendrá anticuerpos elevados al nacer. Por lo tanto, si nace en el período de máxima incidencia de VRS, deberá estar protegido contra la enfermedad grave debida a este agente.
Muñoz publicó un estudio en el que se utilizó una vacuna basada en la proteína de fusión de segunda generación del VRS (PFP-2) en 35 mujeres de 18 a 45 años, con 30 a 34 semanas de gestación y un lapso promedio de 46,9 días entre vacunación y parto. La vacuna fue bien tolerada y no se asoció con un aumento de los síntomas respiratorios. Se observó una leve respuesta inmunogénica, con 100% de transmisión de los anticuerpos al niño, pero con disminución a los 37 días (7).
Se concluyó que lo ideal sería obtener una vacuna similar, que no genere problemas en el embarazo ni para la madre ni para el feto, pero cuya inmunogenicidad sea mayor.
Inmunización primaria en niños pequeños
La vacuna inactivada tuvo mala respuesta, con aumento de la gravedad del cuadro clínico en los niños; en cambio, la administración de virus atenuados no se ha asociado con producción de enfermedad grave.
Los estudios de la respuesta inducida por vacunas modificadas genéticamente indican que lo más probable es que se deba dar dos a tres dosis. Wright realizó un estudio con cepas mutantes, en el que utilizó dos dosis a partir del primer o segundo mes; la primera dosis se asoció con una elevada excreción viral hasta las tres semanas, pero una de estas cepas mutantes se asoció con un aumento de las infecciones respiratorias altas, ya que la primera dosis causó una pobre respuesta de anticuerpos séricos. Con la segunda dosis se observó una reducción de la infección (8).
La inmunización primaria con virus vivos tiene ventajas, ya que se produce inmunidad local y sistémica, es posible administrarla múltiples veces y, además, podría actuar en presencia de anticuerpos maternos, factor de mucho interés.
Los inconvenientes consisten en que tal vez no se les pueda atenuar lo suficiente para administrarlas a niños seronegativos; además, la replicación es prolongada y la transmisión a contactos no vacunados es de 20% a 25%.
En consecuencia, se podría realizar una estrategia combinada y utilizar la vacuna de virus vivo atenuado para inmunizar a los niños, más la inmunización materna. Los anticuerpos maternos podrían proteger a los lactantes y permitir cierto retraso en la primera dosis de la vacuna atenuada; la respuesta sería mejor y el niño tendría más tiempo para crecer y superar este período vulnerable de la vida.
Las vacunas con proteínas de fusión purificada (subunidad PFP), que se aplican en grupos de riesgo, sirven para inducir la formación de anticuerpos neutralizantes que pueden proteger el tracto respiratorio bajo.
Está demostrado que estas vacunas son seguras en niños seropositivos, en portadores de fibrosis quística y displasia broncopulmonar, y en asmáticos; además, lo que es muy importante, también serían seguras en un grupo de riesgo que actúa como fuente de contagio para los niños más pequeños: los adultos mayores, que a su vez pueden presentar cuadros graves.
Nuevas estrategias en vacunas anti VRS
No hay estudios en seres humanos, pero en animales se están efectuando pruebas basadas en el hecho de que algunas proteínas virales pueden ser inmunogénicas y producir respuestas defensivas de tipo humoral y celular (de tipo T), con producción de citoquinas, interferón gamma e interleuquina 5 y 4; lo anterior ha llevado a plantear la posibilidad de efectuar inmunización mediante material genético viral dispuesto en la mucosa nasal para desencadenar el inicio de la respuesta inmune (9).
En octubre de 2003 se publicó un estudio con MGXV (Mucosal Gene Expression Vaccine), en el que se incorporaron segmentos de material genético que codifican antígenos de VRS en un sistema de entrega denominado chitosan, que ofrece estabilidad bioquímica y cuya producción es fácil. Este sistema puede estimular la inmunidad celular y humoral, y los estudios actuales en modelos animales han dado resultados satisfactorios.
Datos preliminares indican que el uso de esta vacuna en la mucosa nasal es seguro y eficaz contra la infección aguda por VRS, en el modelo animal de ratas, y que potencialmente podría prevenir o tratar la enfermedad pulmonar por VRS. La eficacia de esta vacuna se debe a su capacidad para inducir inmunidad humoral en la mucosa e inmunidad celular, incrementando la producción de citoquinas e interferón gamma.
Terapia antiviral
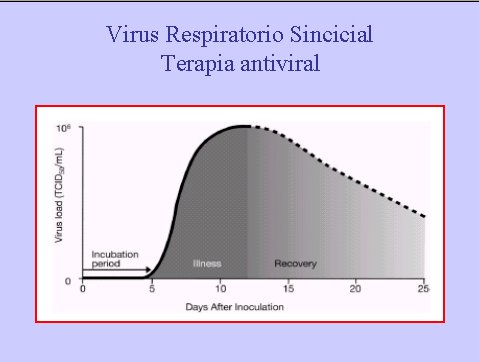
El ideal sería contar con un tratamiento farmacológico que disminuyera la gravedad del cuadro y acortara el período sintomático. Estos antivirales deben afectar el período de mayor carga viral, que probablemente coincide con el comienzo del cuadro clínico y el desarrollo de sintomatología respiratoria alta inespecífica, en el niño.
Sería importante detectar marcadores como citoquinas e interleuquinas, que permitieran evaluar el uso de antivirales en etapas precoces, cuando los síntomas de la infección por VRS son sutiles y éste recién esté replicando. Se sabe que el VRS tiene un período de incubación; los antivirales se deben administrar en el período de aumento logarítmico de la replicación viral, pero la enfermedad como tal alcanza su máxima expresión cuando esta replicación ya ha cesado (Figura 4).
Figura 4.
En un modelo animal se demostró que, en la neumonía por VRS, la gravedad de la enfermedad sigue la dinámica de la replicación viral, pero la enfermedad persiste por mucho más tiempo, aún cuando la carga viral disminuya, debido a mediadores proinflamatorios que también determinan la gravedad de la enfermedad.
En resumen, la administración temprana del antiviral en el curso de la infección permite reducir la carga viral y podría prevenir la fase rápida que induce la formación de mediadores inflamatorios, los que agravan el cuadro.
Ribavirina
La ribavirina es un agente virostático cuyo mecanismo de acción exacto no se conoce; tiene efectos clínicos limitados; es de alto costo y difícil administración. Los estudios iniciales habrían demostrado una reducción de los títulos virales, pero esto no ha sido confirmado en estudios posteriores, de mejor diseño.
En un estudio publicado en 1990 se administró Ribavirina a 20 niños con enfermedad pulmonar subyacente o hipertensión pulmonar (antes de 72 horas del inicio de los síntomas) en una etapa precoz y, probablemente, durante el período de replicación. Después de tres días de tratamiento se demostró una significativa disminución de los síntomas, según un puntaje preestablecido, además de menores necesidades de oxígeno y mayor saturación de oxígeno, en comparación con placebo (10).
Sin embargo, según el Cochrane Review, en el análisis de diez estudios, que acumularon 158 pacientes menores de seis meses, se observó que, aunque no se pudo identificar efectos confiables, tres de los estudios seleccionados demostraron una reducción del tiempo de ventilación mecánica, lo que podría reducir los días de hospitalización. Se concluyó que faltan más experiencias para determinar su utilidad efectiva.
Metapneumovirus humano (hMPV)
Este es un nuevo agente patógeno respiratorio, detectado en los últimos años en Europa y Canadá, y descrito por primera vez en 2001, en Holanda. Forma parte de la familia Paramixoviridae y está relacionado con el VRS, el Parainfluenza, el virus de la parotiditis y el virus del sarampión. Se detectó por reacción en cadena de polimerasa (RCP) y se denominó metapneumovirus humano.
Este descubrimiento planteó que, en un porcentaje de las infecciones en las que no se logra identificar el agente y cuyo cuadro clínico se estima de probable origen viral, la causa puede ser el metapneumovirus humano. Tendría variabilidad estacional y habría al menos dos genotipos distintos.
Lo interesante es que su epidemiología clínica es similar a la del VRS; además, igual que éste, se asocia con bronquiolitis y factores de riesgo similares. La primoinfección subclínica o asintomática es rara, lo que también lo asemeja al VRS.
Greemsell realizó RCP en lavado broncoalveoar de 30 niños con bronquiolitis por VRS grave y determinó que 70% de ellos tenían además RCP positiva para hMPV.
Por otra parte, Vicenti comunicó que, entre 100 muestras positivas para VRS, influenza o parainfluenza, ninguna fue positiva para metapneumovirus, pero que, entre las muestras en que todas las determinaciones fueron negativas, se detectó este agente en 4,1%.
Estudios epidemiológicos plantean que, en alrededor de 10% de los cuadros virales en los que no se logra identificar el agente causal, dicho agente podría ser el metapneumovirus.
En la actualidad no hay exámenes diagnósticos disponibles en la práctica habitual, diferentes de RCP. De existir una prueba diagnóstica asequible, sería muy útil para formar cohortes al detectar casos.
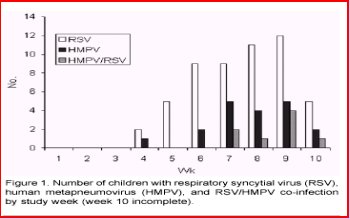
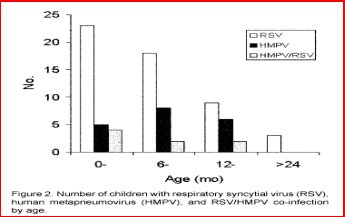
Es importante considerar este virus en presencia de sintomatología sugerente y exámenes virológicos negativos. Este agente puede agregarse a la extensa lista de virus respiratorios humanos que día a día provocan nuevos problemas a las comunidades científicas y médicas, de acuerdo a los gráficos publicados en Emerging Infectious Diseases Vol. 9, No. 12, December 2003 (Figuras 5 y 6) .
Figuras 5 y 6.
Las conclusiones de un estudio realizado en Brasil fueron las siguientes:







 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán.
Edición científica: Dr. Luis Delpiano.
 Expositora:
Daniela Valdivia[1]
Expositora:
Daniela Valdivia[1]

Citación: Valdivia D. Update on respiratory syncytial virus. Medwave 2004 Mar;4(2):e2355 doi: 10.5867/medwave.2004.02.2355
Fecha de publicación: 1/3/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Meissner HC, Welliver RC, Chartrand SA, Law BJ, Weisman LE, Dorkin HL, et al. Immunoprophylaxis with palivizumab, a humanized respiratory syncytial virus monoclonal antibody, for prevention of respiratory syncytial virus infection in high risk infants: a consensus opinion. Pediatr Infect Dis J. 1999 Mar;18(3):223-31. | CrossRef | PubMed |
Meissner HC, Welliver RC, Chartrand SA, Law BJ, Weisman LE, Dorkin HL, et al. Immunoprophylaxis with palivizumab, a humanized respiratory syncytial virus monoclonal antibody, for prevention of respiratory syncytial virus infection in high risk infants: a consensus opinion. Pediatr Infect Dis J. 1999 Mar;18(3):223-31. | CrossRef | PubMed | Halasa NB, Williams JV, Wilson GJ, Walsh WF, Schaffner W, Wright PF. Medical and economic impact of a respiratory syncytial virus outbreak in a neonatal intensive care unit. Pediatr Infect Dis J. 2005 Dec;24(12):1040-4. | CrossRef | PubMed |
Halasa NB, Williams JV, Wilson GJ, Walsh WF, Schaffner W, Wright PF. Medical and economic impact of a respiratory syncytial virus outbreak in a neonatal intensive care unit. Pediatr Infect Dis J. 2005 Dec;24(12):1040-4. | CrossRef | PubMed | Meissner HC, Fulton DR, Groothuis JR, Geggel RL, Marx GR, Hemming VG,et al. Controlled trial to evaluate protection of high-risk infants against respiratory syncytial virus disease by using standard intravenous immune globulin. Antimicrob Agents Chemother. 1993 Aug;37(8):1655-8. | CrossRef | PubMed |
Meissner HC, Fulton DR, Groothuis JR, Geggel RL, Marx GR, Hemming VG,et al. Controlled trial to evaluate protection of high-risk infants against respiratory syncytial virus disease by using standard intravenous immune globulin. Antimicrob Agents Chemother. 1993 Aug;37(8):1655-8. | CrossRef | PubMed | Sánchez PJ. Immunoprophylaxis for respiratory syncytial virus. Pediatr Infect Dis J. 2002 May;21(5):473-8. | CrossRef | PubMed |
Sánchez PJ. Immunoprophylaxis for respiratory syncytial virus. Pediatr Infect Dis J. 2002 May;21(5):473-8. | CrossRef | PubMed | Romero JR. Palivizumab prophylaxis of respiratory syncytial virus disease from 1998 to 2002: results from four years of palivizumab usage. Pediatr Infect Dis J. 2003 Feb;22(2 Suppl):S46-54. | CrossRef | PubMed |
Romero JR. Palivizumab prophylaxis of respiratory syncytial virus disease from 1998 to 2002: results from four years of palivizumab usage. Pediatr Infect Dis J. 2003 Feb;22(2 Suppl):S46-54. | CrossRef | PubMed | Prais D, Schonfeld T, Amir J; Israeli Respiratory Syncytial Virus Monitoring Group. Admission to the intensive care unit for respiratory syncytial virus bronchiolitis: a national survey before palivizumab use. Pediatrics. 2003 Sep;112(3 Pt 1):548-52. | CrossRef | PubMed |
Prais D, Schonfeld T, Amir J; Israeli Respiratory Syncytial Virus Monitoring Group. Admission to the intensive care unit for respiratory syncytial virus bronchiolitis: a national survey before palivizumab use. Pediatrics. 2003 Sep;112(3 Pt 1):548-52. | CrossRef | PubMed | Piedra PA. Clinical experience with respiratory syncytial virus vaccines. Pediatr Infect Dis J. 2003 Feb;22(2 Suppl):S94-9. | CrossRef | PubMed |
Piedra PA. Clinical experience with respiratory syncytial virus vaccines. Pediatr Infect Dis J. 2003 Feb;22(2 Suppl):S94-9. | CrossRef | PubMed | Mohapatra SS. Mucosal gene expression vaccine: a novel vaccine strategy for respiratory syncytial virus. Pediatr Infect Dis J. 2003 Feb;22(2 Suppl):S100-3; discussion S103-4. | PubMed |
Mohapatra SS. Mucosal gene expression vaccine: a novel vaccine strategy for respiratory syncytial virus. Pediatr Infect Dis J. 2003 Feb;22(2 Suppl):S100-3; discussion S103-4. | PubMed |