La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán.
Edición científica: Dr. Luis Delpiano.
Se considera importante tratar este tema, debido a la ausencia de pautas claras para manejar el dolor en el niño, especialmente en la unidad de intermedio, donde se hace más evidente la necesidad de tomar conciencia de la presencia de este síntoma y de aprender a buscarlo, detectarlo, prevenirlo y evitarlo.
La historia del dolor es parte de la historia del hombre, ya que siempre nos ha acompañado, si bien su origen ha variado en las distintas épocas.
La Asociación Internacional para el Estudio del Dolor, en 1994, lo definió como una experiencia sensitiva y emocional desagradable, asociada con un daño tisular real o potencial, o descrito en función de dicho daño.
Mc Caffrey lo describió de la siguiente manera: “Dolor es cualquier cosa que el paciente diga que es dolor, y existe siempre que éste diga que lo hay” .
Los médicos, sin embargo, tienden a definir cuándo hay dolor y su intensidad: olvidan que es individual y subjetivo, de resorte del paciente y no del médico, y que en su percepción influyen la edad, el sexo, el temperamento, el estado afectivo, la experiencia previa de dolor, el contexto o significado, la cultura, cómo los padres perciben el dolor, etc.
En 1980, Loser entregó una descripción práctica para entender la fisiopatología del dolor, el que tiene cuatro dimensiones:
La nocicepción es la única etapa uniforme en todas las personas, porque es bioquímica. Tiene a su vez tres etapas: transducción, transmisión y modulación.
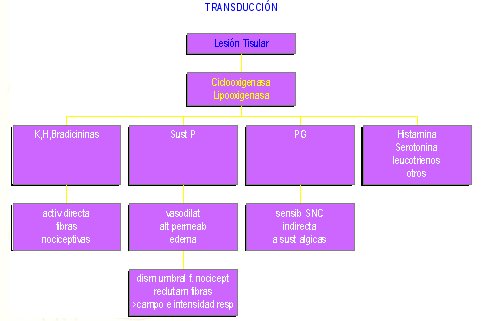
En la transducción, el estímulo químico se convierte en un estímulo eléctrico. En la figura 1 se resumen los episodios que ocurren en esta etapa, la que se inicia cuando se produce una lesión tisular y se activan la ciclooxigenasa y la lipooxigenasa; lo anterior ocasiona:
Figura 1. Nocicepción: Etapa de transducción.
La transmisión, consiste en transmitir el impulso químico transformado en eléctrico. El primer elemento de esa transmisión es el nociceptor propiamente tal, que es la fibra que recibe el estímulo transformado.
Los nervios periféricos y viscerales que transmiten el estímulo al SNC tienen dos tipos de fibras; la primera es la fibra A delta, mielínica, que se activa con estímulos mecánicos y térmicos, y tiene una velocidad de conducción muy alta (5 a 15 m/seg), con el fin de llevar rápidamente el estímulo al SNC, para que el organismo se aleje de la fuente de dolor (retirada).
El segundo tipo es la fibra C, amielínica, que responde a los estímulos químicos, térmicos y mecánicos con una velocidad de conducción más baja (0,2 a 1,5 m/seg), la que permite una transmisión continua, difusa, lejos de la lesión, que determina que el dolor persista. Está relacionada con la memoria, el componente afectivo y otros elementos del dolor, y su objeto es inducir al organismo a buscar refugio o tratamiento.
Las estructuras somáticas, piel, músculos y articulaciones son ricas en fibras A delta, aunque también tienen muchas C; las estructuras viscerales tienen más fibras C y algunas A delta, por eso los dolores viscerales son menos definidos.
La sensibilización es otro elemento de la transmisión. El estímulo repetido de los nociceptores causa una disminución del umbral, debido a una serie de cambios relacionados, entre otros factores, con los canales de calcio; con esto aumenta la sensibilidad y se presenta una respuesta más prolongada. Otras fibras, como las del tacto y propiocepción, tienen umbrales más altos y se fatigan.
A nivel periférico, en la fibra se produce sensibilización por sustancias algésicas, como la sustancia P, que amplifica e incorpora nuevas fibras, disminuye el umbral frente a estímulos repetidos, por lo que cada dolor duele más.
A nivel central, ante los estímulos dolorosos repetidos se producen cambios estructurales en las astas posteriores de la médula, cambian los receptores y los neurotransmisores, lo que causa una amplificación de la respuesta. Este fenómeno se denomina neuroplasticidad.
Entonces, un niño sometido a dolor en forma repetida siente MAS dolor en el presente y va a sentir MAS dolor en el futuro y en la adultez; en suma, aumenta la sensibilidad. Este fenómeno se puede bloquear y por eso es importante la prevención mediante el empleo de anestesia local o epidural, ya que los opiáceos bloquean la neuroplasticidad.
Entonces, producida la lesión, se desencadena una alteración química y ésta se transmite por las fibras A delta hasta la médula y desde ahí hacia los haces espinotalámicos; tienen interacciones con múltiples neuronas a nivel secundario, que regulan el proceso de manera inhibitoria y excitatoria.
La teoría de la puerta de entrada plantea que, al producirse una lesión, se estimulan las fibras nociceptivas del dolor, del tacto y otras; si el estímulo doloroso es mayor que el del tacto, el organismo se va a retirar; si el estímulo del tacto es mayor que el del dolor, la reacción puede ser distinta. A este nivel ejercen su acción la aplicación de calor y masaje local.
Al ascender las fibras, van por dos tractos principales: el neoespinotalámico, que es de conducción rápida y permite retirar la mano de la quemadura, por ejemplo, ya que prácticamente no tiene interconexiones; y el paleoespinotalámico, que es lento, se detiene en el cerebro medio, tálamo y sistema límbico, y aporta el componente individual del dolor: la memoria, la experiencia previa y una serie de otros factores. Al final está la corteza somatosensitiva, que percibe el dolor.
La modulación, se ejerce por medio de las vías descendentes, las que actúan en varias partes del cerebro medio, a nivel periacueductal, mesencefálico, límbico y de núcleos del puente, para ir descendiendo por el cordón dorsolateral hasta llegar a la médula, donde hay una nueva sinapsis y se sintetizan neurotransmisores y opiáceos endógenos que componen el mecanismo analgésico propio (serotonina, GABA, etc.) y determinan la respuesta local al dolor, o sea, la modulación propia.
El último elemento es la percepción del dolor, que está muy relacionada con el sufrimiento y el comportamiento frente al dolor que tiene cada individuo, el que a su vez está determinado por experiencias previas. Por ejemplo, los niños quemados o, incluso, recién nacidos sometidos a punciones repetidas de talón, tienen respuestas alteradas y sienten más dolor cuando se les administra las vacunas.
Varios factores influyen en que el dolor no se trate oportunamente en el niño:
El mito de que el niño no siente dolor como el adulto debemos eliminarlo, porque actualmente se sabe que los prerrequisitos anatómicos, fisiológicos y bioquímicos relacionados con el dolor están presentes desde la vida intrauterina; que las vías del dolor están presentes desde las 24 semanas y la secreción endocrina de cortisol y catecolaminas, que determinan los signos objetivables del dolor, es igual en los recién nacidos que en los adultos.
Sin embargo, se debe considerar que hay diferencias neurofisiológicas en la percepción del dolor:
El desconocimiento de las situaciones clínicas dolorosas también retrasa el tratamiento. Por ejemplo, causa dolor la presencia de espasticidad, tos, hemorragia intracraneana, artritis, derrame, infecciones, adenitis, hernias, obstrucción intestinal, íleo, ascitis, tromboflebitis, meningitis, hipertensión endocraneana, mialgias, etc.
También causan dolor los procedimientos diagnósticos, como punciones lumbares y pleurales, la presión de los músculos para venopunción, la aspiración, la fibrobroncoscopía, las biopsias y los mielogramas. El concepto de quick in quick out, que consiste en que es mejor realizar las menos punciones posibles y rápido, en realidad, no es del todo cierto.
Otra fuente de dolor son los procedimientos terapéuticos, como intubaciones, canulaciones venosas, instalación de sonda nasogástrica, especialmente cuando se moviliza, sondeos vesicales, curaciones de heridas, postoperatorio y escleroterapia.
Es difícil valorar el dolor. Los elementos más fáciles de evaluar son las respuestas fisiológicas, que están determinadas por catecolaminas y cortisol, y que pueden cambiar hasta en 20% en respuesta al dolor.
Los parámetros de esta respuesta son:
Existen múltiples escalas de dolor. Para los adultos y niños mayores de 5 años hay una escala numérica graduada del 0 al 5, o del 0 al 10, en la cual deben ubicar el grado de su dolor. En los menores de cinco años se utiliza una escala con caras con distintas expresiones, sin números; también se utilizan frutas de distintos tamaños. Existe la escala del color rojo, donde se les pide que ubiquen el dolor máximo que sienten.
Además, otras escalas incluyen los elementos fisiológicos aislados o asociados a los cambios de comportamiento. Sin embargo, más que evaluarlo con números, importa darse cuenta de la presencia del dolor y poder catalogarlo como leve, moderado o intenso.
La primera consecuencia del dolor es buena: obliga al individuo a protegerse o alejarse de la fuente de daño.
Entre las malas consecuencias inmediatas: causa irritabilidad; altera el ciclo sueño- vigilia; menor ingesta de nutrientes; puede causar hipertensión endocraneana por cambios en el flujo sanguíneo cerebral; miedo; aumento del consumo de oxígeno y aumento de la acidez gástrica.
A corto plazo, el dolor aumenta el catabolismo, altera el estado emocional y causa alteraciones inmunológicas; a largo plazo se produce memoria del dolor y alteración de la respuesta frente a un nuevo dolor, lo que va a condicionar la forma de ser del niño en el futuro. Es probable que tenga un retardo del desarrollo y dolores más frecuentes durante la infancia y adultez.

 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán.
Edición científica: Dr. Luis Delpiano.
 Expositora:
María Cristina Casado[1]
Expositora:
María Cristina Casado[1]

Citación: Casado MC. Pain in children (part I): history, pathophysiology, assessment and implications. Medwave 2004 Ago;4(7):e2351 doi: 10.5867/medwave.2004.07.2351
Fecha de publicación: 1/8/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión