La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán.
Edición científica: Dr. Luis Delpiano.
La varicela es la infección exantemática más frecuente en los niños; normalmente se aborda como una enfermedad leve, pero no está exenta de riesgo de complicaciones graves, incluso de muerte, en especial en adolescentes, adultos, neonatos y niños inmunosuprimidos o portadores de enfermedades crónicas. Es una enfermedad de presentación endémica, con ciclos epidémicos que se presentan cada 3 a 4 años; su máxima incidencia ocurre entre los 2 y los 8 años de edad y más de 90% de la población la presenta antes de los 15 años.
En los Estados Unidos, antes de la vacunación, había cuatro millones de casos al año; complicaciones en uno de cada 20 a 26 infectados, cifra no despreciable; 11.000 hospitalizaciones; y 100 muertes por año, por esta causa. Después de la vacunación, implementada en 1995, la incidencia de varicela disminuyó en 87% y la mortalidad y las hospitalizaciones en 75%. Como la efectividad no es de 100%, los individuos vacunados pueden presentar la infección, pero será leve y sin complicaciones en casi 100% de los casos. En Chile no existen estadísticas específicas de varicela, pero se calcula que se hospitalizan 700 casos al año y se ha comunicado un aumento de los casos de sobreinfección por Streptococcus pyogenes. Hace años, la incidencia de sobreinfección era de 3% y se ha descrito un aumento hasta de 13%. Lo anterior se podría deber a un fenómeno biológico-epidemiológico que determina un aumento de los casos de complicaciones y muerte, lo que no ocurre en países en que está implementada la vacunación (Nguyen et al. N Engl J Med 2005; 352: 450-458. Rev Chil Infectol 2001; 18: 2001).
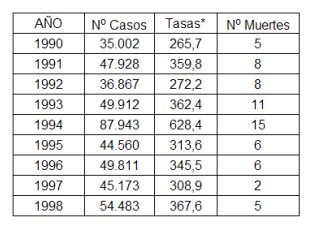
En la Tabla I, que muestra el número de casos y las tasas de infección por varicela desde 1990 a 1998; se puede ver que los niveles han sido variables, con aumento de las tasas en años epidémicos, como 1994, en el que hubo una tasa de 628 por 100.000 habitantes.
Tabla I. Número de casos, tasas y muertes notificadas por varicela en Chile entre 1990 y 1998 (Tasas expresadas por 100.000 habitantes)
Lo prioritario es proporcionar un adecuado manejo para reducir las molestias y evitar las complicaciones; para esto es importante hacer énfasis en las medidas generales: manejo de la fiebre e higiene y manejo del prurito.
En cuanto al uso de antipiréticos para el manejo de la fiebre, hace años se comunicó la asociación entre varicela, antiinflamatorios no esteroidales (AINEs) y síndrome de Reye, por lo que en la mayoría de los países se suspendió el uso de aspirina como antipirético en la varicela y esta complicación ha mostrado un descenso importante. En los últimos años se ha descrito asociación entre uso de AINEs y enfermedad invasora; por eso tampoco se recomienda su administración mientras no existan estudios que avalen su uso; por lo tanto, lo único que se puede recomendar es el paracetamol (American Academy of Pediatrics. Red Book 2004; 510-520). En un trabajo publicado en Pediatrics se describe la relación entre AINEs y enfermedad invasora por S. pyogenes en niños con varicela; en ese estudio se evaluaron 52 pacientes y se concluyó que no hay asociación entre el uso de ibuprofeno y el riesgo de infección necrotizante de tejidos blandos, pero el riesgo de infección invasora por este agente sí aumenta con ibuprofeno, con un odds ratio de 3,9, lo que no se observó con paracetamol. El riesgo no fue mayor al aumentar el tiempo de duración del tratamiento con ibuprofeno (Pediatrics 2001:107;1108-1115).
La higiene y manejo del prurito es un aspecto importante, ya que una buena higiene disminuye en gran medida la complicación mencionada. Se debe recomendar el baño con la mayor frecuencia posible, cuidando de no romper las lesiones y secando con toalla limpia sin frotar, para evitar aumento de las lesiones; se debe evitar la aplicación de cremas y polvos; se deben mantener las uñas cortas y limpias; y se debe evitar el rascado de las lesiones, ya que favorece la sobreinfección. La infección bacteriana de la piel es la complicación más frecuente de varicela y los agentes más frecuentes son el S. pyogenes y Staphylococcus aureus. Lesko publicó un estudio en el que intentó determinar la población en riesgo de infección invasora por S. pyogenes y concluyó que los pacientes provenientes de hogares de bajos ingresos, expuestos a varicela en casa, sobre todo los casos secundarios y con fiebre persistente por más de 8 a 10 días, tenían mayor riesgo de sobreinfección (Lesko et al. Pediatrics 2001; 107:1108-1115)
El antiviral más ampliamente usado en esta enfermedad es aciclovir, cuyo mecanismo de acción consiste en inhibir la replicación del DNA viral por la enzima DNA polimerasa, dependiendo sus beneficios de la precocidad del tratamiento. Otros antivirales disponibles son valaciclovir y famciclovir, que tienen mejor biodisponibilidad que aciclovir, pero no hay estudios en niños que avalen su uso: la mayoría de los estudios se han hecho en niños mayores de 12 años, en los que está claramente recomendado, no así en menores de esa edad, dada la falta de estudios.
La terapia antiviral se indica:
A) en pacientes inmunocomprometidos, que deben recibir aciclovir endovenoso lo más precozmente posible, ya que se obtiene la máxima eficacia si el tratamiento comienza en las primeras 24 a 48 horas de aparecido el exantema, aunque en los niños inmunocomprometidos se debe iniciar aciclovir cualquier sea el grado de avance de la enfermedad, porque la replicación viral es más prolongada que en niños sanos. En estos últimos, la replicación viral cesa a las 72 horas y en los niños inmunocomprometidos se puede prolongar al doble, de modo que está indicado su inicio en cualquier momento de la enfermedad. Las dosis que se recomiendan son 30 mg/kg/día, dividido cada 8 horas, por 7 a 10 días. En algunos trabajos se señala que, si el niño se encuentra en buenas condiciones y sin gravedad extrema, se puede cambiar a terapia oral después de 2 días de tratamiento endovenoso.
B) También se indica terapia antiviral en grupos de riesgo de desarrollar varicela moderada a grave: adolescentes y adultos; personas con enfermedades crónicas, especialmente de piel y pulmón; pacientes con terapia prolongada con salicilatos o con terapia corticocoidal breve, intermitente o en aerosol (los pacientes con terapia cortociodal prolongada se consideran inmunosuprimidos); contactos en el hogar (casos secundarios); lactantes menores, especialmente neonatos e hijos de madres seronegativas, que tendrían más riesgo porque no habría una protección adecuada en los primeros meses de vida por anticuerpos maternos (Abarca K. Rev Chil Infect 2004; 21: S20-S23). La terapia se debe iniciar como máximo hasta las 72 horas de aparición del exantema, siendo de elección el aciclovir por vía oral, en dosis de 80 mg/kg/día, cada 6 horas, por 5 días, con una dosis máxima de 3,2 gramos diarios. En adultos, la dosis está estandarizada en 800 mg cada 4 horas 5 veces al día, por 7 días; como alternativa en adultos se puede usar valaciclovir, 1 gramo cada 8 horas, que sería su principal ventaja, por 5 días.
C) Las embarazadas constituyen otro grupo de riesgo. En este caso no hay acuerdo respecto a la terapia, porque no trabajos que avalen el uso de aciclovir en la mujer embarazada; algunos expertos no lo recomiendan. Se dice que podría prevenir las complicaciones graves de la varicela, pero no se ha comprobado que el uso de aciclovir prevenga la transmisión de la infección al feto. Tampoco se han demostrado efectos teratogénicos en estudios en animales, pero no hay estudios en seres humanos y, por esto, algunos autores no lo recomiendan. La Administración de Alimentos y Drogas (FDA) de Estados Unidos lo considera en categoría C, es decir, se desconocen los riesgos, pero sus potenciales beneficios justificarían su uso en el tercer trimestre del embarazo, y en cualquier etapa de éste si hay complicaciones que pongan en riesgo la vida de la madre y/o el niño.
D) Otra indicación es la varicela grave o complicaciones derivadas del virus. La varicela grave, diseminada, hemorrágica y la neumonía varicelatosa, a cualquier edad, se deben tratar con aciclovir endovenoso, con el mismo esquema que se utiliza en inmunosuprimidos, por 7 a 10 días.
E) En torno a los niños inmunocompetentes hay bastante controversia. El uso de aciclovir no se recomienda de rutina en niños sanos menores de 12 años, debido a que tendría un efecto marginal en una enfermedad de curso benigno y autolimitado. Se ha descrito disminución moderada de la gravedad de los síntomas si se administra dentro de las 24 horas de iniciado el exantema; pero, en un estudio de Cochrane en el que se revisaron 15 trabajos, se comprobó que el uso de aciclovir se asocia con menos días de fiebre, pero sólo uno,, y menos lesiones (English R. Pediatrics in Review 2003; 24: 372-379) Klassen et al. The Cochrane Database of Systematic Reviews 2005). La sintomatología de la enfermedad no disminuyó con el uso de aciclovir, por lo que no se recomienda su uso en niños con bajo riesgo de desarrollar varicela moderada.
La prevención universal de varicela se hace con la vacunación, que constituye una profilaxis pre-exposición. La vacuna antivaricela es un preparado de virus varicela-zoster vivos atenuados de la cepa OKA, que se comenzó a emplear de manera masiva en 1986 en Japón; en Estados Unidos se aprobó su uso en niños sanos, en 1995. Por lo tanto, existen 20 y 10 años de experiencia en su uso, respectivamente.
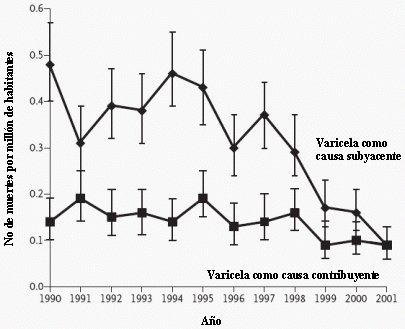
La vacuna tiene una alta inmunogenicidad, principalmente en niños de entre 1 y 12 años de edad, que presentan una seroconversión mayor de 95% luego de una dosis. En mayores de 13 años la seroconversión con una dosis es de 80% y con una segunda dosis aumenta a 95%-99%, por lo que en niños mayores de 12 años se recomiendan dos dosis. La eficacia global de la vacuna es de alrededor de 85% a 90%, pero la eficacia contra enfermedad moderada a grave es de 95% a 100% (Seward et al. JAMA 2004; 292: 704-708). Nguyen publicó un estudio sobre el impacto de la vacuna en Estados Unidos entre 1995 y 2000, en el que se describe que los casos totales de varicela disminuyeron en 80% y las hospitalizaciones bajaron de 2,7- 4,2, a 0,6-1.5 por cada 100.0000 personas; los casos de varicela asociados con infecciones graves por Streptococcus pyogenes también disminuyeron; y la mortalidad causada por varicela disminuyó en 75% (Nguyen et al. N Engl J Med 2005; 352: 450-458) (Fig. 1).
Figura 1: Mortalidad por varicela como causa específica por millón de habitantes, entre 1990 y 2001 (Nguyen et al. N Engl J Med 2005; 352: 450-458)
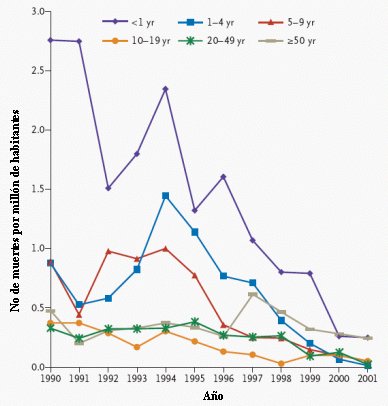
En la Figura 2, la mortalidad se desglosa en los distintos grupos etarios entre 1990, en que la mortalidad se concentraba en los menores de un año, y 2001. Destaca la gran disminución de la mortalidad en ese grupo etario en dicho período, a pesar de que no se vacunaron, lo que se explica por una disminución del virus circulante secundario a la vacunación. Por otra parte, se demostró que a mayor tiempo de empleo de la vacuna, mayor era la disminución de la infección por Streptococcus pyogenes (Patel et al. J Pediatr 2004; 144: 68-74).
Figura 2: Mortalidad por varicela como causa específica por millón de habitantes, entre 1990 y 2001 según grupo etario.
La eficacia de la vacuna en el tiempo, según edad de vacunación, se reduce de 97%, el primer año de vacunado, a 84% en los 7 años siguientes. Actualmente hay una gran controversia, pues la mayoría de los estudios demuestran que hay disminución de la eficacia, pero otros sostienen que no es así. En cambio, la protección contra varicela moderada y grave persiste. La eficacia en el primer año de vacunado depende de la edad del niño, con 99% en mayores de 15 meses de edad y sólo 73% en los vacunados antes de los 15 meses. Este punto se ha discutido mucho, ya que se recomienda administrar la vacuna entre los 12 y 18 meses, pero algunos estudios han demostrado que al aplicar la vacuna a los 12 meses la eficacia es de 73%, cifra que sube a 99% si se aplica sobre los 15 meses (Vázquez et al. JAMA 2004; 291: 851-855). Actualmente se está trabajando en realizar estudios más grandes, para evaluar el problema en forma científica y recomendar la administración a los 15 meses en vez de los 12; para esto tiene que haber un estudio que asegure que el cambio es conveniente.
En cuanto a la duración de la inmunidad en el tiempo, en seguimientos de 6, 10 y hasta 20 años se ha observado que persisten, tanto los anticuerpos tipo IgG como la inmunidad mediada por células, dentro del rango de protección para el paciente, de lo que se deduce que la inmunidad perdura; pero es importante evaluar esta hipótesis a mayor plazo, porque hasta ahora es sólo de 20 años y no se sabe que ocurrirá después. De acuerdo con lo sucedido con otras vacunas virales, es posible que se establezca que se necesita una dosis de refuerzo, por disminución de la eficacia. El temor actual es descubrir que la eficacia en 20 años más es menor, en cuyo caso se podría plantear la necesidad de efectuar la segunda vacunación en la edad adulta.
En los últimos años se ha descrito un aumento de los casos de varicela en niños vacunados, pero en general su presentación es leve, con pocas lesiones y síntomas generales; no se han descrito complicaciones en niños vacunados y se mantiene la eficacia contra casos moderados y graves (Vázquez et al. JAMA 2004; 291: 851-855). En un estudio publicado en 2002 se estudió un brote de varicela en una guardería; el brote comenzó en un niño vacunado y causó la aparición de 25 casos de varicela: 17 en niños vacunados y 8 en no vacunados, o sea, la mayoría de los niños infectados estaban vacunados, por lo que la efectividad de la vacuna fue de 44%, pero 15 de ellos tuvieron varicela muy leve y 2, moderada; en cambio, 4 de los no vacunados tuvieron varicela leve y 4, moderada, luego la eficacia en casos moderados y graves fue alta, de 86% (Galil et al. N Engl J Med 2002; 347: 1909-1915).
Entre los factores que influyen en la falla de la vacuna se cuentan:
Las fallas de la vacuna en niños podrían depender también de los niveles de cobertura de la vacuna. En 8 guarderías en Israel, en que la cobertura de vacuna no superaba el 40%, la eficacia global de fue sólo de 20%, pero la eficacia contra enfermedad moderada a grave se mantuvo (Miron et al. Pediatr Infect Dis J 2005; 24: 233-236). Por otra parte, en una escuela de los Estados Unidos, donde más de 95% de los susceptibles estaban vacunados, la eficacia global de la vacuna fue de 72%; de todas maneras fue menor que el 90% descrito para el primer año de vida, pero nunca tanto como lo ocurrido en Israel, lo que sería atribuible a la cobertura (Tugwell et al. Pediatrics 2004; 113: 455-459).
Keith y su grupo administraron la vacuna junto con otras vacunas con virus vivos, en este caso la trivírica, con el objetivo de evaluar si era posible administrarlas en forma combinada y medir la inmunogenicidad. Para esto reunieron tres grupos: 400 pacientes que recibieron vacuna cuádruple (parotiditis, rubéola, sarampión y varicela); 200 pacientes que recibieron sólo varicela; y un tercer grupo en que las administraron separadas. Observaron una respuesta similar de anticuerpos post-vacunación en parotiditis, rubéola y sarampión, en pacientes que recibieron cuádruple y trivírica; y no hubo diferencias en los pacientes que recibieron cuádruple ni en los pacientes que recibieron trivírica más varicela, por lo que concluyeron que una vacuna no disminuye la inmunogenicidad de la otra y que se pueden administrar juntas, incluso en una misma dosis. La seropositividad post-vacunación de los cuatro virus fue de 100% y hubo leve aumento en los títulos de parotiditis, rubéola y sarampión, pero eran niños de cuatro años que ya tenían títulos para esta vacuna. Asismismo, hubo un aumento sustancial en los títulos de varicela, ya que estos niños ya habían sido vacunados (Keith et al. Pediatrics 2006:117;265-272).
La transmisión del virus vacuna es extremadamente rara y ocurre solamente cuando la vacuna causa exantema como efecto secundario, lo que ocurre en algunos niños, pero la enfermedad que se desarrolla por este tipo de exposición suele ser muy leve. Se ha informado que alcanza a 0,4% (English R. Pediatrics in Review 2003; 24: 372-379).
En cuanto a la posología, la recomendación habitual es entre los 12 y los 18 meses, lo que en el futuro puede variar a entre los 15 y los 18 meses, lo mismo que en adolescentes y adultos susceptibles y con factores de riesgo. Los niños de 1 a 12 años pueden recibir una dosis; en adolescentes y adultos se indican dos dosis, con un intervalo de 4 a 8 semanas. La vacunación es efectiva desde los tres a cinco días posteriores a la vacuna (American Academy of Pediatrics. Red Book 2004; 510-520). Respecto a la indicaciones, actualmente la tendencia es a su uso universal (entre los 12 y los 18 meses); también estaría indicada en pacientes con HIV asintomáticos con CD4 mayores de 500; en pacientes con leucemia linfática aguda en remisión; en pacientes con enfermedades crónicas; en contactos de inmunocomprometidos; en adolescentes y adultos susceptibles; y en trabajadores de la salud susceptibles. Está contraindicada en pacientes inmunocomprometidos y usuarios de terapia inmunosupresora, así como en embarazo y lactancia.



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán.
Edición científica: Dr. Luis Delpiano.
 Expositora:
Carmina González Monzón[1]
Expositora:
Carmina González Monzón[1]

Citación: González C. Varicella I. Medwave 2006 Sep;6(9):e2425 doi: 10.5867/medwave.2006.09.2425
Fecha de publicación: 1/10/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión