 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
Los virus papiloma (VPH) presenta entre sus particularidades la propiedad de ser activos durante un buen tiempo. Se sabía que eran los agentes etiológicos de las verrugas, pero fueron una incógnita hasta el desarrollo de la biología molecular. Sin embargo, este tipo de virus no ha podido ser replicado in vitro, puesto que su proceso replicativo requiere de un epitelio completo en diferenciación.
Lo otro es que los VPH se presentan como varios genotipos, o sea, existe una variación genética; porque al ser virus DNA, que utilizan la maquinaria celular, se producen variaciones genéticas grandes. Se conocen más de 100 genotipos de VPH que tienen variaciones en diferentes partes de su genoma, lo cual es una particularidad. En los adenovirus y virus herpes no se desarrollan estas grandes variaciones genéticas.
Los VPH poseen un genoma organizado en forma muy especial, pues está constituido por los denominados “marcos de lectura abiertos”, en el que se producen una sobreposición de genes (por ejemplo el gen Gn 2 se sobrepone con el famoso Gn 4 y 3), lo cual obedece a que el genoma viral se encuentra encriptado con múltiples mensajes genómicos. También aparecen los nombrados genes “E” (genes tempranos), que codifican para proteínas tempranas al momento de la infección celular; y los genes “L” (genes tardíos) que codifican las proteínas estructurales que formarán parte de la partícula viral (Figura 1).
Figura 1. Esquema genómico de los VPH.
De los 100 genotipos existentes, 30 infectan al tracto genital, en lo que hay que aclarar que los virus que infectan mucosas y los que infectan epitelios no son los mismos, lo cual tiene una implicancia clínica y epidemiológica importante, pues una verruga de la piel no es capaz de transmitir el virus al tracto genital (rango de huésped muy estricto).
Existe una variación genética del genotipo, pero también de variantes genéticas, lo que plantea el hecho de que diferentes virus producen diferentes infecciones y defectos dentro de la célula que infectan.
En la actualidad, se conoce en forma muy clara, que hay genotipos asociados a cánceres, en especial al cáncer de cuello uterino, y que se denominan genotipos de alto riesgo oncogénico (genotipos 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 67, 68, 69, 70 y 82), en tanto hay otros no oncogénicos o que nunca se han encontrado en tumores y que tampoco son capaces de transformar células normales en tumorales (genotipos 6, 11, 13, 44 y 74).
Hoy en día, con el análisis de la genética molecular, se puede establecer el parecido entre los genomas, cuánto se parecen entre si y construir los llamados dendrogramas de homología genética; en los que se aprecia que los genotipos de alto riesgo oncogénico se asemejan genéticamente y, por lo tanto, habría una proyección biológica hacia la clínica, pues el parecido genético se relaciona con la propiedad patogénica de la inducción tumoral. No obstante, están otros genotipos que se asemejan entre sí (genotipos 6 y 11 por ejemplo), pero que no poseen propiedades oncogénicas, lo cual se explica por su pertenencia a una familia diferente. Se infiere entonces que la propiedad oncogénica depende de la genética del virus (Figura 2).
Figura 2. Dendrograma de genotipos y filogenia de VPH.
Todos los candidatos de virus que estén asociados a cáncer tienen que cumplir con ciertos postulados. En primer lugar, la epidemiologia del cáncer debe ser similar a la infección viral, por lo que a mayor prevalencia de infección viral mayor incidencia en el tipo de cáncer (ejemplo: linfomas y virus Epstein Barr); por otro lado, la infección viral debe preceder al desarrollo de cáncer y la seroepidemiología muestra que los pacientes con cáncer poseen niveles elevados de anticuerpos en comparación con controles. Lo más importante, sin embargo, es que se pueda detectar material genético (DNA, RNA y/o proteínas virales) en las células tumorales, y que los virus oncogénicos deben ser capaces de transformar células normales in vitro e inducir el desarrollo de tumores en animales.
Las infecciones por VPH son extraordinariamente frecuentes, la mayor parte de ellas asintomáticas, y sólo un pequeño grupo de estas infecciones logra producir una manifestación clínica. La mayoría de la infecciones tras un periodo de tiempo prolongado se resuelven de forma natural, pero algunas pequeñas persisten, y sólo un grupo pequeño, después de 12 meses, logra progresar hacia lesiones clínicas. Por lo tanto, aquellas infecciones que persisten por 12 meses o más pueden evolucionar hacia una presentación clínica.
Si junto con los datos anteriores, se estudia la epidemiologia de las infecciones por VPH, es posible observar algunas condiciones particulares. Se aprecia entonces que en mujeres sanas menores de 20 años las infecciones genitales por VPH son extraordinariamente frecuentes en una proporción del 25 a 30%, las cuales se resolverán en un periodo de seis meses; en aquellas mujeres entre 20 a 24 años, las infecciones disminuyen a alrededor de 18%; entre los 25 a 49 años disminuyen aún más, pero nunca hasta el valor nulo. No obstante, a partir de los 50 años, vuelven a aumentar las infecciones lo que coincide con la menopausia y con los cambios del switch hormonal; cuya explicación reside en que los VPH tienen dentro de su genoma una secuencia que no codifica para proteínas virales, pero sí es una secuencia blanco para receptores de estrógeno, por lo tanto, el estrógeno condiciona la infección viral y, sumado al rol que tiene la inmunidad en el tracto genital, aparece una reactivación de infecciones en el periodo de la post menopausia (1) (Figura 3).
Figura 3. Prevalencia de infecciones genitales por VPH según grupo etario.
Lo segundo, por la naturaleza de los genotipos de VPH, se sabe que la mayor frecuencia de los genotipos virales en infecciones del tracto genital corresponde a los genotipos 16 y 18, razón por la cual se ha diseñado una vacuna contra estos genotipos. El estudio internacional demuestra que el genotipo con mayor prevalencia corresponde al 16 con el 45%, seguido por el genotipo 18 con 12%, lo cual no ocurre en Chile, pues tras el genotipo 16 comienzan a aparecer genotipos poco frecuentes a nivel internacional como el 56, el 31 y 58 (Figura 4).
Figura 4. Distribución de genotipos de VPH a nivel nacional e internacional.
Un estudio realizado en el Hospital San Juan de Dios, compara las frecuencias de genotipos de VPH obtenidas en la población general y en el servicio de ginecología del mismo hospital. Al observar los resultados se aprecia la coincidencia de los genotipos predominantes (en especial del 16), lo que concuerda además con las lesiones producidas (Figura 5).
La patogenia del cáncer cervicouterino ha sido un verdadero paradigma, porque se ha encontrado que las células normales se transformaban primero en células desdiferenciadas con displasias leves (lesiones de bajo grado), luego moderadas, después severas o carcinomas in situ (lesiones de alto grado) para finalizar como un carcinoma invasor. Este proceso ha sido llamado in continuo por el Dr. Ralph Richard, y que ha servido como modelo para las diferentes neoplasias.
Otra característica especial de la patogenia es el hecho de que el proceso requiere de un periodo de tiempo de años, lo cual permitió, en el caso del cáncer cervicouterino, sentar las bases de la oncología preventiva a través del examen del Papanicolaou en forma periódica, con el cual se puede identificar si las células son normales o presentan displasia leve, moderada, severa o ya han constituido el carcinoma in situ. El problema con el examen es la educación y cultura, pues los recursos están, por lo que en base a la biología y su proyección a la clínica (en teoría) nadie debiera enfermar ni morir de cáncer de cuello uterino.
También se han descubierto que tras la displasia leve no existe producción de virus, pero estos vuelven a aparecer en los periodos de displasia severa y carcinoma in situ, con altos niveles de la proteína o gen E6 y E7, en donde finalmente ocurre la integración del genoma viral al celular. Es la anatomía patológica la encargada de sugerir en qué etapa de la infección se encuentra la paciente, pero la comprobación está dada por el marcador molecular que indica el estado del VPH. (Figura 6).
Figura 6. Patogenia del cáncer de cuello uterino.
Progresión tumoral. El cáncer de cuello uterino aparece en la zona de transición epitelial, la cual consta de células troncales (stem cells) desde donde se originan la mayor parte de los cánceres. De manera que algunas stem cells sufren la transformación y se convierten en displasia o adenoma producto de la infección por VPH, luego otras alteraciones genéticas condicionan que la expresión del genoma viral (si se integran o no E6 y E7 en forma permanente) origine el carcinoma in situ y otros cambios genéticos permitirán que la célula destruya la lamina basal entre al estroma en lo que se conoce como Transición Epitelio-Mesénquima (Epitelial-Mesenchymal Transition).
Después de los cambios previos se inicia el proceso de intravasación (atravesar vasos linfáticos o sanguíneos) por donde las células se diseminarán para dar origen a las metástasis (Figura 7).
Figura 7. Esquema de la progresión tumoral del cáncer de cuello uterino.
Con esta nueva información, se destaca el hecho de que las infecciones dan origen a lesiones de bajo grado con gran frecuencia en menores de 25 años y no existe, en la práctica, cáncer en mujeres de este grupo etario, porque se requiere un proceso que dura años (25 a 35 años). Con el pasar del tiempo, disminuyen las lesiones de bajo grado y aumentan las de alto grado a la edad de 35 a 40 años; y entre los 45 y 55 años es donde está la mayor frecuencia de cáncer de cuello uterino (Figura 8).
Figura 8. Prevalencia de lesiones genitales.
A la histología, se estudian las lesiones de bajo grado (células binucleadas, con coilocitos) y las lesiones de alto grado (transformación en el núcleo de morfología esmerilada e hipercromías abundantes).
Pero lo clave, desde el punto de vista de la oncogénesis viral, es que el DNA viral permanece episomal (no integrado al DNA celular) en los papilomas, mientras que en los carcinomas aparece integrado. Por lo tanto, la prueba molecular para demostrar el inicio de un proceso maligno es la integración del DNA viral, el cual se manifiesta en la ausencia de producción vírica o viriones, y la expresión abundante de las proteínas virales E6 y E7 (Figura 9).
Figura 9. Biología molecular de las infecciones genitales por VPH.
Detección de VPH por PCR. Hoy en día, a través de las técnicas de biología molecular, se conoce el genoma del VPH en forma completa y las secuencias de todos los genotipos, datos con los cuales se han logrado desarrollar primers o partidores de consenso. Así entonces, existen partidores para la secuencia L1 del virus, la cual codifica para la proteína que permite la infección del VPH a las células de la mucosa las que no discriminan cuan distintos son los virus; razón por la que se utiliza el partidor MY09/11 para amplificar una secuencia de 450 pares de bases a través de la reacción en cadena de la polimerasa, GP 5+/6+ que amplifica a 150 pares de bases, y el partidor SPF1/2 que amplifica 65 pares de bases.
Tipificación de VPH por PCR. Existen varias maneras de conocer el genotipo viral, ya sea a través de la secuenciación de ADN, por reacción de hibridación de ácidos nucleicos, o por la digestión con endonucleasas de restricción de la muestra amplificada, método más sencillo que los anteriores. Hay dos endonucleasas de restricción, RSA1 y DD1, que cortan específicamente el DNA de los diferentes VPH en distintas regiones. Tras agregar las nucleasas, se generan fragmentos de ADN los que posteriormente se separan por electroforesis.
Integración genómica del VPH. Cada vez que el virus infecta la célula y se integra al genoma, en sitios conocidos como “sitios frágiles”, lo hace siempre en la misma región del DNA viral, que es en la ruptura del gen E2; lo que significa además que los genes E6 y E7 se mantienen íntegros y para permitir su lectura durante la integración. Se entiende entonces que el gen E2 es el director de orquesta que permite la replicación del virus, pero no producción de viriones; no obstante se mantienen regiones que regulan la expresión de las proteínas E6 y E7. El DNA del VPH episomal consta sólo de 9.000 pares de bases, las cuales aumentan al estar integrado al DNA celular.
Con la integración del genoma, existirá una expresión de E6 y E7 en las células tumorales de un carcinoma de cuello uterino que podrán ser detectadas por hibridación in situ.
Líneas celulares del cáncer de cuello uterino. Henrietta Lacks, madre de cuatro hijos, acudió a su médico en 1951 en Baltimore, Maryland, por presentar hemorragias vaginales intermitentes. El diagnóstico de la mujer fue cáncer de cuello uterino que, después de nueve meses, esta falleció a los 31 años de edad. Doctor Otto Grey, biólogo de Johns Hopkins, obtuvo células del tumor de la señora Lacks, con las cuales logró establecer la línea celular humana más antigua: las células HeLa.
Al trabajar y reproducir in vitro las células HeLa, se determinó que corresponde a un adenocarcinoma de cuello uterino que derivó del endocérvix y que tiene secuencia de VPH 18 integrado. Pero otra línea celular, conocida como células Casky que derivaron de una mujer de 54 años, corresponde a un carcinoma epidermoide, tipo histológico más frecuente en mujeres mayores de 50 años, que se originó del exocérvix y que tiene secuencias de VPH 16.
Transformación maligna por VPH. La esencia del proceso oncogénico, desde el punto de vista molecular, es que las proteínas E6 y E7 se logran unir a dos proteínas supresoras de tumor del organismo humano. La proteína E6se una a la proteína p53 y la destruye, y E7 se une a p105Rb, proteína del retinoblastoma y supresora de tumores, y la neutraliza e impide que ejerza su efecto.
Años atrás, se trató de estudiar cual era el efecto o susceptibilidad de p53 en esta unión con E6. Hoy en día se sabe que hay proteínas celulares que, al existir en las células, tienen diferentes comportamientos y respuestas, lo que ha determinado los polimorfismos de nucleótido simple. A modo de esquema, la presencia de dos alelos iguales pueden determinar un aminoácido, pero también estos alelos pueden ser uno igual y el otro diferente, y determinar un heterocigoto; o puede ser que existan dos mutaciones y ser homocigoto para otro aminoácido; y es este esquema al que se denomina polimorfismo de nucleótido simple.
Así entonces, se observó que p53 presentaba un polimorfismo importante en el codón 72, el cual podría codificar para prolina-prolina en los dos alelos; o podía codificar para Arginina y Prolina en uno y Arginina en el otro; o bien, ser homocigotos para Arginina. Esto tendría un significado importante por su unión a la proteína E6, la que sería determinante de este polimorfismo.
En un estudio realizado en el año 2003, en que se analizó el polimorfismo presente en pacientes chilenas con cáncer de cuello uterino (60 casos) y pacientes sanas (53 mujeres). Se encontró que en el 68,3% de las pacientes con cáncer y en el 47% de las mujeres el polimorfismo más frecuente fue Arginina/Arginina, cuya proporción también fue significativa en comparación a los demás alelos. Entonces hay una diferencia importante en el tipo de polimorfismo para determinar la frecuencia de estos carcinomas que es multifactorial, pero estos factores no son determinantes de los polimorfismos, sino que contribuyen a ellos (2) (Tabla 1).
Tabla 1. Polimorfismo Arginina/Prolina del codón de p53.
Detección de la proteína E6. E6 y E7 actúan como marcadores proteicos de este proceso, los cuales pueden ser detectados por medio de anticuerpos fluorescentes mientras están unidas a sus respectivas proteínas. Se ha propuesto un proyecto orientado hacia el diagnostico y la clínica utilizar este tipo de anticuerpo directamente en frotis de Papanicolaou.
La proyección oncología médica es otro tema que se investiga en la actualidad, el disponer de medicamentos que sean efectivos en el tratamiento del cáncer de cuello uterino, por lo que se han generado experiencias con drogas antineoplásicas, pero todavía existen limitaciones.
Lo que se ha realizado es utilizar en forma experimental lo que se llama RNA de interferencia, que simula un micro RNA (mRNA) creados de forma artificial a partir del DNA viral. Con este proceso, la secuencia de RNA sintetizada servirá de molde para la creación de una droga antisentido (oligonucleótido) que detendrá la síntesis de las proteínas virales (3).
Se ha desarrollado una vacuna que está basada en lo que se conoce como Viral Live Particles, que son carcasas proteicas sin genoma viral, pero que contienen antigénicamente las proteínas de los VPH 16 y 18, que son los más frecuentes a nivel mundial.
La frecuencia de los genotipos varía según la zona de estudio, así por ejemplo en Estados Unidos se encuentran en una proporción de 76%; en Europa es de 74%; en Oceanía es de 78%; en África de 70%; en Asia es de 67% y en América latina alcanza el 65% (4).
Con el avance de la tecnología, ha surgido la posibilidad de definir diferentes haplotipos de genomas de DNA mitocondrial y seguirlos al igual como si fueran grupos sanguíneos. En América Latina, los haplotipos predominantes son A, B, C y D; los que son muy parecidos a los que se presentan en el norte de Clovis, Nuevo México, en donde existe una cultura muy primitiva del poblamiento de América.
Se desprende entonces que VPH proviene de las migraciones humanas desde Asia vía estrecho de Bering; que en el caso de Chile se produjeron hasta Puerto Montt. Estos microorganismos han permanecido por años junto al ser humano y esa es la condición básica microbiológica para establecer condiciones persistentes, desde donde se han producido entradas y salidas de genes del VPH, y por eso los genotipos son diferentes a nivel mundial; lo cual tiene implicancia en la vacuna, que sólo alcanza una cobertura de 65% (para América Latina). Por ende, se debe considerar la vacuna como una excelente herramienta complementaria, pero no hay que descuidar lo que realmente está establecido, que es la prevención a través del Papanicolaou y de exámenes periódicos, con lo cual se puede lograr un perfecto control de la enfermedad (5).

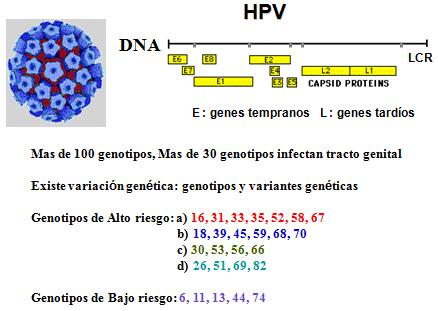 Figura 1. Esquema genómico de los VPH.
Figura 1. Esquema genómico de los VPH.

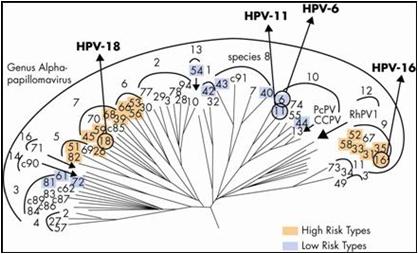 Figura 2. Dendrograma de genotipos y filogenia de VPH.
Figura 2. Dendrograma de genotipos y filogenia de VPH.

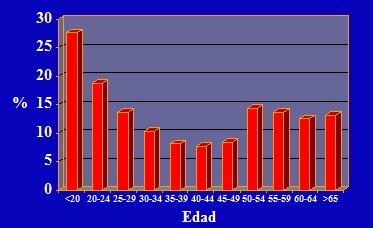 Figura 3. Prevalencia de infecciones genitales por VPH según grupo etario.
Figura 3. Prevalencia de infecciones genitales por VPH según grupo etario.

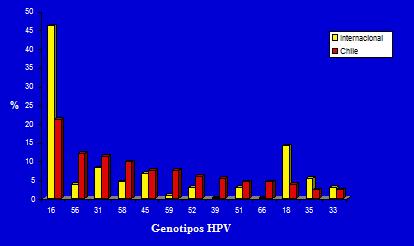 Figura 4. Distribución de genotipos de VPH a nivel nacional e internacional.
Figura 4. Distribución de genotipos de VPH a nivel nacional e internacional.

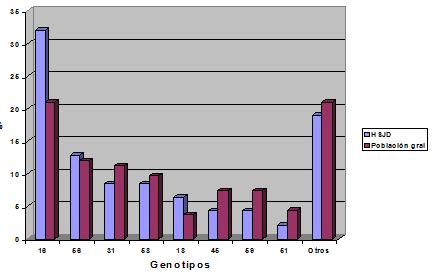 Figura 5. Frecuencias de genotipos de VPH en la población general y en los pacientes del servicio de ginecología del hospital San Juan de Dios.
Figura 5. Frecuencias de genotipos de VPH en la población general y en los pacientes del servicio de ginecología del hospital San Juan de Dios.

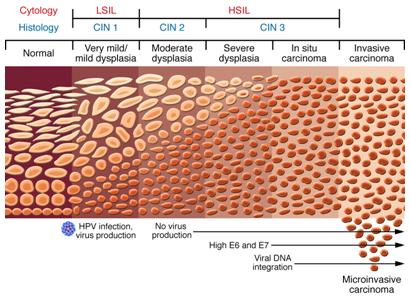 Figura 6. Patogenia del cáncer de cuello uterino.
Figura 6. Patogenia del cáncer de cuello uterino.

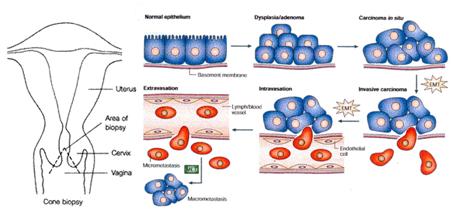 Figura 7. Esquema de la progresión tumoral del cáncer de cuello uterino.
Figura 7. Esquema de la progresión tumoral del cáncer de cuello uterino.

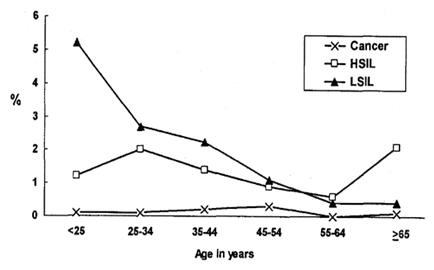 Figura 8. Prevalencia de lesiones genitales.
Figura 8. Prevalencia de lesiones genitales.

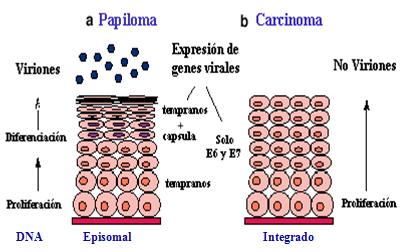 Figura 9. Biología molecular de las infecciones genitales por VPH.
Figura 9. Biología molecular de las infecciones genitales por VPH.

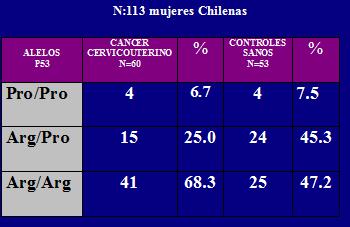 Tabla 1. Polimorfismo Arginina/Prolina del codón de p53.
Tabla 1. Polimorfismo Arginina/Prolina del codón de p53.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
 Expositor:
José Manuel Ojeda F.[1]
Expositor:
José Manuel Ojeda F.[1]

Citación: Ojeda JM. Human papillomavirus: from biology to the clinic. Medwave 2010 Jul;10(7):e4619 doi: 10.5867/medwave.2010.07.4619
Fecha de publicación: 1/7/2010

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Nombre/name: Juan Carlos CARVAJAL
Fecha/date: 2010-07-01 16:20:29
Comentario/comment:
No me dedico a onco y fue como volver a clases de virologÃa despues de 40 años. Me aclaró muchas dudas. Gracias "Profe" Ojeda
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Ferreccio C, Prado RB, Luzoro AV, Ampuero SL, Snijders PJ, Meijer CJ, et al. Population-based prevalence and age distribution of human papillomavirus among women in Santiago, Chile. Cancer Epidemiol Biomarkers Prev 2004;13(12):2271-6. | PubMed |
Ferreccio C, Prado RB, Luzoro AV, Ampuero SL, Snijders PJ, Meijer CJ, et al. Population-based prevalence and age distribution of human papillomavirus among women in Santiago, Chile. Cancer Epidemiol Biomarkers Prev 2004;13(12):2271-6. | PubMed | Ojeda JM, Ampuero S, Rojas P, Prado R, Allende JE, Barton SA, et al. p53 codon 72 polymorphism and risk of cervical cancer. Biol Res 2003;36(2):279-83. | CrossRef | PubMed |
Ojeda JM, Ampuero S, Rojas P, Prado R, Allende JE, Barton SA, et al. p53 codon 72 polymorphism and risk of cervical cancer. Biol Res 2003;36(2):279-83. | CrossRef | PubMed | Jiang M, Milner J. Selective silencing of viral gene expression in HPV-positive human cervical carcinoma cells treated with siRNA, a primer of RNA interference. Oncogene 2002;21(39):6041-8. | CrossRef | PubMed |
Jiang M, Milner J. Selective silencing of viral gene expression in HPV-positive human cervical carcinoma cells treated with siRNA, a primer of RNA interference. Oncogene 2002;21(39):6041-8. | CrossRef | PubMed |