 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
Las complicaciones de la cirrosis hepática no han cambiado a lo largo del tiempo, pero sí lo han hecho las opciones de tratamiento, en especial durante los últimos ocho años. En la actualidad, las principales causas de cirrosis hepática son las de etiología alcohólica, los virus hepatotropos que producen hepatitis (en especial por hepatitis C, seguido de hepatitis B), etiología autoinmune (hepatitis autoinmune y cirrosis biliar primaria), y por último la esteatohepatitis no alcohólica (EHNA) que se relaciona en su etiopatogenia con el síndrome metabólico, que ha aumentado notoriamente en el ùltimo decenio, llegando a ser por ejemplo, la principal causa de trasplante hepático en el Hospital Clínico de la Universidad de Chile.
Al enfrentar a un paciente cirrótico, se debe definir si la enfermedad basal se encuentra compensada o descompensada, para lo cual es necesario evaluar la presencia de ictericia, ascitis, desnutrición, hepatocarcinoma o várices con riesgo de sangrado. La mayoría de los pacientes compensados tiene una buena sobrevida de 10 años, pero una vez que ocurre un evento descompensante, la sobrevida cae en forma inexorable a 15% en cinco años; no obstante, la probabilidad que ocurra alguno de estos eventos es de un 10% anual. Así entonces, el rol de los médicos es mantener la enfermedad compensada y así evitar el trasplante hepático junto con lograr una mejor sobrevida.
Una de las formas disponibles para evaluar la gravedad de la cirrosis hepática es determinar el número y gravedad de las complicaciones mayores, al igual que la estimación de la calidad de vida. En el primer caso, la medición resulta subjetiva y “manipulable”, en tanto que la segunda no es cuantificable ni aplicable.
Otro método más objetivo, que se usa en forma habitual, es el índice de Child-Pugh que tiene ciertas desventajas, pues dos de los criterios a evaluar son subjetivos (ascitis, que se puede modificar con el uso de diuréticos; y encefalopatía) y las variables restantes tienen el problema de presentar un límite superior cuestionable, por ejemplo, no habría diferencia pronóstica entre un paciente con 3 mg/dl de bilirrubina comparado con uno que tenga 15 mg/dl, ya que ambos tendrían igual puntaje en este criterio (Tabla 1).
Tabla 1. Clasificación de Child-Pugh.
En el mundo, y en Chile, se comienza a aplicar el sistema de puntaje model for end stage liver disease (MELD) como índice pronóstico, cuya ventaja radica en que sólo utiliza tres variables cuantitativas, objetivas y fáciles de evaluar, con las que se calcula un puntaje total en base de una fórmula matemática, cuyos valores se distribuyen entre 6 y 40. Este score evalúa, en orden de importancia estadística, el INR, creatinina y bilirrubina. La incorporación de la función renal es la gran ventaja con respecto a la clasificación de Child-Pugh (Tabla 2).
La mortalidad se relaciona en forma directa con el puntaje obtenido en el score MELD en pacientes en lista de espera para trasplante hepático. Un valor menor a 10 se correlaciona con 2% de mortalidad a tres meses y, por lo tanto, no tendría indicación de trasplante; sin embargo, con valores mayores o iguales a 15 (en especial mayores de 20) la mortalidad aumenta en forma importante. Por lo anterior, a nivel mundial ya no se utiliza la clasificación de Child para definir la gravedad de los pacientes en lista de espera de trasplante hepático, sino el score MELD (Tabla 3) (1).
Tabla 3. Riesgo de muerte en pacientes en lista de espera para trasplante hepático.
Las potenciales complicaciones más relevantes de la cirrosis hepática son ascitis, síndrome hepatorrenal (SHR), hemorragia variceal, miocardiopatía y hepatocarcinoma.
Los pacientes cirróticos desarrollan con frecuencia hipertensión portal lo cual determina un aumento de factores vasodilatadores como oxido nítrico y otros péptidos, que entonces provocan una vasodilatación arterial esplácnica patológica con la consecuente hipotensión, que se presenta desde la etapa Child B en adelante, y que es sensada como una hipovolemia por los barorreceptores centrales. Se activa así el sistema nervioso simpático, el sistema renina-angiotensina-aldosterona y aumenta la liberación de hormona antidiurética. La activación persistente del sistema produce una vasoconstricción intensa a nivel cutáneo, cerebral, muscular y del territorio renal, cuya máxima manifestación es el SHR. Junto con lo anterior, se produce una retención de sodio y agua que determina la aparición de ascitis y edema, y la disminución de la excreción de agua libre que se manifiesta como hiponatremia con volumen extracelular expandido (Fig. 1).
Fig. 1. Potenciales complicaciones de la Cirrosis.
El eventual tratamiento del estado de hiperaldosteronismo consiste en la utilización de un diurético distal como la espironolactona, para el cual existen dos modalidades de administración. El primer esquema, llamado progresivo, consiste en el uso del medicamento como monoterapia en dosis creciente hasta alcanzar la dosis máxima (100, 200 y por último 400 mg/día); y de no existir respuesta favorable se asocia, a la dosis máxima de espironolactona, furosemida en dosis creciente hasta alcanzar también la dosis máxima (40, 60, 80 y 160 mg/día). La segunda modalidad, o esquema combinado, es el comienzo de una terapia biasociada de espironolactona más furosemida, en dosis de 100 mg/día y 40 mg/día en forma respectiva, y reevaluar el aumento al doble de la dosis cada cuatro días, hasta llegar a un máximo de 400 mg/día de espironolactona y 160 mg/día de furosemida.
La tasa de respuestas para el esquema progresivo es de 94%, en tanto para el esquema combinado es de 98%; con una media de respuesta aproximada de 12 días para ambos esquemas, pero la necesidad de reducir las dosis por hipovolemia, insuficiencia renal, hiponatremia o encefalopatía es mayor si se asocian dos diuréticos en comparación al uso de espironolactona como monoterapia. Por lo tanto, el esquema progresivo es preferible en pacientes con cirrosis y ascitis (2).
Tratamiento ideal de ascitis grado 2. Es importante la determinación de la natriuresis previo al tratamiento diurético, sin importar si se analiza a partir de muestra aislada o mientras se usan diuréticos. Si el paciente tiene menos de 10 mEq/Lt en muestra aislada, lo más probable es que el proceso de antinatriuresis sea grave, por lo que la respuesta a los diuréticos será deficiente y se deberán utilizar altas dosis desde un comienzo. La respuesta ideal en pacientes sin edema es perder entre 200 a 500 gr/día de peso, en tanto en pacientes con edema, será de 500 a 1000 gr/día (Tabla 4).
Tabla 4. Esquema de tratamiento según excreción de sodio.
El tratamiento de la ascitis moderada no requiere ingreso hospitalario, ya que puede ser controlada bajo una restricción moderada de sodio de 4 a 5 gr/día, y no absoluta, para evitar desnutrición. Junto a lo anterior, se recomienda una ingesta moderada de líquido, uso de diuréticos antagonistas de la Aldosterona (de preferencia espironolactona) y nunca utilizar furosemida como monoterapia.
Ascitis refractaria. Los pacientes con ascitis refractaria a terapia diurética en dosis máximas y bajo restricción de sodio, tienen riesgo de peritonitis bacteriana espontánea y desnutrición, por lo tanto tienen indicación de paracentesis evacuadora total asociada a albumina 8 gr/Lt más terapia diurética intensa. Si la ascitis recidiva, tienen indicación de trasplante hepático, pero en Chile éste no ocurre antes de 18 meses, por lo que durante todo este período de espera se deberá continuar con paracentesis evacuadora a repetición o utilizar una derivación protésica porto-sistémica o TIPS, la cual está indicada en recidivas frecuentes o ascitis refractaria, y contraindicada en pacientes con encefalopatía crónica y uen la trombosis portal (Fig. 2) (3).
Fig. 2. Flujograma de tratamiento frente a ascitis refractaria.
Al realizar paracentesis total, se debe tener en cuenta el riesgo de producir una disfunción circulatoria inducida por paracentesis (DCIP), la cual es una complicación grave, y cuya clínica se caracteriza por ser silente, pero favorece la aparición abrupta de la ascitis uno a seis días posterior al procedimiento, con insuficiencia renal, lo que puede reducir la sobrevida. Esta complicación se produce cuando aumenta en 50% la actividad de renina periférica por sobre el valor previo al tratamiento (no es rutinaria su medición por ser de alto costo y poco práctico), hasta un nivel mayor a 4 ng/ml/hora al sexto día postparacentesis, y cuando no se utilizan expansores plasmáticos. Es así que las paracentesis mayores a 5 Lt siempre deben ser asociadas a un expansor plasmático para evitar la insuficiencia renal y el SHR.
Está demostrado que, de realizar paracentesis total sin utilizar expansor plasmático, la posibilidad de desarrollar DCIP sobrepasa el 50%; el cual disminuye con la administración de albúmina hasta alrededor de 10%. Si se extraen volúmenes pequeños, menores a 5 o 6 Lt, es probable que el aporte de expansores plasmáticos pueda ser menos enérgico; por otra parte, cuando se realizan paracentesis repetidas, procedimiento habitual en el servicio de urgencias, los sistemas antinatriuréticos se mantendrán activados y por lo tanto también se deberá utilizar albúmina. El no utilizar expansores es una mala decisión terapéutica, ya que el riesgo de complicación es muy elevado (4-7) (Fig. 3).
Así entonces, la paracentesis total con albúmina endovenosa es el tratamiento estándar en ascitis refractaria al ser eficaz y segura en la eliminación de la ascitis; aunque puede producir DCIP, lo que provoca una mayor recurrencia de la ascitis y reducción de la supervivencia. Sin embargo, no olvidar que corresponde a un tratamiento local que no modifica los mecanismos responsables de la formación de ascitis, por lo que la recidiva es frecuente.
Hace algunos años se consideraba una entidad intratable y con pronóstico mortal a corto plazo. Hoy en día ha cambiado su enfoque terapéutico y se considera una condición tratable, y con potencial reversibilidad.
Se han definido dos tipos de SHR según el Club Internacional de Ascitis. El SHR tipo 1 corresponde a un deterioro rápido y progresivo de la función renal reflejado en un aumento del 100% en la creatinina plasmática hasta un nivel mayor de 2,5 mg/dl en menos de dos semanas, o una disminución del clearence de creatinina hasta un nivel menor a 20 ml/min en menos de dos semanas; en tanto el SHR tipo 2 se define como un deterioro leve y progresivo de la función renal asociado a una ascitis refractaria a terapia diurética.
La fisiopatología del SHR se inicia con el daño hepático crónico avanzado y con la hipertensión portal secundaria, lo que provoca una disfunción circulatoria grave e hipoperfusión renal con activación del eje renina-angiotensina-aldosterona, el sistema simpático, y el aumento de la síntesis de hormona antidiurética. La isquemia renal resultante provoca un aumento de la síntesis de vasoconstrictores intrarrenales (angiotensina II, adenosina, endotelina –1, leucotrienos, isoprostanos-F2) y disminución de factores vasodilatadores (oxido nítrico, prostaglandinas y calicreína) que perpetuán el ciclo de isquemia. Este proceso explica el SHR tipo 2, que cuando ocurre alguna descompensación con isquemia renal aguda se produce el SHR tipo 1 (Fig. 4).
Fig. 4. Patogenia del Síndrome Hépato Renal.
Las descompensaciones ocurren por la aparición de infecciones graves, peritonitis bacteriana espontánea, neumonia, pielonefritis aguda, aporte excesivo de diurético, vómitos, diarrea o deshidratación grave; las que determinan una necrosis tubular aguda. Los SHR tipo 1 y 2 se consideran en la actualidad como un continuo, en cuyo caso ya no es requisito la ausencia de alguna causa secundaria que explique la reagudización de la falla renal. Si esta falla se mantiene, pese a la resolución de la causa secundaria, se está frente a un SHR tipo 1.
Tratamiento. Los pilares del tratamiento son el incremento del volumen plasmático efectivo, la disminución de la presión portal y el trasplante hepático ortotópico.
Para el aumento del volumen plasmático efectivo, son necesarias drogas vasoconstrictoras del sistema esplácnico y que, por lo tanto, disminuyen la hipertensión portal. Entre éstas drogas se encuentran los análogos de la vasopresina como la ornipresina y la terlipresina (droga económica que se puede administrar por vía periférica), esta última con una efectividad de hasta 50% cuando se asocia a un expansor plasmático para evitar una disfunción circulatoria secundaria a la droga vasoconstrictora; y los agonistas alfa adrenérgicos como la norepinefrina y midodrine.
El efecto de los vasoconstrictores y de la albúmina se refleja en la disminución de la creatinina plasmática bajo 1,5 mg/dl y en la mejoría hemodinámica sistémica del paciente a través de la normalización de la presión arterial media y de la supresión de los sistemas vasoconstrictores.
El tratamiento con terlipresina (0,5 a 2mg cada 4 horas EV) más albúmina (1gr/kg el primer día y 20 a 40 gr/día después) hasta la desaparición del SHR o tras 15 días de tratamiento, permite prolongar el plazo de trasplante hepático hasta seis meses en pacientes que años anteriores no tenían posibilidad alguna de sobrevivir. Se ha demostrado que la asociación de terlipresina junto a albúmina logra una sobrevida de 87% en un mes, en tanto que el tratamiento sólo con terlipresina alcanza una sobrevida de 13% (9).
En el paciente cirrótico recién diagnosticado, las várices esofagogástricas (VEG) están presentes en 30% de los cirróticos compensados y en 60% de los descompensados, y cerca del 30% de estos pacientes desarrollan hemorragia por ruptura de las mismas. La mortalidad inicial por hemorragia puede exceder al 50%, y el riesgo de recidiva hemorrágica en el paciente no tratado es de 60%.
El concepto actual es que los enfermos no deben desarrollar várices, y si las tienen, éstas deben ser de pequeño tamaño y sin signos de riesgo de sangrado (Fig. 5).
Fig. 5. Hemorragia variceal masiva secundaria a paquetes varicosos ligados.
El manejo de la VEG consiste en realizar una profilaxis del primer episodio de hemorragia, manejar el episodio agudo de sangrado cuando corresponda y prevenir el resangrado.
Profilaxis del primer episodio. Todo paciente con VEG, aun con cirrosis compensada que no ha sangrado nunca, debe recibir profilaxis farmacológica. La droga indicada para la profilaxis primaria es el propanolol (bloqueador beta no selectivo) en las dosis máximas que la hemodinamia del enfermo admita, lo que permite una reducción del riesgo de sangrado en 30 a 40%.
Sin embargo, al menos 50% de los enfermos no tolera el manejo farmacológico lo que se manifiesta por frialdad de extremidades inferiores, síndrome bronquial obstructivo, claudicación intermitente o impotencia. Por lo tanto, en aquellos pacientes con VEG de moderado a gran tamaño, que no han sangrado, la profilaxis debe considerar la ligadura variceal endoscópica en aquellos Chile B o C. Si bien, no existe evidencia adecuada que demuestre una disminución de la mortalidad ni los beneficios a largo plazo, cada vez son más los estudios que apoyan este tratamiento por ser más eficaz que el manejo farmacológico.
Episodio de sangrado agudo. El manejo se basa en la corrección de la hipovolemia, en la prevención de complicaciones (infecciones, encefalopatía y broncoaspiración), control de la hemorragia y en la prevención de la recidiva hemorrágica precoz.
La corrección de la hipovolemia debe ser cautelosa para evitar sobretransfundir al paciente, por lo que la indicación de uso de hemoderivados se considera a partir de los 8 gr/dl de Hb. La corrección depende de la edad, las comorbilidades asociadas, la presencia de hemorragia activa, etc.
La translocación bacteriana en el tubo digestivo determina que, a las 48 horas, el 50% de los pacientes esté infectado, lo cual predispone al desarrollo de peritonitis bacteriana espontánea y sepsis. Debido a esto, la prevención de infección se realiza con antibióticos por siete días, con ceftriaxona o norfloxacino.
Para la prevención de encefalopatía se utilizan las medidas clásicas como lactulosa o lactitol (polialcohol empleado como edulcorante artificial). Lactulosa ha demostrado utilidad sólo cuando el paciente presenta encefalopatía y no como profilaxis.
La prevención de broncoaspiración en pacientes con sangrado masivo, hematemesis e inestabilidad hemodinámica, se basa en la intubación orotraqueal en pabellón, para disminuir el riesgo de neumonia por aspiración que tiene una gran mortalidad.
Otro punto importante en el tratamiento de la hemorragia variceal aguda es el uso de vasoconstrictores esplácnicos (terlipresina) previo a endoscopía digestiva alta (EDA), los cuales se puede iniciar en el box de urgencia y se deben mantener por cuatro a cinco días. La EDA tiene que ser llevada a cabo dentro de las primeras 12 horas desde el inicio del episodio agudo.
Una vez controlado el episodio hemorrágico agudo se debe realizar la prevención secundaria, que consiste en la ligadura endoscópica de las várices hasta que desaparezcan o el uso de balones a modo de rescate. En la actualidad la hemorragia variceal no debiera ser una causa importante de mortalidad en pacientes cirróticos.
Existe sin embargo, 80% de riesgo de recidiva hemorrágica, por lo que la prevención de esta debe ser instaurada desde el sexto día posthemorragia. El método ideal es la asociación de ligadura de VEG con bloqueadores beta. En caso de fracaso al tratamiento, se propone el procedimiento de derivaciones porto-sistémicas quirúrgicas y no quirúrgicas (anastomosis esplenorrenal distal o TIPS) en pacientes catalogados como Child A o B; y de trasplante hepático en pacientes Child B a C.
La derivación porto-sistémica intrahepática transyugular (TIPS) se utiliza con una frecuencia cada vez mayor. Corresponde a un canal de baja resistencia a través de una vena hepática (habitualmente la suprahepática derecha) que se conecta con la porción intrahepática de la porta de alto flujo, a través de técnicas angiográficas cuyo objetivo es descomprimir el sistema portal y tratar sus consecuencias. Funciona como una derivación porto-cava quirúrgica, pero de manera calibrada, no requiere anestesia general ni tampoco una gran cirugía. En Chile y en otras partes del mundo es realizado por radiólogos, pero también por hepatólogos (Fig. 6).
Fig. 6. Esquema de derivación porto-sistémica intrahepática transyugular.
Las indicaciones más importantes en la actualidad son el sangrado variceal masivo y la ascitis refractaria. En el contexto de una hemorragia activa, el TIPS disminuye la tasa de sangrado (16% versus 44% de la aplicación de EDA y fármacos); sin embargo, aún no afecta la sobrevida a largo plazo y además aumenta la incidencia de encefalopatía si se compara con el tratamiento endoscópico (33 y 17% respectivamente). Su mayor utilidad es el ser una terapia puente para el trasplante en pacientes con un puntaje Child B o mayor con hemorragias.
Por otra parte, el TIPS mejora la hemodinamia portal, al disminuir la vasodilatación esplácnica, y la perfusión renal. Al cabo de 10 días comienza a aumentar la velocidad de filtración glomerular (VFG) junto al flujo plasmático renal, disminuye la resistencia vascular intrarrenal, aumenta la natriuresis a partir de la primera o segunda semana y, por lo tanto, disminuye la reabsorción proximal de sodio e incrementa la oferta del mismo al túbulo distal. En la actualidad, la colocación de un TIPS es una solución razonable si el paciente lo puede costear.
Los candidatos ideales para la colocación de TIPS son aquellos con una enfermedad en estadio Child A o B, con bilirrubina menor a 2 mg/dl, INR menor a 1,5, creatinina menor a 2 mg/dl y sin encefalopatía. Son factores de mal pronóstico una bilirrubina mayor a 3 mg/dl, un INR mayor a 2, creatinina mayor de 2 mg/dl, encefalopatía grado mayor o igual a 2 e hipertensión pulmonar o falla cardiaca.
En el SHR con ascitis refractaria y con riesgo de desarrollar SHR tipo 1, el TIPS es una terapia que muestra resultados favorables. En SHR tipo 1 produce un lento y moderado aumento de VFG, con disminución de la creatinina en 50% de los casos; con lo que logra una sobrevida aproximada de dos a cuatro meses. Sin embargo, no existen estudios comparativos con vasoconstrictores, pero la eficacia parece ser similar.
En SHR tipo 2, se asocia a mejoría del clearence de creatinina, mejor control de la ascitis y disminución del riesgo de progresión a HRS I. Al comparar con paracentesis repetidas y uso de albúmina, no se encontró mejoría en la sobrevida (10). Es necesario sopesar la utilización de TIPS versus el efecto de vasoconstrictores según costo, reacciones adversas y el dudoso efecto en mejoría sobrevida.
Contraindicaciones. Las absolutas corresponden a pacientes con enfermedad avanzada (Child C) debido al riesgo de hipoperfusión hepática lo que empeora la función hepática, insuficiencia cardiaca con capacidad funcional mayor o igual a II, ya que aumenta el retorno venoso en forma significativa; portador de enfermedad poliquística, trombosis de la vena porta o esplénica, y dilatación masiva de la vía biliar intrahepática. Las contraindicaciones relativas son el poseer una infección activa, encefalopatía, tumor vascularizado hepático, coagulopatía grave, hígado pequeño e hipertensión pulmonar.
Complicaciones. El TIPS, aun en las mejores manos, es un procedimiento que tiene una mortalidad de 1 a 2%, la cual se relaciona con la técnica y al shunt porto-cava; y una morbilidad entre 7 a 10% de los casos. El objetivo es que el TIPS tenga un diámetro pre-calibrado, de forma tal que sea lo bastante grande para reducir la gradiente de presión venosa hepática (GPVH) bajo los 12 mm de mercurio (Hg); y que sea lo bastante pequeño para mantener la presión de perfusión portal para evitar acrecentar la insuficiencia hepática y encefalopatía. Lo ideal es que la GPVH se mantenga entre 9 a 12 mm Hg tras el uso de TIPS.
Hoy en día, para evitar los principales problemas del TIPS (estenosis y trombosis) se utilizan prótesis recubiertas con un material siliconado o teflonado que disminuyen el riesgo de trombosis (Fig. 7).
Fig. 7. Nuevos stents recubiertos.
Enfermedad asociada a cirrosis, por lo general asintomática, caracterizada por una disminución de la respuesta contráctil a estímulos fisiológicos o farmacológicos y puesta en evidencia al existir cierto grado de sobrecarga miocárdica o estrés cardiovascular.
El paciente cirrótico compensado, no azotémico y sin ascitis, presentará en forma progresiva una dilatación paulatina de su territorio esplácnico que determinará la aparición de ascitis. En este continuo, aumentan en forma constante los sistemas antinatriuréticos, la absorción de agua y sodio, y se puede llegar a la complicación más grave que es el SHR. Lo anterior determina una disfunción diastólica del miocardio que aumenta en forma progresiva junto con un deterioro de la capacidad contráctil del mismo. Por lo tanto, mientras los mecanismos fisiopatológicos de los pacientes cirróticos avanzan, la miocardiopatía también lo hace.
El paciente cirrótico es un paciente vasodilatado y rara vez hipertenso, por lo tanto, con una postcarga disminuida, se considera “autotratado” en el sentido de que esta condición favorece el volumen expulsivo; razón por la cual la falla miocárdica es subclínica. Es raro encontrar pacientes Child A o B con disnea de origen cardiogénico, salvo que sean sometidos a una prueba de estrés. Esta prueba puede ser fisiológica, farmacológica o patológica, lo que es relevante en pacientes trasplantados. Cualquier estrés puede desencadenar una respuesta ventricular insuficiente y el desarrollo de una insuficiencia cardíaca.
El TIPS puede desencadenar una descompensación cardíaca al aumentar en forma súbita el retorno venoso, disminuir la vasodilatación esplácnica y al incrementar la postcarga cardíaca. Otro evento en el cual se manifiesta la miocardiopatía es en pacientes trasplantados hepáticos a través de un mecanismo fisiopatológico similar al TIPS, ya que la mejoría de la hipertensión portal post operatoria aumenta el retorno venoso y esto puede hacer claudicar a un ventrículo más rígido. Por otra parte, el TIPS produce un aumento de las presiones cardiopulmonares que puede desencadenar en el 10% de los casos una insuficiencia cardíaca manifiesta. Es necesario tener precaución con esta condición clínica denominada miocardiopatía cirrótica, ya que puede hacer fracasar un trasplante hepático lo que obliga a compensar al paciente en forma previa (11-14).
En conclusión, la miocardiopatía cirrótica es una entidad recientemente descrita, caracterizada por una alteración en la contractilidad cardíaca, cuya causa es multifactorial y que no ha sido aún establecida de manera clara. La disfunción cardíaca es siempre subclínica y se pone de manifiesto en casos de sobrecarga cardíaca como ocurre tras la instalación de un TIPS o posterior al trasplante. El tratamiento no difiere en forma significativa del tratamiento habitual de la insuficiencia cardiaca en pacientes no cirróticos, a excepción de los casos con un debut agudo en donde el pronóstico es ominoso. En la actualidad no existen herramientas adecuadas para el diagnóstico de esta complicación.
Complicación inherente de la cirrosis hepática, que tiene tratamiento y curación en los casos de diagnóstico precoz; en donde el mejor tratamiento es el trasplante hepático.
Los procedimientos terapéuticos se dividen en terapias radicales, correspondientes al 30% de los casos debido a que la gran mayoría consulta en etapas tardías, y que abarcan la resección quirúrgica, el trasplante hepático y las terapias percutáneas (inyección de alcohol y radiofrecuencia); las terapias paliativas en el 40 a 50% de los casos, como son la embolización transarterial o quimioembolización, la embolización transarterial percutánea, inmunoterapia o tratamiento hormonal, y el sorafenib (fármaco inhibido de la tirosin-quinasa que bloquea la vía de señales del ciclo celular e impide tanto la proliferación de células tumorales como la formación de vasos sanguíneos que alimentan el tumor) utilizado además en el tratamiento del hipernefroma, y la terapia sintomática utilizada en el 20 a 30% de los casos. En todo paciente cirrótico, independiente de la causa, se le debe seguir permanentemente con imágenes y alfa feto proteína en forma secundaria.
Así entonces, el rol del médico consiste en diagnosticar un tumor en estadio precoz, el cual se define como un tumor menor de 5 cm o tres nódulos menores de 3 cm, sin invasión vascular ni linfática, con tomografía computarizada de tórax y cintigrafía ósea normales. Bajo estas características, en un enfermo curable y según las condiciones locales, el paciente será candidato a trasplante, resección o alguna técnica percutánea.
Al paciente apto para trasplante se le asignará un puntaje MELD de 22 puntos en forma inicial, ya que el hepatocarcinoma crece en forma paulatina. Con el transcurso del tiempo, al puntaje inicial se le agrega 1 punto cada tres meses, lo que permite elevar la posición en la lista de espera de trasplante hepático debido al empeoramiento del pronóstico. Lo anterior, ha generado que la primera causa de trasplante hepático sea el hepatocarcinoma en pacientes Child A con una función hepática conservada.

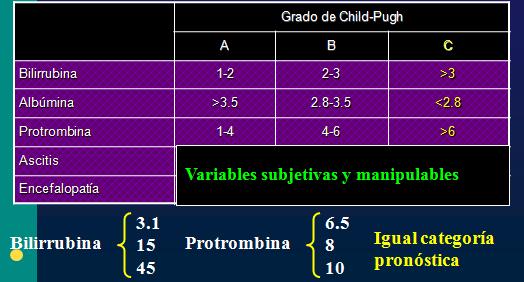 Tabla 1. Clasificación de Child-Pugh.
Tabla 1. Clasificación de Child-Pugh.

 Tabla 2. Fórmula MELD.
Tabla 2. Fórmula MELD.

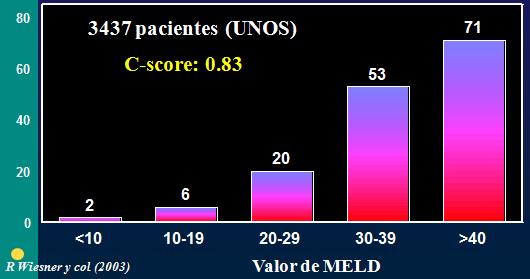 Tabla 3. Riesgo de muerte en pacientes en lista de espera para trasplante hepático.
Tabla 3. Riesgo de muerte en pacientes en lista de espera para trasplante hepático.

 Fig. 1. Potenciales complicaciones de la Cirrosis.
Fig. 1. Potenciales complicaciones de la Cirrosis.

 Tabla 4. Esquema de tratamiento según excreción de sodio.
Tabla 4. Esquema de tratamiento según excreción de sodio.

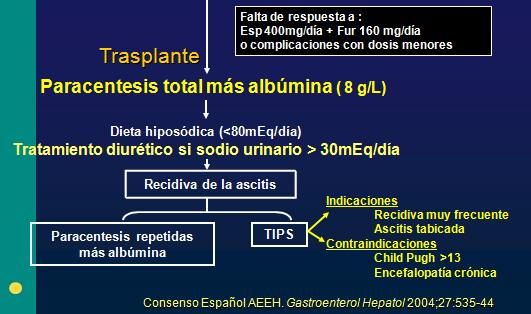 Fig. 2. Flujograma de tratamiento frente a ascitis refractaria.
Fig. 2. Flujograma de tratamiento frente a ascitis refractaria.

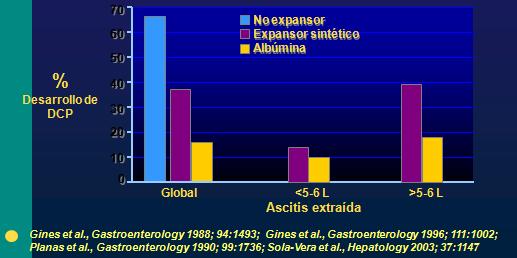 Fig. 3. Porcentaje de desarrollo de DCP según tipo de expansor plasmático utilizado y volumen de líquido extraído.
Fig. 3. Porcentaje de desarrollo de DCP según tipo de expansor plasmático utilizado y volumen de líquido extraído.

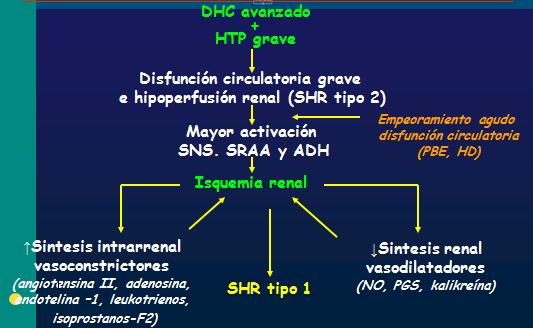 Fig. 4. Patogenia del Síndrome Hépato Renal.
Fig. 4. Patogenia del Síndrome Hépato Renal.

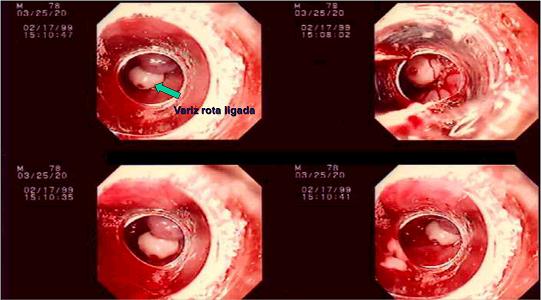 Fig. 5. Hemorragia variceal masiva secundaria a paquetes varicosos ligados.
Fig. 5. Hemorragia variceal masiva secundaria a paquetes varicosos ligados.

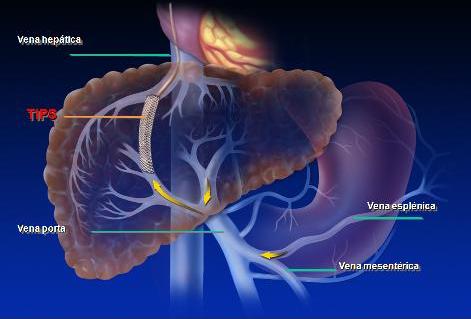 Fig. 6. Esquema de derivación porto-sistémica intrahepática transyugular.
Fig. 6. Esquema de derivación porto-sistémica intrahepática transyugular.

 Fig. 7. Nuevos stents recubiertos.
Fig. 7. Nuevos stents recubiertos.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
 Expositor:
Danny Oksenberg[1]
Expositor:
Danny Oksenberg[1]

Citación: Oksenberg D. Liver cirrosis: modern management of old complications. Medwave 2010 May;10(5):e4518 doi: 10.5867/medwave.2010.05.4518
Fecha de publicación: 1/5/2010

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Wiesner R, Edwards E, Freeman R, Harper A, Kim R, Kamath P, et al. Model for end-stage liver disease (MELD) and allocation of donor livers. Gastroenterology. 2003 Jan;124(1):91-6. | CrossRef | PubMed |
Wiesner R, Edwards E, Freeman R, Harper A, Kim R, Kamath P, et al. Model for end-stage liver disease (MELD) and allocation of donor livers. Gastroenterology. 2003 Jan;124(1):91-6. | CrossRef | PubMed | Santos J, Planas R, Pardo A, Durandez R, Cabre E, Morillas RM, et al. Spironolactone alone or in combination with furosemide in the treatment of moderate ascites in nonazotemic cirrhosis. A randomized comparative study of efficacy and safety. J Hepatol. 2003 Aug;39(2):187-92. | CrossRef | PubMed |
Santos J, Planas R, Pardo A, Durandez R, Cabre E, Morillas RM, et al. Spironolactone alone or in combination with furosemide in the treatment of moderate ascites in nonazotemic cirrhosis. A randomized comparative study of efficacy and safety. J Hepatol. 2003 Aug;39(2):187-92. | CrossRef | PubMed | Gines P, Cabrera J, Guevara M, Morillas R, Ruiz, Solae R, et al. Documento de consenso sobre el tratamiento de la ascitis, la hiponatremia dilucional y el sindrome hepatorrenal en la cirrosis hepatica. Gastroenterol Hepatol. 2004 Nov;27(9):535-44. | CrossRef | PubMed |
Gines P, Cabrera J, Guevara M, Morillas R, Ruiz, Solae R, et al. Documento de consenso sobre el tratamiento de la ascitis, la hiponatremia dilucional y el sindrome hepatorrenal en la cirrosis hepatica. Gastroenterol Hepatol. 2004 Nov;27(9):535-44. | CrossRef | PubMed | Ginès P, Titó L, Arroyo V, Planas R, Panés J, Viver J, et al. Randomized comparative study of therapeutic paracentesis with and without intravenous albumin in cirrhosis. Gastroenterology. 1988 Jun;94(6):1493-502. | PubMed |
Ginès P, Titó L, Arroyo V, Planas R, Panés J, Viver J, et al. Randomized comparative study of therapeutic paracentesis with and without intravenous albumin in cirrhosis. Gastroenterology. 1988 Jun;94(6):1493-502. | PubMed | Ginès A, Fernández-Esparrach G, Monescillo A, Vila C, Domènech E, Abecasis R, et al. Randomized trial comparing albumin, dextran 70, and polygeline in cirrhotic patients with ascites treated by paracentesis. Gastroenterology. 1996 Oct;111(4):1002-10. | CrossRef | PubMed |
Ginès A, Fernández-Esparrach G, Monescillo A, Vila C, Domènech E, Abecasis R, et al. Randomized trial comparing albumin, dextran 70, and polygeline in cirrhotic patients with ascites treated by paracentesis. Gastroenterology. 1996 Oct;111(4):1002-10. | CrossRef | PubMed | Planas R, Ginès P, Arroyo V, Llach J, Panés J, Vargas V, et al. Dextran-70 versus albumin as plasma expanders in cirrhotic patients with tense ascites treated with total paracentesis. Results of a randomized study. Gastroenterology. 1990 Dec;99(6):1736-44. | PubMed |
Planas R, Ginès P, Arroyo V, Llach J, Panés J, Vargas V, et al. Dextran-70 versus albumin as plasma expanders in cirrhotic patients with tense ascites treated with total paracentesis. Results of a randomized study. Gastroenterology. 1990 Dec;99(6):1736-44. | PubMed | Sola-Vera J, Miñana J, Ricart E, Planella M, González B, Torras X, et al. Randomized trial comparing albumin and saline in the prevention of paracentesis-induced circulatory dysfunction in cirrhotic patients with ascites. Hepatology. 2003 May;37(5):1147-53. | CrossRef | PubMed |
Sola-Vera J, Miñana J, Ricart E, Planella M, González B, Torras X, et al. Randomized trial comparing albumin and saline in the prevention of paracentesis-induced circulatory dysfunction in cirrhotic patients with ascites. Hepatology. 2003 May;37(5):1147-53. | CrossRef | PubMed | Ortega R. Gastroenterología y Hepatología: capítulo ascitis. Colombia: Editorial Celsus, 2006:361- 372.
Ortega R. Gastroenterología y Hepatología: capítulo ascitis. Colombia: Editorial Celsus, 2006:361- 372.  Ortega R, Ginès P, Uriz J, Cárdenas A, Calahorra B, De Las Heras D, et al. Terlipressin therapy with and without albumin for patients with hepatorenal syndrome: results of a prospective, nonrandomized study. Hepatology. 2002 Oct;36(4 Pt 1):941-8. | PubMed |
Ortega R, Ginès P, Uriz J, Cárdenas A, Calahorra B, De Las Heras D, et al. Terlipressin therapy with and without albumin for patients with hepatorenal syndrome: results of a prospective, nonrandomized study. Hepatology. 2002 Oct;36(4 Pt 1):941-8. | PubMed | Ginès P, Uriz J, Calahorra B, Garcia-Tsao G, Kamath PS, Del Arbol LR, et al. Transjugular intrahepatic portosystemic shunting versus paracentesis plus albumin for refractory ascites in cirrhosis. Gastroenterology. 2002 Dec;123(6):1839-47. | CrossRef | PubMed |
Ginès P, Uriz J, Calahorra B, Garcia-Tsao G, Kamath PS, Del Arbol LR, et al. Transjugular intrahepatic portosystemic shunting versus paracentesis plus albumin for refractory ascites in cirrhosis. Gastroenterology. 2002 Dec;123(6):1839-47. | CrossRef | PubMed | Aggarwal S, Kang Y, Freeman J, DeWolf AM, Begliomini B. Is there a post-reperfusion syndrome? Transplant Proc. 1989 Jun;21(3):3497-9. | CrossRef | PubMed |
Aggarwal S, Kang Y, Freeman J, DeWolf AM, Begliomini B. Is there a post-reperfusion syndrome? Transplant Proc. 1989 Jun;21(3):3497-9. | CrossRef | PubMed | Navasa M, Feu F, Garcia-Pagan JC, Jimenez W, Llach J, Rimola A, et al. Hemodynamic and humoral changes after liver transplantation in patients with cirrhosis. Hepatology. 1993 Mar;17(3):355-60. | PubMed |
Navasa M, Feu F, Garcia-Pagan JC, Jimenez W, Llach J, Rimola A, et al. Hemodynamic and humoral changes after liver transplantation in patients with cirrhosis. Hepatology. 1993 Mar;17(3):355-60. | PubMed | Piscaglia F, Zironi G, Gaiani S, Mazziotti A, Cavallari A, Gramantieri L, et al. Systemic and splanchnic hemodynamic changes after liver transplantation for cirrhosis: a long-term prospective study. Hepatology. 1999 Jul;30(1):58-64. | CrossRef | PubMed |
Piscaglia F, Zironi G, Gaiani S, Mazziotti A, Cavallari A, Gramantieri L, et al. Systemic and splanchnic hemodynamic changes after liver transplantation for cirrhosis: a long-term prospective study. Hepatology. 1999 Jul;30(1):58-64. | CrossRef | PubMed | Donovan CL, Marcovitz PA, Punch JD, Bach DS, Brown KA, Lucey MR, et al. Two-dimensional and dobutamine stress echocardiography in the preoperative assessment of patients with end-stage liver disease prior to orthotopic liver transplantation. Transplantation. 1996 Apr 27;61(8):1180-8. | CrossRef | PubMed |
Donovan CL, Marcovitz PA, Punch JD, Bach DS, Brown KA, Lucey MR, et al. Two-dimensional and dobutamine stress echocardiography in the preoperative assessment of patients with end-stage liver disease prior to orthotopic liver transplantation. Transplantation. 1996 Apr 27;61(8):1180-8. | CrossRef | PubMed |