 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: dislipidemia, metabolismo, endocrinología, medicina interna
Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
Los factores de riesgo cardiovascular son múltiples y se dividen en tres categorías: no modificables, sobre los cuales no se puede intervenir, entre ellos sexo, edad, antecedente familiar y personalidad tipo A (impaciente, irritable, dominante y autoritario); modificables, como tabaquismo, sedentarismo, obesidad, hipertensión, diabetes y dislipidemias; y emergentes, entre los cuales figuran PCR altamente sensible, fibrinógeno, homocisteína, déficit de antioxidantes e infección por Chlamydia pneumoniae.
Según los resultados del estudio INTERHEART (A Global Case-Control Study of Risk Factors for Acute Myocardial Infarction) que se publicaron en el año 2004, el factor de riesgo cardiovascular más importante es la dislipidemia. En este estudio se evaluó la relación de tabaquismo, diabetes, hipertensión, obesidad abdominal y otros factores, tanto en hombres como en mujeres sobre el riesgo cardiovascular y se encontró que la relación ApoB/ApoA1, o relación colesterol LDL (C-LDL)/colesterol HDL (C-HDL) es el factor que más aumenta dicho riesgo, y que las personas con mayor nivel de LDL o menor de HDL son las que tienen mayor riesgo cardiovascular. Con esta base se concluyó que la dislipidemia es el factor de riesgo aislado más importante (1).
El estudio de los niveles de colesterol en distintas poblaciones muestra que los humanos cazadores-recolectores tienen un colesterol total alrededor de 130, con un C-LDL entre 60 y 70 y que algunos primates salvajes tienen niveles similares a éstos; en cambio el adulto americano tiene niveles de colesterol alrededor de 210, lo cual no está determinado por la genética, sino por el medio ambiente (2).
Como se observa en la Fig. 1, la prevalencia de hipercolesterolemia en Chile alcanza a 35,4% y más de la mitad de las personas mayores de 45 años de edad tienen colesterol elevado (3).
Figura 1. Niveles de colesterol según rango de edad y sexo, Chile 2004.
En pacientes diabéticos la dislipidemia también es altamente prevalente. Aquellos con o sin tratamiento y con C-LDL mayor a 100 representan el 70%; aquellos con valores de HDL bajo corresponden cerca de un tercio; y aquellos con niveles de triglicéridos (TG) elevados corresponden cerca de la mitad de los pacientes (Fig. 2) (4).
Figura 2. Dislipidemia en pacientes diabéticos del Hospital Clínico de la Universidad de Chile.
Para tratar la dislipidemia se dispone de estatinas, ezetimiba, fibratos y niacina. Todos ellos son beneficiosos desde el punto de vista del perfil lipídico, puesto que disminuyen los niveles de C-LDL y TG y aumentan el C-HDL; pero cada droga tiene su particularidad: las estatinas son los fármacos más potentes para disminuir el nivel de C-LDL; ezetimiba es una droga adicional a las estatinas que ayuda a reducir principalmente el C-LDL; los fibratos son tal vez las drogas con acción más completa, pues disminuyen el colesterol LDL, pero reducen los TG mucho más que las estatinas y además tienen un efecto positivo sobre el C-HDL, al igual que el ácido nicotínico o niacina (Tabla I) (5).
Tabla I. Efectos metabólicos de distintos tipos de hipolipemiantes.
Los fibratos y el ácido nicotínico parecen teóricamente ser más eficaces que las estatinas; sin embargo éstas son ampliamente utilizadas porque, al igual que las grasas omega 3, se demostró que reducen la mortalidad general lo que no ocurre con fibratos, resinas, ácido nicotínico o dieta. Esto se basa en datos aportados por un metaanálisis que evaluó 97 estudios, con un total de 137.976 pacientes tratados y 138.976 pacientes control; en el mismo se encontró que la mortalidad cardiovascular es influenciada por estatinas, resinas y grasas omega 3, pero no por fibratos y que la mortalidad no cardiovascular no cambia mayormente con ninguno de estos tratamientos; por lo tanto, se concluyó que las estatinas y en cierta medida el omega 3 reducen las muertes (6).
Como las estatinas disminuyen principalmente el C-LDL, lo que interesa es conocer de qué forma este efecto influye en los eventos cardiovasculares. Se sabe que los pacientes se benefician de las estatinas y de la disminución del C-LDL tanto en prevención primaria como secundaria, pero en este último caso el beneficio es mayor, lo que permite entender las recomendaciones de los expertos. Así, en prevención primaria un paciente sin factores de riesgo ni eventos coronarios no tiene mayor diferencia en el pronóstico con un nivel de C-LDL de 100 ó 160; en cambio en un paciente en prevención secundaria esta diferencia en los niveles produciría una variación significativa en el pronóstico. Tal como lo demuestra la Fig. 3, el paciente en prevención secundaria tiene mayor riesgo, pero resulta más beneficiado con el tratamiento (7).
Figura 3. Reducción de eventos coronarios al reducir colesterol LDL.
Según las recomendaciones del Adult Treatment Panel III (ATP III), las personas con un equivalente coronario deben tener colesterol menor de 100 mg/dl (e incluso menor de 70 mg/dl en algunos casos seleccionados); aquellos con dos o más factores de riesgo, pero sin equivalentes coronarios, la meta es lograr un C-LDL de 130 mg/dl o menos; y en pacientes con uno o ningún factor de riesgo bastaría con un C-LDL menor de 160 mg/dl. El tratamiento no farmacológico comienza desde el momento en que el paciente no logra la meta esperada; y el farmacológico, luego de una diferencia de 30 mg/dl para cada etapa, es decir, en aquellos pacientes con equivalentes coronarios el tratamiento comienza cuando el nivel de C-LDL es igual o sobrepasa 130 mg/dl; en aquellos con dos o más factores de riesgo, cuando supere los 160 mg/dl; y en los portadores de uno o ningún factor de riesgo, el tratamiento inicia con niveles sobre 190 mg/dl (Tabla II) (5).
Tabla II. Recomendaciones en el manejo de las dislipidemias. Guías NCEP-ATP III.
La diabetes tipo 2 se comporta como un equivalente coronario, como lo demostró un estudio del año 1998 en el que se determinó la incidencia de infartos durante siete años en pacientes diabéticos y no diabéticos con y sin infarto previo y se encontró que el diabético tipo 2 que nunca ha sufrido un infarto se comporta igual que el paciente con antecedentes de infarto (Fig. 4) (8).
En el diabético no basta con disminuir la glicemia o controlar la hemoglobina glicosilada.
En un metaanálisis en que se evaluó los resultados macrovasculares en diabéticos tipo 1 y 2 se encontró que el control glicémico en diabéticos tipo 1 disminuye el riesgo de complicaciones macrovasculares, cardíacas, vasculares periféricas y cerebrovasculares; sin embargo, en el diabético tipo 2 la reducción del riesgo a través del control glicémico es menor: la reducción en el diabético tipo 1 es 62% y en el tipo 2, sólo 19% (9).
En la Fig. 5 se puede observar que en los estudios realizados con fibratos (rombos verdes) se produce discreta reducción del C-LDL, mayor aumento del HDL y leve reducción de eventos cardiovasculares, aproximadamente 20%. Las estatinas, (rombos amarillos), se utilizan más que otras terapias, porque además de modificar en mayor medida los lípidos reducen el en mayor magnitud el riesgo cardiovascular. La tendencia actual es ser más agresivo y administrar estatinas a pacientes de alto riesgo y muchas guías internacionales no recomiendan medir niveles de colesterol, sino iniciar de inmediato el tratamiento con estatinas (10).
Figura 5. Reducción de eventos cardiovasculares según nivel de control de lípidos.
La reducción de C-LDL con las distintas estatinas y sus distintas dosis es predecible. Así, se puede iniciar el tratamiento hipolipemiante con dosis correcta de estatinas sin necesidad de titular las dosis, conociendo el nivel inicial de C-LDL, la meta y las herramientas disponibles; de esta forma, 10 mg de atorvastatina reducirán en 34% el C-LDL, por lo tanto en un paciente diabético cuya meta de LDL es menor a 100 y cuyo LDL inicial es 180 no se debería iniciar tratamiento con 10 mg de atorvastatina, porque no se logrará bajar el C-LDL en 50%. Con estos datos es posible realizar una terapia específica sin realizar demasiadas titulaciones. Una dosis de rosuvastatina de 40 mg permitiría reducir el C-LDL en 62% (Tabla III) (11).
Tabla III. Estatinas y sus respuestas a distintas dosis.
El C-LDL no es lo único importante; mientras menor es el nivel de C-LDL menor es el riesgo de eventos cardiovasculares, pero si se diferencia estos niveles según quintiles de niveles de C-HDL se observa que para un mismo nivel de C-LDL mientras más bajo es el HDL el riesgo es mayor (Fig. 6) (12).
Además, según el estudio PROCAM, equivalente al Framingham en Europa, en la medida que aumenta el C-LDL aumenta el riesgo de infarto, pero este riesgo también aumenta en la medida en que se incrementa el nivel de TG. Entonces es muy importante disminuir los niveles de LDL, pero no se debe descuidar C-HDL ni TG, dislipidemia que se observa especialmente en pacientes diabéticos e insulinorresistentes (Fig. 7) (13).
Figura 7. Eventos cardiovasculares de acuerdo a valores de LDL y TG.
Al analizar el United Kingdom Prospective Diabetes Study (UKPDS) en busca de los factores que influyeron en el desarrollo de infarto en pacientes diabéticos tipo 2, que en orden de importancia son: LDL, HDL, hemoglobina glicosilada A1c (HbA1c), hipertensión sistólica y tabaco, se encuentra que en el caso del infarto no fatal o fatal el primer lugar lo ocupa el nivel de C-LDL seguido por presión diastólica, tabaco, HDL y hemoglobina glicosilada. Esto hace pensar que en el diabético tipo 2 es necesario controlar la presión y los lípidos, y no solamente la HbA1c (14).
Entre los años 1950 y 1960, cuando se inició el estudio Framingham el paciente de riesgo era un individuo delgado, fumador, hipertenso e hipercolesterolémico, por lo que en ese momento se desarrollaron terapias hipolipemiantes y antihipertensivas y programas antitabaco; no obstante el problema no se detuvo, debido al aumento del sedentarismo y a la dieta hipercalórica, lo que ha transformado al paciente en portador de obesidad abdominal, diabetes tipo 2 y síndrome metabólico. Por tal motivo es necesario desarrollar nuevas herramientas para evaluar el riesgo en estos pacientes, ya que el score de Framingham no sería una herramienta óptima en la actualidad.
El diabético tipo 2 no disminuye su nivel de lípidos a un nivel óptimo. En un estudio de prevención primaria en pacientes tratados y no tratados, subdivididos en diabéticos y no diabéticos, se encontró que el diabético tratado con estatinas disminuye su riesgo de desarrollar un evento cardiovascular al nivel del no diabético, no tratado. Quizás falte controlar la presión arterial o la HbA1c para lograr un nivel óptimo de control, ya que ninguno por sí solo es suficiente (15).
El páncreas produce insulina, cuya función en el tejido adiposo es disminuir la lipólisis. En la insulinorresistencia esto no ocurre y el tejido graso libera ácidos grasos y citoquinas, sustancias que llegan al hígado donde se procesan estos ácidos grasos y se forman TG y apoproteínas Apo B y luego se sintetiza colesterol VLDL y LDL. Además, por efecto de las citoquinas aumenta la PCR, que de este modo sirve como marcador de riesgo cardiovascular. El VLDL que sale del hígado, rico en TG, normalmente debiera ingresar a la vía endógena del metabolismo de las lipoproteínas y entregar los ácidos grasos al músculo y al tejido adiposo por acción de la lipoproteinlipasa, pero en condiciones de insulinorresistencia esta enzima no funciona adecuadamente y el VLDL no ingresa a la vía metabólica endógena, sino que recurre a una enzima conocida como CETP (proteína transportadora de ésteres de colesterol) que se produce en el tejido adiposo visceral y ayuda al VLDL a desprender sus TG y entregarlos a C-HDL, a cambio de colesterol; luego el C-HDL producido por este intercambio se cataboliza y aumenta el nivel de Apo A-1 urinario, apoproteína de la HDL (Fig. 8).
Figura 8. Modelo de dislipidemia en la resistencia a la insulina.
En síntesis, el paciente posee niveles elevados de TGC y bajos de HDL; su VLDL rico en TGC intercambia colesterol y TGC con C-LDL, el que luego es sometido a hidrólisis por la lipoproteinlipasa y la lipasa hepática. La lipoproteinlipasa no funciona muy bien con VLDL, pero sí con LDL y además aparece la función de la lipasa hepática, que transforma al LDL en una molécula rica en colesterol y depletada de TG que en el hígado no será reconocida por su receptor, sino por el macrófago de la pared arterial. Esto explica que los pacientes con dislipidemia aterogénica tengan LDL pequeños y densos, que son altamente aterogénicos y que no tengan niveles mayores de C-LDL (Fig. 9). Además, las moléculas de LDL pequeñas predominan sobre HDL bajos y TG altos. Tanto hombres como mujeres diabéticos tienen menos C-HDL, más TG y además tienen moléculas de C-LDL más pequeñas y aterogénicas (16).
Al estudiar las características de C-LDL en pacientes no diabéticos con distintos grados de tolerancia a la glucosa, Reaven encontró que aquellos pacientes con glicemias e insulinemias menores, es decir, pacientes sanos, presentan un patrón de LDL A (moléculas grandes no aterogénicas); en cambio, aquellos pacientes con niveles de glicemia e insulina mayores o insulinorresistentes tienen un patrón de LDL B (moléculas LDL más pequeñas). En otras palabras el paciente insulinorresistente, intolerante a la glucosa y diabético tiene un C-LDL más aterogénico (17).
Figura 10. Diámetro de LDL según glicemia e insulinemia.
El síndrome metabólico, también conocido como síndrome de resistencia a la insulina, que se caracteriza por la presencia de la dislipidemia aterogénica, tiene baja incidencia en personas normoglicémicas; en cambio, está presente en alrededor de 50% de las personas intolerantes a la glucosa y en casi 100% de los diabéticos. No es necesario preguntarse si se justifica tratar a un paciente insulinorresistente o diabético, ya que los datos epidemiológicos son contundentes: los pacientes fallecen y las intervenciones aisladas no son suficientes (Fig. 11) (18).
Figura 11. Prevalencia del síndrome metabólico según tolerancia a la glucosa y sexo.
En cuanto al tratamiento, las medidas no farmacológicas juegan un rol tan importante como uso de medicamentos, entre ellos la Aspirina®. Por este motivo se debe reforzar la suspensión del tabaco, la promoción de actividad física y el cambio de dieta.
La metformina en pacientes diabéticos disminuye el colesterol total y C-LDL en 11% y los TGC, en 17%; el C-HDL aumenta discretamente (Fig. 12) (19).
Figura 12. Efectos lipídicos de metformina.
Las tiazolinedionas, como pioglitazona o rosiglitazona, tienen un efecto favorable sobre los lípidos, puesto que se producen C-LDL menos aterogénicos, pero con rosiglitazona aumenta el colesterol por mayor síntesis y los niveles de C-LDL son mayores; con pioglitazona no ocurre cambio en el C-LDL y con ambas glitazonas aumenta el C-HDL entre 5 a 15% y se reducen los TG (Fig. 13) (20).
Figura 13. Efectos metabólicos de las tiazolinedionas.
El uso de Orlistat asociado a cambios en el estilo de vida disminuye el C-LDL en 11% al primer año y en 12,8% al cuarto año, es decir, tiene un efecto significativo y mantenido en el tiempo. El mecanismo de Orlistat para producir esto es la reducción de peso (Fig. 14) (21).
Figura 14. Efectos de orlistat sobre colesterol LDL.
La sibutramina en la etapa de baja de peso disminuye los TGC en 20%, pero cuando se suspende su administración regresan al nivel inicial. En cuanto al C-HDL, los niveles aumentan hasta 20% de lo normal y al suspender la administración tienden a disminuir. Sin embargo no es una terapia de primera línea, ya que aún falta evidencia de que estos pacientes tengan menos mortalidad y/o disminución de la incidencia de eventos cardiovasculares (Fig. 15) (22).
Figura 15. Efectos de sibutramina sobre triglicéridos y c-HDL








.jpg) Tabla III. Estatinas y sus respuestas a distintas dosis.
Tabla III. Estatinas y sus respuestas a distintas dosis.

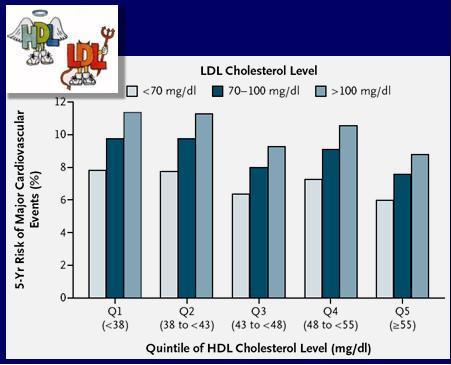 Figura 6. Riesgo de evento cardiovascular según quintiles de niveles de C-HDL a determinados niveles de LDL.
Figura 6. Riesgo de evento cardiovascular según quintiles de niveles de C-HDL a determinados niveles de LDL.









 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
 Expositor:
Rodolfo Lahsen M.[1]
Expositor:
Rodolfo Lahsen M.[1]

Citación: Lahsen R. Dyslipidemia in internal medicine. Medwave 2010 Abr;10(04):e4497 doi: 10.5867/medwave.2010.04.4497
Fecha de publicación: 1/4/2010

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Nombre/name: carlos roberto gonzález
Fecha/date:
Comentario/comment:
Primero gracias por la puesta al dÃa en este importante y prevalente tema. Y una pregunta: en la figura 5 aparece en amarillo y verde los efectos de las estatinas y fibratos. Hay unos rombos grises ¿Qué representan?
Nombre/name: carlos roberto gonzález
Fecha/date:
Comentario/comment:
Excelente puesta al dÃa en un tema tan prevalente. HabÃa enviado un emmail con una consulta al autor, pero tal vez no era el medio correcto. En la figura 5 se muestran los resultados de varios estudios en que se ve la buena respuesta de las estatinas sobre fibratos. Hay unos rombos grises, que no se identifican en el comentario de la tabla. ¿A qué corresponden?
Nombre/name: Maximino Salvador Vazquez
Fecha/date: 2011-01-15 17:10:51
Comentario/comment:
Excelente artÃculo que nos proporciona una enseñanza para el manejo de nuestros pacientes eficaz y eficiente,la misma duda de los rombos que citan otros colegas.Mis felicitaciones a los autores y gracias a uds por permitirme formar parte de su grupo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 2004 Sep 11-17;364(9438):937-52. | CrossRef | PubMed |
Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 2004 Sep 11-17;364(9438):937-52. | CrossRef | PubMed | O'Keefe JH Jr, Cordain L, Harris WH, Moe RM, Vogel R. Optimal low-density lipoprotein is 50 to 70 mg/dl: lower is better and physiologically normal. J Am Coll Cardiol. 2004 Jun 2;43(11):2142-6. | PubMed |
O'Keefe JH Jr, Cordain L, Harris WH, Moe RM, Vogel R. Optimal low-density lipoprotein is 50 to 70 mg/dl: lower is better and physiologically normal. J Am Coll Cardiol. 2004 Jun 2;43(11):2142-6. | PubMed | Ministerio de Salud. Encuesta Nacional de Salud–MINSAL, 2004
Ministerio de Salud. Encuesta Nacional de Salud–MINSAL, 2004  Araya I, Berríos A, Contreras C, Franulic L, Lahsen R. Diabetes tipo 2 en el adulto mayor: características clínicas y de laboratorio. En: XV Congreso SOCHEM, Concepción 2004.
Araya I, Berríos A, Contreras C, Franulic L, Lahsen R. Diabetes tipo 2 en el adulto mayor: características clínicas y de laboratorio. En: XV Congreso SOCHEM, Concepción 2004.  Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001 May 16;285(19):2486-97. | CrossRef | PubMed |
Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001 May 16;285(19):2486-97. | CrossRef | PubMed | Studer M, Briel M, Leimenstoll B, Glass TR, Bucher HC. Effect of different antilipidemic agents and diets on mortality: a systematic review. Arch Intern Med. 2005 Apr 11;165(7):725-30. | CrossRef | PubMed |
Studer M, Briel M, Leimenstoll B, Glass TR, Bucher HC. Effect of different antilipidemic agents and diets on mortality: a systematic review. Arch Intern Med. 2005 Apr 11;165(7):725-30. | CrossRef | PubMed | Illingworth DR. Management of hypercholesterolemia. Med Clin North Am. 2000 Jan;84(1):23-42. | CrossRef | PubMed |
Illingworth DR. Management of hypercholesterolemia. Med Clin North Am. 2000 Jan;84(1):23-42. | CrossRef | PubMed | Haffner SM, Lehto S, Rönnemaa T, Pyörälä K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med. 1998 Jul 23;339(4):229-34. | CrossRef | PubMed |
Haffner SM, Lehto S, Rönnemaa T, Pyörälä K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med. 1998 Jul 23;339(4):229-34. | CrossRef | PubMed | Stettler C, Allemann S, Jüni P, Cull CA, Holman RR, Egger M, et al. Glycemic control and macrovascular disease in types 1 and 2 diabetes mellitus: Meta-analysis of randomized trials. Am Heart J. 2006 Jul;152(1):27-38. | CrossRef | PubMed |
Stettler C, Allemann S, Jüni P, Cull CA, Holman RR, Egger M, et al. Glycemic control and macrovascular disease in types 1 and 2 diabetes mellitus: Meta-analysis of randomized trials. Am Heart J. 2006 Jul;152(1):27-38. | CrossRef | PubMed | Reasner C. Rational therapy of mixed dyslipidaemia in a patient with diabetes. British Journal of Diabetes & Vascular Disease January 2007 vol. 7 no. 1 25-30. | CrossRef | Link |
Reasner C. Rational therapy of mixed dyslipidaemia in a patient with diabetes. British Journal of Diabetes & Vascular Disease January 2007 vol. 7 no. 1 25-30. | CrossRef | Link | Barter P, Gotto AM, LaRosa JC, Maroni J, Szarek M, Grundy SM, et al. HDL cholesterol, very low levels of LDL cholesterol, and cardiovascular events. N Engl J Med. 2007 Sep 27;357(13):1301-10. | CrossRef | PubMed |
Barter P, Gotto AM, LaRosa JC, Maroni J, Szarek M, Grundy SM, et al. HDL cholesterol, very low levels of LDL cholesterol, and cardiovascular events. N Engl J Med. 2007 Sep 27;357(13):1301-10. | CrossRef | PubMed | Schulte H, Cullen P, Assmann G. Obesity, mortality and cardiovascular disease in the Münster Heart Study (PROCAM). Atherosclerosis. 1999 May;144(1):199-209. | CrossRef | PubMed |
Schulte H, Cullen P, Assmann G. Obesity, mortality and cardiovascular disease in the Münster Heart Study (PROCAM). Atherosclerosis. 1999 May;144(1):199-209. | CrossRef | PubMed | Turner RC, Millns H, Neil HA, Stratton IM, Manley SE, Matthews DR, et al. Risk factors for coronary artery disease in non-insulin dependent diabetes mellitus: United Kingdom Prospective Diabetes Study (UKPDS: 23) BMJ. 1998 Mar 14;316(7134):823-8. | CrossRef | PubMed | PMC |
Turner RC, Millns H, Neil HA, Stratton IM, Manley SE, Matthews DR, et al. Risk factors for coronary artery disease in non-insulin dependent diabetes mellitus: United Kingdom Prospective Diabetes Study (UKPDS: 23) BMJ. 1998 Mar 14;316(7134):823-8. | CrossRef | PubMed | PMC | Costa J, Borges M, David C, Vaz Carneiro A. Efficacy of lipid lowering drug treatment for diabetic and non-diabetic patients: meta-analysis of randomised controlled trials. BMJ. 2006 May 13;332(7550):1115-24. Epub 2006 Apr 3. | CrossRef | PubMed | PMC |
Costa J, Borges M, David C, Vaz Carneiro A. Efficacy of lipid lowering drug treatment for diabetic and non-diabetic patients: meta-analysis of randomised controlled trials. BMJ. 2006 May 13;332(7550):1115-24. Epub 2006 Apr 3. | CrossRef | PubMed | PMC | Howard BV, Cowan LD, Go O, Welty TK, Robbins DC, Lee ET. Adverse effects of diabetes on multiple cardiovascular disease risk factors in women. The Strong Heart Study. Diabetes Care. 1998 Aug;21(8):1258-65. | CrossRef | PubMed |
Howard BV, Cowan LD, Go O, Welty TK, Robbins DC, Lee ET. Adverse effects of diabetes on multiple cardiovascular disease risk factors in women. The Strong Heart Study. Diabetes Care. 1998 Aug;21(8):1258-65. | CrossRef | PubMed | Reaven GM, Chen YD, Jeppesen J, Maheux P, Krauss RM. Insulin resistance and hyperinsulinemia in individuals with small, dense low density lipoprotein particles. J Clin Invest. 1993 Jul;92(1):141-6. | CrossRef | PubMed | PMC |
Reaven GM, Chen YD, Jeppesen J, Maheux P, Krauss RM. Insulin resistance and hyperinsulinemia in individuals with small, dense low density lipoprotein particles. J Clin Invest. 1993 Jul;92(1):141-6. | CrossRef | PubMed | PMC | Isomaa B, Almgren P, Tuomi T, Forsén B, Lahti K, Nissén M, et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care. 2001 Apr;24(4):683-9. | CrossRef | PubMed |
Isomaa B, Almgren P, Tuomi T, Forsén B, Lahti K, Nissén M, et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care. 2001 Apr;24(4):683-9. | CrossRef | PubMed | DeFronzo RA, Goodman AM. Efficacy of metformin in patients with non-insulin-dependent diabetes mellitus. The Multicenter Metformin Study Group. N Engl J Med. 1995 Aug 31;333(9):541-9. | CrossRef | PubMed |
DeFronzo RA, Goodman AM. Efficacy of metformin in patients with non-insulin-dependent diabetes mellitus. The Multicenter Metformin Study Group. N Engl J Med. 1995 Aug 31;333(9):541-9. | CrossRef | PubMed | Torgerson JS, Hauptman J, Boldrin MN, Sjöström L. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care. 2004 Jan;27(1):155-61. | CrossRef | PubMed |
Torgerson JS, Hauptman J, Boldrin MN, Sjöström L. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care. 2004 Jan;27(1):155-61. | CrossRef | PubMed |