 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el marco de las reuniones clínicas de la Unidad General de Cuidados del Niño del Hospital Padre Hurtado. La publicación de estas actas científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Unidad. El jefe de la UGCN es el Dr. Alejandro Donoso y el Encargado de las Reuniones Clínicas es el Dr. Mario Vildoso.
En la primera parte de esta presentación se habló sobre aspectos generales de la enfermedad por neumococo y del desarrollo de las vacunas contra este agente. A continuación se resumirá las características de las nuevas vacunas disponibles a la fecha (2009), que son las siguientes:
Prevenar 13 está en fase 3 de un programa clínico cuyos resultados se publicarán pronto y que incluye los siguientes aspectos: estudios de no inferioridad con base en inmunogenicidad; evaluación de la efectividad de distintos esquemas: tres dosis más un booster (esquema 3 + 1) o dos dosis más un booster (esquema 2+1); estudios en niños mayores no vacunados con una, dos o tres dosis; evaluación de respuesta inmune a vacunas administradas al mismo tiempo y estudios de seguridad e inmunogenicidad en todos los países (Tabla I).
Tabla I. Prevenar 13: Programa Clínico de Fase 3.
En la Fig. 1 se aprecia un estudio hecho en Alemania sobre inmunogenicidad. Después de la serie primaria, con un punto de corte de IgG de 0,35 ug/ml, se observa que los niveles de anticuerpos son muy semejantes a Prevenar 7®, ya que posee casi las mismas características, mientras que para los otros seis serotipos la respuesta es buena (Fig. 2).
Después de la cuarta dosis o booster las diferencias se tienden a igualar, logrando buenos niveles de anticuerpos para los seis nuevos serotipos que incorpora y alcanzando en 90% de los sujetos los títulos requeridos para el serotipo 3, que en general responde mal ya que su cápsula es muy grande y cuesta mucho evaluar la respuesta (Fig. 2).
Existe un estudio del laboratorio Wyeth que compara dos grupos de pacientes: los vacunados con Prevenar 13® y los vacunados con las tres dosis de Prevenar 7® más una última dosis con Prevenar 13® después del año de edad, con un punto de corte de 0,35 ug/mL. Los resultados fueron óptimos para los seis nuevos serotipos y se lograron buenos niveles para los demás. Se lograron títulos de OPA mayores a 1:8 en más de 90% de los pacientes, lo que cumple con los requisitos de la OMS.
Prevenar 13® se diferencia de las otras vacunas en que logra concentraciones de anticuerpos algo más altas; por ejemplo, los títulos para el serotipo 7F alcanzan una media de 8000 cuando se administran cuatro dosis y de 17.000 cuando se administran tres dosis de Prevenar 7® y una de Prevenar 13®, lo que demuestra que no siempre a mayor dosis se obtiene mayor respuesta. Esto sí ocurre para el serotipo 3, pero es probable que los otros serotipos también tengan una respuesta algo ambivalente. La OMS no estableció una norma de títulos porque no se considera que sean buenos indicadores. Claramente al comparar Prevenar 13® y Synflorix® esta última genera mayores títulos de anticuerpos, pero no necesariamente mayor dosis implica mayor título. Contra algunos serotipos se alcanzan títulos de 126 mientras que para otros se llega a 8.000, porque algunos son mucho más reactogénicos.
Los efectos adversos aumentan en forma directamente proporcional con el número de dosis, por lo que se espera que la cuarta dosis provoque más efectos adversos que la primera. Se evaluó la seguridad e inmunogenicidad en niños mayores que recibieron las dosis sin un esquema inicial: tres dosis cuando se vacuna después de los siete meses, dos dosis cuando se vacuna entre uno y dos años y una dosis después de los 24 meses; y se observó que se lograron buenos niveles de anticuerpos para estos esquemas (1).
En junio de 2009 se publicó un trabajo sobre la eficacia de una vacuna 11 valente, que agrega a lo que se conoce como Synflorix (10 valente) el serotipo 3, en el que se demostró buenos niveles de respuesta de anticuerpos (mayor de 93%) a las 18 semanas, es decir, después de la serie primaria para nueve serotipos, con niveles algo menores para los serotipos 6B y 23F (87% y 76% respectivamente), aunque el booster corregiría estas pequeñas diferencias. El trabajo demostró una reducción de 23% de cualquier neumonía radiológica a dos años de la vacunación. Por lo tanto, aunque la OMS omita pasos y la vacuna 11 valente se haya retirado del mercado por provocar interferencia con las vacunas de los programas nacionales, tiene un efecto protector (2).
Synflorix (Pneumococcal polysaccharide protein D-conjugate vaccine, PHiD-CV) contiene los serotipos comunes para todas las vacunas y agrega 1, 5, y 7F. Ocho de los diez serotipos se acompañan de una proteína D de Haemophilus, mientras que el serotipo 18C y 19F poseen como proteína conjugada el toxoide tetánico y el toxoide diftérico (Tabla II).
Tabla II. Formulación de Synflorix.
Cada laboratorio diseña su propio kit para medir respuestas de vacunas. GSK diseñó un kit que contempla una etapa previa que absorbe los anticuerpos para el serotipo 22F, lo que produce un punto de corte menor, por lo que el valor 0,2 ug/ml es equivalente al 0,35 ug/ml cuando se utiliza este kit, lo que fue aprobado por la OMS. El serotipo 6B no es un buen indicador en la serie primaria, mejorando en las otras. Synflorix no es inferior a la vacuna 7 valente para los siete serotipos comunes y logra buena respuesta para los tres serotipos adicionales. Los niveles de OPA son cercanos a 100%, con excepción del serotipo 1 en que la respuesta es algo menor (Fig. 3).
Figura 3. Synflorix es immunogénica para todos los serotipos.
Con respecto a la posibilidad de usar dos o tres dosis, se ha demostrado que la respuesta al esquema 3+1 es mayor pero no en forma significativa, por lo que se podría utilizar el esquema 2+1 nivel nacional, lo que disminuiría el costo. Después del refuerzo las diferencias son menos importantes, pues todos los niveles de anticuerpos suben (Fig. 4). El serotipo que tiene mayor diferencia es el 6B (3).
Figura 4. Inmunogenicidad del esquema primario de tres dosis y dos dosis.
La reactogenicidad de Synflorix es similar a la de Prevenar 13 y muy comparable a la de Prevenar 7. Por otra parte, se dice que existe una reacción cruzada para algunos serotipos de la Prevenar 7, entendiéndose que normalmente la respuesta inmune para un serotipo específico es siempre mejor que la respuesta de la reacción cruzada. Los estudios al respecto muestran que los niveles OPA para el serotipo 6A, que no está en la Prevenar 7, son similares para ésta y para PHiD-CV, tanto post-primario como post refuerzo, pero para el serotipo 19A existe muy mala respuesta con Prevenar 7 en ambas situaciones. Synflorix tiene una respuesta mucho mayor, pero está por verse si esto tiene correlación clínica, ya que los niveles de anticuerpos sería efectivos si están sobre 70% (Tabla III).
Tabla III. Protección cruzada contra serotipos 6A y 19A.
Un cálculo estimado del impacto de la PHiD-CV frente a enfermedad neumológica invasiva indica que tendría una efectividad de 68,4% para el serotipo 19A y de 84,6% para el 6A, utilizando los datos de reacción cruzada.
La proteína D se encuentra en la superficie de todos los H. influenzae, por lo tanto los anticuerpos antiproteína D son protectores para infecciones por Haemophilus, como se demostró en estudiuos experimentales en ratones. El Haemophilus es el agente responsable de alrededor de 30% de las OMA, al igual que el neumococo. El estudio POET (Pneumococcal Otitis Media Efficacy Trial), que se efectuó antes del lanzamiento de la vacuna Synflorix para evaluar la eficacia de la vacuna 11 valente de GSK con respecto a la OMA mediante el seguimiento de casi 5000 lactantes durante 24 meses, fue el primer estudio en que se demostró la eficacia significativa de esta vacuna en la OMA, así como una reducción significativa de la portación nasofaríngea de los serotipos de neumococo contenidos en la vacuna y del H. Influernzae no tipificable, por el efecto rebaño. Por otra parte la inmunogenicidad de esta vacuna para el serotipo 3 fue escasa, como lo demostró la presencia de títulos de anticuerpos post-refuerzo más bajos comparados que los títulos post-primarios, es decir, con la cuarta dosis los niveles de anticuerpos disminuyeron; además hubo más casos de enfermedad por serotipo 3 en los pacientes que estaban vacunados que en los que no lo estaban (4). Por este riesgo de hipo-respuesta se retiró el serotipo 3 de la vacuna. Prevenar 13 tiene el mismo problema.
Synflorix GSK 10 valente se aprobó por primera vez en Canadá en febrero del año 2009, para protección contra enfermedad invasiva por neumococo; la Agencia Europea del Medicamento (EMEA) emitió una opinión favorable y la recomendó para protección contra enfermedades invasivas y OMA. El uso de Synflorix es un poco más extenso que el de Prevenar a nivel mundial. Chile es el primer país en que se aprobó el uso de Prevenar 13, lo que ocurrió recientemente y es probable que en septiembre de 2009 se apruebe en los Estados Unidos.
La vacuna 7 valente se ha evaluado mediante tres estudios de serotipos en Chile: el primero se realizó durante diez años en la Región Metropolitana (RM) en menores de 35 meses e incluyó 1630 cepas; el segundo se hizo en Temuco, también durante diez años, en niños menores de dos años e incluyó 95 cepas; finalmente está el estudio realizado en Chillán y Temuco en niños entre 2 y 24 meses, con 33 cepas. Los porcentajes de cobertura de Prevenar 7 rn enfermedad invasora neumocócica fueron 59%, 47% y 60% respectivamente.
La vacuna 10 valente aumentó la cobertura a 72% en la RM y Temuco y a 63% según los datos del tercer estudio; al agregar la cobertura para el serotipo 6A por reacción cruzada los valores aumentan a 77%, 77% y 66% respectivamente.
La Prevenar 13 valente tiene cobertura de 83%, 80% y 81% respectivamente.
El porcentaje de cobertura de las vacunas neumocócicas en enfermedad invasora en niños de 0 a 35 meses de la Región Metropolitana (2000-2007) es similar en pacientes hospitalizados y ambulatorios.
En Chile el serotipo 3 prácticamente no existe y el valor de su cobertura es 0,64%, 0% y 0% en los estudios mencionados. El serotipo 6A es más importante, con valores de 5%, 5% y 3%. La mayor diferencia se observa con el serotipo 19A, con 5%, 2% y 15%, aunque este último valor equivale a dos o tres cepas, por lo que no tiene tanto impacto. La diferencia entre Prevenar 10 y 13 valente es de 10% y está dada 5% por el serotipo 6A y 5% por el serotipo 19ª (Tabla IV).
Tabla IV. Frecuencia de los serotipos 3, 6A y 19A en tres lugares de Chile.
Datos sobre los serotipos de neumococo presentes en niños chilenos con OMA indican que los agentes de otitis son diferentes a los agentes de neumonía, meningitis o bacteriemia y que la cobertura de la vacuna 7 valente para los serotipos causantes de OMA es de 47%, cifra que aumenta a 60% con la vacuna 10 valente. Aún no hay datos sobre la 13 valente.
Las recomendaciones del Grupo de Asesoramiento Estratégico de Expertos (SAGE) sobre Inmunizaciones de la OMS establecen que la incorporación de las vacuna neumocócicas conjugadas a los Programas Nacionales de Inmunización es una prioridad, sin embargo falta mucha información. Actualmente se está desarrollando en Argentina y otros países de Latinoamérica el estudio COMPAS (Clinical Otitis Media and Pneumonia Study), que entregará datos sobre la eficacia de la vacuna Synflorix para reducir la OMA por Haemophilus, permitirá confirmar la eficacia de la proteína D que se observó en el estudio POET y permitirá determinar si el aumento del título de anticuerpos y OPA contra 19A por reacción cruzada se correlaciona o no con la clínica. En cuanto a Prevenar 13, se está esperando datos de publicaciones y en Chile ya se aprobó su uso (5).
En resumen, los costos y beneficios de cada vacuna se deberán evaluar en forma individual. Por un lado está Prevenar 13, con cobertura para 13 serotipos de neumococo, compuesta por una proteína transportadora CMR conocida y que se ha probado previamente con buenos niveles de anticuerpos, enfocada a cubrir principalmente las infecciones invasivas. Por otro lado está Synflorix, que entrega cobertura para 10 serotipos aunque sumando el 6A tendría sólo 5% de diferencia gracias al uso de una nueva proteína transportadora y permitiría reducir en forma importante la tasa de OMA a largo plazo, como se espera que demuestre el estudio COMPAS. Además la eficacia contra Haemophilus Influenzae no tipificable podría superar el 5% de diferencia contra el neumococo (Fig. 5).
Figura 5. Factores a considerar en la elección de una vacuna neumocócica conjugada.


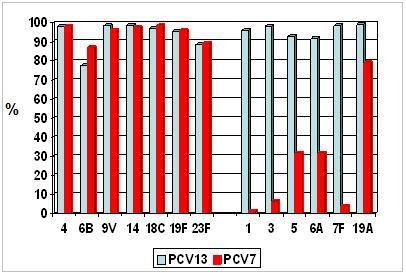 Figura 1. Estudio de comparación de inmunogenicidad entre Prevenar 7 y Prevenar 13: sujetos alcanzan concentraciones de IgG > 0,35 ug/mL después de la serie primaria.
Figura 1. Estudio de comparación de inmunogenicidad entre Prevenar 7 y Prevenar 13: sujetos alcanzan concentraciones de IgG > 0,35 ug/mL después de la serie primaria.







 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el marco de las reuniones clínicas de la Unidad General de Cuidados del Niño del Hospital Padre Hurtado. La publicación de estas actas científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Unidad. El jefe de la UGCN es el Dr. Alejandro Donoso y el Encargado de las Reuniones Clínicas es el Dr. Mario Vildoso.
 Expositora:
Juanita Zamorano[1]
Expositora:
Juanita Zamorano[1]

Citación: Zamorano J. New pneumococcal vaccines, 2009. Medwave 2010 Mar;10(03):e4448 doi: 10.5867/medwave.2010.03.4448
Fecha de publicación: 1/3/2010

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 European Society for Pediatric Infectious Disease (ESPID). Safety and Immunogenicity of a 13-valent Pneumococcal Conjugate Vaccine Administered to Older Infants and Children Naïve to Previous Vaccination. Brussels, Belgium, 2009.
European Society for Pediatric Infectious Disease (ESPID). Safety and Immunogenicity of a 13-valent Pneumococcal Conjugate Vaccine Administered to Older Infants and Children Naïve to Previous Vaccination. Brussels, Belgium, 2009.  Lucero MG, Nohynek H, Williams G, Tallo V, Simões EA, Lupisan S, et al. Efficacy of an 11-valent pneumococcal conjugate vaccine against radiologically confirmed pneumonia among children less than 2 years of age in the Philippines: a randomized, double-blind, placebo-controlled trial. Pediatr Infect Dis J. 2009 Jun;28(6):455-62. | CrossRef | PubMed |
Lucero MG, Nohynek H, Williams G, Tallo V, Simões EA, Lupisan S, et al. Efficacy of an 11-valent pneumococcal conjugate vaccine against radiologically confirmed pneumonia among children less than 2 years of age in the Philippines: a randomized, double-blind, placebo-controlled trial. Pediatr Infect Dis J. 2009 Jun;28(6):455-62. | CrossRef | PubMed | Bermal N, Szenborn L, Chrobot A, Alberto E, Lommel P, Gatchalian S, et al. The 10-valent pneumococcal non-typeable Haemophilus influenzae protein D conjugate vaccine (PHiD-CV) coadministered with DTPw-HBV/Hib and poliovirus vaccines: assessment of immunogenicity. Pediatr Infect Dis J. 2009 Apr;28(4 Suppl):S89-96. | CrossRef | PubMed |
Bermal N, Szenborn L, Chrobot A, Alberto E, Lommel P, Gatchalian S, et al. The 10-valent pneumococcal non-typeable Haemophilus influenzae protein D conjugate vaccine (PHiD-CV) coadministered with DTPw-HBV/Hib and poliovirus vaccines: assessment of immunogenicity. Pediatr Infect Dis J. 2009 Apr;28(4 Suppl):S89-96. | CrossRef | PubMed | Prymula R, Peeters P, Chrobok V, Kriz P, Novakova E, Kaliskova E, et al. Pneumococcal capsular polysaccharides conjugated to protein D for prevention of acute otitis media caused by both Streptococcus pneumoniae and non-typable Haemophilus influenzae: a randomised double-blind efficacy study. Lancet. 2006 Mar 4;367(9512):740-8.
http://dx.doi.org/10.1016/S0140-6736(06)68304-9 | PubMed |
Prymula R, Peeters P, Chrobok V, Kriz P, Novakova E, Kaliskova E, et al. Pneumococcal capsular polysaccharides conjugated to protein D for prevention of acute otitis media caused by both Streptococcus pneumoniae and non-typable Haemophilus influenzae: a randomised double-blind efficacy study. Lancet. 2006 Mar 4;367(9512):740-8.
http://dx.doi.org/10.1016/S0140-6736(06)68304-9 | PubMed | WHO Weekly Epidemiological Record. Pneumococcal conjugate vaccine for childhood immunization--WHO position paper. Wkly Epidemiol Rec. 2007 Mar 23;82(12):93-104. | PubMed |
WHO Weekly Epidemiological Record. Pneumococcal conjugate vaccine for childhood immunization--WHO position paper. Wkly Epidemiol Rec. 2007 Mar 23;82(12):93-104. | PubMed |