 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
En la primera parte de esta conferencia se habló sobre epidemiología, fisiopatología y detección de la insuficiencia renal crónica, así como del riesgo cardiovascular asociado a esta condición. En la presente segunda parte se analizarán las medidas disponibles en la actualidad para la prevención de la progresión del daño renal en la insuficiencia renal crónica.
En el año 1983, cuando aún no estaban en uso los IECA, se demostró el impacto del tratamiento de la hipertensión en sujetos con diabetes mellitus tipo I sobre la VFG. Hoy se considera que el tratamiento de esta condición, tanto en la nefropatía diabética como no diabética es la herramienta más importante para disminuir la progresión de la enfermedad renal en la población, sin importar el fármaco que se utilice (1). En el estudio MDRD, realizado en pacientes con nefropatía y distintos grados de proteinuria, se demostró que los pacientes con proteinuria mayor de 3 g tienen una caída muy importante de la VFG cuando la presión arterial media (PAM) es mayor de 92 mmHg. En pacientes con proteinuria menor la caída de la VFG se acentúa cuando la PAM es alrededor de 98 mmHg. Esto demuestra que la proteinuria es un factor de riesgo independiente de progresión de enfermedad renal, por tanto cuando la proteinuria es mayor de 1 g/día se aconseja mantener una presión arterial menor de 125/75 mmHg y cuando la proteinuria es menor de 1g/día se debe mantener la presión menor de 130/80 mmHg (2).
Otro estudio sobre los IECA, realizado por Lewis en 1993, demostró el efecto beneficioso del captopril sobre la progresión de la insuficiencia renal y la mortalidad, en comparación con el tratamiento convencional. Una parte del efecto se debía a la presión arterial, ya que los enfermos tenían 2 a 3 mmHg menos, pero no lo explicaba totalmente, lo que sugiere un efecto específico del fármaco sobre la progresión (3). Esto se ha demostrado también en pacientes con diabetes mellitus tipo 2 y microalbuminuria, en los cuales la progresión de ésta es mucho menor cuando se administra un IECA que cuando se ocupan otros fármacos antihipertensivos (4). Otro grupo de investigadores demostró que la progresión de la microalbuminuria es mucho menor en los pacientes con diabetes tipo 2 que recibieron irbersartan en dosis máximas que en los que reciben placebo, incluso se han demostrado casos en los que se puede revertir este fenómeno (5). En patologías proteinúricas no diabéticas también se obtiene una protección importante cuando se usa ramipril, en comparación con el tratamiento convencional. Por lo tanto está clara la ventaja adicional que se obtiene al utilizar IECA, sin embargo, si no se es posible hacerlo el tratamiento de la hipertensión arterial es más potente que el bloqueo del eje.
Por otro lado el bloqueo dual en las nefropatías proteinúricas es más efectivo que el bloqueo único, tanto para mantener el nivel de creatinina como la excreción de proteínas en la orina (6). El estudio COOPERATE, el más importante sobre este tema, se realizó con el objetivo de evaluar la eficacia y seguridad del tratamiento combinado comparado con monoterapia en dosis máximas, en que se adiciona un IECA a un ARA II en pacientes con nefropatía crónica no diabética. El estudio incluyó a 336 pacientes que se asignaron en forma aleatoria a losartán 100 mg/d, trandolapril 3 mg/d o losartán 100 mg/d más trandolapril 3 mg/d y demostró que la proteinuria, es mucho menor en los pacientes que reciben la terapia dual, aunque se mantenga el control de la PAM en forma similar, y que la proporción de pacientes que llegan a ERCT o mueren es menor que en los pacientes con terapia única (7). En conclusión, en las glomerulopatías proteinúricas el tratamiento combinado retarda en forma segura la progresión de la enfermedad renal crónica, en comparación con la monoterapia.
En cuanto al efecto del bloqueador de la renina aliskiren sobre la progresión de las nefropatías, la literatura disponible es escasa. El único trabajo importante publicado demuestra que cuando se adiciona este fármaco a losartán se observa una disminución de la secreción de proteínas en 15%, mientras que si se agrega enalapril a valsartán disminuye en 30%, por lo que no se tiene certeza de que su uso sea ventajoso (8).
Teniendo en cuenta que estos fármacos tienen efectos colaterales en pacientes con insuficiencia renal, como hipercalemia o caída de la VFG, entre otras, es necesario definir hasta cuándo prevenir. Con este objetivo se realizó un estudio en dos grupos de pacientes: uno con niveles de creatinina entre 1,5 y 3 mg/dl y otro con niveles de creatinina entre 3,1 y 5 mg/dl, es decir, pacientes con falla renal avanzada, con menos de 30 ml/minuto. Este grupo se subdividió en dos: a un subgrupo se le administró placebo y al otro, benazepril y se encontró que la progresión para llega a falla renal fue más lenta en el grupo que recibió el fármaco, retardando el inicio de diálisis con el consiguiente beneficio para los pacientes (9).
También es importante definir cuándo es necesario prevenir. En julio de 2009 se publicó un trabajo en el que se analizó el efecto del antagonista de los receptores de angiotensina II losartán y del IECA enalapril para la prevención primaria de la microalbuminuria en pacientes con diabetes tipo 1, normotensos y sin microalbuminuria. Los pacientes fueron seguidos durante cinco años y no se encontró un beneficio con el uso de estos fármacos e incluso con losartán la evolución podría ser peor. Sin embargo este estudio no puede servir para decidir el no uso de estos fármacos, porque los pacientes tenían once años de evolución de la diabetes en promedio y se habían mantenido normotensos y sin microalbuminuria, por lo tanto probablemente nunca habrían desarrollado nefropatía; además, cinco años no es un tiempo adecuado para un estudio de este tipo (10).
Existe mucha evidencia sobre el uso de IECA y/o ARA II en la prevención de la progresión de nefropatías, especialmente proteinúricas. El uso de antagonistas de renina requiere el apoyo de más trabajos clínicos y de estudios que comparen su eficacia con la de los IECA y los ARA II.
Se sabe que la aldosterona, considerada tradicionalmente como una hormona renal, es un factor clave en el desarrollo de hipertensión arterial, insuficiencia cardíaca y enfermedad renal. Esto proviene del reconocimiento reciente de sus acciones inflamatorias y fibrogénicas y del descubrimiento de sitios de síntesis fuera de las suprarrenales. Los efectos deletéreos de la aldosterona se producen porque esta hormona promueve la acción de una serie de factores proinflamatorios y causa disfunción endotelial y pérdida de potasio, además de que promueve la fibrosis, la hipertensión y la progresión tanto de la enfermedad renal como de la insuficiencia cardíaca y la disfunción endotelial (11) (Fig. 1).
Figura 1. Efectos deletéreos de la aldosterona.
Estudios de histopatología renal en ratas con uninefrectomía tratadas con aldosterona y aldosterona más eplerona han demostrado el rol de la aldosterona en la génesis del daño renal (12). Asimismo, estudios del receptor de mineralocorticoide en células mesangiales en cultivo han demostrado una disminución de la nefrina, que es una proteína podocitaria, evidenciando el daño que produce la aldosterona (13). También se ha demostrado el efecto de eplerona e hidralazina en ratas Dahl sal sensibles sobre el daño podocitario a las cinco semanas de sobrecarga salina (14). En la Fig. 2 se muestra la progresión del daño renal provocado por la hiperfiltración típica a las cuatro y ocho semanas; en cambio al agregar espironolactona se observa regresión del daño glomerular en la biopsia, lo que demuestra el efecto de la aldosterona en la progresión de este daño (15).
Figura 2. Regresión de la glomeruloesclerosis por espironolactona en nefrectomía 5/6.
Se podría decir que los enfermos que están con bloqueo de la angiotensina por medio de IECA o ARAII están protegidos, pues les disminuye la aldosterona, pero se sabe que ésta disminuye inicialmente y en un grupo de pacientes se produce después un escape de aldosterona: estos pacientes se benefician especialmente con el uso de antialdosterónicos (16). El efecto de la espironolactona en la nefropatía diabética con macroalbuminuria es una disminución importante de la proteinuria y de la caída de la VFG (17); lo mismo ocurre en glomerulopatías primitivas de otro tipo (18). Aparentemente el esquema espironolactona más ramipril es tan efectivo como espironolactona más ramipril e irbesartan, es decir, no sería necesario realizar un triple bloqueo, el cual además se asocia a una incidencia mucho mayor de hipercalemia. Sin embargo un trabajo piloto que se publicó recientemente sugiere que la triple terapia sería mejor.
Como conclusión sobre la aldosterona, existe abundante evidencia experimental que comprueba la acción deletérea de la aldosterona a nivel renal (podocitario, tubular, mesangial) y el efecto beneficioso del bloqueo de la aldosterona en modelos animales y humanos sobre la proteinuria, en nefropatía diabética y no diabética; sin embargo no hay evidencia actual que apoye la utilidad del efecto del bloqueo de la aldosterona en la filtración glomerular a largo plazo. Parece razonable incluir un bloqueador de la aldosterona en nefropatías proteinúricas, ya sea solo o en combinación con IECA o ARA II. La triple terapia no tiene fundamento.
El uso de estatinas previene la progresión del daño renal por sus efectos no sólo sobre el colesterol, sino también sobre el estrés oxidativo (19). Un metaanálisis demostró que el tratamiento es beneficioso, al igual que la mayoría de los trabajos con estatinas. Los objetivos de colesterol son parecidos a los de la diabetes mellitus, es decir, bajo 100 o bajo 70 de LDL (20).
En los últimos años, varios trabajos han demostrado que el ácido úrico es capaz de aumentar la renina y por lo tanto la angiotensina y la aldosterona, además produce arteriolopatía y aumento del estrés oxidativo. En sujetos jóvenes normales que difieren sólo en los niveles de uricemia, aquellos con mayores niveles de ácido úrico son más propensos a desarrollar insuficiencia renal, por lo que sería razonable considerar como un factor de riesgo al ácido úrico y mantener sus niveles dentro de lo normal.
Finalmente, se ha demostrado que el control estricto de la glicemia con el objetivo de mantener la hemoglobina glicosilada menor de 7% es una medida de prevención primaria eficaz para disminuir la progresión de la microalbuminuria; y en prevención secundaria, es decir, en pacientes que ya tienen microalbuminuria, esta medida disminuye tanto la micro como la macroalbuminuria. Por lo tanto es importante que los pacientes diabéticos, por lo menos en las etapas precoces, mantengan un nivel de hemoglobina glicosilada de 7% o menor (21).
En Chile, la guía preventiva de enfermedad renal crónica aún no se incorpora dentro del plan de salud AUGE (Acceso Universal con Garantías Explícitas), pero esto debería ocurrir en el futuro. Esta guía establece que se debe identificar a la población de riesgo, principalmente a los portadores de hipertensión arterial y diabetes, sin olvidar otros factores de riesgo como parientes de primer grado y antecedentes nefrourológicos.
En la Fig. 3 se observa el algoritmo para la pesquisa y manejo de una posible enfermedad renal.
Figura 3. Pesquisa y manejo de enfermedad renal en atención primaria.
En la nefropatía diabética se debe iniciar el estudio con un examen de orina completa; el estudio y manejo posterior dependerá de la detección de proteinuria en este examen. En la Fig. 4 se muestra el algoritmo de la detección de nefropatía en pacientes con diabetes mellitus tipo 2.
Figura 4. Detección de nefropatía en pacientes con diabetes mellitus tipo 2.
Los objetivos en el tratamiento de un paciente con ERC son: presión arterial menor de 130/80 mmHg en los pacientes nefrópatas y menor de 120/75 mmHg si tienen proteinuria importante. Tratar de disminuir al máximo la progresión de la función renal. En los exámenes de orina se recomienda la razón proteína/creatinina. Mantener los triglicéridos bajo 150 mg/dl, el colesterol menos de 70-100 mg/dl, el ácido úrico en niveles normales y controlar los factores asociados a la insuficiencia renal, es decir, calcio, fósforo, paratohormona, además de una hemoglobina glicosilada menor de 7%. En la Tabla I se observan con más detalle los objetivos y metas de tratamiento.
Tabla I. Parámetros de control y objetivos y metas de tratamiento en un paciente con ERC.
Para aplicar esta guía se creó una ficha de atención primaria que se titula “Enfermedad Renal Crónica: Detección y Prevención de la Progresión”, que debe estar disponible en todos los policlínicos que atienden pacientes con diabetes, enfermedad cardiovascular o hipertensión. En ella se consignan los factores de riesgo: diabetes, hipertensión, antecedentes nefrourológicos o antecedentes familiares de primer grado, los datos de peso, presión y creatinina para calcular la VFG, las características del examen de orina, la presencia de proteinuria confirmada y cualquier otra alteración (Fig. 5).
La ficha contiene una recomendación de la conducta a seguir con los pacientes diabéticos y no diabéticos, lo que asegura que los pacientes que tienen una enfermedad renal crónica se deriven al nefrólogo por lo menos una vez, con excepción de los pacientes diabéticos que tienen una VFG mayor de 60 y que tienen sólo microalbuminuria, cuyo tratamiento inicial se puede iniciar y controlar a nivel de atención primaria (Fig. 6).

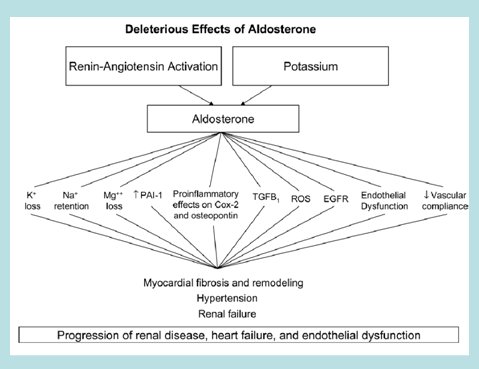 Figura 1. Efectos deletéreos de la aldosterona.
Figura 1. Efectos deletéreos de la aldosterona.

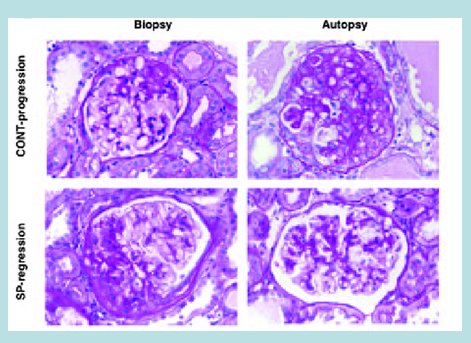 Figura 2. Regresión de la glomeruloesclerosis por espironolactona en nefrectomía 5/6.
Figura 2. Regresión de la glomeruloesclerosis por espironolactona en nefrectomía 5/6.

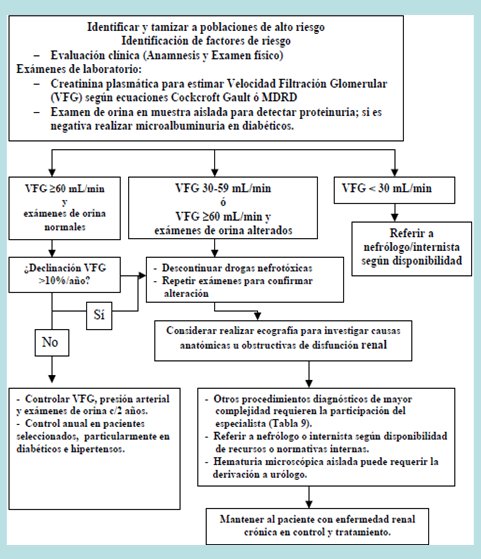 Figura 3. Pesquisa y manejo de enfermedad renal en atención primaria.
Figura 3. Pesquisa y manejo de enfermedad renal en atención primaria.

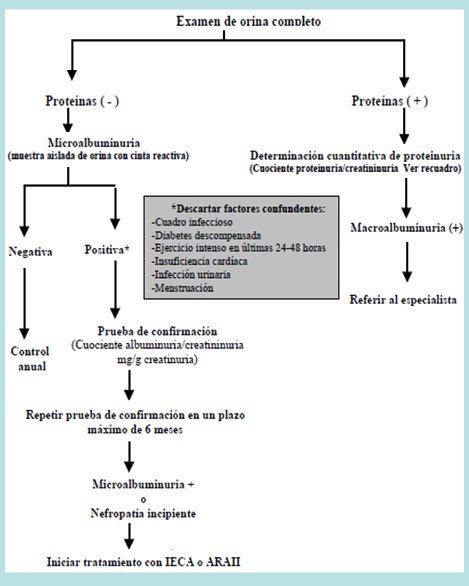 Figura 4. Detección de nefropatía en pacientes con diabetes mellitus tipo 2.
Figura 4. Detección de nefropatía en pacientes con diabetes mellitus tipo 2.

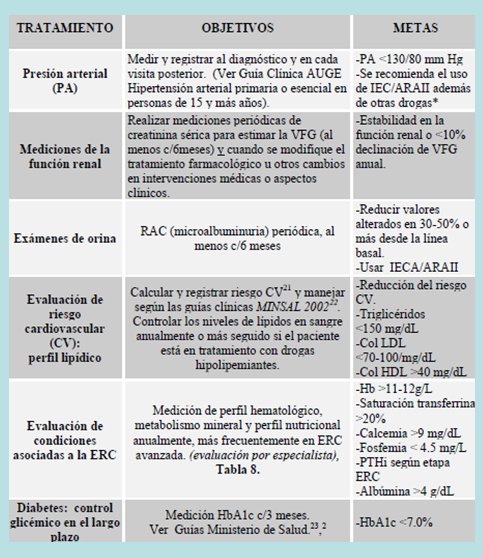 Tabla I. Parámetros de control y objetivos y metas de tratamiento en un paciente con ERC.
Tabla I. Parámetros de control y objetivos y metas de tratamiento en un paciente con ERC.

 Figura 5. Ficha de atención primaria para detección y prevención de la progresión de la enfermedad renal crónica. Ministerio de Salud de Chile, Subsecretaría de Salud Pública.
Figura 5. Ficha de atención primaria para detección y prevención de la progresión de la enfermedad renal crónica. Ministerio de Salud de Chile, Subsecretaría de Salud Pública.

 Figura 6. Ficha para detección y prevención de la progresión de la enfermedad renal crónica. Ministerio de Salud de Chile, Subsecretaría de Salud Pública.
Figura 6. Ficha para detección y prevención de la progresión de la enfermedad renal crónica. Ministerio de Salud de Chile, Subsecretaría de Salud Pública.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
 Autora:
Miriam Alvo Abodovsky[1]
Autora:
Miriam Alvo Abodovsky[1]

Citación: Alvo M. Prevention of chronic kidney disease: practical measures. Medwave 2009 Dic;9(12):e4305 doi: 10.5867/medwave.2009.12.4305
Fecha de publicación: 1/12/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Parving HH, Andersen AR, Smidt UM, Svendsen PA. Early aggressive antihypertensive treatment reduces rate of decline in kidney function in diabetic nephropathy. Lancet. 1983 May 28;1(8335):1175-9. | CrossRef | PubMed |
Parving HH, Andersen AR, Smidt UM, Svendsen PA. Early aggressive antihypertensive treatment reduces rate of decline in kidney function in diabetic nephropathy. Lancet. 1983 May 28;1(8335):1175-9. | CrossRef | PubMed | Peterson JC, Adler S, Burkart JM, Greene T, Hebert LA, Hunsicker LG,et al. Blood pressure control, proteinuria, and the progression of renal disease. The Modification of Diet in Renal Disease Study. Ann Intern Med. 1995 Nov 15;123(10):754-62. | PubMed |
Peterson JC, Adler S, Burkart JM, Greene T, Hebert LA, Hunsicker LG,et al. Blood pressure control, proteinuria, and the progression of renal disease. The Modification of Diet in Renal Disease Study. Ann Intern Med. 1995 Nov 15;123(10):754-62. | PubMed | Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med. 1993 Nov 11;329(20):1456-62. | CrossRef | PubMed |
Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med. 1993 Nov 11;329(20):1456-62. | CrossRef | PubMed | Ruggenenti P, Fassi A, Ilieva AP, Bruno S, Iliev IP, Brusegan V, et al. Preventing microalbuminuria in type 2 diabetes. N Engl J Med. 2004 Nov 4;351(19):1941-51. Epub 2004 Oct 31. | CrossRef | PubMed |
Ruggenenti P, Fassi A, Ilieva AP, Bruno S, Iliev IP, Brusegan V, et al. Preventing microalbuminuria in type 2 diabetes. N Engl J Med. 2004 Nov 4;351(19):1941-51. Epub 2004 Oct 31. | CrossRef | PubMed | Parving et al. Effects of Losartan Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE, Parving HH, Remuzzi G, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med. 2001 Sep 20;345(12):861-9. | CrossRef | PubMed |
Parving et al. Effects of Losartan Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE, Parving HH, Remuzzi G, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med. 2001 Sep 20;345(12):861-9. | CrossRef | PubMed | Campbell R, Sangalli F, Perticucci E, Aros C, Viscarra C, Perna A, et al. Effects of combined ACE inhibitor and angiotensin II antagonist treatment in human chronic nephropathies. Kidney Int. 2003 Mar;63(3):1094-103. | CrossRef | PubMed |
Campbell R, Sangalli F, Perticucci E, Aros C, Viscarra C, Perna A, et al. Effects of combined ACE inhibitor and angiotensin II antagonist treatment in human chronic nephropathies. Kidney Int. 2003 Mar;63(3):1094-103. | CrossRef | PubMed | Nakao N, Yoshimura A, Morita H, Takada M, Kayano T, Ideura T. Combination treatment of angiotensin-II receptor blocker and angiotensin-converting-enzyme inhibitor in non-diabetic renal disease (COOPERATE): a randomised controlled trial. Lancet. 2003 Jan 11;361(9352):117-24. | CrossRef | PubMed |
Nakao N, Yoshimura A, Morita H, Takada M, Kayano T, Ideura T. Combination treatment of angiotensin-II receptor blocker and angiotensin-converting-enzyme inhibitor in non-diabetic renal disease (COOPERATE): a randomised controlled trial. Lancet. 2003 Jan 11;361(9352):117-24. | CrossRef | PubMed | Ingelfinger JR. Aliskiren and dual therapy in type 2 diabetes mellitus. N Engl J Med. 2008 Jun 5;358(23):2503-5. | CrossRef | PubMed |
Ingelfinger JR. Aliskiren and dual therapy in type 2 diabetes mellitus. N Engl J Med. 2008 Jun 5;358(23):2503-5. | CrossRef | PubMed | Hou FF, Zhang X, Zhang GH, Xie D, Chen PY, Zhang WR, et al. Efficacy and safety of benazepril for advanced chronic renal insufficiency. N Engl J Med. 2006 Jan 12;354(2):131-40. | CrossRef | PubMed |
Hou FF, Zhang X, Zhang GH, Xie D, Chen PY, Zhang WR, et al. Efficacy and safety of benazepril for advanced chronic renal insufficiency. N Engl J Med. 2006 Jan 12;354(2):131-40. | CrossRef | PubMed | Mauer M, Zinman B, Gardiner R, Suissa S, Sinaiko A, Strand T, et al. Renal and retinal effects of enalapril and losartan in type 1 diabetes. N Engl J Med. 2009 Jul 2;361(1):40-51. | CrossRef | PubMed | PMC |
Mauer M, Zinman B, Gardiner R, Suissa S, Sinaiko A, Strand T, et al. Renal and retinal effects of enalapril and losartan in type 1 diabetes. N Engl J Med. 2009 Jul 2;361(1):40-51. | CrossRef | PubMed | PMC | Epstein M. Aldosterone blockade: an emerging strategy for abrogating progressive renal disease. Am J Med. 2006 Nov;119(11):912-9. | CrossRef | PubMed |
Epstein M. Aldosterone blockade: an emerging strategy for abrogating progressive renal disease. Am J Med. 2006 Nov;119(11):912-9. | CrossRef | PubMed | Blasi ER, Rocha R, Rudolph AE, Blomme EA, Polly ML, McMahon EG. Aldosterone/salt induces renal inflammation and fibrosis in hypertensive rats. Kidney Int. 2003 May;63(5):1791-800. | CrossRef | PubMed |
Blasi ER, Rocha R, Rudolph AE, Blomme EA, Polly ML, McMahon EG. Aldosterone/salt induces renal inflammation and fibrosis in hypertensive rats. Kidney Int. 2003 May;63(5):1791-800. | CrossRef | PubMed | Terada Y, Kobayashi T, Kuwana H, Tanaka H, Inoshita S, Kuwahara M, et al. Aldosterone stimulates proliferation of mesangial cells by activating mitogen-activated protein kinase 1/2, cyclin D1, and cyclin A. J Am Soc Nephrol. 2005 Aug;16(8):2296-305. Epub 2005 Jun 23. | CrossRef | PubMed |
Terada Y, Kobayashi T, Kuwana H, Tanaka H, Inoshita S, Kuwahara M, et al. Aldosterone stimulates proliferation of mesangial cells by activating mitogen-activated protein kinase 1/2, cyclin D1, and cyclin A. J Am Soc Nephrol. 2005 Aug;16(8):2296-305. Epub 2005 Jun 23. | CrossRef | PubMed | Nagase M, Shibata S, Yoshida S, Nagase T, Gotoda T, Fujita T. Podocyte injury underlies the glomerulopathy of Dahl salt-hypertensive rats and is reversed by aldosterone blocker. Hypertension. 2006 Jun;47(6):1084-93. Epub 2006 Apr 24. | PubMed |
Nagase M, Shibata S, Yoshida S, Nagase T, Gotoda T, Fujita T. Podocyte injury underlies the glomerulopathy of Dahl salt-hypertensive rats and is reversed by aldosterone blocker. Hypertension. 2006 Jun;47(6):1084-93. Epub 2006 Apr 24. | PubMed | Aldigier JC, Kanjanbuch T, Ma LJ, Brown NJ, Fogo AB. Regression of existing glomerulosclerosis by inhibition of aldosterone. J Am Soc Nephrol. 2005 Nov;16(11):3306-14. Epub 2005 Sep 28. | PubMed |
Aldigier JC, Kanjanbuch T, Ma LJ, Brown NJ, Fogo AB. Regression of existing glomerulosclerosis by inhibition of aldosterone. J Am Soc Nephrol. 2005 Nov;16(11):3306-14. Epub 2005 Sep 28. | PubMed | Sato A, Saruta T. Aldosterone breakthrough during angiotensin-converting enzyme inhibitor therapy. Am J Hypertens. 2003 Sep;16(9 Pt 1):781-8. | CrossRef | PubMed |
Sato A, Saruta T. Aldosterone breakthrough during angiotensin-converting enzyme inhibitor therapy. Am J Hypertens. 2003 Sep;16(9 Pt 1):781-8. | CrossRef | PubMed | van den Meiracker AH, Baggen RG, Pauli S, Lindemans A, Vulto AG, Poldermans D,
et al. Spironolactone in type 2 diabetic nephropathy: Effects on proteinuria, blood pressure and renal function. J Hypertens. 2006 Nov;24(11):2285-92. | CrossRef | PubMed |
van den Meiracker AH, Baggen RG, Pauli S, Lindemans A, Vulto AG, Poldermans D,
et al. Spironolactone in type 2 diabetic nephropathy: Effects on proteinuria, blood pressure and renal function. J Hypertens. 2006 Nov;24(11):2285-92. | CrossRef | PubMed | Bianchi S, Bigazzi R, Campese VM. Long-term effects of spironolactone on proteinuria and kidney function in patients with chronic kidney disease. Kidney Int. 2006 Dec;70(12):2116-23. Epub 2006 Oct 11. | PubMed |
Bianchi S, Bigazzi R, Campese VM. Long-term effects of spironolactone on proteinuria and kidney function in patients with chronic kidney disease. Kidney Int. 2006 Dec;70(12):2116-23. Epub 2006 Oct 11. | PubMed | Campese VM, Park J. HMG-CoA reductase inhibitors and the kidney. Kidney Int. 2007 Jun;71(12):1215-22. Epub 2007 May 9. | CrossRef | PubMed |
Campese VM, Park J. HMG-CoA reductase inhibitors and the kidney. Kidney Int. 2007 Jun;71(12):1215-22. Epub 2007 May 9. | CrossRef | PubMed |