 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
La presente conferencia se divide en dos partes. En la primera se hablará sobre epidemiología, fisiopatología y detección de la insuficiencia renal crónica, así como del riesgo cardiovascular asociado a esta condición. En la segunda parte se analizarán las medidas disponibles en la actualidad para la prevención de la progresión del daño renal en la insuficiencia renal crónica.
La enfermedad renal se define como la disminución de la velocidad de filtración glomerular (VFG) bajo 60 ml/min, o velocidad de filtración glomerular con rango normal en pacientes que tienen algún estigma de daño renal. La Tabla I muestra los diferentes estadios de la enfermedad renal crónica y su prevalencia.
Tabla I. Estadios y prevalencia de la enfermedad renal crónica.
La prevalencia de enfermedad renal crónica (ERC) en la población adulta en Chile es de alrededor de 11%. Según datos de la Encuesta Nacional de Salud (ENS) 2003, 23% de los sujetos evaluados tenía VFG menor de 80 ml/min, por lo que se estima que entre 10 y 14% de la población padece ERC. La mayor parte de los afectados son sujetos de edad avanzada. Porcentajes similares se han descrito en múltiples estudios de países occidentales.
La población global en diálisis ha aumentado progresivamente desde 1990, en que se registró a 500.000 individuos, hasta el año 2000, en que la cifra llegó a 1.000.000, lo que significa que en la última década prácticamente se duplicó el número de pacientes que ingresa a diálisis; se estima que en 2010 habrá 2.000.000 de personas en diálisis. Esto se explica por dos razones: aumento de la incidencia de la enfermedad renal crónica terminal (ERCT) y el aumento de la sobrevida de los sujetos en diálisis (1). El aumento de los pacientes en diálisis incrementa los costos asociados a la insuficiencia renal crónica (IRC) y a los tratamientos de sustitución renal, que alcanzan montos de trillones de dólares y continuarán aumentando en forma indefinida, lo que los hará insostenibles incluso para los países más desarrollados (2).
Los sujetos más susceptibles a desarrollar enfermedad renal crónica son los portadores de las siguientes condiciones:
La prevención primaria y secundaria de la ERC se debe enfocar en estos grupos de riesgo y se debe orientar a tres objetivos primordiales: primero, disminuir la prevalencia de la ERCT y sus consecuencias sobre el individuo; segundo, disminuir el riesgo cardiovascular (CV), ya que se considera a la ERC como el mayor factor de riesgo para el desarrollo de enfermedad CV, mucho más que el colesterol o la hipertensión arterial; tercero, disminuir los costos insostenibles que genera esta enfermedad: actualmente en Chile, 20% del presupuesto del Fondo Nacional de Salud (FONASA) se destina a diálisis.
Los parámetros más importantes para pesquisar la ERC y establecer la etapa en que se encuentra son la estimación de la VFG y la detección del daño renal. Para estimar la VFG sólo se necesita el valor plasmático de creatinina, que permite calcular el clearance mediante la fórmula de Cockroft Gault, que se diseñó para estimar el clearance de creatinina y no la VFG por lo que ésta se sobreestima, lo que constituye una limitación; aún así es muy útil desde el punto de vista clínico. La fórmula establece que VFG = (140-edad) x peso/creatinina x 72). El resultado se multiplica por 0,85 si el sujeto es de sexo femenino, ya que ellas tienen aproximadamente 15% menos de masa muscular que los hombres.
Otra fórmula para estimar la VFG es la MDRD, que establece que VFG = 186 x (Pcr)-1,154 x (edad) - 0,203 ml/min/1,73 m2, multiplicado por 0,742 si es mujer o por 1,210 si el paciente es afroamericano. Este método es el que más se recomienda, especialmente en pacientes con daño renal; considera creatinina, edad, sexo y raza y es el más exacto para calcular VFG menores de 60 ml/min, pero no está validado para VFG mayores ya que entrega resultados como “mayor de 70 ml/min” sin que se pueda determinar si corresponde a 70, 80 o 90 ml/min.
La detección del daño renal se puede realizar mediante:
Para fines de estudio de población lo más importante es la detección de proteinuria, que se realiza con una tira reactiva que detecta albúmina cuando el nivel es mayor de 20 a 30 mg/dl. Si este examen es positivo se debe confirmar mediante cuantificación de proteinuria. La relación entre proteinuria y creatininuria entrega una buena estimación de la proteinuria en 24 horas; su valor normal es menor de 200 mg/g de proteína. En sujetos diabéticos el daño renal se mide mediante determinación de microalbuminuria, aunque se acepta que éste es un buen marcador de daño renal sólo en la diabetes tipo 2 y no hay consenso sobre su utilidad en otras poblaciones ni en la diabetes tipo 1. La Tabla II muestra las definiciones de albuminuria y proteinuria.
Tabla II. Definiciones de proteinuria y albuminuria.
Independiente del mecanismo inicial de la nefropatía crónica, sea glomerulonefritis crónica, nefropatía diabética, enfermedad poliquística o pielonefritis crónica, entre otras, existen factores secundarios que facilitan la progresión del deterioro de la función renal y son comunes a todas las nefropatías. Los más importantes son la hipertensión arterial y la proteinuria, ambos influenciados por angiotensina II; algunos sólo tienen documentación experimental y esperan su validación en la clínica.
La hipertensión e hipertrofia glomerular produce lesión directa a células endoteliales; además estimula la producción de citoquinas y factores de crecimiento que aumentan la tensión de la pared, desprenden los podocitos que atrapan macromoléculas y generan depósitos hialinos, con la consiguiente obliteración de los capilares. Por otra parte se produce tensión sobre las células mesangiales, que también liberan citoquinas (TGF-beta, PDGF) y aumentan la matriz mesangial. El daño tubulointersticial es más bien de origen mecánico, pero también es mediado por angiotensina II que libera una serie de factores que dañan en forma progresiva el riñón. En la Fig. 1 se observa un riñón esclerosado: corresponde a una glomeruloesclerosis focal y segmentaria con fibrosis intersticial.
En la Fig. 2 se demuestra la importancia de la hipertensión glomerular en el desarrollo de la glomerulopatía. La imagen es de un paciente con diabetes mellitus con y sin estenosis de una arteria renal. El riñón de la arteria no estenótica, es decir, donde se trasmite la presión arterial y la hiperfiltración glomerular, tiene los glomérulos completamente dañados. En el mismo paciente, el riñón que tiene estenosis de la arteria renal está prácticamente indemne.
En la enfermedad renal primaria disminuye el número de nefrones, lo que aumenta la presión glomerular capilar, produciendo hiperfiltración con aumento de proteinuria y esto lleva a la glomeruloesclerosis, transformándose en un círculo vicioso. Por otro lado la enfermedad renal primaria se acompaña de aumento de la angiotensina II, lo que provoca hipertensión arterial con cambios hemodinámicos y liberación de una serie de citoquinas y factores de crecimiento como TGF-B, IL-6, MCP-1, RANTES, MMP-2 y MMP-9, que llevan a mayor hipertrofia glomerular y proteinuria y agravan la glomeruloesclerosis (Fig. 3).
Figura 3. Rol central de la angiotensina II en el daño renal.
Otro factor importante en la progresión de la nefropatía es la proteinuria per se (tráfico de proteínas), que se asocia claramente al pronóstico renal, es decir, una enfermedad renal que tiene creatinina elevada y proteinuria tiene peor pronóstico a mayor grado de proteinuria, sobre todo si es mayor de 3 g. Los mecanismos de daño de la proteinuria son: toxicidad mesangial y podocitaria; sobrecarga tubular con hiperplasia; toxicidad tubular de proteínas filtradas como transferrina/fierro, inmunoglobulinas, albúmina y complemento; inducción de moléculas proinflamatorias como MCP-1, RANTES, osteopontina; y fibrosis intersticial mediada por mayor expresión de TGF-beta.
El daño renal no es sólo un problema para el riñón, también es un problema para el aparato cardiovascular. En 1974 Belding Hibbard Scribner, un gran nefrólogo y pionero de la diálisis publicó que a diez años de iniciada la diálisis, 50% de los pacientes morían por causa cardiovascular y propuso la hipótesis de la aterogénesis acelerada en pacientes en hemodiálisis crónica (3). Después de eso se vio que de los pacientes con ERC que fallecen antes de ingresar a diálisis o trasplante, 10% fallece en etapa uno, 20% en etapa dos, 24% en etapa tres y 46% en etapa cuatro (4). Muchos enfermos fallecen de causa cardíaca antes de llegar a diálisis y esto se observa claramente en las curvas de enfermedad cardiovascular y muerte efectuadas en una gran población, las que muestran que los pacientes con mayor daño renal (VFG entre 15 y 30) tienen una mortalidad cardiovascular mucho mayor que la población sin daño renal (5). Estos pacientes no sólo poseen mayor frecuencia de enfermedad CV; también presentan eventos CV mucho más graves.
En la Fig. 4 se muestra una población con coronariografía inicial que se etapificó por los mismos grados de daño y falla renal; se puede ver que los pacientes con falla renal tienen una mortalidad mucho mayor, a pesar de que las lesiones coronarias eran similares al comienzo (6).
El ramipril, un inhibidor de la enzima convertidora de angiotensina, IECA, puede disminuir la mortalidad en pacientes con insuficiencia renal por un efecto independiente de la hipertensión; ahí podría estar el rol de la angiotensina II.
En resumen, la insuficiencia renal aumenta la prevalencia y fatalidad de los eventos CV, de modo que se considera como un factor de riesgo CV mayor. Los efectos CV de la IRC aparecen en la etapa temprana de la caída de la filtración glomerular y se deben tratar en forma enérgica, como en todo sujeto de alto riesgo CV; hay evidencia sobre los beneficios de los IECA y los betabloqueadores y sobre el manejo agresivo de la hipertensión arterial, uso de estatinas y otros.
En la segunda parte se esta presentación se analizará con detalle el rol de estas y otras medidas en la prevención de la IRC.

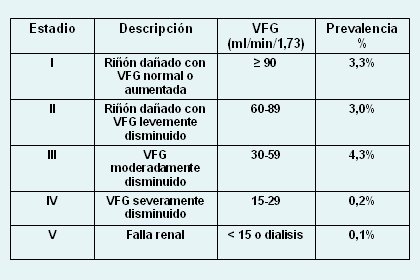 Tabla I. Estadios y prevalencia de la enfermedad renal crónica.
Tabla I. Estadios y prevalencia de la enfermedad renal crónica.

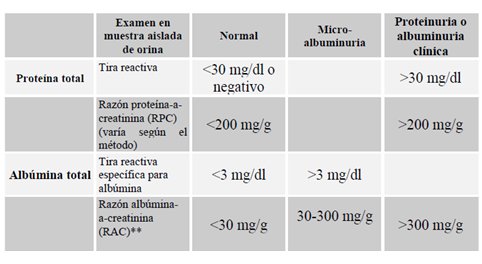 Tabla II. Definiciones de proteinuria y albuminuria.
Tabla II. Definiciones de proteinuria y albuminuria.

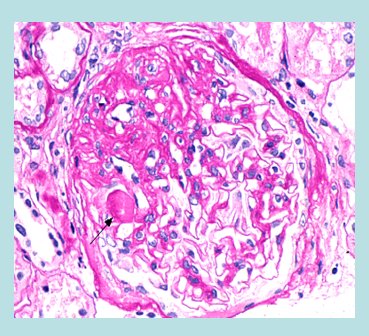 Figura 1. Manifestaciones histológicas de daño renal: glomeruloesclerosis focal y segmentaria, fibrosis intersticial.
Figura 1. Manifestaciones histológicas de daño renal: glomeruloesclerosis focal y segmentaria, fibrosis intersticial.

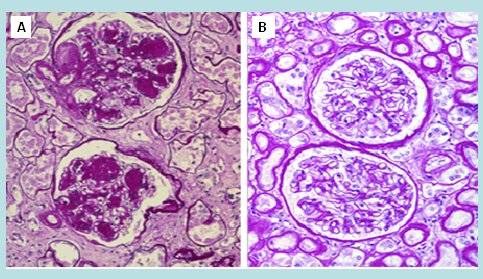 Figura 2. Glomeruloesclerosis diabética unilateral. A: sin estenosis renovascular. B: con estenosis renovascular.
Figura 2. Glomeruloesclerosis diabética unilateral. A: sin estenosis renovascular. B: con estenosis renovascular.

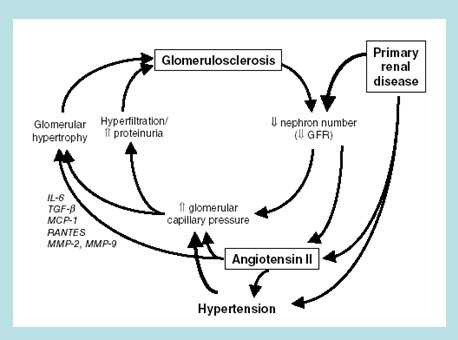 Figura 3. Rol central de la angiotensina II en el daño renal.
Figura 3. Rol central de la angiotensina II en el daño renal.

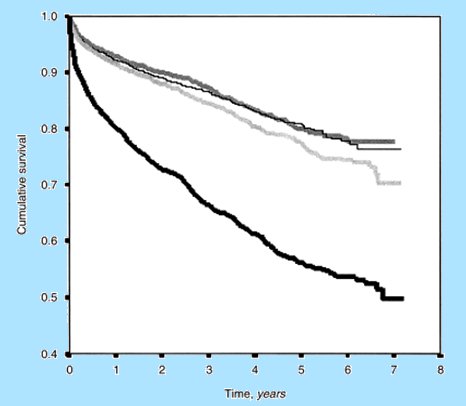 Figura 4: Impacto de la insuficiencia renal en el riesgo de infarto y muerte en pacientes con coronariografía inicial.
Figura 4: Impacto de la insuficiencia renal en el riesgo de infarto y muerte en pacientes con coronariografía inicial.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
 Autora:
Miriam Alvo Abodovsky[1]
Autora:
Miriam Alvo Abodovsky[1]

Citación: Alvo M. Prevention of chronic kidney disease: general aspects. Medwave 2009 Nov;9(11):e4263 doi: 10.5867/medwave.2009.11.4263
Fecha de publicación: 1/11/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Almaguer M, Herrera R, Alfonso J, Magrans C, Mañalich R, Martínez A. Primary health care strategies for the prevention of end-stage renal disease in Cuba. Kidney Int Suppl. 2005 Aug;(97):S4-10 | CrossRef | PubMed |
Almaguer M, Herrera R, Alfonso J, Magrans C, Mañalich R, Martínez A. Primary health care strategies for the prevention of end-stage renal disease in Cuba. Kidney Int Suppl. 2005 Aug;(97):S4-10 | CrossRef | PubMed | Lysaght MJ. Maintenance dialysis population dynamics: current trends and long-term implications. J Am Soc Nephrol. 2002 Jan;13 Suppl 1:S37-40. | PubMed |
Lysaght MJ. Maintenance dialysis population dynamics: current trends and long-term implications. J Am Soc Nephrol. 2002 Jan;13 Suppl 1:S37-40. | PubMed | Lindner A, Charra B, Sherrard DJ, Scribner BH. Accelerated atherosclerosis in prolonged maintenance hemodialysis. N Engl J Med. 1974 Mar 28;290(13):697-701. | CrossRef | PubMed |
Lindner A, Charra B, Sherrard DJ, Scribner BH. Accelerated atherosclerosis in prolonged maintenance hemodialysis. N Engl J Med. 1974 Mar 28;290(13):697-701. | CrossRef | PubMed | Keith DS, Nichols GA, Gullion CM, Brown JB, Smith DH. Longitudinal follow-up and outcomes among a population with chronic kidney disease in a large managed care organization. Arch Intern Med. 2004 Mar 22;164(6):659-63. | CrossRef | PubMed |
Keith DS, Nichols GA, Gullion CM, Brown JB, Smith DH. Longitudinal follow-up and outcomes among a population with chronic kidney disease in a large managed care organization. Arch Intern Med. 2004 Mar 22;164(6):659-63. | CrossRef | PubMed |