 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
En la primera parte de esta conferencia se analizó el metabolismo del hierro, sus mecanismos de regulación y generalidades de la anemia ferropriva. En esta segunda parte se hablará sobre el diagnóstico etiológico y tratamiento de este tipo de anemia.
Existe consenso entre los gastroenterólogos, más que entre los hematólogos, en que en los hombres y mujeres post-menopáusicas (que tienen 25% de incidencia de anemia ferropriva) siempre se debe estudiar el tracto gastrointestinal superior e inferior. Si se realiza primero la endoscopía alta se recomienda hacer de todos modos una colonoscopía, independientemente de los hallazgos de la primera debido a que se ha descrito la presencia de lesiones en ambos sitios en 29% de los pacientes. En personas mayores de 50 años la recomendación es partir con la colonoscopía; se describe un caso de cáncer colorrectal por cada 9 a 13 pacientes con anemia por déficit de hierro (1). En mujeres jóvenes la principal causa de déficit de hierro son las menstruaciones aumentadas o múltiples embarazos; el hallazgo de una malignidad gastrointestinal es excepcional, por lo tanto en este grupo de pacientes se podría postergar la decisión de realizar endoscopías (2), pero se recomienda realizarla en pacientes que tienen factores de riesgo de cáncer de colon y en aquellas refractarias a tratamiento. No obstante, aunque se sigan estas recomendaciones, alrededor de 30% de los casos quedan sin resolver debido a que en el estudio endoscópico no se encuentra una lesión hemorrágica que explique la anemia ferropriva. Para continuar el estudio se clasifica a los pacientes en dos grupos: los asintomáticos desde el punto de vista gastrointestinal y sin evidencias de hemorragia oculta y los pacientes que tienen sangrado oculto.
En los pacientes asintomáticos y sin evidencias de hemorragia oculta hay dos posibles abordajes. El primero consiste en realizar biopsias gástricas y duodenales múltiples para diagnosticar lesiones no hemorrágicas responsables de la mala absorción de hierro, método que según algunos estudios permite identificar en otro 20% de pacientes una causa de la deficiencia de hierro, como la enfermedad celíaca, la gastritis atrófica del cuerpo y la gastritis por H. pylori; la gastritis atrófica del cuerpo es una causa muy reconocida de aclorhidria y por lo tanto de incapacidad de solubilizar el hierro y la gastritis por H. pylori, si bien hay controversia sobre este punto, alteraría la solubilización del hierro (3, 4). El segundo abordaje, más novedoso, es no invasivo y plantea que se puede realizar pruebas de tamizaje para estos mismos diagnósticos, tales como anticuerpos específicos para enfermedad celíaca y tamizaje específico para gastritis autoinmune e infección por H. pylori. Lo anterior es especialmente importante en mujeres jóvenes que han sido refractarias al tratamiento oral de prueba, donde estas condiciones son especialmente frecuentes.
En los pacientes que tienen un test de sangre oculta en deposiciones positivo y un estudio endoscópico superior e inferior negativo, la exploración del intestino delgado tiene mayor rendimiento, ya que cuando la enteroscopía se realiza en forma ciega, sin seleccionar a los pacientes, el rendimiento es muy bajo: se encuentran lesiones de intestino delgado en menos de 10% de los casos. El método de exploración se selecciona según el cuadro clínico:
La relación entre la infección por H. pylori y el desarrollo de gastritis atrófica autoinmune se descubrió cuando se observó que pacientes jóvenes que desarrollaban este tipo de gastritis tenían alta prevalencia de infección por esta bacteria, la cual por otra parte prácticamente no se encontraba en ancianos con anemia perniciosa. Los autores que hicieron estas observaciones plantearon que la gastritis por H. pylori podría constituir la fase temprana de la gastritis atrófica autoinmune, en forma análoga al linfoma MALT (Linfoma del Tejido Linfoide Asociado a las Mucosas), en el cual un proceso infeccioso es reemplazado gradualmente por un proceso inmunológico que daña en forma irreversible la mucosa del cuerpo gástrico: en forma similar, el H. pylori desencadenaría una respuesta inmune que en determinado momento de la evolución escaparía de control y se transformaría en una proliferación clonal, conduciendo al desarrollo de un linfoma (5).
Hay evidencias inmunológicas que apoyan esta hipótesis y apuntan a un proceso de imitación antigénica: los pacientes infectados con H. pylori que tienen anticuerpos circulantes dirigidos contra epítopes de las células de la mucosa gástrica, tienen mayor riesgo de desarrollar atrofia gástrica; por otra parte, existen anticuerpos contra el liposacárido del H. pylori de estructura antigénica similar a los antígenos del grupo sanguíneo Lewis; la cadena beta de la bomba de protones en la célula parietal tiene epítopes que comparte con el grupo Lewis; finalmente, los anticuerpos contra la proteína H+K+ATPasa, el autoantígeno más común en la anemia perniciosa, se detecta en muchos pacientes portadores del germen. También hay evidencias poblacionales que apuntan en el mismo sentido: la serología positiva para H. pylori aumenta desde 28% en los menores de 20 años a más de 70% en los mayores de 50 años; los niveles de gastrina también aumentan con la edad, evidenciando atrofia gástrica; y la tasa de anticuerpos aumenta desde 2% en menores de 20 años a 16% en mayores de 80 años. Los investigadores postulan que este aumento de la gastrina y por lo tanto de la atrofia gástrica se podría explicar por la presencia de autoanticuerpos y por la mayor incidencia de infección por H. pylori (6).
En otros estudios se ha demostrado la progresión desde la infección por H. pylori hasta el desarrollo de la gastritis crónica: en uno de ellos, 17 de 85 pacientes que tenían infección por H. pylori se hicieron negativos para la bacteria durante el período de seguimiento de 32 años (tasa 0,6% anual), con aparición simultánea de anticuerpos contra células parietales y desarrollo de gastritis atrófica corporal (7); en otro estudio, realizado en 160 pacientes estratificados por grupos de edad, se encontró aumento progresivo de la gastrina concomitante con depleción de los niveles de cobalamina y disminución de la prevalencia de H. pylori desde 88% a 12%, lo que sugiere el inicio de una enfermedad muchos años antes que se establezca la deficiencia de cobalamina debido a un proceso autoinmune gatillado por H. pylori. Los autores plantearon que las personas jóvenes, especialmente las mujeres que son las más afectadas, desarrollan deficiencia de hierro refractaria a tratamiento mucho antes de desarrollar una anemia perniciosa, ya que para que exista ésta se requiere la presencia de anticuerpos contra el factor intrínseco, no basta la gastritis atrófica por sí sola (8).
Finalmente hay evidencias provenientes de estudios de erradicación de H. pylori que demuestran que la eliminación de la bacteria permite curar anemias por deficiencia de B12 sin administrar esta vitamina (9).
En resumen:
Un aspecto importante es el de la evaluación gastrointestinal de aquellos pacientes anémicos, pero que no tienen deficiencia de hierro. Es muy común que pacientes anémicos que se han realizado endoscopías altas y bajas con resultados normales sean derivados al hematólogo, pero la mayor parte de ellos no tiene anemia ferropriva. El principal problema de estos pacientes es que aún no se cuenta con una prueba definitiva para diagnosticar con certeza la anemia por déficit de hierro; todos los estudios se basan en la ferritina, pero como ya se mencionó ésta se puede alterar frente a estados inflamatorios, enfermedades hepáticas, insuficiencia renal y en los ancianos. En un trabajo realizado en alrededor de 50 pacientes mayores de 80 años que tenían deficiencia de hierro demostrada en la médula ósea se encontró que sólo 16% de ellos tenía exámenes convencionales compatibles con deficiencia de hierro.
En un estudio controlado se estratificó a los pacientes anémicos, según los niveles de ferritina, en tres grupos: <50 mcg/L, que se diagnostican convencionalmente como anemia por déficit de hierro con todas sus limitaciones, entre 50 y 100 mcg/L y >100 mcg/L; no se encontró diferencia en cuanto a la incidencia de lesiones que causan deficiencia de hierro entre los pacientes anémicos y aquellos con ferritina entre 50 y 100 mcg/L, mientras que la tasa de cáncer fue mucho mayor en los pacientes con ferritina disminuida, hecho que se repite en todos los estudios. Los enfermos con cáncer tienen más anemia, disminución de volumen corpuscular medio y hemoglobina corpuscular media y niveles de ferritina bajos, es decir, el diagnóstico de anemia ferropriva suele ser claro en ellos. En pacientes con ferritina mayor de 100 y pacientes no anémicos que se realizaron colonoscopía dentro de un programa de screening de cáncer de colon, la incidencia de lesiones potencialmente causantes de anemia ferropriva fue baja (10).
En otro estudio efectuado en pacientes mayores de 70 años, la incidencia de lesiones potencialmente hemorrágicas en el tracto gastrointestinal inferior fue similar en los pacientes deficientes en hierro, que los autores definieron por ferritina <30 mcg/L, y en los pacientes con ferritina entre 30 mcg/L y 100 mcg/L, mientras que en los pacientes con ferritina >100 mcg/L la tasa fue significativamente menor; lo mismo se encontró en el tracto gastrointestinal superior. Los cánceres fueron más frecuentes en las personas deficientes en hierro y la mayoría se encontró en mayores de 60 años; por lo tanto, se puede decir que con un valor de ferritina <100 mcg/L se debe realizar un estudio endoscópico, independiente de la morfología de la anemia. En cambio en los pacientes menores de 70 años de edad sí hubo diferencias entre los grupos con ferritina menor de 30 mcg/L y mayor de ese nivel y sin anemia inflamatoria: se encontró una lesión del tracto gastrointestinal superior benigna en 17% de los pacientes con deficiencia de hierro y en 8% del grupo sin esta deficiencia y no hubo ningún caso de cáncer en el primer grupo, mientras que sí lo hubo en 5% de los pacientes del segundo grupo. En el tracto gastrointestinal inferior ocurrió lo mismo. No se encontró ningún caso de cáncer en personas menores de 70 años con anemia que no fuera causada por deficiencia de hierro, con base en ese valor de corte para la ferritina (11). En resumen, en pacientes mayores de 70 años se debería usar un valor de corte de ferritina de 100 mcg/L para decidir el estudio endoscópico, mientras que en las personas mas jóvenes la definición debería ser más estricta, ya que todo esto implica costos que debería asumir el sistema de salud.
La administración de hierro por vía oral es el tratamiento más adecuado para la gran mayoría de los pacientes, en dosis de 50 a 60 mg de hierro elemental tres veces al día, lejos de las comidas. Este esquema terapéutico permite absorber aproximadamente 50 mg, aunque la respuesta de la médula ósea se obtiene con 20 mg/día de hierro elemental. En la Tabla I se observan los preparados orales de hierro de uso habitual.
Tabla I. Preparados orales de hierro de uso habitual.
El problema del hierro es que tiene efectos secundarios gastrointestinales. Los síntomas gastrointestinales superiores son dependientes de la dosis, de modo que se pueden controlar disminuyendo la dosis o administrándola con alimentos aunque se comprometa la absorción; a diferencia de los síntomas gastrointestinales inferiores (constipación o diarrea), que no se relacionan con la dosis y se deben tratar en forma sintomática solamente. Los preparados de liberación sostenida se han hecho muy populares, pero si bien son mejor tolerados tienen muy baja biodisponibilidad y se liberan mas allá de donde se absorben; en otras palabras, funcionan mal y son muy caros.
La respuesta que se espera con el tratamiento es un aumento de la hemoglobina de al menos 1 g en dos a tres semanas y su normalización en cuatro a seis semanas; después de lograr esto se debe continuar administrando fierro hasta repletar los depósitos y conseguir una ferritina de por lo menos 50 mcg. Si no hay respuesta se debe descartar las causas más comunes de fracaso, como falta de adherencia, ciertos factores dietéticos como tanatos y fitatos, uso de medicamentos que elevan el pH gástrico, como antiácidos, inhibidores de la bomba de protones y bloqueadores H2 y persistencia de sangrado oculto importante. Finalmente, como ya se mencionó, se debe descartar causas importantes de refractariedad al tratamiento como la infección por H. pylori, la gastritis crónica atrófica y la enfermedad celíaca. Es muy interesante que la erradicación del H. pylori se asocia en un porcentaje muy importante a una normalización de la respuesta al hierro en un grupo significativo de pacientes (12, 13, 14, 15). El hierro endovenoso se indica en casos de sangrado crónico que no se puede corregir, mala absorción no reversible, intolerancia y presencia de anemia muy grave (<6 g/dl) en que se desea recuperar la hemoglobina es forma más rápida sin transfundir al paciente.
El concepto de deficiencia funcional de hierro se refiere a la deficiencia inducida por el uso de factores estimuladores de la eritropoyetina, que aumentan la eritropoyesis y por consiguiente aumentan considerablemente la demanda por hierro. La mayor demanda de hierro biodisponible, en el contexto de depósitos repletos, pero que no se movilizan con la suficiente rapidez, conduce finalmente a anemia asociada a eritropoyesis deficiente en hierro, como se ve en pacientes con insuficiencia renal crónica. En este contexto los criterios son completamente diferentes: pacientes con ferritina mayor de 100 pueden tener sus depósitos de hierro muy depletados.
Las recomendaciones en estos pacientes dependen de varias condiciones: en pacientes con enfermedad renal crónica que no están en diálisis, pero están en tratamiento con eritropoyetina se debe asegurar una ferritina mayor de 100 para lograr una hemoglobina de 11 g/dl y una saturación de transferrina mayor de 20 %; lo mismo es válido para los pacientes que se encuentran en peritoneodiálisis. En los pacientes en hemodiálisis las exigencias son más altas: se debe mantener la ferritina en niveles mayores a 200 mcg/L y la saturación por sobre 20 %; si se logra estos objetivos el paciente requerirá dosis menores de eritropoyetina. Hay controversia sobre la posible mayor incidencia de infecciones, mayor progresión de ateroesclerosis y otros efectos no deseados, pero no se ha demostrado que esta terapia sea perjudicial para el paciente y en cambio está claro que logra disminuir la cantidad de eritropoyetina que requiere.

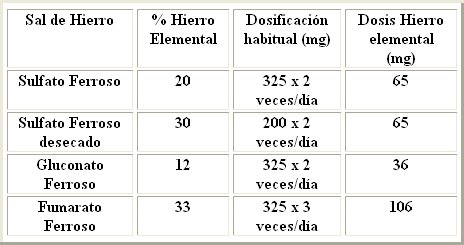 Tabla I. Preparados orales de hierro de uso habitual.
Tabla I. Preparados orales de hierro de uso habitual.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
 Autor:
Daniel Araos[1]
Autor:
Daniel Araos[1]

Citación: Araos D. Iron deficiency anemia II: etiological diagnosis, treatment. Medwave 2009 Oct;9(10):e4216 doi: 10.5867/medwave.2009.10.4216
Fecha de publicación: 1/10/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Hardwick RH, Armstrong CP. Synchronous upper and lower gastrointestinal endoscopy is an effective method of investigating iron-deficiency anaemia. Br J Surg. 1997 Dec;84(12):1725-8. | CrossRef | PubMed |
Hardwick RH, Armstrong CP. Synchronous upper and lower gastrointestinal endoscopy is an effective method of investigating iron-deficiency anaemia. Br J Surg. 1997 Dec;84(12):1725-8. | CrossRef | PubMed | Ioannou GN, Rockey DC, Bryson CL, Weiss NS. Iron deficiency and gastrointestinal malignancy: a population-based cohort study. Am J Med. 2002 Sep;113(4):276-80. | CrossRef | PubMed |
Ioannou GN, Rockey DC, Bryson CL, Weiss NS. Iron deficiency and gastrointestinal malignancy: a population-based cohort study. Am J Med. 2002 Sep;113(4):276-80. | CrossRef | PubMed | Raya Sánchez JM. Déficit de hierro sin pérdidas hemorrágicas evidentes: ¿un “reto” para la práctica clínica? An Med Interna. 2003 May;20(5):225-6. | PubMed |
Raya Sánchez JM. Déficit de hierro sin pérdidas hemorrágicas evidentes: ¿un “reto” para la práctica clínica? An Med Interna. 2003 May;20(5):225-6. | PubMed | Kaye PV, Garsed K, Ragunath K, Jawhari A, Pick B, Atherton JC. The clinical utility and diagnostic yield of routine gastric biopsies in the investigation of iron deficiency anemia: a case-control study. Am J Gastroenterol. 2008 Nov;103(11):2883-9. Epub 2008 Sep 4. | CrossRef | PubMed |
Kaye PV, Garsed K, Ragunath K, Jawhari A, Pick B, Atherton JC. The clinical utility and diagnostic yield of routine gastric biopsies in the investigation of iron deficiency anemia: a case-control study. Am J Gastroenterol. 2008 Nov;103(11):2883-9. Epub 2008 Sep 4. | CrossRef | PubMed | Appelmelk BJ, Simoons-Smit I, Negrini R, Moran AP, Aspinall GO, Forte JG, et al. Potential role of molecular mimicry between Helicobacter pylori lipopolysaccharide and host Lewis blood group antigens in autoimmunity. Infect Immun. 1996 Jun;64(6):2031-40. | PubMed | PMC |
Appelmelk BJ, Simoons-Smit I, Negrini R, Moran AP, Aspinall GO, Forte JG, et al. Potential role of molecular mimicry between Helicobacter pylori lipopolysaccharide and host Lewis blood group antigens in autoimmunity. Infect Immun. 1996 Jun;64(6):2031-40. | PubMed | PMC | Jassel SV, Ardill JE, Fillmore D, Bamford KB, O'Connor FA, Buchanan KD. The rise in circulating gastrin with age is due to increases in gastric autoimmunity and Helicobacter pylori infection. QJM. 1999 Jul;92(7):373-7. | CrossRef | PubMed |
Jassel SV, Ardill JE, Fillmore D, Bamford KB, O'Connor FA, Buchanan KD. The rise in circulating gastrin with age is due to increases in gastric autoimmunity and Helicobacter pylori infection. QJM. 1999 Jul;92(7):373-7. | CrossRef | PubMed | Valle J, Kekki M, Sipponen P, Ihamäki T, Siurala M. Long-term course and consequences of Helicobacter pylori gastritis. Results of a 32-year follow-up study. Scand J Gastroenterol. 1996 Jun;31(6):546-50. | CrossRef | PubMed |
Valle J, Kekki M, Sipponen P, Ihamäki T, Siurala M. Long-term course and consequences of Helicobacter pylori gastritis. Results of a 32-year follow-up study. Scand J Gastroenterol. 1996 Jun;31(6):546-50. | CrossRef | PubMed | Hershko C, Ronson A, Souroujon M, Maschler I, Heyd J, Patz J. Variable hematologic presentation of autoimmune gastritis: age-related progression from iron deficiency to cobalamin depletion. Blood. 2006 Feb 15;107(4):1673-9. Epub 2005 Oct 20. | CrossRef | PubMed |
Hershko C, Ronson A, Souroujon M, Maschler I, Heyd J, Patz J. Variable hematologic presentation of autoimmune gastritis: age-related progression from iron deficiency to cobalamin depletion. Blood. 2006 Feb 15;107(4):1673-9. Epub 2005 Oct 20. | CrossRef | PubMed | Kaptan K, Beyan C, Ural AU, Cetin T, Avcu F, Gülºen M, et al. Helicobacter pylori--is it a novel causative agent in Vitamin B12 deficiency? Arch Intern Med. 2000 May 8;160(9):1349-53. | CrossRef | PubMed |
Kaptan K, Beyan C, Ural AU, Cetin T, Avcu F, Gülºen M, et al. Helicobacter pylori--is it a novel causative agent in Vitamin B12 deficiency? Arch Intern Med. 2000 May 8;160(9):1349-53. | CrossRef | PubMed | Sawhney MS, Lipato T, Nelson DB, Lederle FA, Rector TS, Bond JH. Should patients with anemia and low normal or normal serum ferritin undergo colonoscopy? Am J Gastroenterol. 2007 Jan;102(1):82-8. Epub 2006 Oct 13. | CrossRef | PubMed |
Sawhney MS, Lipato T, Nelson DB, Lederle FA, Rector TS, Bond JH. Should patients with anemia and low normal or normal serum ferritin undergo colonoscopy? Am J Gastroenterol. 2007 Jan;102(1):82-8. Epub 2006 Oct 13. | CrossRef | PubMed | Powell N, McNair A. Gastrointestinal evaluation of anaemic patients without evidence of iron deficiency. Eur J Gastroenterol Hepatol. 2008 Nov;20(11):1094-100. | PubMed |
Powell N, McNair A. Gastrointestinal evaluation of anaemic patients without evidence of iron deficiency. Eur J Gastroenterol Hepatol. 2008 Nov;20(11):1094-100. | PubMed | Franceschi F, Gasbarrini A. Helicobacter pylori and extragastric diseases. Best Pract Res Clin Gastroenterol. 2007;21(2):325-34. | CrossRef | PubMed |
Franceschi F, Gasbarrini A. Helicobacter pylori and extragastric diseases. Best Pract Res Clin Gastroenterol. 2007;21(2):325-34. | CrossRef | PubMed | Nahon S, Lahmek P, Massard J, Lesgourgues B, Mariaud de Serre N, Traissac L, et al. Helicobacter pylori-associated chronic gastritis and unexplained iron deficiency anemia: a reliable association? Helicobacter. 2003 Dec;8(6):573-7. | CrossRef | PubMed |
Nahon S, Lahmek P, Massard J, Lesgourgues B, Mariaud de Serre N, Traissac L, et al. Helicobacter pylori-associated chronic gastritis and unexplained iron deficiency anemia: a reliable association? Helicobacter. 2003 Dec;8(6):573-7. | CrossRef | PubMed | Annibale B, Capurso G, Lahner E, Passi S, Ricci R, Maggio F, et al. Concomitant alterations in intragastric pH and ascorbic acid concentration in patients with Helicobacter pylori gastritis and associated iron deficiency anaemia. Gut. 2003 Apr;52(4):496-501. | CrossRef | PubMed | PMC |
Annibale B, Capurso G, Lahner E, Passi S, Ricci R, Maggio F, et al. Concomitant alterations in intragastric pH and ascorbic acid concentration in patients with Helicobacter pylori gastritis and associated iron deficiency anaemia. Gut. 2003 Apr;52(4):496-501. | CrossRef | PubMed | PMC | Chen LH, Luo HS. Effects of H pylori therapy on erythrocytic and iron parameters in iron deficiency anemia patients with H pylori-positive chronic gastristis. World J Gastroenterol. 2007 Oct 28;13(40):5380-3. | PubMed |
Chen LH, Luo HS. Effects of H pylori therapy on erythrocytic and iron parameters in iron deficiency anemia patients with H pylori-positive chronic gastristis. World J Gastroenterol. 2007 Oct 28;13(40):5380-3. | PubMed |