Este texto completo es la transcripción editada y revisada de una conferencia dictada en el marco de las reuniones clínicas del Servicio de Pediatría del Complejo de Salud San Borja-Arriarán. La publicación de estas actas científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría. El jefe de Servicio es el Dr. Francisco Barrera y el coordinador de las Reuniones Clínicas es el Dr. Luis Delpiano.
Los virus Influenza se incluyen en el grupo de virus ARN de la familia orthomyxoviridae; son virus capsulados y segmentados, característica muy importante porque explica los cambios que presenta. Existen tres tipos conocidos: A, B y C; los tipos B y C causan enfermedad en los seres humanos y el A, cuyo principal reservorio silvestre está en las aves, infecta a aves y mamíferos, pero puede infectar también a los vertebrados. Además existe una serie de subtipos debido a las variantes de los antígenos de superficie hemaglutinina (HA) y neuroaminidasa (NA), que han originado 15 HA y 9 NA, de modo que se podría obtener muchas posibles combinaciones. Los subtipos H1, H2, H3 y N1 y N2 son los que han afectado a los humanos con mayor frecuencia.
En la siguiente imagen se muestra una fotografía obtenida a través de microscopía electrónica de transmisión en la que se distinguen claramente las espículas de la superficie del virus, dadas por la HA y la NA (Fig. 1). El virus tiene un núcleo y una envoltura o manto compuesto por una bicapa de lípidos derivados de la membrana celular del hospedero, de la cual sobresalen alrededor de quinientas espículas. La particular característica del virus de tener un ARN fraccionado en ocho segmentos explica su gran capacidad de recombinación. Las mutaciones puntuales, conocidas en inglés como drifts, son cambios menores que originan los diferentes subtipos virales y son responsables del brote estacional y el consiguiente cambio que se introduce en la vacuna correspondiente. Las mutaciones mayores, que en inglés se denominan shifts, tienen un potencial pandémico y se producen porque dentro del mismo hospedero pueden coexistir dos virus influenza de diferente tipo, por ejemplo un virus influenza de cerdo con un virus aviar, lo que facilita el intercambio y reordenamiento del material genético y la aparición de un nuevo subtipo con potencial pandémico, el cual también depende del grado de adaptabilidad del virus a la nueva especie y de su poder de diseminación dentro de ésta.
Figura 1. Estructura del virus Influenza.
Las aves acuáticas son el mayor reservorio del virus influenza A; ocasionalmente se produce transmisión desde las aves a seres humanos, con “baja” posibilidad de sucesiva transmisión entre éstos; no obstante esto sucedió con la gripe aviar, que logró saltar la barrera entre especies aunque afortunadamente el virus no logró suficiente fitness en seres humanos como para que se produjera transmisión entre éstos, lo que anuló su potencial pandémico.
Los cerdos son los animales que más favorecen el intercambio genético entre cepas, ya que se pueden coinfectar con cepas de distintas especies, reordenarlas genéticamente y generar una nueva cepa con capacidad pandémica. En la Fig. 2 se ilustra el mecanismo por el cual se puede producir el intercambio genético: una hebra de virus porcino y otra hebra de virus aviar se mezclan dentro de un hospedero y así se produce un intercambio de material genético que determina un cambio mayor, que se define por la mezcla de materiales genéticos diferentes.
Figura 2. Mecanismo de recombinación de las hebras de ácidos nucleicos.
Las pandemias ocurren a intervalos impredecibles: después de la de 1918 no hubo otra hasta 1957, luego ocurrió la de 1968 y finalmente la de 1977, que fue de menor magnitud. El virus influenza A es más patogénico que el B, el cual no produce pandemias sino pequeños brotes epidémicos en seres humanos. Recientemente se encontró un cadáver en Alaska en el que se identificó el virus H1N1 de la pandemia de 1918, que se habría originado en cerdos o aves; se aplicó este virus recuperado a un grupo de ratones y se observó que la mortalidad fue cercana a 50%. El virus de la gripe aviar H5N1, aislado en 1997 en Hong Kong, produjo 18 casos y 6 muertes. Luego se ha descrito varios casos esporádicos de transmisión de aves a humanos en el sureste de China y en 2004, en Vietnam; en 2008 se registraron 390 casos y 246 decesos por H5N1, la mayoría de los cuales se produjo en Indonesia, Tailandia, Vietnam y Camboya. En estos casos la adaptabilidad del virus a seres humanos no ha permitido una transmisión eficaz entre éstos, pero sucesivas mutaciones podrían conferir un poder pandémico al H5N1.
Las aves migratorias, especialmente los patos son responsables de muchas transmisiones de un continente a otro, como la que se produjo desde África hacia Nueva York. Estas aves realizan algunas escalas en su jornada de vuelo y en esos lapsos pueden entrar en contacto con aves domésticas y, a través de estas, con seres humanos; de esta forma un virus aviar puede llegar el ser humano y, si logra alcanzar una configuración genética adecuada, generar una transmisión pandémica. En los últimos cuarenta años han aparecido diez tipos de virus con potencial pandémico; de producirse, la pandemia actual sería la número 11.
En la figura 3 se observa la evolución del virus H5N1: en el curso del tiempo aparecieron otras cepas recombinantes que se transmitieron desde las aves hacia los humanos, pero durante todo este período predominó la cepa H5N1, que entre los años 2004 y 2005 produjo gran mortalidad en Tailandia, Indonesia y Camboya. Este virus aún no ha alcanzado un potencial adecuado de transmisión entre seres humanos (Fig. 3).
Figura 3. Casos y muertes causados por virus influenza recombinantes en el mundo desde 1997.
El virus influenza ingresa a la vía respiratoria y se replica de preferencia en el epitelio respiratorio, aunque también tiene capacidad para replicarse en entericitos, lo que explica los síntomas digestivos. La HA se adhiere a receptores del acido siálico presentes en las células del epitelio respiratorio e induce la formación de un endosoma; luego se produce la liberación de la nucleocápside desde el endosoma mediante la acción de la proteína M2, que es donde actúa la amantadina en el virus influenza tipo A. La proteína M2 forma canales iónicos dentro del endosoma y permite la salida del material genético del virus hacia el citoplasma, desde donde debe ingresar al núcleo para que se produzca la replicación de los segmentos de ARN viral y posteriormente, la transcripción proteica en los ribosomas. La polaridad de la hebra ARN del virus permite que se replique en forma inmediata, de modo que no necesita una transcriptasa reversa; el ARN replicado se dirige hacia los cromosomas, donde induce la síntesis de todas las proteínas. La salida del virus hacia el exterior se produce por yemación masiva, lo que provoca la lisis celular; la NA favorece la liberación.
La cepa causante del actual brote es un virus recombinante nuevo, por lo que no existe memoria inmunológica en la población. En la actualidad no existe vacuna disponible para el virus Influenza A H1N1, pero se está trabajando en ello.
Las fases de las pandemias son seis; el brote de influenza actual, a mayo 2009, está en fase cinco. A continuación se describen brevemente estas fases.
Figura 4. Fases de la pandemia establecidas por la OMS.
Clínicamente son importantes las siguientes definiciones:
Caso sospechoso de H1N1: aquella persona que consulta por infección respiratoria aguda con el antecedente de viaje en los 7 días anteriores al inicio de los síntomas a alguno de los países afectados por el brote de influenza porcina A H1N1 en humanos; o que tiene antecedente de contacto con una persona enferma proveniente de los países afectados por el brote de influenza en el día previo y hasta 7 días después del inicio de los síntomas respiratorios del contacto.
Infección respiratoria aguda: presencia de fiebre mayor o igual a 37,5°C y al menos dos de los siguientes síntomas: rinorrea o congestión nasal; odinofagia; tos; dificultad respiratoria; diarrea y/o vómitos.
Caso probable: aquel caso clínicamente sospechoso cuya prueba PCR realizada en el Instituto de Salud Pública resulta positiva. No es un caso confirmado, ya que no se cuenta con el resultado de una PCR específica, pero la probabilidad es alta.
Contacto: aquella persona que vive bajo el mismo techo o que ha estado en contacto cercano con un caso probable de influenza porcina A H1N1. El contacto cercano se refiere al contacto a menos de un metro con un paciente con influenza porcina A H1N1 probable.
En la fase 4 se indicó aislar al paciente mediante el uso de métodos de barrera, tanto para él como para el personal y proceder a la notificación inmediata por la vía más expedita a epidemiología de la SEREMI de salud correspondiente, indicando claramente nombre, RUT, dirección permanente y al menos dos teléfonos de contacto para la pesquisa posterior; asimismo se registraban los datos de los contactos, familiares u otros.
La atención clínica inicial del paciente sospechoso consideraba la implementación en los centros de atención de un sistema de triage para seleccionar a los pacientes que cumplieran con la definición de caso sospechoso, para aplicar en ellos las siguientes medidas: colocar al paciente mascarilla quirúrgica; efectuar su atención en sala o box individual. Finalmente se debía verificar que el personal de salud cumpliera las siguientes instrucciones: aplicar las precauciones estándar; usar mascarilla nº 95 o mascarilla quirúrgica, si la anterior no estaba disponible; usar antiparras o protección ocular para la atención clínica directa del caso, sobre todo al obtener muestras del paciente; estar vacunado contra la influenza estacional; y estar sano.
Se estableció la toma de muestra respiratoria para realizar inmunofluorescencia en el laboratorio local y en forma simultánea enviar muestra para reacción en cadena de polimerasa (RCP) al ISP, acompañada del formulario de envío correspondiente. Como anécdota, al primer paciente que se consideró como caso sospechoso se le tomó muestra y ésta se envió al ISP sin la orden.
El paciente debía permanecer en una habitación individual con puerta cerrada, con precauciones de vía aérea y de contacto, en espera de confirmación por RCP y comenzaría a recibir tratamiento con oseltamivir en espera del resultado de la muestra enviada al ISP. Se dispuso el tratamiento antiviral con oseltamivir a nivel de la red asistencial pública y privada con el objetivo de bloquear el brote inicial y se ordenó limitar los traslados del caso a lo estrictamente necesario.
El tratamiento y la conducta posterior de los casos sospechosos dependerían de los resultados de laboratorio de la RCP enviada al ISP, que de ser positiva definiría al paciente como caso probable de influenza A porcina H1N1, en cuyo caso el paciente se debía mantener hospitalizado en condiciones de aislamiento por siete días o mientras tuviera síntomas, además de recibir tratamiento con oseltamivir por cinco días. Si la RCP era negativa se consideraba descartado el caso y se daba de alta y manejaba según su condición clínica y cuadro de base. La tabla I muestra el esquema de dosificación de oseltamivir para casos sospechosos y probables de influenza porcina A en lactantes menores de un año, niños y adultos (Tabla I).
El manejo y seguimiento clínico de los contactos quedó a cargo del personal de epidemiología de la SEREMI de salud.
Además se entregaron recomendaciones provisorias para el personal de salud en contacto con pacientes sospechosos. Se definió como contacto al personal de salud que ha estado en contacto cercano con un caso probable de influenza porcina A H1N1, considerando como contacto cercano al que ha estado a menos de 1 metro de distancia sin barreras de protección personal. Se establecieron las siguientes recomendaciones para todo el personal de salud, clínico de apoyo y de laboratorio en contacto con un caso sospechoso de influenza porcina A H1N1 o con muestras respiratorias provenientes del caso:
La transmisión del agente es por gotitas, pero en la fase inicial se manejó a los casos con precauciones de vía aérea para retardar la transmisión local entre humanos, lo que implica:
Se implementó el uso de las siguientes barreras de protección personal antes de entrar a la habitación:
Se estableció que las instituciones de la red pública y privada que atiendan casos sospechosos debería definir un encargado local para:
Se estableció el inicio de tratamiento profiláctico con oseltamivir en el personal de salud asintomático que hubiera tenido contacto con un caso probable de influenza porcina A H1N1: que hubiera participado en la atención directa del paciente sin barreras de protección, o que hubiera participado en la atención directa al paciente con o sin barreras de protección y con factores de riesgo tales como adulto mayor o morbilidad asociada. La dosis de oseltamivir profiláctico para adultos que se utilizó en ese momento fue 75 mg cada 24 horas por siete días.
El Centers for Disease Control (CDC) estima que la influenza estacional es responsable de alrededor des 20.000 muertes al año en el mundo. Las mujeres en el tercer trimestre de embarazo tienen mayor riesgo de complicaciones por Influenza A y B, al igual que las personas mayores de 65 años y los niños menores de 1 año. Aún no se ha confeccionado la vacuna contra esta nueva cepa y la vacuna contra el virus estacional es activa sólo contra este último.
El nuevo virus es resistente a amantadina y rimantadina, pero los inhibidores de la NA, como oseltamivir (Tamiflu®) y zanamivir (Relenza®) aún son activos como antivirales. Su administración se debe iniciar dentro de las primeras 48 horas de la presentación de los síntomas, ya que después del tercer día no modifican la evolución clínica de la infección. La excreción viral ocurre en el momento de los síntomas o hasta 24 horas antes del inicio de la enfermedad y se mantiene durante 5 a 10 días, aunque en niños pequeños se puede prolongar aún más, poniendo en riesgo a otras personas. La excreción viral se controla con el uso de oseltamivir.
En la Fig. 5 se ilustra el mecanismo de acción del oseltamivir. Cuando el virus comienza el proceso de yemación la NA actúa obre el receptor de ácido siálico, lo que permite que el virus se desprenda e infecte a otras células; el inhibidor de la NA bloquea esta acción e impide el clivaje viral del receptor, de modo que el virus no se puede desprender de la célula: se puede decir que el oseltamivir es un inhibidor de la diseminación. El resto del trabajo lo realiza el sistema inmune.
Figura 5. Mecanismo de acción del antiviral oseltamivir.
La posibilidad de que se desatara una nueva pandemia de influenza se había planteado en el año 2007, cuando se produjo un número significativo de nuevos casos de gripe aviar. Ante el brote actual, el 28 de abril de 2009 se constituyó el Comité de Pandemias en el hospital San Borja Arriarán y se tomaron las medidas necesarias para enfrentarlo.

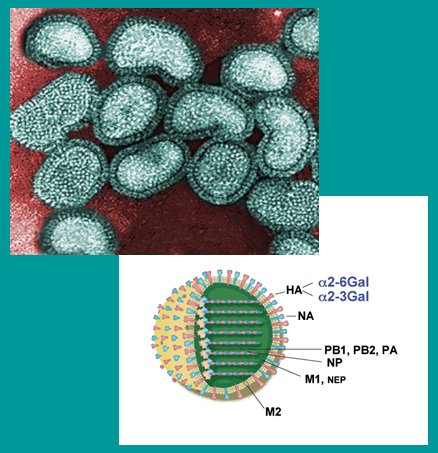 Figura 1. Estructura del virus Influenza.
Figura 1. Estructura del virus Influenza.

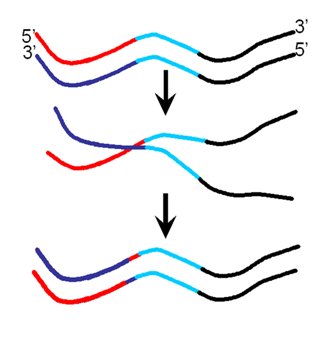 Figura 2. Mecanismo de recombinación de las hebras de ácidos nucleicos.
Figura 2. Mecanismo de recombinación de las hebras de ácidos nucleicos.

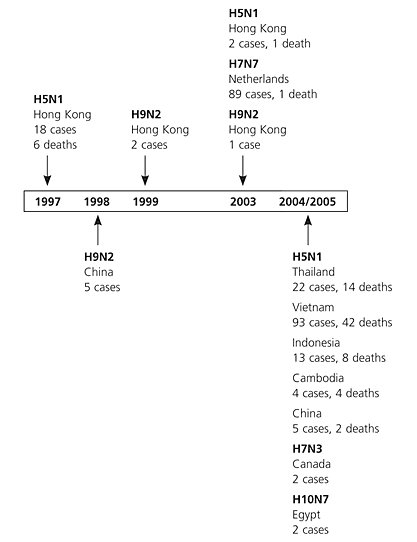 Figura 3. Casos y muertes causados por virus influenza recombinantes en el mundo desde 1997.
Figura 3. Casos y muertes causados por virus influenza recombinantes en el mundo desde 1997.

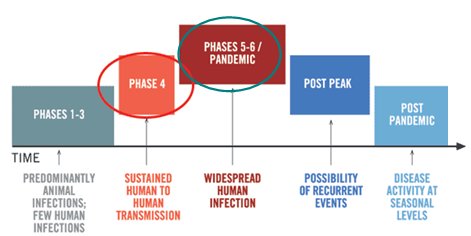 Figura 4. Fases de la pandemia establecidas por la OMS.
Figura 4. Fases de la pandemia establecidas por la OMS.

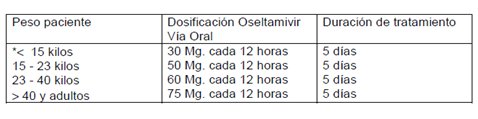 Tabla I. Dosificación de oseltamivir para tratamiento de casos sospechosos y probables de influenza porcina A H1N1.
Tabla I. Dosificación de oseltamivir para tratamiento de casos sospechosos y probables de influenza porcina A H1N1.

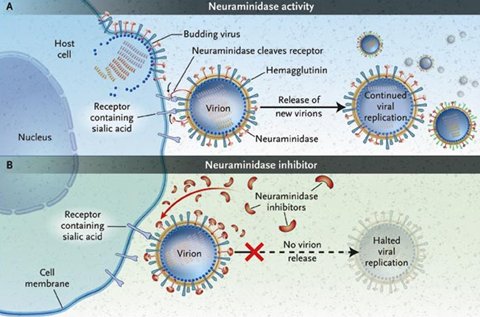 Figura 5. Mecanismo de acción del antiviral oseltamivir.
Figura 5. Mecanismo de acción del antiviral oseltamivir.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el marco de las reuniones clínicas del Servicio de Pediatría del Complejo de Salud San Borja-Arriarán. La publicación de estas actas científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría. El jefe de Servicio es el Dr. Francisco Barrera y el coordinador de las Reuniones Clínicas es el Dr. Luis Delpiano.
 Autor:
Álvaro Vera Araneda[1]
Autor:
Álvaro Vera Araneda[1]

Citación: Vera A. Influenza A H1N1, 2009. Medwave 2009 Jul;9(7):e4043 doi: 10.5867/medwave.2009.07.4043
Fecha de publicación: 1/7/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión