 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
El diagnóstico de nódulo pulmonar ha aumentado notablemente en los últimos años debido a los avances en los métodos diagnósticos, sobre todo en el campo de las imágenes. Se entiende como nódulo pulmonar a una imagen que reúne las siguientes características:
Todas estas características se deben analizar en conjunto para catalogar al nódulo como maligno o benigno.
El escáner de tórax permite identificar nódulos menores de 1 mm de diámetro. En una cohorte de 1.500 pacientes fumadores, en 74% se detectó un nódulo pulmonar solitario (NPS) en cinco años de seguimiento; por esa razón el número de consultas por derivación de pacientes portadores de nódulos pulmonares ha aumentando mucho en los últimos años; no obstante, la mayoría de ellos son benignos (1). La radiografía de tórax es capaz de discriminar nódulos de más de 5 mm; cuando se usa como screening el porcentaje de pesquisa disminuye a 20% (2).
En un estudio efectuado en países asiáticos, 31.567 pacientes fumadores se estudiaron con escáner de tórax y en 4.186 casos se encontró un nódulo pulmonar; de ellos 405 resultaron malignos. En una segunda evaluación de los pacientes que no tuvieron nódulos en el estudio inicial, se encontró otros cinco casos de cáncer; en el resto de los pacientes se hizo un tamizaje con escáner, con el que se pesquisó 74 casos más. En resumen, en alrededor de 31.000 pacientes de alto riesgo se encontraron 484 casos de cáncer. Con estos resultados se demuestra que con la TAC de tórax aumenta la posibilidad de pesquisa precoz de cáncer pulmonar, no obstante lo que no queda claro es si esta política sería costo efectiva (3).
En la evaluación clínica de un nódulo pulmonar, lo primero es descartar lesiones extrapulmonares. Por ejemplo en la Fig. 1 se observa una pequeña imagen nodular que corresponde a una calcificación pleural secundaria a la exposición a asbesto (4).
Figura 1. Nódulo pulmonar: descartar lesión extrapulmonar sobreproyectada en el campo pulmonar.
También es importante que el nódulo tenga aspecto de tal en todas las proyecciones: cuando la relación entre el ancho y el alto es de un 1,8:1 existe 100% de probabilidades de que el nódulo sea benigno En el escáner de la Fig. 2 se observa un nódulo adosado a la pared torácica, que en el corte sagital toma una forma ovalada y aplanada; se trata de una adenopatía calcificada, es decir, una lesión benigna. Por tal razón es necesario confirmar la naturaleza esférica del nódulo en todas sus dimensiones (5).
Figura 2. Relación ancho/alto >1,8:1 tiene 100% de sensibilidad para nódulo benigno.
En la siguiente imagen se observa un nódulo en un paciente que consulta por un cuadro pulmonar agudo, con tos, fiebre y desgarro purulento. En este caso se administró antibiótico y se repitió el escáner a las seis semanas. Se puede observar una regresión parcial, aunque esto no asegura que el nódulo sea benigno (Fig. 3).
Una vez que se confirma el hallazgo de un nódulo, porque se ha descartado que sea artefacto, pezón o lesión extrapulmonar, se debe determinar las siguientes características (2).
En estudios de pacientes con nódulos pulmonares, el análisis multivariado ha demostrado que el riesgo de cáncer es muy alto en los fumadores, en pacientes de mayor edad y en los que tienen nódulos de mayor tamaño, mientras que los años que el paciente ha dejado de fumar constituyen un factor protector. Por lo tanto, estos elementos son los pilares de la evaluación clínica del paciente (6).
En la morfología del NPS interesa el tamaño, la forma, los márgenes y la composición del nódulo: si tiene calcificación, grasa, cavitación, broncograma o aspecto de vidrio esmerilado. Además interesa la tasa de crecimiento y la respuesta al medio de contraste. Estos cinco elementos permiten establecer el riesgo de cáncer.
Tamaño: En un estudio de la clínica Mayo efectuado en 1.500 enfermos se encontró que los nódulos de 3 cm o más tienen 90% de probabilidades de cáncer, mientras que los de menos de 4 mm tienen 1% de malignidad, por lo tanto si un paciente no es fumador y tiene un nódulo de 4 mm o menos se podría asegurar que no requiere mayor estudio (4). La primera recomendación que desarrolló la Sociedad de Radiólogos de los Estados Unidos se basó en el tamaño del nódulo y la presencia de factores de riesgo: los pacientes sin riesgo y con un nódulo menor de 4 mm no necesitan ningún tipo de estudio, no obstante la mayoría de los nódulos menores de 1 cm requieren seguimiento, cuya periodicidad depende de los factores de riesgo y se debe prolongar al menos por dos años (7). En nódulos de más de 1 cm se debe hacer estudio y seguimiento más activos (Tabla I).
Tabla I. Guía para el manejo del nódulo pulmonar solitario pequeño pesquisado en el escáner.
Forma y márgenes: Cuando un nódulo tiene contorno liso en la mayor parte de su superficie es muy probable que sea benigno, aunque hay excepciones, especialmente en las metástasis de mamas, colon, carcinoide y tumores del sistema urogenital. En la Fig. 4 se muestra un nódulo benigno en la parte superior y un nódulo metastático en la parte inferior: en el recuadro C aparece como un nódulo de contorno liso, pero posteriormente adoptó una forma lobulada (Fig. 4).
Figura 4. A, B: Nódulo pulmonar benigno. C, D: nódulo maligno, de origen metastático.
El borde espiculado de un NPS es muy sugerente de malignidad, más aún si es mayor de de 1 cm; el borde lobulado tiene riesgo intermedio y se dice que la lobulación de márgenes cóncavos se asocia a carácter benigno, mientras que la lobulación convexa se asocia a lesiones malignas. La presencia de cola es de riesgo intermedio para malignidad. En la siguiente imagen se muestran ejemplos nódulos especulado, lobulado y con cola; este último además está cavitado (Fig. 5).
Figura 5. A: nódulo pulmonar espiculado. B: lobulado. C: nódulo pulmonar con “cola”.
Cuando un nódulo posee lesiones satélites es altamente probable que se trate de una lesión granulomatosa, que en Chile lleva a pensar en tuberculosis y en otros países, en lesiones fúngicas (Fig. 6).
Figura 6. Nódulo con lesiones satélites: imagen muy sugerente de granulomas.
La siguiente imagen corresponde a un estudio con contraste en el que se observa un nódulo alimentado por un vaso arterial y drenado por un vaso venoso. Esto corresponde a una malformación arteriovenosa y no requiere más estudio (Fig.7).
Figura 7. La identificación de vasos que alimentan al nódulo sugiere MAV.
Patrón de calcificación: La calcificación total o central es muy sugerente de lesión benigna. En caso de que los nódulos sean demasiado pequeños para determinar si están o no calcificados se puede medir su densidad en unidades Hounsfield (UH) mediante el procesador del escáner; si la densidad de igual o mayor de 200 UH significa que el nódulo está calcificado y por lo tanto, es benigno (Fig. 8).
Las calcificaciones granulares con forma de pop corn son prácticamente patognomónicas de hamartoma, que es una lesión benigna. En cambio, la presencia de calcificaciones principales excéntricas o distróficas es propia de las lesiones malignas, como la que aparece en la parte inferior de la siguiente imagen, que además tiene bordes especulados y mide más de 2 cm: en este caso la biopsia reveló un adenocarcinoma (Fig. 9).
En la Fig. 10 se observa una imagen oscura de densidad similar a la de la grasa. La presencia de grasa en el interior de un nódulo también es patognomónico de un hamartoma, salvo que se trate de un liposarcoma, que rara vez se presenta en los pulmones.
Figura 10. Nódulo con densidades compatibles con grasa son muy sugerentes de hamartoma.
Cavitación: La cavitación suele estar presente en lesiones benignas, como granuloma o vasculitis, no obstante un grosor de pared de 15 mm o mayor sugiere malignidad: generalmente se trata de tumores espinocelulares que se necrosan en el centro, lo que dificulta el diagnóstico ya que los estudios de actividad metabólica no tienen buen rendimiento debido a esta necrosis (Fig. 11).
Vidrio esmerilado: Los nódulos con aspecto de vidrio esmerilado, que se caracterizan porque el observador puede ver a través de la lesión, son malignos hasta en 60% de los casos; corresponden a carcinoide o carcinomas bronquioloalveolares que son muy difíciles de diagnosticar mediante imágenes, tanto con el PET scan como con la adquisición de contraste. La figura 12 muestra una lesión con broncograma aéreo que sugiere fuertemente un carcinoma bronquioloalveolar (Fig. 12). Las hiperplasias adenomatosas también pueden dar una imagen en vidrio esmerilado.
La tasa de crecimiento de un nódulo pulmonar no es fácil de determinar debido a que son estructuras tridimensionales que tienen volumen, motivo por el cual basta que el contorno aumente en 30% para que la masa doble su tamaño; por ejemplo, si un nódulo de 4 mm crece a 5 mm su tamaño aumentará al doble, pero radiológicamente esto es muy difícil de apreciar, lo que determina una gran variabilidad entre los distintos observadores.
Se ha usado como criterio de malignidad el hecho de que el nódulo doble su masa en un periodo mayor de 30 días y menor de dos años; las lesiones que doblan su tamaño en menos de un mes suelen ser de origen infeccioso y las que tardan más de dos años también suelen ser benignas. Los cánceres bronquioloalveolares y el carcinoide típico son excepciones a esta regla, ya que son de crecimiento lento y pueden tener tasas de doblaje mayores de dos años.
Para evitar el problema de la variabilidad interobservador se utilizan programas computacionales, como el que está disponible en el Hospital Clínico de la Universidad de Chile. Este programa establece que una tasa de doblaje menor de 500 días tiene: sensibilidad de 91%; especificidad de 90%; valor predictivo positivo de 67% y valor predictivo negativo de 98%, es decir, si la tasa de doblaje no es menor de 500 días casi se puede asegurar que el paciente no tiene cáncer (8). En la siguiente imagen se observa a simple vista que el nódulo no cambio de tamaño; la medición de masa a través del área de interés entrega un valor de doblaje de 290 días, lo que sugiere que es maligno.
Figura 13. Determinación del tiempo de doblaje de un nódulo pulmonar.
Se ha demostrado que 5 a 10% de los nódulos malignos se reducen de tamaño en intervalos cortos de seguimiento; por lo tanto si una lesión de mal aspecto se reduce, pero no desaparece no significa que no sea cáncer y se debe continuar el seguimiento durante el plazo indicado de dos años (9).
El uso de medio de contraste se basa en el principio de que las lesiones neoplásicas, que poseen mayor cantidad vasos de neoformación, captan más medio de contraste. Esto es cierto siempre y cuando el nódulo benigno no corresponda a una lesión inflamatoria en fase aguda, que también tiene aumento de la vascularización, por lo que existe un traslape. Los tumores benignos inflamatorios ganan contraste, pero los malignos ya tienen ganancia; por lo tanto si un nódulo no aumenta en al menos 15 UH su intensidad en la captación de contraste, lo más probable es que no sea cáncer. Esto tiene elevada sensibilidad (98%), pero baja especificidad (58%). Si el examen sale negativo se puede afirmar que el nódulo es benigno, pues el valor predictivo negativo es 98% (Fig. 14).
Figura 14. Estudios complementarios: evaluación del nódulo con contraste.
La ganancia de medio de contraste se determina mediante observación, según protocolo, al minuto y a los dos, tres y cuatro minutos. Esto es importante, pues existen lesiones que no aparecen en la tomografía de emisión de positrones, pero sí tienen ganancia de contraste, como el tumor carcinoide, que es vascularizado (10).
En la técnica de medicina nuclear PET (Tomografía de Emisión de Positrones) se administra glucosa marcada con flúor, la cual es captada ávidamente por las células que poseen un metabolismo activo; como las células neoplásicas tienen mayor recambio celular y elevada tasa metabólica, en presencia de cáncer la señal se intensifica. Gould hizo un metaanálisis en el que demostró que este examen es útil para evaluar nódulos de 1 cm o mayores, con sensibilidad 97% y especificidad 78%, por lo que recomienda su uso en nódulos indeterminados en pacientes de alto riesgo. Como es un análisis de cuerpo entero permite encontrar tumores en otros lugares y cambiar la etapificación, de modo que es un gran aporte al manejo del paciente; esto sin olvidar que la técnica que no ha sido validada para tumores menores de 1 cm (11). Pueden dar falsos negativos los tumores carcinoide, bronquioloalveolar y adenocarcinoma de bajo grado, y falsos positivos todos los tumores con alta tasa metabólica, como los secundarios a enfermedades infecciosas o inflamatorias, la sarcoidosis y la enfermedad de Wegener. Tiene bajo rendimiento en nódulos menores de 1 cm y en nódulos con aspecto de vidrio esmerilado. En la siguiente figura se observa, en la parte superior, una imagen de PET negativo en un paciente con un adenocarcinoma que no ganó más contraste que el resto de las estructuras. Abajo se observa un PET positivo con intensa captación, que corresponde a un granuloma por tuberculosis (Fig. 15).
Figura 15. A: PET negativo, adenocarcinoma. B: PET falso positivo, granuloma tuberculoso.
Punción transtorácica del nódulo. Mientras más cerca esté el nódulo de la pared torácica y mientras más grande sea, más fácil será efectuar este procedimiento; asimismo, a mayor cercanía de la pared menor será la probabilidad de provocar un neumotórax, complicación que ocurre en 30% de los enfermos aunque en la mayoría de los casos no tiene importancia clínica, pues mejora espontáneamente. La sensibilidad de de la punción transtorácica para cáncer es 80 a 95% y la especificidad, entre 50 y 88%. Cuando se sospecha que la lesión es benigna es mejor utilizar una aguja que permita extraer un trozo de tejido, como la aguja core (Fig. 16).
Figura 16. Punción percutánea guiada por TAC.
Broncoscopía: Esta técnica es poco útil para el estudio de los nódulos periféricos, ya que tiene bajo rendimiento y sensibilidad, alrededor de 20 a 40%, porque es muy difícil llegar a una lesión de este tipo por vía bronquial, si bien el rendimiento puede llegar a 70% en lesiones con broncograma aéreo. Actualmente se está aplicando esta técnica combinada con ultrasonografía, que identifica la posición del nódulo y dirige la introducción del instrumento a través de los bronquios, lo que incrementa el rendimiento a 88%. En el futuro la broncoscopía podría llegar a ser una buena herramienta para obtener muestras histológicas de los nódulos (12).

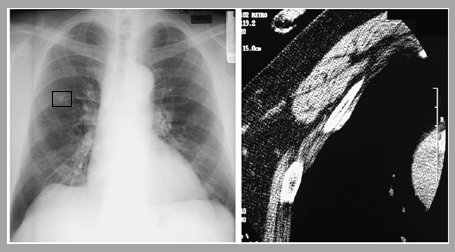 Figura 1. Nódulo pulmonar: descartar lesión extrapulmonar sobreproyectada en el campo pulmonar.
Figura 1. Nódulo pulmonar: descartar lesión extrapulmonar sobreproyectada en el campo pulmonar.

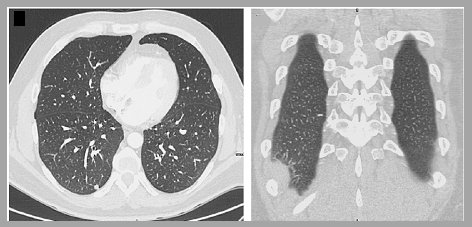 Figura 2. Relación ancho/alto >1,8:1 tiene 100% de sensibilidad para nódulo benigno.
Figura 2. Relación ancho/alto >1,8:1 tiene 100% de sensibilidad para nódulo benigno.

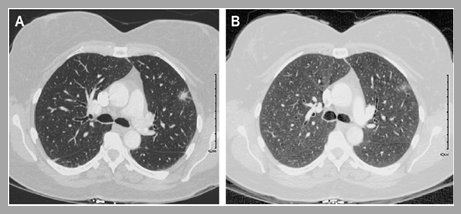 Figura 3. Cuando el hallazgo del nódulo está en el contexto de un cuadro pulmonar agudo se debe considerar tratamiento antibiótico empírico y evaluación posterior.
Figura 3. Cuando el hallazgo del nódulo está en el contexto de un cuadro pulmonar agudo se debe considerar tratamiento antibiótico empírico y evaluación posterior.

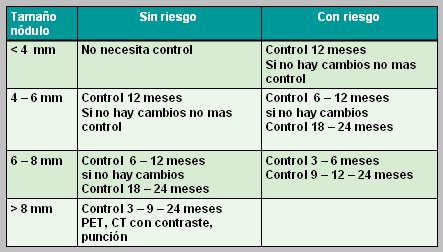 Tabla I. Guía para el manejo del nódulo pulmonar solitario pequeño pesquisado en el escáner.
Tabla I. Guía para el manejo del nódulo pulmonar solitario pequeño pesquisado en el escáner.

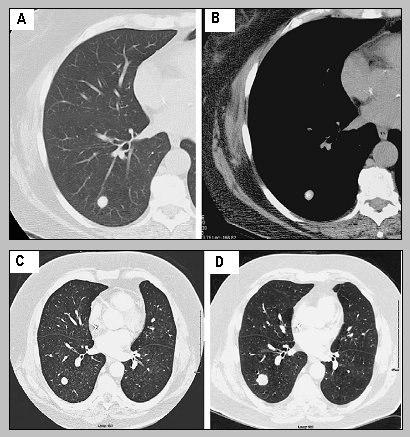 Figura 4. A, B: Nódulo pulmonar benigno. C, D: nódulo maligno, de origen metastático.
Figura 4. A, B: Nódulo pulmonar benigno. C, D: nódulo maligno, de origen metastático.

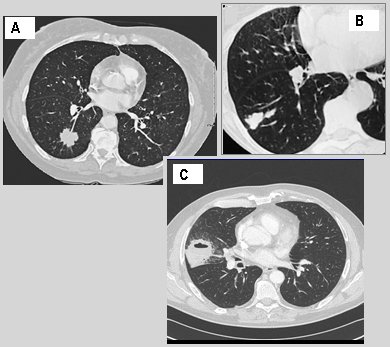 Figura 5. A: nódulo pulmonar espiculado. B: lobulado. C: nódulo pulmonar con “cola”.
Figura 5. A: nódulo pulmonar espiculado. B: lobulado. C: nódulo pulmonar con “cola”.

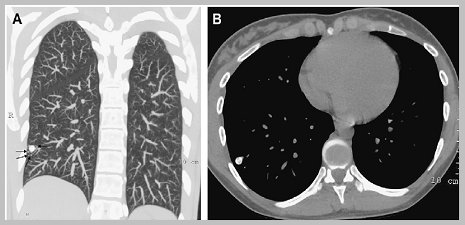 Figura 6. Nódulo con lesiones satélites: imagen muy sugerente de granulomas.
Figura 6. Nódulo con lesiones satélites: imagen muy sugerente de granulomas.

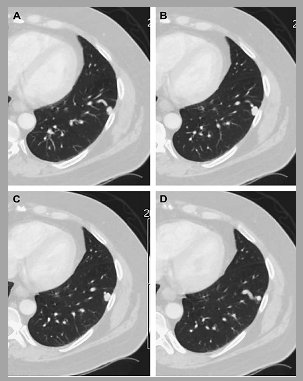 Figura 7. La identificación de vasos que alimentan al nódulo sugiere MAV.
Figura 7. La identificación de vasos que alimentan al nódulo sugiere MAV.

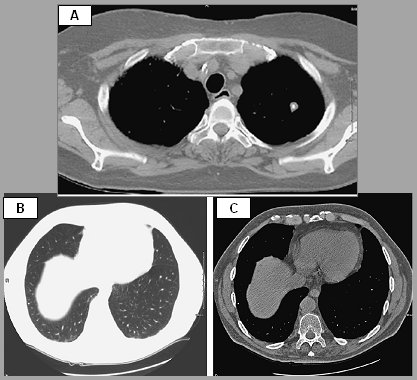 Figura 8. A: Calcificación total o central es altamente sugerente de lesión benigna. B y C: Nódulo con densidad igual o mayor de 200 UH, indica que está calcificado.
Figura 8. A: Calcificación total o central es altamente sugerente de lesión benigna. B y C: Nódulo con densidad igual o mayor de 200 UH, indica que está calcificado.

 Figura 9. A: Calcificaciones granulares (pop corn) indican hamartoma. B: Calcificaciones excéntricas o distróficas pueden enmascarar una lesión maligna.
Figura 9. A: Calcificaciones granulares (pop corn) indican hamartoma. B: Calcificaciones excéntricas o distróficas pueden enmascarar una lesión maligna.

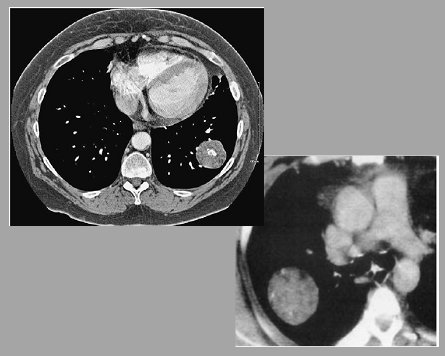 Figura 10. Nódulo con densidades compatibles con grasa son muy sugerentes de hamartoma.
Figura 10. Nódulo con densidades compatibles con grasa son muy sugerentes de hamartoma.

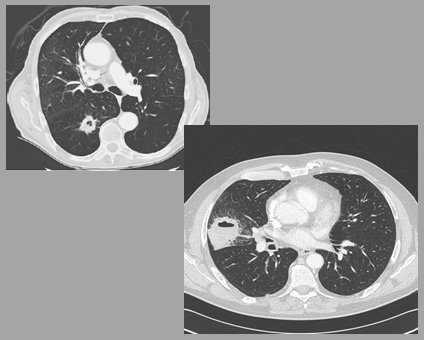 Figura 11. La cavitación puede estar presente en lesiones benignas y malignas, no obstante el grosor de la pared de 15 mm o mayor sugiere malignidad.
Figura 11. La cavitación puede estar presente en lesiones benignas y malignas, no obstante el grosor de la pared de 15 mm o mayor sugiere malignidad.

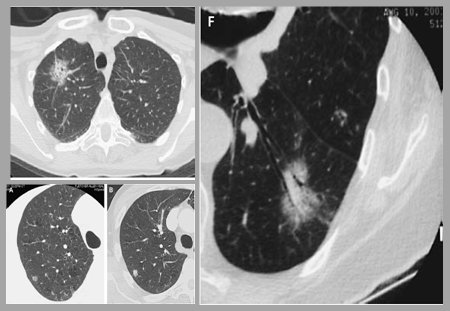 Figura 12. Los nódulos heterogéneos que contienen broncograma aéreo o vidrio esmerilado pueden ser malignos hasta en 60% de los casos.
Figura 12. Los nódulos heterogéneos que contienen broncograma aéreo o vidrio esmerilado pueden ser malignos hasta en 60% de los casos.

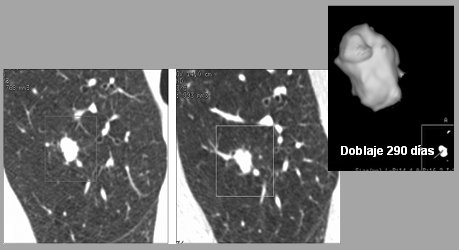 Figura 13. Determinación del tiempo de doblaje de un nódulo pulmonar.
Figura 13. Determinación del tiempo de doblaje de un nódulo pulmonar.

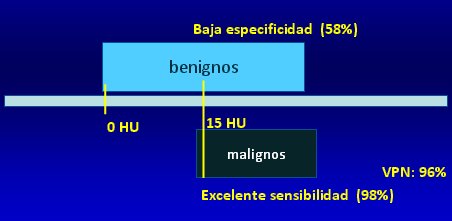 Figura 14. Estudios complementarios: evaluación del nódulo con contraste.
Figura 14. Estudios complementarios: evaluación del nódulo con contraste.

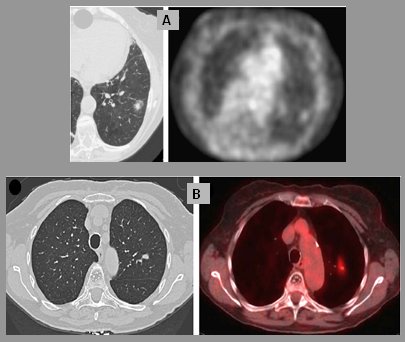 Figura 15. A: PET negativo, adenocarcinoma. B: PET falso positivo, granuloma tuberculoso.
Figura 15. A: PET negativo, adenocarcinoma. B: PET falso positivo, granuloma tuberculoso.

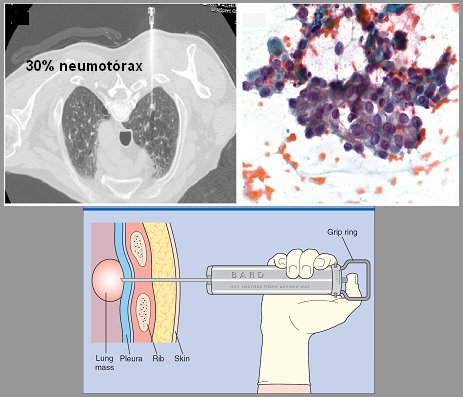 Figura 16. Punción percutánea guiada por TAC.
Figura 16. Punción percutánea guiada por TAC.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
 Autor:
Mauricio Ruiz[1]
Autor:
Mauricio Ruiz[1]

Citación: Ruiz M. Solitary pulmonary nodule. Medwave 2009 Jul;9(7):e4042 doi: 10.5867/medwave.2009.07.4042
Fecha de publicación: 1/7/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Swensen SJ, Jett JR, Hartman TE, Midthun DE, Mandrekar SJ, Hillman SL, et al. CT screening for lung cancer: five-year prospective experience. Radiology. 2005 Apr;235(1):259-65. Epub 2005 Feb 4. | CrossRef | PubMed |
Swensen SJ, Jett JR, Hartman TE, Midthun DE, Mandrekar SJ, Hillman SL, et al. CT screening for lung cancer: five-year prospective experience. Radiology. 2005 Apr;235(1):259-65. Epub 2005 Feb 4. | CrossRef | PubMed | Ost D, Fein AM, Feinsilver SH. Clinical practice. The solitary pulmonary nodule. N Engl J Med. 2003 Jun 19;348(25):2535-42. | CrossRef | PubMed |
Ost D, Fein AM, Feinsilver SH. Clinical practice. The solitary pulmonary nodule. N Engl J Med. 2003 Jun 19;348(25):2535-42. | CrossRef | PubMed | International Early Lung Cancer Action Program Investigators, Henschke CI, Yankelevitz DF, Libby DM, Pasmantier MW, Smith JP, et al. Survival of patients with stage I lung cancer detected on CT screening. N Engl J Med. 2006 Oct 26;355(17):1763-71. | CrossRef | PubMed |
International Early Lung Cancer Action Program Investigators, Henschke CI, Yankelevitz DF, Libby DM, Pasmantier MW, Smith JP, et al. Survival of patients with stage I lung cancer detected on CT screening. N Engl J Med. 2006 Oct 26;355(17):1763-71. | CrossRef | PubMed | Klein JS, Braff S. Imaging evaluation of the solitary pulmonary nodule. Clin Chest Med. 2008 Mar;29(1):15-38, v. | CrossRef | PubMed |
Klein JS, Braff S. Imaging evaluation of the solitary pulmonary nodule. Clin Chest Med. 2008 Mar;29(1):15-38, v. | CrossRef | PubMed | Takashima S, Sone S, Li F, Maruyama Y, Hasegawa M, Matsushita T, et al. Small solitary pulmonary nodules (< or =1 cm) detected at population-based CT screening for lung cancer: Reliable high-resolution CT features of benign lesions. AJR Am J Roentgenol. 2003 Apr;180(4):955-64. | PubMed |
Takashima S, Sone S, Li F, Maruyama Y, Hasegawa M, Matsushita T, et al. Small solitary pulmonary nodules (< or =1 cm) detected at population-based CT screening for lung cancer: Reliable high-resolution CT features of benign lesions. AJR Am J Roentgenol. 2003 Apr;180(4):955-64. | PubMed | Gould MK, Ananth L, Barnett PG; Veterans Affairs SNAP Cooperative Study Group. A clinical model to estimate the pretest probability of lung cancer in patients with solitary pulmonary nodules. Chest. 2007 Feb;131(2):383-8. | CrossRef | PubMed | PMC |
Gould MK, Ananth L, Barnett PG; Veterans Affairs SNAP Cooperative Study Group. A clinical model to estimate the pretest probability of lung cancer in patients with solitary pulmonary nodules. Chest. 2007 Feb;131(2):383-8. | CrossRef | PubMed | PMC | MacMahon H, Austin JH, Gamsu G, Herold CJ, Jett JR, Naidich DP, et al. Guidelines for management of small pulmonary nodules detected on CT scans: a statement from the Fleischner Society. Radiology. 2005 Nov;237(2):395-400. | CrossRef | PubMed |
MacMahon H, Austin JH, Gamsu G, Herold CJ, Jett JR, Naidich DP, et al. Guidelines for management of small pulmonary nodules detected on CT scans: a statement from the Fleischner Society. Radiology. 2005 Nov;237(2):395-400. | CrossRef | PubMed | Revel MP, Merlin A, Peyrard S, Triki R, Couchon S, Chatellier G, et al. Software volumetric evaluation of doubling times for differentiating benign versus malignant pulmonary nodules. AJR Am J Roentgenol. 2006 Jul;187(1):135-42. | CrossRef | PubMed |
Revel MP, Merlin A, Peyrard S, Triki R, Couchon S, Chatellier G, et al. Software volumetric evaluation of doubling times for differentiating benign versus malignant pulmonary nodules. AJR Am J Roentgenol. 2006 Jul;187(1):135-42. | CrossRef | PubMed | Jennings SG, Winer-Muram HT, Tann M, Ying J, Dowdeswell I. Distribution of stage I lung cancer growth rates determined with serial volumetric CT measurements. Radiology. 2006 Nov;241(2):554-63. Epub 2006 Sep 27. | CrossRef | PubMed |
Jennings SG, Winer-Muram HT, Tann M, Ying J, Dowdeswell I. Distribution of stage I lung cancer growth rates determined with serial volumetric CT measurements. Radiology. 2006 Nov;241(2):554-63. Epub 2006 Sep 27. | CrossRef | PubMed | Swensen SJ, Viggiano RW, Midthun DE, Müller NL, Sherrick A, Yamashita K, et al. Lung nodule enhancement at CT: multicenter study. Radiology. 2000 Jan;214(1):73-80. | PubMed |
Swensen SJ, Viggiano RW, Midthun DE, Müller NL, Sherrick A, Yamashita K, et al. Lung nodule enhancement at CT: multicenter study. Radiology. 2000 Jan;214(1):73-80. | PubMed |