 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
En esta conferencia se tratará los siguientes aspectos de las terapias biológicas:
El primer objetivo de las terapias blanco moleculares fue desarrollar tratamientos para la leucemia aguda promielocítica (APL), en la cual existe una translocación (15;17) que lleva a la formación de una proteína anómala denominada proteína de fusión PML/RAR alfa, que es una forma aberrante del receptor del ácido retinoico (RAR) que recluta complejos co-represores que impiden que el promielocito alcance su madurez.
El primer gran paso en el tratamiento de la APL fue la introducción del ácido trans-retinoico (ATRA), capaz de inducir la remisión completa en casi todos los pacientes con APL a través de la diferenciación de los blastos leucémicos. El Profesor Degos, del Institut Universitaire d'Hématologie, Saint Louis, demostró este efecto en células de leucemia in vitro, hallazgo que fue observado por un médico chino que estaba como becado en ese momento. Cuando este médico volvió a su país se enfrentó al problema de que en China había un gran rechazo hacia las transfusiones, que se requieren en gran cantidad en la leucemia promielocítica aguda debido a la tendencia de la enfermedad a producir coagulación intravascular diseminada; por lo tanto decidió administrar tabletas de ATRA a los pacientes y, para su sorpresa, logró la remisión completa en gran número de ellos. Lo más interesante fue que las células granulocíticas maduras continuaban presentando la marca leucémica aguda conocida como bastones de Auer, lo que demostraba que las células leucémicas habían madurado. Antes de este descubrimiento se pensaba que las células cancerosas correspondían al estado terminal de un trastorno irreversible, de modo que había que destruirlas; este resultado introdujo con fuerza un nuevo paradigma en la oncología: es posible normalizar el funcionamiento de las células cancerosas.
El segundo paso importante fue la introducción de Gleevec® (mesilato de imatinib) “la primera droga del siglo XXI”, para el tratamiento de la leucemia mieloide crónica (LMC). Este tipo de leucemia se caracteriza por una translocación 9;22 que también genera una proteína de fusión anormal. Esta proteína posee actividad tirosina quinasa y por lo tanto está incluida dentro del citoplasma, lo cual provoca que la célula reaccione como si hubiese llegado un impulso al receptor; como consecuencia, esta célula se multiplica en forma continua. El mesilato de imatinib es una molécula que interfiere con los sitios de activación de esta proteína anormal, gracias a lo cual el pronóstico de los pacientes con leucemia mieloide crónica ha mejorado notablemente disminuyendo la necesidad de trasplantes de médula ósea (1) (Fig. 1).
Figura 1. Mecanismo de acción de mesilato de imatinib.
Otro avance en la terapia oncológica, esta vez en el campo de los linfomas, fue la elaboración del anticuerpo monoclonal anti-CD20 rituximab, que se une de manera específica al antígeno CD20 y produce por diversos mecanismos, sea directos o inmunitarios, la lisis de las células CD20 positivas presentes en la gran mayoría de los linfomas. Este avance ha permitido mejorar el pronóstico de los linfomas, tanto de bajo grado como de los más agresivos.
Para extender los exitosos resultados de las terapias de las enfermedades hematológicas se comenzó por determinar las características más importantes de las células tumorales. Así se encontró que estas células poseen independencia de las señales de crecimiento o, lo que es lo mismo, son insensibles a las señales que frenan el crecimiento; además presentan angiogénesis mantenida, evasión de la apoptosis, invasión tisular y metástasis, y tendencia a la inmortalización; por lo tanto, las investigaciones sobre terapias blanco moleculares se dirigieron hacia estas características.
Una de las primeras terapias desarrolladas, y la más usada hasta ahora, actúa frenando las señales que llegan a una familia de receptores de factores de crecimiento; estos receptores poseen un dominio intracitoplasmático, un dominio membranoso y un dominio extracitoplasmático, lugar donde se unen los ligandos. Son cuatro tipos de receptores y el más interesante hasta ahora es el segundo, el HER-2/neu (Fig. 2).
Figura 2. La familia EGFR (HER/ErbB) y ligandos.
El receptor HER-2/neu no posee ligandos sino que actúa como comodín de los otros, pues para que se produzca la estimulación debe llegar un ligando que une a dos receptores a través de la parte extracitoplasmática; al hacer eso la parte intracitoplasmática de los receptores se contacta y de esa manera se activa la tirosina quinasa provocando la señal de fosforilación que se dirigirá hacia un factor de transcripción en el núcleo, dando una señal de crecimiento, una señal de muerte, etc. Existen dos maneras de atacar a estos factores de crecimiento: la primera es a través de anticuerpos monoclonales como rituximab, trastuzumab o cetuximab, que se unen a la parte extracitoplasmática; la segunda manera es usar moléculas pequeñas capaces de introducirse dentro de la célula y bloquear en forma específica el sitio de activación de la tirosina quinasa, tales como lapatinib, gefitinib y erlotinib (Fig. 3).
Figura 3. Estrategias para inhibir los receptores TK.
El mayor éxito se ha obtenido en el cáncer de mama. Alrededor de 20% de las pacientes con cáncer de mama sobreexpresan el gen HER-2/neu, hecho que determina un pronóstico más sombrío (2). En la siguiente figura, en el recuadro A se observa el esquema de una célula con un receptor HER-2, que no posee ligando y por lo tanto necesita unirse a otro receptor para enviar la señal al núcleo. Lo que sucede en las pacientes que tienen sobreexpresión del gen HER-2/neu es que existen tantos receptores que no necesitan que llegue un ligando, pues basta que entren en contacto para provocar una activación permanente de la célula (B). El anticuerpo monoclonal trastuzumab (Herceptin ®) se une a estos receptores y permite que la célula los internalice y destruya al interior del citoplasma (C) (Fig. 4).
Figura 4. Mecanismo de acción del anticuerpo monoclonal trastuzumab.
En un estudio en que se probó la eficacia del trastuzumab agregado a la quimioterapia en enfermas con cáncer metastásico que ya habían sido tratadas los resultados fueron mucho mejores que con quimioterapia sola, lo que sugiere que este medicamento es de gran utilidad en la adyuvancia del tratamiento quirúrgico del cáncer de mama, ya que permite aumentar los porcentajes de curación. En otros tres estudios, dos estadounidenses y uno europeo, con un número entre 3000 y 6000 pacientes, la administración de Herceptin® redujo las recaídas de cáncer de mama en 50%, la mayor cifra que jamás haya logrado droga alguna. Cuesta mucho demostrar el impacto de una terapia adyuvante en la sobrevida, ya que las enfermas de cáncer de mama que recaen no fallecen de inmediato, pero en esos tres trabajos se demostró claramente el aumento de la sobrevida a los dos años. En la actualidad se considera que toda paciente con cáncer de mama con sobreexpresión del HER2 debe recibir Herceptin® en forma obligatoria.
Uno de los mecanismos de resistencia a Herceptin® es la pérdida de la parte extracitoplasmática del receptor, de modo que el anticuerpo no tiene dónde unirse. Para subsanar este problema se desarrolló la nueva molécula lapatinib, de pequeño tamaño, que además de inhibir al receptor de HER-2/neu inhibe al receptor HER-1 o receptor del factor de crecimiento epidérmico (EGF), lo que produce un doble bloqueo. En un estudio efectuado en pacientes metastásicas resistentes a Herceptin® se demostró que la asociación de lapatinib a la quimioterapia mejora significativamente el resultado en cuanto a tiempo de progresión del tumor. El paso siguiente es llevar al lapatinib a la adyuvancia comparándolo con Herceptin® para comprobar cuál de los dos es mejor en este aspecto.
El receptor del EGF está mucho más extendido que el HER-2/neu y se puede encontrar en gran número de tumores. Por ello se sintetizó un anticuerpo conocido como cetuximab (Erbitux®) para hacer lo mismo que con Herceptin®; sin embargo, aunque hubo resultados positivos, desde el punto de vista clínico éstos no fueron espectaculares. En un estudio en que se evaluó el uso de este anticuerpo en pacientes con cáncer de colon, como segunda línea pues los pacientes ya eran resistentes a irinotecan, se comparó el uso de cetuximab solo con la administración conjunta con irinotecan, resultando mejor la combinación, lo que se podría deber a que cetuximab mejora la posibilidad de apoptosis. En otro estudio en que se utilizó cetuximab como primera línea, si bien hubo una diferencia estadística, la diferencia en cuanto a resultados clínicos fue escasa. En tumores de cabeza y cuello los resultados fueron mejores y la toxicidad menor con la combinación de radioterapia y cetuximab que con la terapia estándar. Finalmente, en cáncer pulmonar de células no pequeñas la diferencia fue pequeña, o sea, los resultados con este anticuerpo no fueron tan brillantes como los obtenidos con Herceptin®.
Otra forma de actuar contra el receptor del EGF es mediante moléculas pequeñas, de las cuales la única que ha demostrado tener una ventaja es el erlotinib (Tarceva®), que ha logrado mejores resultados que placebo. En un estudio realizado en pacientes con cáncer pulmonar de células no pequeñas que llevaban dos o tres líneas de tratamiento se encontró mejor respuesta con este fármaco que con placebo, con una mediana de dos meses más y una sobrevida al año 10% mayor. Investigaciones posteriores demostraron que muchos de estos enfermos poseen mutaciones en el dominio de la tirosina quinasa para el receptor y que ellos responden mucho mejor, es decir, la respuesta a los TKI es mayor cuando hay mutaciones del EGFR. Desde la perspectiva clínica, se ha visto que los pacientes que responden mejor a este medicamento son: las mujeres, los portadores de adenocarcinomas, los pacientes que nunca han fumado y aquellos de ascendencia asiática.
Herceptin® actúa mejor por varias razones. Primero, el receptor HER-2/neu juega el papel de comodín, uniéndose a los monómeros de los otros receptores para formar un dímero que activa la tirosina quinasa intracitoplasmática; cuando entra en juego HER-2/neu la potencia del dímero es mucho mayor y por esta razón es tan importante bloquearlo. La otra razón es que mientras los otros dímeros, homodímeros, se asocian y disocian rápidamente produciendo una señal débil, al formarse un heterodímero con el receptor HER-2 éste se mantiene asociado y produce una señal mantenida para realizar la multiplicación. Esa es la razón por la cual es mucho más eficaz bloquear el receptor HER-2 que el receptor HER-1. En la siguiente figura, en el recuadro A se aprecia la vía de transmisión de señales de las quinasas mitogénicamente activadas, que se activa por acción del ligando que llega al receptor del EGF, desde donde se produce la estimulación hasta el núcleo. En B, cuando se coloca el anticuerpo, en este caso cetuximab, se bloquea la señal. En el recuadro C, posterior a esto se descubrió que cuando se encuentra mutado el gen K-Ras la señal se desvía por otro lado y por esta razón no actúa (3) (Fig. 5).
Figura 5. Receptor del factor de crecimiento epidérmico (EGFR) y KRAS.
En el estudio Crystal (Erbitux® (cetuximab) más FOLFIRI, una quimioterapia basada en irinotecan, en pacientes con cáncer colorrectal metastásico no tratado previamente), se hizo una reevaluación del estudio con cetuximab en primera línea en el cáncer de colon y se encontró diferencia entre los pacientes que poseen el gen mutado, mientras que no hubo diferencia en aquellos pacientes con el gen nativo. Por lo tanto, no basta con bloquear algo, sino que también se debe estudiar la vía de información con el núcleo para que estos tratamientos sean más eficaces.
En resumen:
Antes se pensaba que las células cancerosas se hacían dependientes de una sola vía, pero hoy se sabe que esto no es así; a nivel de los nematodos las vías eran separadas y lineales, de modo que hubiera bastado con bloquear una, pero a medida que transcurrió la evolución las células fueron entendiendo que no podían depender de una sola vía y construyeron una compleja red de interacción; por ende, si se bloquea una vía se puede escapar por otra. La Fig. 6 ilustra el estado evolutivo de estas redes.
Actualmente se está trabajando en dos soluciones para este problema: agregar un segundo bloqueo “aguas abajo” de la señal, o bloquear en forma simultánea dos vías. Ya están disponibles medicamentos para efectuar el bloqueo “aguas abajo”: el bloqueador de mTOR conocido con el nombre de temsirolimus ha demostrado ser útil en los pacientes con cáncer renal que poseen riesgo elevado en la clasificación TNM.
La otra vía que se puede bloquear en forma simultánea es la vía del receptor del factor de crecimiento insulinosimil, IGF1R, bloqueo con el que se ha logrado resultados en algunos sarcomas.
En condiciones de hipoxia, la célula tumoral envía señales para que se formen nuevos capilares, los cuales son inducidos especialmente por el factor de crecimiento del endotelio vascular (VEGF). Cuando el tumor no posee vasos su crecimiento es muy lento y no representa peligro, pues no puede metastizar; cuando se forman vasos el tumor adquiere agresividad, porque crece mejor nutrido y puede metastizar desde ahí. Los nuevos vasos formados son anormales, por lo tanto dejan salir líquido intravascular hacia el intersticio y de esa manera aumenta la hipoxia y la secreción de VEGF y, lo que es más grave, aumenta la presión hidrostática, lo que impide el acceso de las drogas al sitio del tumor. Para enfrentar este problema se fabricó un anticuerpo monoclonal conocido como bevacizumab (Avastin ®), que retira de circulación el VEGF y que, al menos a nivel experimental, permite la normalización de la red capilar. La experiencia clínica disponible sugiere que el uso de bevacizumab es muy útil en cáncer de colon en pacientes que ya han recibido otros tratamientos, cáncer de mama, cáncer pulmonar y cáncer renal (4), de modo que en este momento se está trasladando el bevacizumab, tal como se hizo con Herceptin, para terapia adyuvante.
Además de este anticuerpo contra VEGF se dispone de moléculas pequeñas que bloquean la tirosina quinasa de los receptores. En la siguiente imagen se muestra un ejemplo en el cual se bloquea el receptor de VEGF y también el del factor de crecimiento derivado de plaquetas (PDGF), con lo que se logra un bloqueo más completo de la formación de vasos sanguíneos y linfáticos. El medicamento empleado, sunitinib, tuvo un efecto superior a las terapias que en ese momento eran el tratamiento estándar en el cáncer renal metastásico (Fig. 7).
Figura 7. Mecanismo de acción de sunitinib en cáncer colorectal.
A medida que el cáncer se desarrolla aparecen otros factores de crecimiento pro angiogénicos, aparte del VEGF, así que es probable que el manejo antiangiogénico tenga que considerar el uso de terapias de amplio espectro.
Las células poseen dos vías a través de las cuales reciben la orden de muerte: la vía extrínseca, a través de un ligando y la la vía intrínseca, que se activa frente a un estrés importante o por el retiro de los factores de crecimiento. En ésta es muy importante la mitocondria, que liberará citocromo C y otras sustancias importantes en la activación de las caspasas, que iniciarán la apoptosis (Fig. 8).
Figura 8. Dos vías de señales para la apoptosis.
Muchos tumores tienen muy activado el retiro de las proteínas proapoptóticas por el sistema de degradación ubiquitina-proteaosoma. En patologías como mieloma múltiple, el uso de bloqueadores del proteasoma ha logrado buenos resultados como tratamiento de primera línea. También se puede utilizar agonistas de los receptores proapoptóticos (PARAs) para estimular en forma artificial la vía extrínseca. Existe un gran bloqueador de la apoptosis, el Bcl-2, cuyo bloqueo mediante inhibidores permite que se pueda llevar a cabo la apoptosis, favoreciendo el efecto de la quimioterapia y la radioterapia, que consiste justamente en producir la apoptosis.
Se ha demostrado que existe un cambio en los genes activados entre el tumor primario y el tumor que se desarrolla en la metástasis, lo que sugiere que ciertos genes favorecen la metástasis. Lo interesante es que estos genes pueden ser inhibidos de manera farmacológica.
Se ha trabajado mucho sobre la posibilidad de bloquear el ciclo celular que se encuentra hiperactivado en el cáncer; los primeros resultados promisorios se han obtenido con los inhibidores de las quinasas aurora, una familia de quinasas de serina-tronina necesarias para la condensación de la cromatina durante la mitosis, cuya sobreexpresión produce transformación celular, se encuentran sobreexpresadas en cáncer de mama y pulmón y su bloqueo podría producir buenos resultados.
Otra posibilidad terapéutica es actuar sobre la metilación del ADN. Se sabe que una célula normal posee metilaciones, pero éstas no ocurren en forma habitual en el islote CpG, que es el promotor del gen, mientras que las células cancerosas, al revés de las normales, tienen hipermetilación del islote CpG e hipometilación de otros genes, lo que los inactiva. En la actualidad se dispone de drogas desmetilantes que se están utilizando en las mielodisplasias.
Para derrotar al cáncer es necesario comprobar, con la mayor certeza posible, la hipótesis de que es posible transformar las células cancerosas en células normales. Sin embargo, encontrar la verdad no es fácil y ésa es la inquietud que ha perseguido al hombre a través de su historia.
En el siglo VI antes de Cristo, Anaximandro dice: “Los dioses no revelan desde el inicio todas las cosas a los hombres, pero en el transcurso del tiempo, buscando, podemos aprender y conocer mejor las cosas.” Sin embargo, añade: “pero con respecto a ciertas verdades, ningún hombre las ha conocido, nunca las conocerá, ni siquiera por medio de los dioses” “…ni siquiera todas las cosas sobre las cuales hablo, ni aunque se les revelaran por azar…La perfecta verdad no podrá conocerla, porque todo no es más que una red tejida de conjeturas”.
En el siglo XVIII, Inmanuel Kant escribe en su obra Crítica a la razón pura (1787): “La mente no es un simple recipiente de las sensaciones producidas por las cosas que nos rodean, sino que actúa también en forma activa al entender esas sensaciones en términos de ciertas categorías y principios que él mismo lleva a participar en su experiencia.” Y añade que “el hombre ordena el mundo para comprenderlo”. De ese modo, nuestra visión del mundo no nos asegura que sea la del mundo real.
Bertrand Russel, en La perspectiva científica, dice que: “El hombre corriente piensa que la materia es sólida, pero el físico piensa que es una onda de probabilidad que ondula en la nada. Dicho brevemente, la materia en un lugar determinado, es definida como la probabilidad de ver en ese lugar un fantasma.” Es por eso que la ciencia avanza sobre la base de conjeturas y refutaciones, o sea, la formulación de hipótesis y su comprobación.
Karl Popper, en Conjectures and refutations (1963), afirma que “La verdad existe, pero para el hombre es imposible tener la certeza de que la ha alcanzado; el progreso del conocimiento se produce por el planteamiento de hipótesis y sus refutaciones; no podemos demostrar la verdad de una hipótesis, pero sí su falsedad (experimento crucial.)” En otras palabras, la verdad es aquella hipótesis que se somete a las mayores pruebas posibles y sigue permaneciendo en pie. “El progreso es un continuo a base de la prueba de las hipótesis.”
Thomas Kuhn, en The Structure of Scientific Revolution (1962), habla del falsacionismo ingenuo de Popper, porque a los científicos les cuesta mucho cambiar los conceptos establecidos. Según él ése es el gran problema de los libros de texto, que muestran al progreso científico como un continuo, lo cual es falso. Según las propias palabras de Kuhn, “los científicos no abandonan sus teorías por refutaciones, sino que buscan la forma de explicar las anomalías (falsacionismo ingenuo). Sólo cuando se acumulan las anomalías no explicables y cuando existe una teoría alternativa que las explica mejor, se cambia la teoría dominante. El progreso se realiza por saltos, revoluciones, en los cuales un paradigma es reemplazado por otro.” El paradigma oncológico moderno establece que es posible transformar las células cancerosas en células normales, pero quizás en unos años más se demuestre que esto no es verdad y que existe otra explicación para las observaciones en las cuales se basa la afirmación.
Las células normales funcionan todas en forma similar, mientras que las células cancerosas poseen distintos funcionamientos, de modo que en un mismo tumor existen células con distintas formas de actuar. Este hecho trae a la mente lo que sucede en las familias según León Tolstoy, que en su obra Ana Karenina escribe: “todas las familias dichosas son semejantes… y cada familia infeliz lo es a su propia manera.”
En la actualidad, en oncología se aplican terapias no seleccionadas. En el futuro se deberá considerar que los tumores son heterogéneos, que existen distintas familias de células y que se deberá hacer una estratificación de los pacientes sobre la base del estudio de las características de las vías alteradas en las células cancerosas y de la farmacogenética de cada paciente, lo que permitirá diseñar un tratamiento a la medida.

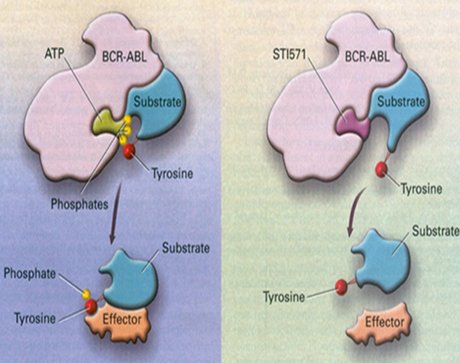 Figura 1. Mecanismo de acción de mesilato de imatinib.
Figura 1. Mecanismo de acción de mesilato de imatinib.

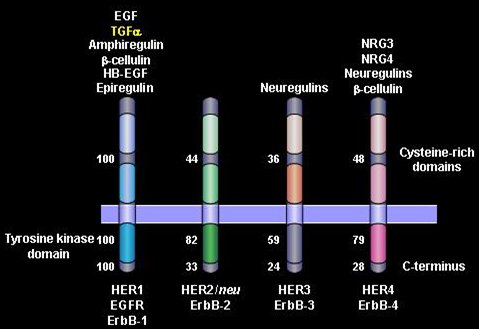 Figura 2. La familia EGFR (HER/ErbB) y ligandos.
Figura 2. La familia EGFR (HER/ErbB) y ligandos.

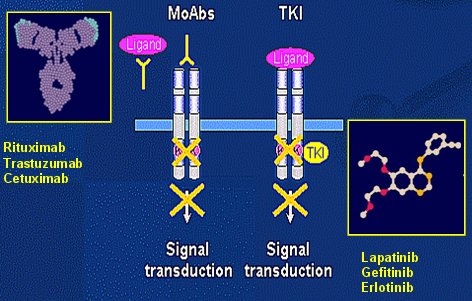 Figura 3. Estrategias para inhibir los receptores TK.
Figura 3. Estrategias para inhibir los receptores TK.

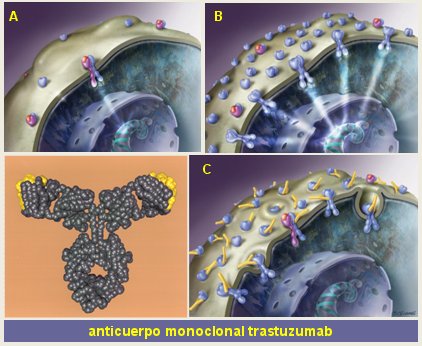 Figura 4. Mecanismo de acción del anticuerpo monoclonal trastuzumab.
Figura 4. Mecanismo de acción del anticuerpo monoclonal trastuzumab.

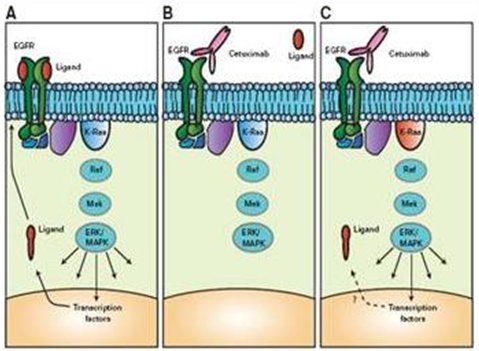 Figura 5. Receptor del factor de crecimiento epidérmico (EGFR) y KRAS.
Figura 5. Receptor del factor de crecimiento epidérmico (EGFR) y KRAS.

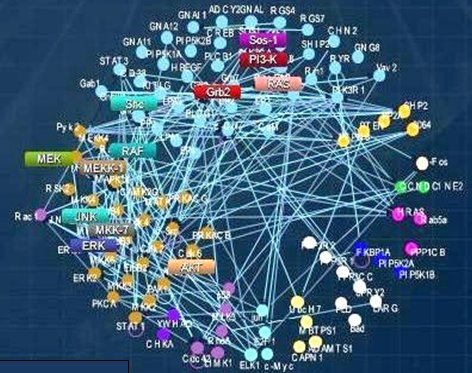 Figura 6. Redes de señales.
Figura 6. Redes de señales.

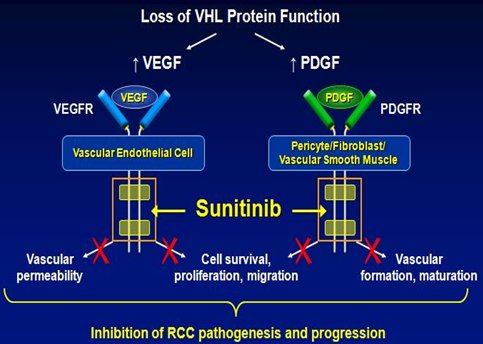 Figura 7. Mecanismo de acción de sunitinib en cáncer colorectal.
Figura 7. Mecanismo de acción de sunitinib en cáncer colorectal.

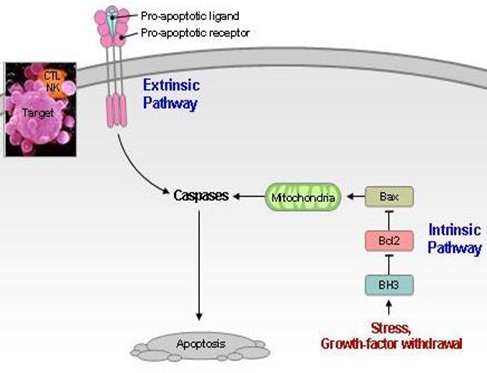 Figura 8. Dos vías de señales para la apoptosis.
Figura 8. Dos vías de señales para la apoptosis.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
 Autor:
Jorge Gutiérrez[1]
Autor:
Jorge Gutiérrez[1]

Citación: Gutiérrez J. Biological therapies in cancer: a new era in oncology. Medwave 2009 May;9(5):e3919 doi: 10.5867/medwave.2009.05.3919
Fecha de publicación: 1/5/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Goldman JM, Melo JV. Targeting the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med. 2001 Apr 5;344(14):1084-6. | CrossRef | PubMed |
Goldman JM, Melo JV. Targeting the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med. 2001 Apr 5;344(14):1084-6. | CrossRef | PubMed | Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987 Jan 9;235(4785):177-82. | CrossRef | PubMed |
Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987 Jan 9;235(4785):177-82. | CrossRef | PubMed |