 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
La importancia del cáncer se mama es bien conocida: se sabe que es el cáncer más prevalente en la mujer y que su pronóstico depende estrechamente de la etapa en que se pesquise: la sobrevida a 8 años es de 90%, 70%, 40% y 10% según el cáncer se encuentre en estadio I, II, III ó IV respectivamente. El IV corresponde al cáncer de mama ramificado, prácticamente incurable.
En Chile no se dispone de estudios de incidencia y prevalencia, pero sí se cuenta con tasas de mortalidad. En la siguiente figura se puede observar que el cáncer de mama es la segunda o tercera causa de muerte por cáncer en las mujeres en Chile, después del cáncer de vesícula y vía biliar, aunque estas cifras no reflejan la incidencia del cáncer de mama (Fig. 1).
Figura 1. Tasa de mortalidad por cáncer en mujeres, Chile.
En los Estados Unidos el cáncer de mama es la primera causa de cáncer en mujeres, pero no es la primera causa de muerte e incluso la curva de mortalidad ha ido en descenso en las últimas décadas (1), como se aprecia en la Fig. 2.
Figura 2. Tasas de mortalidad por cáncer anuales, ajustadas por edad, Estados Unidos 1930 a 2003.
Existen dos genes BRCA-1, ubicado en el cromosoma 17 y BRCA-2, ubicado en el cromosoma 13. La mutación genética del gen BRCA - 1 se asocia a 85% de riesgo de desarrollar cáncer de mama y 45% de desarrollar cáncer de ovario; la mutación del BRCA - 2 implica 60% de riesgo de desarrollar cáncer de mama. En los Estados Unidos, cuando se detecta esta alteración genética en las mujeres se realiza mastectomía profiláctica.
Se dice que la práctica de ejercicio aeróbico tres veces por semana durante 40 minutos disminuiría el riesgo de cáncer de mama; la dieta no tendría mayor impacto, como se mencionó previamente; el tabaco tiene un rol claro en la incidencia de cáncer de mama; el efecto del alcohol no está muy claro; y con respecto a la lactancia se dice que el alimentar con leche a los bebés por más de seis meses podría ser un factor protector, pero tampoco está muy claro. En cuanto a la quimioprevención, en un gran estudio desarrollado por un grupo estadounidense y publicado en 1998, en el cual se siguió durante siete años a 13.000 mujeres que recibieron tamoxifeno o placebo, se encontró que el fármaco redujo el riesgo de desarrollar cáncer de mama en más de 50%. Además la hormonoterapia con tamoxifeno protege contra la osteoporosis, pero aumenta la incidencia de cáncer de endometrio y de accidentes cerebrovasculares, por esto se debe sopesar los beneficios y los riesgos. Para ello se aplica la escala Gail score, que predice el riesgo de desarrollar cáncer de mama según distintos factores como edad, biopsias previas e historia familiar, entre otros; si el score de Gail es de 1,76%, la mujer debería recibir tamoxifeno.
Los métodos disponibles para efectuar el screening de cáncer de mama son:
El autoexamen mamario es la medida básica de tamizaje (screening), pero cuando una mujer detecta un nódulo en la mama ya es demasiado tarde: por lo tanto, el gold standard es la mamografía. Ésta se puede hacer con distintas técnicas, desde la tradicional hasta la mamografía digital, que permite detectar un elevado porcentaje de casos de cáncer de mama, aunque no 100%; por ello, en mujeres jóvenes , con mamas más densas o en aquellas mujeres que son portadoras de una mutación y tienen mayor riesgo de desarrollar cáncer de mama, se debe complementar el estudio con otros métodos, como la ecografía o la RNM, que es un excelente examen pero todavía no está estandarizado como método de screening por su elevado costo.
El informe de una mamografía siempre contempla la clasificación BI-RAD (Breast Imaging Reporting and Database System) que va desde 0 a 6, en el cual 0 corresponde a una lesión sospechosa que necesita mayor evaluación y 6 es una lesión maligna comprobada por biopsia. Lo importante es que si el informe de la mamografía indica BI-RAD 4 ó 5, la paciente debe ir a biopsia (Tabla I).
Tabla I. Clasificación BI-RAD de las lesiones mamográficas.
La RNM se indica en los siguientes casos:
El cáncer de mama se encuentra en el plan AUGE, el cual contiene las normas para realizar RNM cuando corresponde.
En la Fig. 3 se observan dos lesiones: a izquierda una con bordes irregulares en la cual la mamografía se informó como BI-RAD 4 y la biopsia confirmó un carcinoma tubular. La imagen de la derecha, de bordes nítidos, se informó como BI-RAD 2 y la biopsia confirmó un fibroadenolipoma.
Figura 3. A izquierda, carcinoma tubular. A derecha, fibroadenolipoma (descripción en el texto).
En la siguiente imagen se observa una lesión espiculada de bordes irregulares que se informó como BI-RAD 4; en la biopsia se informó que correspondía a un carcinoma lobulillar invasor de la mama (Fig. 4).
Figura 4. Lesión BI-RAD 4 que corresponde a un carcinoma invasivo lobular.
La ecografía es un examen complementario a la mamografía que se debería solicitar siempre, pues lo que no se ve en la mamografía se puede ver en la ecografía, o viceversa. La siguiente imagen muestra un nódulo que posee sombra posterior y tiene un diámetro anteroposterior menor que el diámetro longitudinal, lo cual es típico de una lesión maligna de la mama. También fue informada como BI-RAD 4. Se confirmó un carcinoma invasivo ductal (Fig. 5).
Figura 5. Lesión BI-RAD 4 correspondiente a carcinoma invasivo ductal (descripción en el texto).
La siguiente imagen es una RNM efectuada en una mujer de 46 años de edad con adenopatía axilar positiva. El examen mamario, la mamografía y la ecografía fueron normales. La RNM muestra claramente una lesión de 7 mm compatible con cáncer (Fig. 6).
Figura 6. RNM con lesión de 7 mm sugerente de cáncer (descripción en el texto).
En la siguiente imagen una mamografía con imágenes calcificadas lineales en forma de “punto y guión”, que son muy sugerentes de una lesión maligna (comedocarcinoma), la cual fue informada como un BI-RAD 5 que en forma posterior la biopsia confirmó que correspondía una lesión benigna (Fig. 7).
En la siguiente imagen, a la izquierda se observa una masa densa de bordes parcialmente nítidos, BI-RAD 4; la biopsia demostró fibroadenoma. El cuadro derecho muestra una pequeña masa espiculada informada como lesión BI-RAD 5 que se catalogó como lesión benigna, pero resultó ser un carcinoma ductal invasor (Fig. 8).
Frente a un examen alterado y una biopsia se debe proceder a determinar el estadio de la lesión, tanto clínico, que se basa en la palpación de la mama y la axila, como patológico, que es el más importante. El estadio patológico depende de:
Los pilares del tratamiento de los tumores sólidos de la mama son:
La cirugía ha cambiado en gran medida desde la época de las grandes cirugías mutiladoras, en que se realizaban mastectomías radicales y resecciones axilares en los niveles I, II y III, no existían las reconstrucciones inmediatas y se producían muchos efectos adversos, como linfedema y dolor en los brazos. En un gran estudio realizado hace mucho tiempo se demostró que la mastectomía parcial más radioterapia tenía los mismos resultados que la mastectomía total. En la actualidad se cuenta con la técnica del ganglio centinela, que evita en muchos casos la disección axilar y cuando se realiza una mastectomía radical se ofrece a la mujer la reconstrucción inmediata, que se puede efectuar mediante implante autólogo o exógeno, de preferencia el primero, a partir del recto abdominal anterior que se traslada hacia la mama con celular subcutáneo y paquete vascular y se recubre con piel y grasa. También se puede utilizar un colgajo músculo-cutáneo de dorsal ancho, pero deja una cicatriz poco estética. Es preferible no utilizar prótesis, porque éstas no tienen buen resultado estético en una mama en que no existe glándula; además es complicado lograr la distensión de la piel y finalmente, la mama implantada no envejece al mismo ritmo que la otra.
La técnica del ganglio centinela, previa a cualquier procedimiento quirúrgico, consiste en inyectar un colorante azul dentro de la masa tumoral y determinar cuál es el primer ganglio linfático que se tiñe, que sería el ganglio centinela (Fig. 9).
Figura 9. Técnica del ganglio centinela.
Esta técnica se debe complementar con técnicas de medicina nuclear para marcar exactamente el ganglio centinela y posteriormente enviar a la paciente a cirugía (Fig. 10).
Figura 10. Determinación del ganglio centinela por medicina nuclear.
En la intervención se encuentra el ganglio centinela, que se ve de color azul, se reseca y se analiza de inmediato con biopsia rápida y más tarde con biopsia definitiva. Si el ganglio centinela está comprometido se debe practicar una disección axilar, de modo que se puede requerir una cirugía en dos tiempos (Fig. 11).
Figura 11. Visualización del ganglio centinela en la cirugía mamaria.
Las indicaciones generales de radioterapia son: posterior a mastectomías parciales, mastectomías totales con tumores mayores de 5 cm o axila positiva. Está demostrado que siempre se debe aplicar radioterapia, como se observa en los resultados de un metaanálisis (Fig. 12).
Figura 12. Metaanálisis sobre el beneficio de la radioterapia en el cáncer de mama.
En un estudio en que la mitad de las pacientes recibió quimioterapia y la otra mitad radioterapia, se observó que no importa con cuál técnica se comienza; sin embargo, después de la radioterapia la zona de la mama se enrojece y se puede presentar neutropenia, de modo que es preferible comenzar con la quimioterapia.
La quimioterapia para el cáncer de mama ha evolucionado mucho desde la década de los ochenta, en que el esquema CMF (ciclofosfamida, metotrexato y fluorouracilo) fue una novedad: en la década de los noventa se comenzó a utilizar antraciclinas; en el año 2000 se agregaron los taxanos; en 2005, las terapias moleculares y desde 2007 está disponible una nueva familia de drogas, las epotilonas. Existen múltiples esquemas de quimioterapia, con distintas combinaciones de fármacos; la elección dependerá de muchos factores, como número de ganglios linfáticos, edad de la paciente, presencia o ausencia de receptores. La quimioterapia mejora la sobrevida de las pacientes con cáncer de mama, mejora el período libre de enfermedad y retrasa la aparición de metástasis, lo cual es muy positivo para las pacientes.
El advenimiento de las terapias moleculares permitirá realizar tratamientos más prolongados, como por ejemplo, hormonoterapia con tamoxifeno o con inhibidores de la aromatasa de tercera generación, de los cuales existen en el mercado anastrazol, letrozol y exemestane. Se ha demostrado que el uso de tamoxifeno durante cinco años es beneficioso, pero están realizando estudios para probar el efecto de la administración secuencial de este fármaco e inhibidores de la aromatasa durante cinco años (Fig. 13).
En la siguiente imagen se muestra los resultados de estos estudios: aparentemente la terapia mejora la sobrevida libre de enfermedad, pero no hay evidencia de que mejore la sobrevida global (Tabla II).
Tabla II. Estudios fase III: resultados (DFS = sobrevida libre de enfermedad. NR= no reportado).
En 2005 se produjo una revolución en la Oncología médica con la publicación de estudios sobre transtuzumab, una molécula que se une al receptor de transmembrana que se expresa en los cánceres de mama, el CERB-2. El análisis de los resultados demostró que la administración de transtuzumab aumenta en 52% la sobrevida libre de enfermedad y en 53% la sobrevida libre de metástasis; actualmente se están analizando los efectos sobre la sobrevida global. En los estudios B-31 y N983, la administración de transtuzumab mejoró significativamente la sobrevida. Estos estudios cambiaron la historia del manejo de los tumores sólidos, sobre todo del cáncer de mama (2, 3).

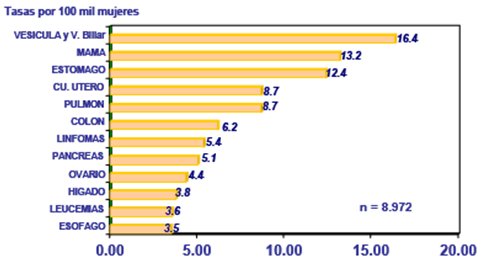 Figura 1. Tasa de mortalidad por cáncer en mujeres, Chile.
Figura 1. Tasa de mortalidad por cáncer en mujeres, Chile.

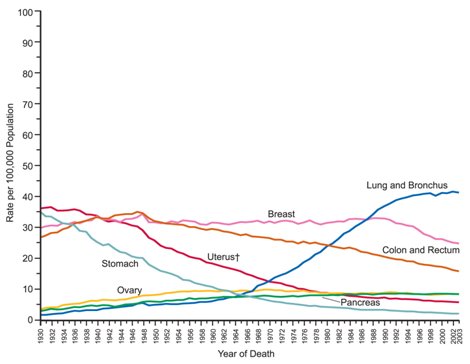 Figura 2. Tasas de mortalidad por cáncer anuales, ajustadas por edad, Estados Unidos 1930 a 2003.
Figura 2. Tasas de mortalidad por cáncer anuales, ajustadas por edad, Estados Unidos 1930 a 2003.

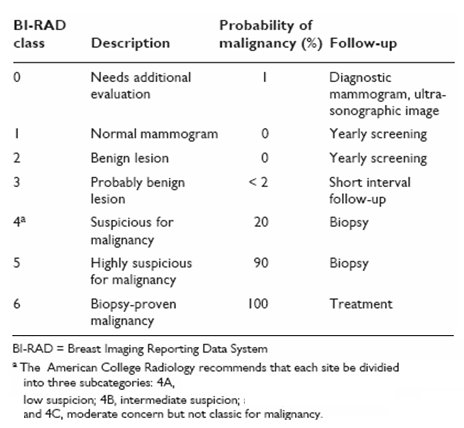 Tabla I. Clasificación BI-RAD de las lesiones mamográficas.
Tabla I. Clasificación BI-RAD de las lesiones mamográficas.

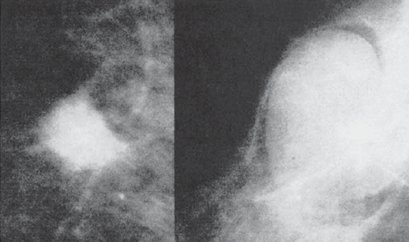 Figura 3. A izquierda, carcinoma tubular. A derecha, fibroadenolipoma (descripción en el texto).
Figura 3. A izquierda, carcinoma tubular. A derecha, fibroadenolipoma (descripción en el texto).

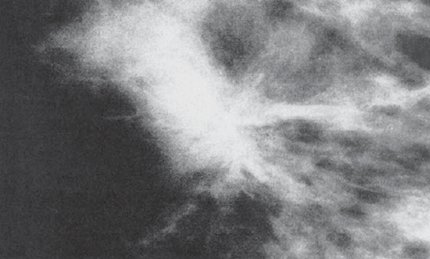 Figura 4. Lesión BI-RAD 4 que corresponde a un carcinoma invasivo lobular.
Figura 4. Lesión BI-RAD 4 que corresponde a un carcinoma invasivo lobular.

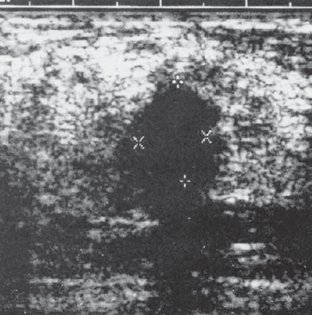 Figura 5. Lesión BI-RAD 4 correspondiente a carcinoma invasivo ductal (descripción en el texto).
Figura 5. Lesión BI-RAD 4 correspondiente a carcinoma invasivo ductal (descripción en el texto).

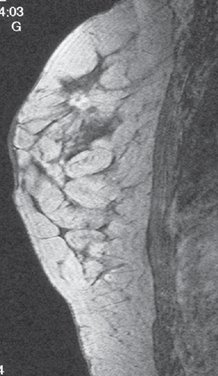 Figura 6. RNM con lesión de 7 mm sugerente de cáncer (descripción en el texto).
Figura 6. RNM con lesión de 7 mm sugerente de cáncer (descripción en el texto).

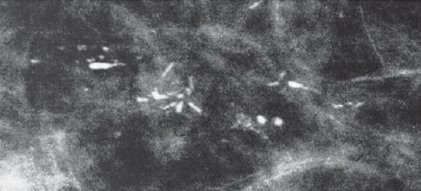 Figura 7. Calcificaciones malignas (comedocarcinoma) en una configuración clásica en punto y guión. BI-RAD 5.
Figura 7. Calcificaciones malignas (comedocarcinoma) en una configuración clásica en punto y guión. BI-RAD 5.

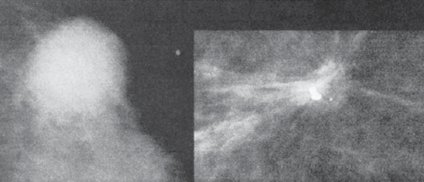 Figura 8. A la izquierda, lesión BI-RAD 4, fibroadenoma. A derecha, lesión BI-RAD, carcinoma ductal invasor (descripción en el texto).
Figura 8. A la izquierda, lesión BI-RAD 4, fibroadenoma. A derecha, lesión BI-RAD, carcinoma ductal invasor (descripción en el texto).

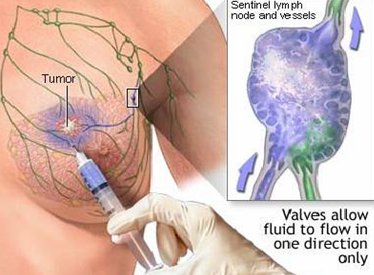 Figura 9. Técnica del ganglio centinela.
Figura 9. Técnica del ganglio centinela.

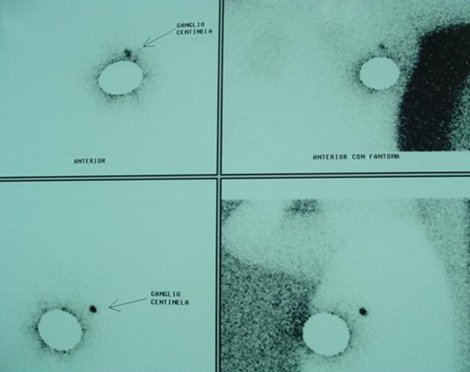 Figura 10. Determinación del ganglio centinela por medicina nuclear.
Figura 10. Determinación del ganglio centinela por medicina nuclear.

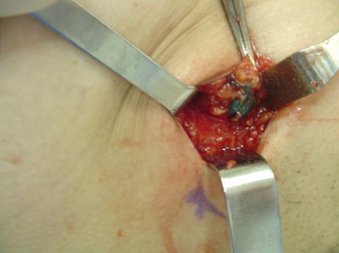 Figura 11. Visualización del ganglio centinela en la cirugía mamaria.
Figura 11. Visualización del ganglio centinela en la cirugía mamaria.

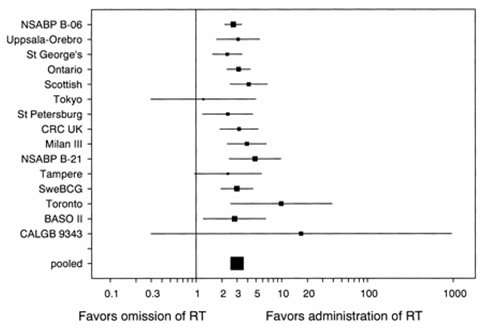 Figura 12. Metaanálisis sobre el beneficio de la radioterapia en el cáncer de mama.
Figura 12. Metaanálisis sobre el beneficio de la radioterapia en el cáncer de mama.

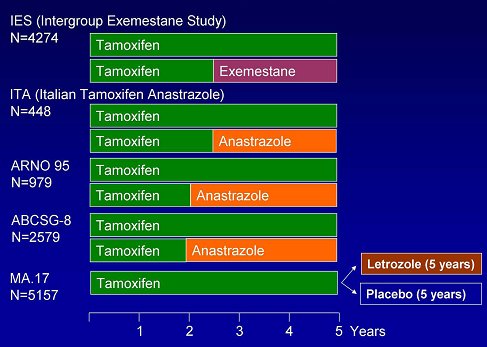 Figura 13. Estudios fase III de administración secuencial de tamoxifeno versus inhibidores de la aromatasa en cáncer de mama.
Figura 13. Estudios fase III de administración secuencial de tamoxifeno versus inhibidores de la aromatasa en cáncer de mama.

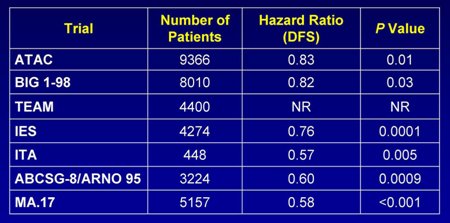 Tabla II. Estudios fase III: resultados (DFS = sobrevida libre de enfermedad. NR= no reportado).
Tabla II. Estudios fase III: resultados (DFS = sobrevida libre de enfermedad. NR= no reportado).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
 Autora:
Pamela Salman Boghikian[1]
Autora:
Pamela Salman Boghikian[1]

Citación: Salman P. Advances in breast cancer. Medwave 2009 Abr;9(5):e3856 doi: 10.5867/medwave.2009.04.3856
Fecha de publicación: 1/4/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Nombre/name: Ana MarÃa Salinas
Fecha/date: 2009-04-02 16:15:57
Comentario/comment:
¿Quisera saber cúal es la casuistica de fibroadenoma en niñas de 11 años?
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin. 2007 Jan-Feb;57(1):43-66. | CrossRef | PubMed |
Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin. 2007 Jan-Feb;57(1):43-66. | CrossRef | PubMed |