Resumen
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría del Hospital Clínico San Borja Arriarán. Edición científica: Dr. Luis Delpiano.
Historia
En el siglo II antes de Cristo, el patriarca judío Rabbi Judah estableció una norma que eximía de la circuncisión al tercer hijo de una mujer, en caso de que dos de sus hermanos mayores hubieran muerto o sufrido grandes hemorragias después de este procedimiento. Sin embargo, las primeras descripciones científicas de la hemofilia datan de fines del siglo XVIII, momento en el que algunos autores describieron familias en las cuales los varones sufrían hemorragias postraumáticas anormalmente prolongadas. Luego, en el siglo XIX se acumuló una extensa literatura sobre esta enfermedad hemorrágica, a la que se adjudicaron distintos nombres, tales como hemorrea, idiosincrasia hemorrágica, hematofilia y diátesis hemorrágica hereditaria, hasta que finalmente adquirió su nombre actual: hemofilia, que significa amor a la sangre, término que dio el título a un extenso tratado publicado en 1828. El compromiso de las articulaciones, que es el síntoma más característico de la hemofilia, se describió con detalle recién en 1890; antes se confundía con artritis reumática, tuberculosa o de otros tipos. En la realeza europea hubo varios casos de hemofilia, de los cuales el más conocido es el de Alexei Romanov, hijo del último zar de Rusia, Nicolás II (Fig. 1).
Figura 1. El Zarevich Alexei Romanov era hemofílico.
Hacia 1938 los investigadores descubrieron que sólo la transfusión de sangre era una terapia eficaz; en los años 50 se desarrollaron las técnicas para preparar factor VIII humano en Gran Bretaña, Francia y Suecia; también en esa época se desarrollaron concentrados a partir de sangre de animales. En 1965 se adoptó en forma amplia el uso de crioprecipitado en los servicios de terapia transfunsional, como tratamiento sustituto del factor antihemofílico para los procedimientos de rutina. Desde entonces, los concentrados liofilizados han mejorado la vida de los hemofílicos de tal manera, que hoy los pacientes se pueden autotratar en forma precoz mediante inyección
endovenosa de los preparados de factor VIII/IX, que pueden conservar en sus hogares, lo que ha permitido tratar y prevenir las hemorragias. En la actualidad existen además los preparados recombinantes, que evitan el riesgo de transmisión de enfermedades, pero los liofilizados extraídos del plasma humano tienen una excelente bioseguridad.
Definición, cuadro clínico, patogenia
En Chile, a partir del primero de julio del 2006 la hemofilia se incorporó al plan AUGE – GES
(Acceso Universal al Sistema de Garantías Explícitas en Salud), para lo cual se utilizó la siguiente definición: “Enfermedad hereditaria, ligada al sexo, congénita, caracterizada por sangrado excesivo con tendencia a lo incoercible, sin que exista relación causa efecto evidente, que se produce en cualquier sitio de la economía, a menos que el paciente reciba en forma oportuna, en cantidad y calidad, el o los factores deficientes por vía intravenosa, a lo largo de toda su vida, ya sea en forma de demanda precoz o preventiva. Las secuelas y complicaciones biopsicosociales de esta enfermedad, sin manejo oportuno con calidad, cantidad y seguridad biológica, son causa de gran carga de enfermedad síquica, física o ambas, de carácter invalidante y muerte prematura”.
Las hemofilias, que se clasifican como enfermedades hereditarias de la coagulación, caracterizadas por una alteración en la hemostasia secundaria, pueden ser de tres tipos:
- Hemofilia A, que es la más frecuente y se debe a déficit de factor VIII;
- Hemofilia B, que se debe a déficit de factor IX;
- Hemofilia C, que se caracteriza por déficit de factor XI (muy rara; en Chile se han comunicado sólo dos casos).
Los síntomas de la hemofilia están dados por las hemorragias que se producen en los diferentes sistemas:
- Hemartrosis: es el síntoma más característico de la hemofilia. Se produce cuando los niños empiezan a caminar, alrededor del año de edad.
- Hematomas profundos.
- Hemorragia quirúrgica.
- Alveolorragia.
- Epistaxis.
- Equimosis.
- Hematuria: se presenta por lo menos una vez al año.
- Hemorragia intracraneana: es la principal causa de muerte en los pacientes hemofílicos. El traumatismo desencadenante puede ser de bajo impacto.
- Hemorragia del frenillo.
- Hemorragia digestiva.
- Hemorragia en sitios de vacuna, que puede ser muy precoz, por ejemplo, al administrar la vacuna BCG.
La hemartrosis clásica de rodilla se caracteriza por pérdida de las líneas articulares y de su función (Fig. 2). La única alternativa es el uso de prótesis en la edad adulta, porque la hemorragia produce gran daño articular, que conduce a la invalidez en pacientes que recibieron un tratamiento inadecuado durante su infancia (Fig. 3). Lo mismo ocurre en otras articulaciones, como cadera, que también podría requerir prótesis. Estas cirugías tienen un gran impacto económico, ya que se requiere una cantidad considerable de factor VIII durante la cirugía y una rehabilitación adecuada, para que el paciente no sangre. Cualquier articulación podría sangrar, a excepción de la temporomandibular, que raras veces presenta este problema.
Figura 2. Hemartrosis de rodilla derecha.
Figura 3. Prótesis en ambas rodillas por secuelas de hemartrosis.
Con respecto a su frecuencia, la hemofilia A se presenta en 1 de cada 10.000 nacidos vivos y la hemofilia B, en 1 de cada 30.000; en 30% de los casos no existen antecedentes familiares y se denominan primer mutante o hemofílicos de novo.
En cuanto a la patogenia, los genes de los factores VIII y IX se localizan en el cromosoma X, por lo tanto es una enfermedad con herencia ligada al sexo. 50% de los casos de hemofilia A grave resultan de la inversión de una sección del brazo largo del cromosoma X. En los pacientes con hemofilia sin antecedentes familiares pueden existir mutaciones puntuales o deleciones parciales o totales del gen, que afectan la regulación de éste.
Clasificación
Las hemofilias se clasifican en leves, moderadas y graves según el porcentaje del factor correspondiente (Tabla I). Es leve si hay entre 5% a 25% del factor; moderada si hay entre 1% a 4% y grave, si hay menos de 1% del factor. Esta clasificación se aplica a las hemofilias A y B. Las hemofilias graves sangran en forma espontánea, incluso se producen hemartrosis espontáneas; las moderadas sangran frente a accidentes o contusiones y las leves sangran frente a procedimientos quirúrgicos.
Tabla I. Clasificación de gravedad de la hemofilia.
En el año 2006 se realizó una estratificación etaria de las personas con hemofilia en Chile y se encontró que la mayoría eran jóvenes: 77,4% eran menores de 40 años y 45,5%, menores de 20, lo que se debe a que estos pacientes mueren en edades tempranas o llegan a la adultez en muy malas condiciones, situación que se espera revertir con la incorporación de esta patología al AUGE.
Manejo de las hemofilias
El manejo se puede dividir en profilaxis y manejo del sangrado agudo. El hemofílico que consulta en urgencia no puede esperar, debe ingresar en forma inmediata porque se puede complicar rápidamente. El tratamiento consiste en terapia de reemplazo, que se puede efectuar mediante tres tipos de elementos:
- Liofilizados: son el tratamiento de elección. Están disponibles desde hace 30 años, pero llegaron a Chile en forma masiva hace sólo una década. Se pueden obtener de donantes o recombinantes; estos últimos son muy caros, por eso en Chile se usa el proveniente de donante. Entre sus ventajas está que su volumen es pequeño; son de fácil y rápida administración, incluso se pueden autoadministrar; y son fáciles de guardar y transportar. Son de uso exclusivo endovenoso y se deben administrar alrededor de 100 unidades/minuto, no más rápido.
- Crioprecipitados: son la segunda elección para los pacientes con hemofilia A. Cada bolsa contiene entre 80 y 100 unidades de factor VIII y de factor Von Willebrand.
- Plasma: se usa en caso de no existir liofilizado o crioprecipitado. Aporta 1 unidad/ml de factor.
El cálculo de la terapia de reemplazo es sencillo: se calcula el peso del paciente y el nivel del factor que se desea obtener, porque no es lo mismo una hemorragia cerebral que una hemartrosis o una gingivorragia. Frente a una hemorragia cerebral se tendría que llevar el nivel del factor a 80-100%, en cambio en una gingivorragia bastaría con llevarlo a 40%. En la figura 4 se muestran las fórmulas que se utilizan para hacer el cálculo de la cantidad de liofilizado que se debe administrar en las hemofilias A y B. Es importante no eliminar los sobrantes del liofilizado, porque es preferible proporcionar al enfermo una cantidad mayor de concentrado.
Figura 4. Cálculo de la terapia de reemplazo en las hemofilias A y B.
Las Normas de manejo clínico de las hemofilias fueron confeccionadas por un panel de expertos; actualmente están en revisión y la nueva versión debería salir a más tardar a principios de 2007. Hasta el momento se han distribuido a los equipos de salud de la mayoría de los hospitales y a los enfermos, 1.500 ejemplares en formato bolsillo y 1.500 afiches con el algoritmo de manejo rápido, en el que se destaca que la hemofilia es una emergencia permanente. Además existe una credencial de identificación oficial de la condición de portador de hemofilia, que debería ser usada por todos los pacientes que padecen de esta enfermedad (Fig. 5).
Figura 5. Credencial de identificación oficial de la condición de portador de hemofilia.
Profilaxis
La profilaxis se define como el aporte del factor de coagulación deficitario por vía endovenosa en forma anticipada, con el fin de prevenir las hemorragias. Se hace fundamentalmente a nivel pediátrico. Como en la actualidad el liofilizado está disponible para todos los pacientes, el objetivo es que todo niño hemofílico grave reciba liofilizado para prevenir el sangrado y sus complicaciones, como en la hemartrosis, lo que se logra con el solo hecho de mantener el nivel de factor de coagulación en más de 1%; para esto se debe efectuar la administración bisemanal de este preparado.
El principal fundamento de la profilaxis es que el daño articular se puede prevenir mediante la administración continua de los factores en déficit, para evitar que la concentración de los factores VIII y IX disminuya bajo 1%. En 1960 la Dra. Nilsson inició el programa de profilaxis y en el año 1992 se publicó el primer resultado, que demostró que los niños que recibieron profilaxis tuvieron menor porcentaje de complicaciones. El segundo fundamento para el uso de profilaxis es que el tratamiento a demanda es insuficiente, porque cuando un paciente sangra un poco y se le administra una pequeña cantidad de factor, 54% de los pacientes presenta morbilidad musculoesquelética significativa y sólo alrededor de 4% tiene radiología normal.
Tratamiento
No se debe esperar a que aparezcan evidencias directas o indirectas del efecto de una hemorragia para tomar decisiones, porque cuando eso ocurre por lo general ya es muy tarde para prevenir las complicaciones y secuelas. Si el paciente refiere un traumatismo, se debe tratar; el manejo dependerá del sitio de sangrado, ya que con este antecedente se calculan los días y la cantidad de liofilizado a administrar. Además de liofilizado, crioprecipitado y plasma, existe el tratamiento con coadyuvantes: desmopresina, antifibrinolíticos (ácido tranexámico) y corticoides.
La desmopresina es un análogo sintético de la vasopresina, que aumenta los niveles plasmáticos del factor VIII y del factor Von Willebrand en 2 a 5 veces, a partir de los depósitos que existen en las células endoteliales; por lo tanto no tendría utilidad en los hemofílicos graves, porque éstos no tienen más factor. Es muy útil en los hemofílicos tipo A leve y tiene menor utilidad en los pacientes con hemofilia moderada, en los que permite evitar el uso de liofilizado en sangrados menores. Lo ideal es medir la cantidad del factor antes y después de la administración de desmopresina; el nivel deseado se alcanza a los 15 minutos de administración, con una dosis de 0,3 a 0,4 ug/kg/día. La dosis se debe diluir en 50 a 100 ml de suero fisiológico y se debe infundir en 20 a 30 minutos, para evitar reacciones adversas. Su efecto dura entre 8 y 10 horas. La desmopresina de aplicación nasal no tiene efecto, porque la dosis es insuficiente: se requerirían 150 microgramos en un niño y 300 microgramos en un adulto.
Los antifibrinolíticos son fármacos cuya acción es bloquear la retroalimentación circular, que consiste en la conversión de plasminógeno en plasmina, la consiguiente acción de ésta sobre la fibrina y la de ésta sobre el plasminógeno, con su consecuente conversión en plasmina. En Chile el más utilizado es el ácido tranexámico, que se utiliza en dosis de 30 a 50 mg/kg/día, cada 6 a 8 horas, por vía endovenosa u oral. También es muy útil como coadyuvante en la terapia de los hemofílicos.
Complicaciones
Las complicaciones más graves son las que ocurren en el sistema nervioso central. Toda cefalea en un paciente con hemofilia se debe considerar como un
proceso expansivo intracraneano hemorrágico hasta que se demuestre lo contrario, de modo que antes de realizar una tomografía axial computarizada o una resonancia magnética (RM) se debe administrar factor al paciente. 70% de las muertes en personas con hemofilia se deben a una hemorragia intracraneana. En estos casos el tratamiento es de urgencia y el manejo consiste en administrar una dosis de ataque, con el objetivo de aumentar el factor en un rango entre 80 a 100% y aplicarlo tanto si el tratamiento es médico como quirúrgico. Es importante recordar que no siempre existe el antecedente de trauma, sobre todo en los niños, pero basta la sospecha clínica para iniciar la terapia de reemplazo de inmediato; que los exámenes complementarios deben ser exclusivamente no invasivos; y que los eventuales traslados a centros de mayor complejidad se efectuarán sólo después de que se haya iniciado la terapia de reemplazo.
Otra complicación de la hemofilia es el
hematoma del psoas, que se puede confundir con una apendicitis aguda, pero hoy la ecografía ha facilitado su diagnóstico. También está el
pseudotumor hemofílico, que habitualmente se debe a una hemorragia compacta del subperiostio que destruye hueso y cartílago, dando el aspecto de un verdadero tumor; el diagnóstico se realiza por medio de RM, es de muy difícil manejo y siempre debe ser sometido a biopsia. También la
hematuria constituye una complicación, que se maneja con reposo, aumento de la ingesta de líquido y eventual uso de corticoides; mejora en dos a tres días y no se deben usar liofilizados ni antifibrinolíticos, porque puede producir una coagulación intrarrenal. Finalmente, estos pacientes tienen mayor índice de
suicidio que la población general, ya que ven cómo se va deteriorando su calidad de vida y se deprimen al ver que no pueden jugar ni tener las mismas actividades que sus pares. Para evitar estas complicaciones, el manejo del paciente hemofílico debe ser multiprofesional, con participación de hematólogo, traumatólogo, kinesiólogo, terapeuta ocupacional, dentista al menos una vez al año y psicólogo.
En los últimos diez años ha habido un aumento importante en la provisión de factores anti-hemofílicos. En 1995 prácticamente no estaban disponibles en Chile, pero en el año 2006 la cantidad de liofilizado disponible aumentó a más del doble, con un total de 2,49 UI/habitante/país/año. En los registros de mortalidad disponibles entre 1980 y 2006 se encontró 74 pacientes fallecidos; la hemorragia intracraneana y el SIDA causaron 71% de las muertes, pero el SIDA debería disminuir a medida que se masifica el uso del liofilizado. Por otro lado, 62% de los pacientes fallecieron antes de los 40 años de edad y 24% fallecieron antes de los 20 años.
El desarrollo de
inhibidores, que son anticuerpos contra factores, es actualmente la complicación más grave derivada del uso de la terapia de reemplazo, en especial, de concentrados de factor antihemofílico. Los inhibidores se pueden desarrollar no sólo en pacientes hemofílicos, sino también en el transcurso de otras enfermedades, dando origen a la entidad que se conoce como “hemofilia adquirida”. La sospecha es principalmente clínica y se plantea cuando hay mala respuesta al tratamiento habitual o aumento de eventos en niños que se mantienen con profilaxis. El estudio actual de la hemofilia está centrado en la investigación de estos anticuerpos.
En Chile hay sólo dos o tres pacientes con inhibidores, porque la mayoría de los hemofílicos ha tenido muy poco contacto con los factores VIII y IX, pero a medida que aumente el uso de liofilizado va a aumentar también esta complicación, que ocurre con los liofilizados recombinantes y con los provenientes de donantes. Los pacientes con títulos bajos se pueden tratar con dosis más altas de liofilizado, mientras que los que tienen títulos altos deben usar factor VII activado, que se salta parte de la cascada de coagulación, pero tiene un costo elevado: la ampolla cuesta alrededor de 500.000 pesos.
En el futuro se espera que esté disponible la terapia recombinante, ya empleada en otros países y que no presenta riesgo de transmisión de enfermedades. Además, en los próximos 50 años esperamos que la terapia génica alcance el desarrollo necesario para tratar esta enfermedad.

 Figura 1. El Zarevich Alexei Romanov era hemofílico.
Figura 1. El Zarevich Alexei Romanov era hemofílico.

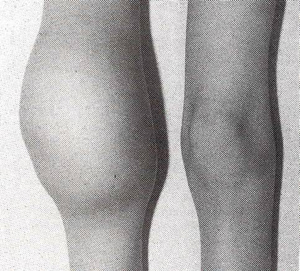 Figura 2. Hemartrosis de rodilla derecha.
Figura 2. Hemartrosis de rodilla derecha.

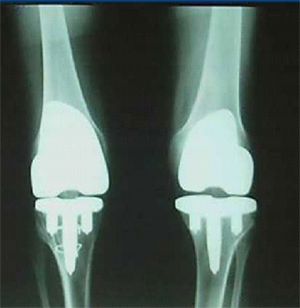 Figura 3. Prótesis en ambas rodillas por secuelas de hemartrosis.
Figura 3. Prótesis en ambas rodillas por secuelas de hemartrosis.

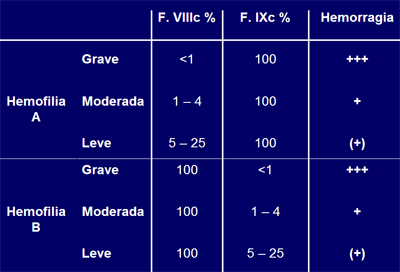 Tabla I. Clasificación de gravedad de la hemofilia.
Tabla I. Clasificación de gravedad de la hemofilia.

 Figura 4. Cálculo de la terapia de reemplazo en las hemofilias A y B.
Figura 4. Cálculo de la terapia de reemplazo en las hemofilias A y B.

 Figura 5. Credencial de identificación oficial de la condición de portador de hemofilia.
Figura 5. Credencial de identificación oficial de la condición de portador de hemofilia.

Esta
obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Figura 1. El Zarevich Alexei Romanov era hemofílico.
Figura 1. El Zarevich Alexei Romanov era hemofílico.

 Figura 2. Hemartrosis de rodilla derecha.
Figura 2. Hemartrosis de rodilla derecha.

 Figura 3. Prótesis en ambas rodillas por secuelas de hemartrosis.
Figura 3. Prótesis en ambas rodillas por secuelas de hemartrosis.

 Tabla I. Clasificación de gravedad de la hemofilia.
Tabla I. Clasificación de gravedad de la hemofilia.

 Figura 4. Cálculo de la terapia de reemplazo en las hemofilias A y B.
Figura 4. Cálculo de la terapia de reemplazo en las hemofilias A y B.

 Figura 5. Credencial de identificación oficial de la condición de portador de hemofilia.
Figura 5. Credencial de identificación oficial de la condición de portador de hemofilia.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Autor:
Felipe Espinoza[1]
Autor:
Felipe Espinoza[1]

