 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
En el Consenso chileno de 1998 se definió a la Enfermedad Pulmonar Obstructiva Crónica (EPOC) como “una patología con limitación irreversible del flujo aéreo, usualmente progresiva, cuyo agente etiológico más importante es el tabaco, que actuando sobre un terreno susceptible determina una combinación de grados variables de enfisema e inflamación crónica de las vías aéreas periféricas. Se considera que la alteración es irreversible cuando el VEF1 se mantiene bajo lo normal aun después de un tratamiento adecuado y prolongado”. En esta definición llama la atención el adjetivo “irreversible” y el hecho de que se limita a lo que ocurre en el interior del pulmón, olvidando los efectos extrapulmonares de la enfermedad.
La última definición de la Iniciativa Global para el Diagnóstico, Tratamiento y Prevención de la EPOC (GOLD, por sus siglas en inglés) data de 2006 y define a la EPOC como “una enfermedad prevenible y tratable, con afectación sistémica extrapulmonar que puede contribuir a la gravedad en algunos pacientes. El componente pulmonar se caracteriza por una limitación del flujo aéreo que no es completamente reversible. La limitación del flujo aéreo es por lo general progresiva y se asocia a una respuesta inflamatoria pulmonar anómala a partículas o gases nocivos”. En esta definición se pasa del concepto de enfermedad irreversible al de enfermedad prevenible y tratable; y se introduce el concepto que la EPOC presenta una afectación sistémica con compromiso extrapulmonar, que puede contribuir a la gravedad en algunos pacientes. Su defecto es que es algo vaga con respecto a la etiopatogenia, dado que el cigarrillo sigue siendo el principal factor causal.
Los principales hechos epidemiológicos de la EPOC son: que va en aumento, sobre todo en mujeres, que se asocia a mortalidad y que existe un problema de subdiagnóstico.
Varios estudios epidemiológicos han demostrado que la prevalencia de la EPOC ha aumentado en forma significativa entre el período 1960-1979, en que oscilaba alrededor de 6% y el período 2000-2007, en que la cifra llegó a 9-10%. La mayoría de los datos epidemiológicos de la EPOC provienen de estudios realizados en países desarrollados, principalmente Europa, Estados Unidos y China, excepto el estudio PLATINO (Proyecto Latinoamericano de Investigación en Obstrucción Pulmonar), que se acerca más a la realidad latinoamericana y, si bien tiene algunas observaciones en cuanto a metodología, ha entregado datos valiosos, especialmente de las ciudades de São Paulo, Montevideo, México DF, Santiago y Caracas (1). Este estudio se desarrolló entre 2002 y 2004 y demostró que la prevalencia de la EPOC ha aumentado en comparación con la descrita en estudios previos, aunque esto se podría explicar por el hecho de que el objetivo de este estudio fue investigar la prevalencia de la EPOC en todas las personas mayores de 40 años (Fig. 1).
En cuanto a mortalidad, las enfermedades respiratorias, dentro de las cuales se encuentra la EPOC, ocupan el cuarto lugar como causa de muerte en los Estados Unidos; y es necesario destacar que en pacientes mujeres la mortalidad se ha doblado en los últimos 20 años. Si bien la EPOC ocupa uno de los lugares más bajos como causa de mortalidad específica en los Estados Unidos, llama la atención que es la única de las causas principales de muerte que tiene una pendiente en ascenso (2), de modo que se estima que en el año 2020 llegará a ser la tercera causa de muerte (Fig. 2).
El diagnóstico de EPOC se basa en la sospecha clínica y la espirometría. En el estudio PLATINO se preguntó a los pacientes que resultaron tener EPOC, si alguna vez se les había dicho que sufrían una enfermedad pulmonar crónica, sea bronquitis crónica, enfisema o EPOC y se encontró que sólo 11% de los encuestados había recibido dicha notificación, lo que significa que en la población general existe un porcentaje muy alto de pacientes con EPOC sin diagnóstico, situación que también se presenta en Santiago.
(Tabla I).
Por otro lado, en un porcentaje muy importante, 47,8% de los pacientes con EPOC a los cuales se les había dicho previamente que tenían enfisema o EPOC, nunca se había solicitado una espirometría (Fig. 3).
Figura 3. Espirometría en algún momento de su vida en sujetos con obstrucción según estudio PLATINO.
Se podría pensar que lo anterior es un problema regional, dado el menor desarrollo de los países latinoamericanos; sin embargo en un estudio austríaco poblacional que se publicó en el año 2007, en el que se aplicaron los mismos criterios del estudio PLATINO, se encontró una prevalencia de 26%, bastante mayor que en Chile y se observó que en sólo 5,6% de los pacientes catalogados como EPOC el médico tratante ya había hecho el diagnóstico, lo que demuestra que en países desarrollados también existe el problema del subdiagnóstico (3). Asimismo, en un gran estudio poblacional chino en el que se incluyó a 1668 pacientes con EPOC, en 35,1% de ellos se había hecho el diagnóstico en forma previa y en sólo 6,5% del total de pacientes se había solicitado una espirometría (4).
Un hecho importante es que la prevalencia de EPOC en mujeres va en aumento y se asocia a mayor mortalidad; para explicar esto se han propuesto diversas hipótesis: probablemente se deba a compromiso anatómico diferente, mayor susceptibilidad o mayor sintomatología. En la Fig. 4 se observa que la mortalidad aumenta progresivamente en ambos géneros, pero la pendiente es mayor para las mujeres.
En otro estudio se tomaron 1053 pacientes que estaban siendo evaluados para una resección quirúrgica de enfisema, con el objetivo de buscar diferencias atribuibles al sexo en pacientes con enfisema grave; 38,8% de los pacientes eran mujeres. Se les realizó una evaluación clínica y funcional completa, además de tomografía axial computada (TAC) de tórax y hubo un subgrupo (n=101) al cual se le hizo estudio histológico. En las mujeres se observó que al mismo VEF1, es decir, el mismo estado funcional, que en los hombres, sus vías aéreas eran más pequeñas, de mayor grosor y el enfisema era menos extenso y de menor tamaño, pero más central. Asociado a lo anterior, a igual VEF1 las mujeres presentaban menor índice de tabaquismo, menor edad y menor índice de masa corporal (IMC), mayor disnea, mayor puntaje BODE, que es un índice que evalúa IMC, obstrucción de vía aérea, disnea y tolerancia al ejercicio, mayor depresión, peor puntaje mental SF36 y menor calidad de vida (5).
Hay cuatro aspectos importantes de la espirometría en la EPOC: primero, las recomendaciones nacionales e internacionales son claras en cuanto a los valores espirométricos que se deben utilizar para diagnosticar EPOC, pero esto ha ido cambiando en el tiempo e incluso existe controversia sobre los criterios para clasificar las etapas de la EPOC; segundo, subsiste el mito de que en la EPOC no existe respuesta al broncodilatador; tercero, se debe señalar el valor que tiene la espirometría como factor predictor de riesgo y en cuarto lugar, es importante recordar su utilidad para el screening de esta enfermedad.
La espirometría mide el volumen de aire exhalado en función del tiempo. Luego de una inspiración máxima se realiza una espiración forzada, en la que se expulsa todo el aire hasta que se llega a un plateau, cuando sólo queda el volumen residual al interior de los pulmones. Todo el volumen que se alcanza a expulsar en esta espiración forzada durante el primer segundo corresponde al VEF1, mientras que el total de lo expulsado corresponde a la capacidad vital forzada (CVF).
Sin embargo, se debe recordar que cuando se analiza una variable, en cualquier grupo de sujetos sanos, existe una distribución de tipo normal, por lo que un porcentaje bajo de ellos estará bajo el punto de corte fijado, aun siendo sanos; asimismo, habrá sujetos realmente enfermos que se ubicarán sobre ese valor (Fig. 5). Estos problemas siempre estarán presentes al utilizar una prueba para confirmar o descartar una enfermedad y la espirometría no es la excepción.
Como ya se mencionó, actualmente se prefiere la relación fija VEF1/CVF post-BD menor de 0,7 para el diagnóstico de EPOC, pero este criterio también tiene sus detractores, debido a la posibilidad de sobrediagnóstico. Este aspecto constituye el principal cuestionamiento al estudio PLATINO y a otros estudios epidemiológicos que han utilizado como criterio diagnóstico esta relación. Un ejemplo de lo anterior es un estudio noruego realizado por Hardie y cols, en el cual se seleccionaron sujetos mayores de 70 años (n = 71) sanos, asintomáticos y que nunca habían fumado. Los autores encontraron que, con los actuales criterios de las guías GOLD, 25% de los individuos quedaba clasificado como EPOC etapa 1 y 10%, como EPOC etapa 2 (6).
Mannino y cols, en un estudio más reciente, de 2007, encontraron que aun en pacientes asintomáticos, la relación VEF1/CVF baja puede ser un predictor de complicaciones futuras. Los autores reclutaron 1621 participantes mayores de 65 años y los siguieron hasta por 11 años; en el subgrupo de personas normales según el criterio de estar bajo el límite inferior de lo normal, pero que tenían una relación VEF1/CVF menor de 0,7, los autores encontraron un aumento del riesgo relativo de morir (RR 1,3) y de la necesidad de hospitalizaciones por EPOC (RR 2,6), lo que apoya la hipótesis de que la relación VEF1/CVF es una herramienta más útil para el diagnóstico de EPOC (7).
El conocido mito de la no respuesta a broncodilatador (BD) es otro aspecto de la espirometría en EPOC que genera controversia. Muchos piensan, sobre todo en el ambiente no especialista, que si en la espirometría se observa un cambio significativo post BD se debe dudar del diagnóstico de EPOC, pero eso no es así, como lo demostró Tashkin y cols en un estudio publicado en 2008, en el que estudiaron a 5756 pacientes con EPOC con VEF1 39% del teórico y encontraron que este índice aumentaba en promedio 229 ml después del BD, lo que se considera como significativo; además, en alrededor de 15% de los pacientes el VEF1 aumentaba más que eso. Como estos pacientes están hiperinsuflados, la CVF es el indicador que más aumenta con el uso de broncodilatadores (8).
Por último, cabe destacar el rol del VEF1 como predictor de riesgo independiente. En una revisión publicada en 2007, en la que se analizaron resultados de estudios epidemiológicos, se concluyó que poseer un VEF1 bajo aumenta el riesgo de mortalidad cardiovascular y por cualquier otra causa. Los autores observaron que un no fumador con VEF1 bajo puede tener incluso mayor riesgo de mortalidad por cualquier causa, que un sujeto que tenga el VEF1 normal pese a ser, o haber sido, un gran fumador (9).
De acuerdo con lo anterior, no sólo se debiera hacer más espirometrías para diagnosticar la EPOC cuando ésta se sospecha, sino que este examen también puede ser una muy buena herramienta de screening, tanto para EPOC como para el estado de salud, en general. En un estudio polaco reciente se realizaron 100.000 espirometrías como screening; se encontraron 4494 fumadores activos, de los cuales 26,2% tenía un patrón obstructivo al examen. Lo interesante es que se hizo una consejería breve a todos los fumadores, en la misma sesión, sin terapia farmacológica, utilizando el conocido gráfico de Fletcher y Peto de declinación de función pulmonar. En la Fig. 6 se observa la curva de función pulmonar según edad, en pacientes EPOC fumadores y en personas no fumadoras, así como la recuperación de la pendiente normal al discontinuar el hábito tabáquico. El punto negro muestra la intersección entre el % del VEF1 predicho del participante y la edad actual.
Figura 6. Diagrama de Fletcher y Peto que se utilizó para consejería a fumadores activos.
Un año después, 12% de los fumadores sin limitación crónica del flujo aéreo (LCFA) había dejado de fumar, cifra que llegó a 16% entre aquellos fumadores con LCFA en el momento de la consejería (10).
El tabaquismo sigue siendo la principal causa de EPOC y se sabe que hasta 25% de los fumadores puede llegar a desarrollar la enfermedad; sin embargo, hay otros factores de riesgo, como la exposición a biomasa en mujeres, que se suele dar en medios rurales; el tabaquismo pasivo; la contaminación ambiental y laboral y factores genéticos, como el déficit de alfa-1 antitripsina.
La bronquitis crónica es uno de los factores que inciden en el pronóstico, aunque esto ha sido motivo de controversia. Se define como bronquitis crónica a la presencia de tos en la mayoría de los días del mes, por al menos tres meses, durante dos años consecutivos. En los primeros consensos GOLD esto correspondía a la etapa 0, en la que el paciente tenía una espirometría normal, pero presentaba sintomatología respiratoria; posteriormente los expertos llegaron a la conclusión de que la evidencia no mostraba una progresión significativa, en cuanto a porcentaje, desde este estado de sintomático respiratorio a la etapa 1 de la EPOC, por lo que se retiró la etapa 0. Sin embargo, en un trabajo publicado en 2007, luego del segundo acuerdo GOLD, se describió el seguimiento efectuado por más de diez años a 5002 individuos sin asma, de 22 a 44 años de edad y con función pulmonar normal (11); en ese estudio se encontró que los pacientes con sintomatología respiratoria persistente tenían mucho mayor riesgo de desarrollar EPOC que aquellas personas que nunca habían tenido dicha sintomatología (Fig. 7).
Figura 7. Incidencia de EPOC en cohorte de adultos jóvenes con tos y expectoración crónicas.
La dieta es un aspecto en el que existen novedosos avances. En un estudio llevado a cabo en los Estados Unidos se siguió durante varios años a 42917 hombres, que se dividieron en dos grupos según sus hábitos alimentarios: estilo de alimentación poco saludable o estilo prudente y saludable. 111 de los sujetos tenían diagnóstico de EPOC. Los autores encontraron que el riesgo relativo de desarrollar EPOC era mayor en personas con alimentación poco saludable y que el tener un estilo de alimentación saludable disminuía el riesgo de EPOC futura (12).
El ejercicio físico también tiene un efecto protector para el desarrollo de EPOC, aun en fumadores: se ha demostrado que los fumadores que realizan ejercicio físico moderado o intenso tienen menor disminución de la función pulmonar y menor riesgo de desarrollar EPOC que los que no hacen ejercicio (13).
El tipo de hábito tabáquico es importante. Según el estudio PLATINO, el riesgo de EPOC en fumadores es mayor que en los usuarios de cigarrillos de papel o de paja, que no existen en Chile, aunque en términos generales las personas fumadoras siempre tienen mayor riesgo de desarrollar EPOC que las que nunca han fumado (Fig. 8).
Figura 8. Prevalencia de EPOC según tipo de tabaquismo (Estudio PLATINO).
Así también, en las ciudades de este estudio se encontró una relación inversa entre el nivel educacional y el riesgo de desarrollar EPOC (Fig. 9).
Figura 9. Asociación entre EPOC y escolaridad (Estudio PLATINO).
También se estudió la relación entre EPOC y exposición a polvo en el lugar de trabajo y se encontró una asociación significativa sólo cuando dicha exposición se prolongaba por más de diez años (Fig. 10). En cambio, no se encontró en Santiago una asociación significativa entre la exposición a humo de carbón o leña y el riesgo de EPOC, a diferencia de otros estudios.
Por último, se ha planteado que la EPOC es una enfermedad de la infancia, lo que podría explicar porqué algunos fumadores desarrollan EPOC y otros no. En PLATINO sólo se estableció una relación clara entre EPOC y hospitalizaciones por problemas pulmonares de la infancia en tres ciudades, entre las cuales está Santiago (Fig. 11).
El criterio de gravedad clásico de EPOC es el VEF1, pero en la actualidad se ha desarrollado el índice BODE (Body-mass, airflow Obstruction, Dyspnea and Exercise capacity), que considera otros elementos de los pacientes con EPOC que forman parte del compromiso multisistémico y que pueden influir en la mortalidad.
El VEF1 constituye un factor de mortalidad por sí mismo, pero tiene algunos inconvenientes: primero, hay manifestaciones sistémicas en los pacientes EPOC que no se reflejan en este índice; segundo, el VEF1 tiene una correlación bastante débil con la disnea y la calidad de vida; finalmente, la disnea y calidad de vida parecen ser mejores predictores del riesgo de muerte que el VEF1 aislado. En vista de lo anterior, muchos investigadores han buscado índices que representen mejor el estado funcional de los pacientes; así, se ha encontrado que la EPOC se asocia a mayor gravedad si el paciente tiene bajo índice de masa corporal (IMC), menor tolerancia al ejercicio o más disnea. Con base en estas observaciones se desarrolló el índice BODE, en el que se asigna un puntaje para los cuatro ítems que lo conforman: disnea según escala MMRC, IMC, VEF1 y distancia recorrida en 6 minutos; el puntaje puede estar entre 0 y 10, siendo 10 el peor resultado. El índice BODE es mejor como predictor de riesgo de muerte que el VEF1 (14).
En pacientes con EPOC está aumentada la síntesis de mediadores proinflamatorios, que afectan a otros órganos además de los pulmones: se ha descrito aumento de la expresión de moléculas de adhesión en neutrófilos circulantes, así como de varias citoquinas, proteasas y quimioquinas, lo que estaría relacionado con la limitación al flujo aéreo. También se ha estudiado la proteína C reactiva (PCR) como marcador de inflamación y se ha demostrado que tiene relación con mayor compromiso funcional, riesgo de hospitalización por exacerbaciones, desarrollo de disfunción endotelial y aumento del riesgo cardiovascular. Existen mediadores conocidos, como el Factor de Necrosis Tumoral alfa (TNF-alfa), la interleuquina (IL) 6 y la PCR, que pueden explicar el compromiso extrapulmonar de la EPOC: debilidad o atrofia muscular, eventos cardiovasculares, compromiso hepático, síndrome metabólico y mayor frecuencia de osteoporosis, independientemente del uso de corticoides inhalados.
El pilar fundamental del manejo de la EPOC sigue siendo la suspensión del tabaquismo, junto a la terapia broncodilatadora, que es la piedra angular para controlar la sintomatología de los pacientes. El uso de corticoides todavía es motivo de controversia; la rehabilitación es útil, pero poco factible en el medio chileno; y el apoyo nutricional, las vacunas y la oxigenoterapia son medidas demostradamente efectivas en el tratamiento. Sobre la ventilación crónica y la cirugía, aún existe controversia.
Como ya se mencionó, los corticoides inhalados constituyen un aspecto controvertido dentro del tratamiento de la EPOC. El estudio TORCH, que se realizó en 6112 pacientes con EPOC moderado a grave que se siguieron durante 3 años, con el objetivo de demostrar que el uso combinado de broncodilatadores de acción prolongada y corticoides inhalados tenía un efecto significativo sobre la mortalidad por EPOC, fracasó en demostrar este punto, aunque sí se encontró una disminución de la tasa de exacerbaciones, que era un objetivo secundario, al igual que lo descrito en otros estudios. Dentro de los efectos adversos se evidenció un aumento en la incidencia de neumonía, fenómeno para el cual no existe aún una explicación consistente (15).
La rehabilitación tiene un efecto sinérgico con la terapia broncodilatadora, de modo que el ideal es disponer siempre de ella; sin embargo, es difícil de implementar. Al parecer se asocia con disminución de las exacerbaciones, pero ese aspecto no está todavía muy claro y tampoco se ha demostrado un beneficio claro sobre la mortalidad. En un estudio llevado a cabo por nuestro grupo en 26 pacientes con EPOC, controlados con placebo, se utilizó el entrenamiento específico de los músculos respiratorios como alternativa a la rehabilitación y se demostró un beneficio significativo sobre la fuerza de los músculos respiratorios, las presiones inspiratorias máximas, las presiones inspiratorias máximas sostenidas y las pruebas de resistencia de los músculos respiratorios, si bien no se encontró un efecto significativo en la calidad de vida.
Finalmente, existe una serie de terapias que están en fase experimental, como los anticuerpos monoclonales y las estatinas, que se aplican considerando a la EPOC como una enfermedad sistémica. Se han probado anticuerpos anti TNF-alfa, como el infliximab, sin lograr demostrar beneficios en cuanto a calidad de vida, disnea y tasa de exacerbaciones; en cambio, se observó mayor incidencia de neumonías (16). Por otro lado, estudios en ratas enfisematosas sugieren que la administración de estatinas reduce el enfisema (17) y en otro estudio, de tipo observacional, se encontró que el uso de estatinas se asocia a menor declinación de la función pulmonar (18).

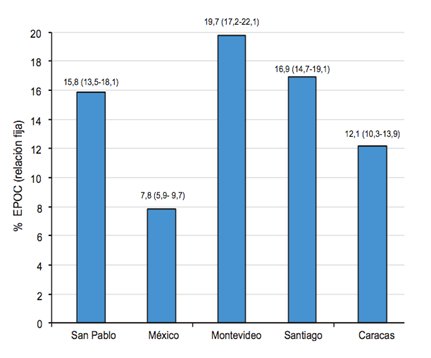 Figura 1. Prevalencia de EPOC en personas mayores de 40 años en cinco ciudades de Latinoamérica, según estudio PLATINO.
Figura 1. Prevalencia de EPOC en personas mayores de 40 años en cinco ciudades de Latinoamérica, según estudio PLATINO.

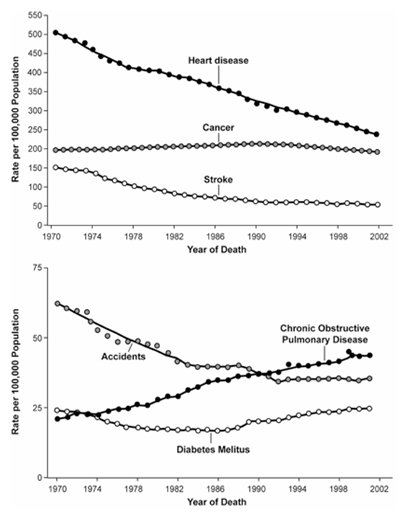 Figura 2. Tendencias de las tasas de mortalidad normalizadas para la edad, para las seis principales causas de muerte en los Estados Unidos, 1970-2002.
Figura 2. Tendencias de las tasas de mortalidad normalizadas para la edad, para las seis principales causas de muerte en los Estados Unidos, 1970-2002.

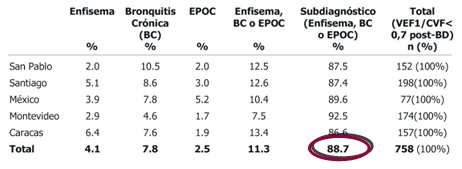 Tabla I. Diagnóstico médico previo en sujetos con VEF1/CVF menor de 0,7 post broncodilatador en los cinco centros del estudio PLATINO.
Tabla I. Diagnóstico médico previo en sujetos con VEF1/CVF menor de 0,7 post broncodilatador en los cinco centros del estudio PLATINO.

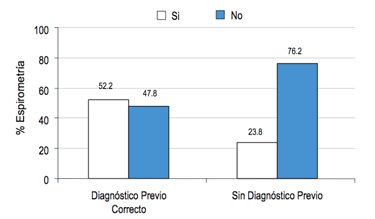 Figura 3. Espirometría en algún momento de su vida en sujetos con obstrucción según estudio PLATINO.
Figura 3. Espirometría en algún momento de su vida en sujetos con obstrucción según estudio PLATINO.

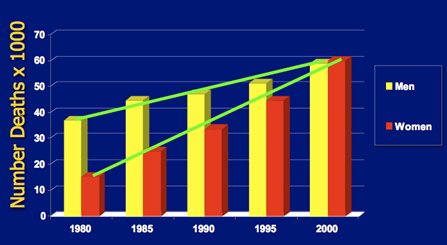 Figura 4. Mortalidad por EPOC según género entre 1980 y 2000. (Centers for Disease Control and Prevention (CDC), Estados Unidos, 2002).
Figura 4. Mortalidad por EPOC según género entre 1980 y 2000. (Centers for Disease Control and Prevention (CDC), Estados Unidos, 2002).

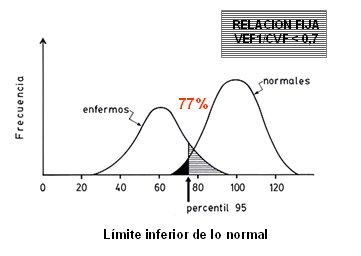 Figura 5. Límite inferior de lo normal y relación fija VEF1/CVF como criterios para el diagnóstico de EPOC.
Figura 5. Límite inferior de lo normal y relación fija VEF1/CVF como criterios para el diagnóstico de EPOC.

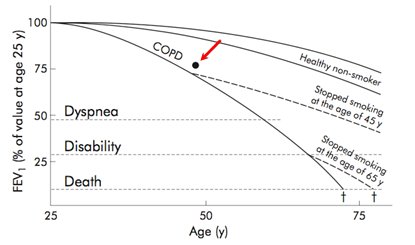 Figura 6. Diagrama de Fletcher y Peto que se utilizó para consejería a fumadores activos.
Figura 6. Diagrama de Fletcher y Peto que se utilizó para consejería a fumadores activos.

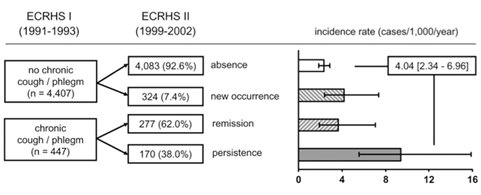 Figura 7. Incidencia de EPOC en cohorte de adultos jóvenes con tos y expectoración crónicas.
Figura 7. Incidencia de EPOC en cohorte de adultos jóvenes con tos y expectoración crónicas.

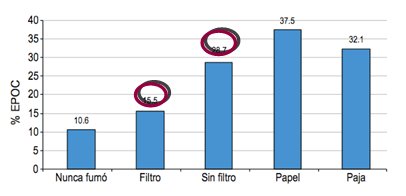 Figura 8. Prevalencia de EPOC según tipo de tabaquismo (Estudio PLATINO).
Figura 8. Prevalencia de EPOC según tipo de tabaquismo (Estudio PLATINO).

 Figura 9. Asociación entre EPOC y escolaridad (Estudio PLATINO).
Figura 9. Asociación entre EPOC y escolaridad (Estudio PLATINO).

 Figura 10.
Figura 10.

 Figura 11. Prevalencia de EPOC según hospitalización por problemas pulmonares de la infancia (Estudio PLATINO).
Figura 11. Prevalencia de EPOC según hospitalización por problemas pulmonares de la infancia (Estudio PLATINO).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
 Expositora:
Laura Mendoza[1]
Expositora:
Laura Mendoza[1]

Citación: Mendoza L. New perspectives for chronic obstructive pulmonary disease. Medwave 2008 sep;8(8):e1662 doi: 10.5867/medwave.2008.08.1662
Fecha de publicación: 1/9/2008

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Menezes AM, Pérez-Padilla R, Jardim JR, Muiño A, Lopez MV, Valdivia G, et al. Chronic obstructive pulmonary disease in five Latin American cities: The PLATINO study. Lancet. 2005 Nov 26;366(9500):1875-81. | CrossRef | PubMed |
Menezes AM, Pérez-Padilla R, Jardim JR, Muiño A, Lopez MV, Valdivia G, et al. Chronic obstructive pulmonary disease in five Latin American cities: The PLATINO study. Lancet. 2005 Nov 26;366(9500):1875-81. | CrossRef | PubMed | Jemal A, Ward E, Hao Y, Thun M. Trends in the Leading Causes of Death in the United States, 1970-2002. JAMA. 2005 Sep 14;294(10):1255-9. | CrossRef | PubMed |
Jemal A, Ward E, Hao Y, Thun M. Trends in the Leading Causes of Death in the United States, 1970-2002. JAMA. 2005 Sep 14;294(10):1255-9. | CrossRef | PubMed | Schirnhofer L, Lamprecht B, Vollmer W, Allison M, Studnicka M, Jensen R, et al. COPD Prevalence in Salzburg, Austria: Results From the Burden of Obstructive Lung Disease (BOLD) Study. Chest. 2007 Jan;131(1):29-36. | CrossRef | PubMed |
Schirnhofer L, Lamprecht B, Vollmer W, Allison M, Studnicka M, Jensen R, et al. COPD Prevalence in Salzburg, Austria: Results From the Burden of Obstructive Lung Disease (BOLD) Study. Chest. 2007 Jan;131(1):29-36. | CrossRef | PubMed | Zhong N, Wang C, Yao W, Chen P, Kang J, Huang S, et al. Prevalence of Chronic Obstructive Pulmonary Disease in China: A Large, Population-based Survey. Am J Respir Crit Care Med. 2007 Oct 15;176(8):753-60. Epub 2007 Jun 15. | CrossRef | PubMed |
Zhong N, Wang C, Yao W, Chen P, Kang J, Huang S, et al. Prevalence of Chronic Obstructive Pulmonary Disease in China: A Large, Population-based Survey. Am J Respir Crit Care Med. 2007 Oct 15;176(8):753-60. Epub 2007 Jun 15. | CrossRef | PubMed | Martinez F, Curtis J, Sciurba F, Mumford J, Giardino N, Weinmann G, et al. Sex Differences in Severe Pulmonary Emphysema. Am J Respir Crit Care Med. 2007 Aug 1;176(3):243-52. Epub 2007 Apr 12. | CrossRef | PubMed | PMC |
Martinez F, Curtis J, Sciurba F, Mumford J, Giardino N, Weinmann G, et al. Sex Differences in Severe Pulmonary Emphysema. Am J Respir Crit Care Med. 2007 Aug 1;176(3):243-52. Epub 2007 Apr 12. | CrossRef | PubMed | PMC | Hardie A, Buist A, Vollmer W, Ellingsen I, Bakke P, Mørkve O. Risk of over-diagnosis of COPD in asymptomatic elderly never-smokers. Eur Respir J. 2002 Nov;20(5):1117-22. | CrossRef | PubMed |
Hardie A, Buist A, Vollmer W, Ellingsen I, Bakke P, Mørkve O. Risk of over-diagnosis of COPD in asymptomatic elderly never-smokers. Eur Respir J. 2002 Nov;20(5):1117-22. | CrossRef | PubMed | Mannino D, Buist A, Vollmer W. Chronic obstructive pulmonary disease in the older adult: what defines abnormal lung function? Thorax. 2007 Mar;62(3):237-41. Epub 2006 Nov 7. | CrossRef | PubMed | PMC |
Mannino D, Buist A, Vollmer W. Chronic obstructive pulmonary disease in the older adult: what defines abnormal lung function? Thorax. 2007 Mar;62(3):237-41. Epub 2006 Nov 7. | CrossRef | PubMed | PMC | Tashkin D, Celli B, Decramer M, Liu D, Burkhart D, Cassino C, et al. Bronchodilator responsiveness in patients with COPD. Eur Respir J. 2008 Apr;31(4):742-50. Epub 2008 Feb 6. | CrossRef | PubMed |
Tashkin D, Celli B, Decramer M, Liu D, Burkhart D, Cassino C, et al. Bronchodilator responsiveness in patients with COPD. Eur Respir J. 2008 Apr;31(4):742-50. Epub 2008 Feb 6. | CrossRef | PubMed | Young P, Hopkins R, Eaton T. Forced expiratory volume in one second: not just a lung function test but a marker of premature death from all causes. Eur Respir J. 2007 Oct;30(4):616-22. | CrossRef | PubMed |
Young P, Hopkins R, Eaton T. Forced expiratory volume in one second: not just a lung function test but a marker of premature death from all causes. Eur Respir J. 2007 Oct;30(4):616-22. | CrossRef | PubMed | Bednarek M, Gorecka D, Wielgomas J, Czajkowska-Malinowska M, Regula J, Mieszko-Filipczyk G, et al. Smokers with airway obstruction are more likely to quit smoking. Thorax. 2006 Oct;61(10):869-73. Epub 2006 Jun 29. | CrossRef | PubMed | PMC |
Bednarek M, Gorecka D, Wielgomas J, Czajkowska-Malinowska M, Regula J, Mieszko-Filipczyk G, et al. Smokers with airway obstruction are more likely to quit smoking. Thorax. 2006 Oct;61(10):869-73. Epub 2006 Jun 29. | CrossRef | PubMed | PMC | De Marco R, Accordini S, Cerveri I, Corsico A, Antó J, Künzli N, et al. Incidence of Chronic Obstructive Pulmonary Disease in a Cohort of Young Adults According to the Presence of Chronic Cough and Phlegm. Am J Respir Crit Care Med. 2007 Jan 1;175(1):32-9. Epub 2006 Sep 28. | CrossRef | PubMed |
De Marco R, Accordini S, Cerveri I, Corsico A, Antó J, Künzli N, et al. Incidence of Chronic Obstructive Pulmonary Disease in a Cohort of Young Adults According to the Presence of Chronic Cough and Phlegm. Am J Respir Crit Care Med. 2007 Jan 1;175(1):32-9. Epub 2006 Sep 28. | CrossRef | PubMed | Varraso R, Fung T, Hu F, Willett W, Camargo C. Prospective study of dietary patterns and chronic obstructive pulmonary disease among US men. Thorax. 2007 Sep;62(9):786-91. Epub 2007 May 15. | CrossRef | PubMed |
Varraso R, Fung T, Hu F, Willett W, Camargo C. Prospective study of dietary patterns and chronic obstructive pulmonary disease among US men. Thorax. 2007 Sep;62(9):786-91. Epub 2007 May 15. | CrossRef | PubMed | Garcia-Aymerich J, Lange P, Benet M, Schnohr P, Antó JM. Regular Physical Activity Modifies Smoking-related Lung Function Decline and Reduces Risk of Chronic Obstructive Pulmonary Disease: A Population-based Cohort Study. Am J Respir Crit Care Med. 2007 Mar 1;175(5):458-63. Epub 2006 Dec 7. | CrossRef | PubMed |
Garcia-Aymerich J, Lange P, Benet M, Schnohr P, Antó JM. Regular Physical Activity Modifies Smoking-related Lung Function Decline and Reduces Risk of Chronic Obstructive Pulmonary Disease: A Population-based Cohort Study. Am J Respir Crit Care Med. 2007 Mar 1;175(5):458-63. Epub 2006 Dec 7. | CrossRef | PubMed | Celli B, Cote C, Marin J, Casanova C, Montes de Oca M, Mendez R. et al. The Body-Mass Index, Airflow Obstruction, Dyspnea, and Exercise Capacity Index in Chronic Obstructive Pulmonary Disease. N Engl J Med. 2004 Mar 4;350(10):1005-12. | CrossRef | PubMed |
Celli B, Cote C, Marin J, Casanova C, Montes de Oca M, Mendez R. et al. The Body-Mass Index, Airflow Obstruction, Dyspnea, and Exercise Capacity Index in Chronic Obstructive Pulmonary Disease. N Engl J Med. 2004 Mar 4;350(10):1005-12. | CrossRef | PubMed | Calverley P, Anderson J, Celli B, Ferguson G, Jenkins C, Jones P, et al. Salmeterol and Fluticasone Propionate and Survival in Chronic Obstructive Pulmonary Disease for the TORCH investigators. N Engl J Med. 2007 Feb 22;356(8):775-89. | CrossRef | PubMed |
Calverley P, Anderson J, Celli B, Ferguson G, Jenkins C, Jones P, et al. Salmeterol and Fluticasone Propionate and Survival in Chronic Obstructive Pulmonary Disease for the TORCH investigators. N Engl J Med. 2007 Feb 22;356(8):775-89. | CrossRef | PubMed | Rennard S, Fogarty C, Kelsen S, Long W, Ramsdell J, Allison J, et al. The Safety and Efficacy of Infliximab in Moderate to Severe Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med. 2007 May 1;175(9):926-34. Epub 2007 Feb 8. | CrossRef | PubMed |
Rennard S, Fogarty C, Kelsen S, Long W, Ramsdell J, Allison J, et al. The Safety and Efficacy of Infliximab in Moderate to Severe Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med. 2007 May 1;175(9):926-34. Epub 2007 Feb 8. | CrossRef | PubMed | Lee J, Lee D, Kim E, Choe K, Oh Y, Shim T, et al. Simvastatin Inhibits Cigarette Smoking–induced Emphysema and Pulmonary Hypertension in Rat Lungs. Am J Respir Crit Care Med. 2005 Oct 15;172(8):987-93. Epub 2005 Jul 7. | CrossRef | PubMed |
Lee J, Lee D, Kim E, Choe K, Oh Y, Shim T, et al. Simvastatin Inhibits Cigarette Smoking–induced Emphysema and Pulmonary Hypertension in Rat Lungs. Am J Respir Crit Care Med. 2005 Oct 15;172(8):987-93. Epub 2005 Jul 7. | CrossRef | PubMed |