 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: syncope, neurally mediated faints, tilt table test, postural orthostatic intolerance, electrocardiogram, cardiac event monitor
El Síncope representa uno de los principales motivos de consulta en los servicios de urgencias. Su adecuada identificación permitirá además de la optimización de los recursos en la salud, un diagnóstico acertado de la causa o posibles causas del mismo. Teniendo clara su clasificación, será la historia clínica, basada en un adecuado interrogatorio, la que permitirá establecer cuáles de esos pacientes presentan un síncope neuralmente mediado y cuales un síncope de origen cardiaco. El uso de métodos diagnósticos como el tilt test, dará claridad sobre qué tipo de síncope neuralmente mediado predomina en el paciente. El electrocardiograma, será la herramienta clave en la identificación de los pacientes cuya manifestación clínica inicial de síncope, representa un verdadero episodio de muerte súbita autolimitada o abortada, lo cual tiene implicaciones pronósticas y terapéuticas que impactarán en la morbimortalidad de los pacientes.
Importancia y polémica
El síncope se define como la pérdida transitoria y autolimitada de la conciencia, que ocurre como consecuencia de una hipoperfusión cerebral global transitoria, caracterizada por un inicio rápido, corta duración y recuperación completa y espontánea. Es de aparición súbita, de corta duración (usualmente menos de 20 segundos) y al recuperarse no se presenta déficit neurológico [1]. La caída transitoria de la presión arterial sistémica hasta un nivel por debajo del mínimo necesario para sostener el flujo sanguíneo cerebral (límite inferior del rango autoregulatorio cerebral) es la causa más común de síncope. El síncope no representa una enfermedad, es un síntoma complejo y muy difícil de interpretar por el médico debido a que la forma de relatar los episodios por los pacientes es diversa y depende en gran parte del nivel sociocultural. Las causas más comunes de síncope son el sincope neurocardiogénico (mediado neuralmente o antiguamente llamado vasovagal) y los síndromes de intolerancia ortostática, seguidas por el síncope cardíaco bien sea de origen arrítmico o cardiovascular estructural [2].
Los síndromes de intolerancia ortostática se caracterizan por síntomas al asumir la posición de pie, que incluyen la hipotensión postural, el síndrome de taquicardia ortostática postural y aquellos otros que no tienen criterios para estos dos diagnósticos pero que presentan síntomas al asumir la posición de pie. Los pacientes con intolerancia ortostática tienen síntomas incapacitantes con o sin síncope, que para la mayoría son más importantes que el síncope mismo (astenia, adinamia, cefalea, déficit de atención, frialdad, fatiga fácil entre otros) [3].
El sistema nervioso autónomo es el encargado de regular las funciones viscerales del organismo y mantener la homeostasis general. Entre estas funciones están la regulación del inotropismo y el cronotropismo cardíaco, y la reactividad vascular. El ortostatismo es uno de los estímulos más importantes en los cuales participa activamente el sistema nervioso autónomo. El control autonómico cardiovascular asociado a los cambios de posición, requiere la participación de las divisiones antagónicas del sistema nervioso autónomo: el sistema nervioso simpático y el parasimpático. De esta manera, se produce una adecuada interacción entre la frecuencia cardíaca y la presión arterial. Existen procesos fisiopatológicos que pueden afectar la tolerancia y los patrones electrocardiográficos durante el ortostatismo, cuya etiología se relaciona con alteraciones en la función del sistema nervioso autónomo a diferentes niveles: anatómico, celular, neurotransmisión y reflejos, entre otros. La caracterización clínica y fisiopatológica de los síndromes de disfunción autonómica que se asocian a intolerancia ortostática y trastornos de la conducción, permite una adecuada orientación terapéutica de los mismos [4] (Tabla 1).
Tabla 1. Opciones terapéuticas en los síndromes de intolerancia ortostática
El término de pérdida transitoria de la conciencia se define como la pérdida del estado de conciencia y la respuesta apropiada a estímulos externos e implica una pérdida del tono postural en la cual, si el paciente está de pie, se debe caer, si está sentado, se debe doblar y si le sucede acostado o es una arritmia grave o no es un síncope. Las causas más comunes de pérdida transitoria de la conciencia no inducidas por hipoperfusión cerebral global son la epilepsia, la hipoglicemia severa en diabéticos que reciben insulina o hipoglucemiantes orales, el accidente cerebrovascular que involucra la circulación vertebrobasilar (stroke), la intoxicación por monóxido de carbono, la migraña y algunas patologías siquiátricas, como los desórdenes de ansiedad y el pánico, la depresión y la hiperventilación. Ninguna de estas últimas cumple con la definición de síncope y por lo tanto hoy se consideran como causas de pérdida transitoria de la conciencia no sincopales [5],[6].
Es bien sabido que las causas cardíacas de síncope (el síncope cardíaco puede ser arrítmico o cardiovascular estructural) están asociadas con un aumento de la mortalidad (30% a un año y 50% a tres años) y es por esta razón que el acertado reconocimiento electrocardiográfico de las patologías que pongan en riesgo a estos pacientes permitirá intervenirlas de manera precoz y evitar desenlaces fatales, hecho por el cual haremos énfasis importante en las alteraciones electrocardiográficas causantes de síncope y que implican alto riesgo de muerte en el paciente con síncope [7].
La clasificación del síncope dependerá de las enfermedades de base, del mecanismo fisiopatológico o del patrón de respuesta hemodinámico observado durante la prueba de ortostatismo. Es así como se distinguen los tipos que se describen a continuación.
Síncope reflejo o neuralmente mediado
Se refiere a aquellas condiciones en las cuales el mecanismo reflejo de regulación de la circulación falla de forma intermitente. Esto se manifestará como hipotensión y/o bradicardia. Si predomina la hipotensión se llamará vasodepresor y si predomina la bradicardia o la asistolia se llamará cardioinhibitorio. Si ambos mecanismo están presentes se denominará mixto. Según sea el desencadenante, el síncope reflejo podrá ser: vasovagal (mediado por emociones o estrés ortostático), situacional (desencadenado por tos, micción, defecación, risa, deglución, ver sangre o venopunción, etcétera) o síncope por hipersensibilidad del seno carotídeo (desencadenado por estimulación mecánica del seno carotídeo) [8].
Síncope ortostático
Es la pérdida del ajuste compensatorio al cambio de posición, debido a la suspensión del tono simpático. Debe ser diferenciado de la intolerancia ortostática, la cual se define como la presencia de signos y síntomas al estar de pie. Se reconocen dos formas: la falla autonómica primaria, como la presentada en el síndrome de Shy-Drager, la degeneración estriatonigral y olivopontocerebelosa y la enfermedad de Parkinson; y las formas secundarias, como las debidas a diabetes mellitus, abuso de alcohol, enfermedades hepáticas, uso de antihistamínicos, antidepresivos tricíclicos, fenotiazinas, inhibidores de la monoaminooxidasa y Levodopa [9].
Síncope de origen cardiovascular
Puede ser causado por trastornos del ritmo (taquiarritmias, bradiarritmias o canalopatías) o por patologías estructurales. Las arritmias representan la causa más frecuente de síncope cardíaco, donde las más asociadas son: las formas más severas de bloqueo AV (bloqueo AV 2º Mobitz II, bloqueos avanzados y bloqueo AV completo). Las enfermedades del nodo sinusal, representadas por las pausas sinusales y los bloqueos sinoauriculares, son otra causa que se deberá considerar. Las patologías estructurales obstructivas (estenosis aórtica subvalvular, cardiomiopatía hipertrófica obstructiva, embolismo pulmonar, mixoma auricular y enfermedades pericárdicas) y la disección aórtica, la hipertensión pulmonar severa y el robo de subclavia se deberán tener presentes según los hallazgos clínicos y ecocardiográficos [10],[11].
En la Figura 1, se ilustra de manera práctica la clasificación del síncope.
Figura 1. Algoritmo para el enfoque inicial del paciente con síncope.
Se reconocen cuatro tipos de respuesta a la prueba de mesa basculante o prueba de mesa inclinada (tilt test):
Existe otra clasificación realizada en 1992 por el grupo VASIS (Vasovagal Syncope International Study) [12]:
Existen dos condiciones que deben ser reconocidas: una de ellas es el síndrome de taquicardia ortostática postural, definida como: 1) un incremento de la frecuencia cardíaca, de al menos 30 latidos por minuto, en los primeros 10 minutos de asumir la posición de pie, al ser comparada con los valores basales en supino; 2) frecuencia cardíaca mayor de 120 latidos por minuto; 3) presión sanguínea estable; 4) síntomas de intolerancia ortostática. La otra, es la taquicardia sinusal inapropiada, definida como el incremento anormal de la frecuencia cardíaca, el cual se asocia con demandas metabólicas comunes. Se inicia por cambios posturales, ejercicio mínimo y estrés sicológico, y no está asociada con incrementos exagerados de la demanda fisiológica o metabólica [13],[14].
Cuando se asume una posición de pie (erguido) hay un desplazamiento gravitacional de 300 a 800 ml de sangre hacia los pies. Esto causa una disminución del volumen expulsado y de la presión arterial. Normalmente, se desencadenará una respuesta eferente simpática por la estimulación de los baroreceptores localizados en el arco aórtico y el tallo cerebral, lo que produce vasoconstricción y aumento de la frecuencia cardíaca. Sin embargo, las posturas erguidas prolongadas provocan una respuesta contrarregulatoria mediada por fibras del nervio vago (retiro simpático), lo cual produce una disminución del cronotropismo e inotropismo, que resulta en bradicardia, asistolia y/o hipotensión.
Características clínicas
El enfoque diagnóstico del paciente que se presenta con síncope, debe iniciar con una historia clínica completa y detallada. Las siguientes son características clínicas que ayudan en el diagnóstico:
Pruebas de función autonómica
Generalidades
Debido a que el sistema nervioso autónomo está constituido, en su mayoría, por fibras postganglionares que no son mielinizadas, éstas no se pueden evaluar de manera convencional con estudios de conducción y electromiografía. Es así como se requiere la realización de pruebas de función autonómicas indirectas, las cuales cuantifican los reflejos autonómicos en respuestas a estímulos externos.
Para la realización de esas pruebas los pacientes requieren una preparación especial que incluye un ayuno mínimo de cuatro horas y reposo adecuado durante las ocho horas previas al procedimiento. Además, se deben suspender medicamentos, bebidas alcohólicas, xantinas o nicotina 24 horas antes de la realización de las pruebas ya que estos factores pueden alterar las respuestas reflejas que se evalúan.
Para la realización de las pruebas de función autonómica cardiovascular, se necesita un monitoreo continuo no invasivo latido a latido del electrocardiograma (DII) y de la presión arterial, mediante la técnica de servo-pletismografía. En el mercado existen diferentes equipos de monitoreo que integran estas dos funciones y permiten la grabación y el análisis posterior de diferentes señales biológicas [18].
A continuación se describen las pruebas de función autonómica cardiovascular de mayor uso en la práctica clínica, que involucran la evaluación del sistema de conducción del corazón y las características electrocardiográficas presentes en cada una de ellas.
Prueba de mesa basculante
La prueba de mesa basculante se realiza con el fin de identificar las respuestas cardiovasculares durante el estrés ortostático e identificar la presencia de reflejos anormales autonómicamente mediados que llevan a la aparición de síncope recurrente e intolerancia ortostática crónica. La prueba de mesa basculante se realiza en el laboratorio de fisiología autonómica, por medio de una mesa motorizada que puede inclinarse hasta un ángulo de 60º a 70º para efectuar un monitoreo continuo no invasivo de la presión arterial latido a latido, y del electrocardiograma.
La respuesta normal al estrés ortostático se caracteriza por una disminución de la presión arterial con recuperación después del primer minuto de la prueba y un incremento relativo de la frecuencia que permite el mantenimiento de las variables hemodinámicas a largo plazo. En la mayoría de los laboratorios, la prueba de mesa basculante consta de dos fases: una fase inicial pasiva durante los primeros 15 minutos sin medicamentos y una fase activa de 15 minutos con medicamentes inductores de respuesta vasovagal, si el paciente permanece asintomático después de la primera fase. Los medicamentos que se utilizan en la práctica clínica son la nitroglicerina (dosis ajustada de 400 mg) vía sublingual y el isoproterenol vía endovenosa a una tasa de infusión de 1 a 3 mg/min, dependiendo de la edad, presencia de enfermedad cardiovascular y características autonómicas del paciente [19],.
A. Respuesta disautonómica (Figura 2), que se caracteriza por una reducción progresiva en la presión arterial y presión de pulso sin cambios en la frecuencia cardíaca. Esta respuesta es frecuente en adultos mayores de género masculino con falla autonómica pura (un trastorno crónico degenerativo del sistema nervioso autónomo).
B. Taquicardia postural ortostática: se caracteriza por una respuesta exagerada de la frecuencia cardíaca (taquicardia sinusal) al estrés ortostático asociada con síntomas de intolerancia ortostática causada por mala función vascular y estados de hiperactividad simpática. Con frecuencia esta respuesta se da en poblaciones adolescentes y adultos jóvenes.
C. Respuesta vasovagal: la determina la aparición abrupta de hipotensión y bradicardia asociada con pérdida del conocimiento transitorio. Es la respuesta que más se observa en la práctica clínica ya que permite el diagnóstico de síncope neurocardiogénico. La respuesta a la prueba de mesa basculante se considera positiva para síndrome neurocardiogénico, si los síntomas de síncope o presíncope se asemejan al episodio clínico previo y se produce disminución en la presión arterial sistólica mayor de 70 mm Hg con o sin bradicardia menor a 60 latidos por minuto. En la práctica clínica, la respuesta vasovagal se caracteriza de acuerdo con la clasificación de VASIS-2 en [20]:
Figura 2. Patrones de respuesta durante la prueba de mesa basculante.
Figura 3. Respuesta vasovagal mixta durante la prueba de mesa basculante.
Figura 4. Respuesta vasovagal cardioinhibitoria durante la prueba de mesa basculante.
Estudios previos evidencian que la especificidad de la prueba de mesa basculante es del 90%; sin embargo dado que no existe un patrón de oro para comparación, se habla de una capacidad diagnóstica del 75% aproximadamente.
La identificación de los diferentes patrones de respuesta durante la prueba de mesa basculante puede permitir la orientación de las estrategias terapéuticas a utilizar. Las diferentes alternativas terapéuticas para los síndromes de intolerancia ortostática se describen en la tabla 1.
El uso de marcapasos en pacientes con síncope neuralmente mediado recurrente, ha sido materia de discusión durante la última década. Estudios iniciales abiertos como VASIS (The Vasovagal Syncope International Study) y VPS (Vasovagal Pacemaker Study), mostraron una reducción del riesgo en la recurrencia de síncope cercana al 80%. Sin embargo, estos estudios tuvieron limitaciones serias en la metodología que no permitieron la generalización de los resultados. Recientemente, dos estudios multicéntricos aleatorizados controlados en los que comparó marcapasos activo versus inactivo, VPS-II (Second Vasovagal Pacemaker Study) y SYNPACE (The Vasovagal Syncope and Pacing Trial), demostraron una reducción en el riesgo de recurrencia de síncope de aproximadamente el 28% que no fue significativa. Estos hallazgos sugieren que el beneficio del marcapasos en pacientes con síncope neuralmente mediado, es leve y no se debe recomendar como medida terapéutica en el tratamiento. Sin embargo, es posible que haya pacientes con un riesgo más alto de asistolia que pueden beneficiarse en mayor grado [21],[22],[23],[24],[25].
Ortostatismo activo (índice 30:15)
Como se explicó anteriormente, al asumir la bipedestación de manera activa, la gravedad produce una disminución del gasto cardíaco al concentrar en los miembros inferiores la mayoría del volumen sanguíneo. Lo anterior conlleva aumento del tráfico simpático y retirada de la eferencia parasimpática debido a la activación del barorreflejo [26]. Esto se traduce en un aumento inmediato de la frecuencia cardíaca pasados tres segundos después del cambio de posición con incremento posterior a los 12 segundos y disminución de la frecuencia cardíaca de manera refleja a los 20 segundos de adaptación ortostática [27]. Bajo monitoreo continuo no invasivo de presión arterial y electrocardiograma, después de un reposo de 10 minutos se le pide al paciente que asuma la posición erecta de manera rápida. La respuesta de esta prueba se evalúa mediante el cálculo del índice 30:15, que corresponde a la relación entre el intervalo RR más largo (latido 30) y el intervalo RR más corto (latido 15) después de asumir la bipedestación. Una respuesta disminuida en el índice 30:15 (menor a 1,0), indica una alteración en la rama parasimpática del sistema nervioso autónomo que inerva el corazón. No obstante, debido a la fisiología compleja del barorreflejo, no se descarta la participación de la rama simpática del sistema nervioso autónomo [28].
Masaje del seno carotídeo
El masaje del seno carotídeo se usa en la práctica clínica para diagnosticar el síndrome del seno carotídeo, una entidad que no se diagnostica con mucha frecuencia en la práctica diaria pero que en un número importante de adultos mayores es la causa de síncope inexplicado [29].
La fisiopatología del síndrome del seno carotídeo involucra mecanismos periféricos como degeneración local de baroreceptores y alteraciones anatómicas en el cuello, así como alteraciones centrales en los receptores alfa-2 post-sinápticos en la región dorso-medial del núcleo del tracto solitario.
El masaje del seno carotídeo se realiza previa auscultación de las arterias carótidas en el cuello para descartar soplos y otras alteraciones anatómicas. Bajo monitoreo no invasivo de presión arterial y electrocardiograma, con el paciente en posición supina, se presiona con delicadeza el seno carotídeo de cada lado contra el proceso transverso de las vértebras cervicales superiores durante 10 segundos y se correlacionan los cambios en las variables hemodinámicas con la sintomatología que manifiesta el paciente. Morillo y colaboradores demostraron un incremento significativo en la sensibilidad de la prueba, cuando la misma se realiza durante el estrés ortostático a 60° grados de inclinación [30].
El síndrome del seno carotídeo se clasifica de acuerdo con el tipo de respuesta que se obtiene posterior a la compresión del seno carotídeo, así:
Desde el punto de vista terapéutico existen tres alternativas de tratamiento para el control del síndrome del seno carotídeo:
La indicación de un marcapasos definitivo debe basarse en el tipo de respuesta observada durante el masaje; los candidatos ideales son aquellos con respuesta de tipo cardioinhibitorio. Recientemente, nuestro grupo publicó el único meta-análisis existente sobre la eficacia del implante de un marcapasos definitivo para la prevención de la recurrencia del síncope. En este análisis se incluyeron tres estudios observacionales que compararon marcapasos en modo VVI o DDD contra no marcapasos (inactivo). En total se incluyeron 57 pacientes en el grupo marcapasos y 54 pacientes en el grupo control. Se observó una reducción del riesgo relativo del 80% (IC 95% 0,05-0,74; p=0,02).
En conclusión, la opción terapéutica para el tratamiento del síndrome del seno carotídeo de tipo vasodepresor está encaminada a evitar la manipulación directa del seno carotídeo y en algunos casos implica la utilización de medicamentos que contribuyan a disminuir la respuesta vasovagal exagerada. Para casos puramente cardioinhibitorios, la terapia de estimulación cardíaca aporta un mayor beneficio y disminuye la recurrencia de eventos a largo plazo [32].
Prueba de respiración profunda controlada
La frecuencia respiratoria tiene una influencia directa sobre la frecuencia cardíaca debido a la estimulación parasimpática que producen los movimientos de la caja torácica durante cada ciclo respiratorio. La prueba de respiración profunda controlada se realiza con el fin de evaluar la integridad del reflejo cardiovagal. Para la realización de la prueba se le pide al paciente que respire con una frecuencia controlada de seis ciclos por minuto. Mediante el registro continuo de la frecuencia cardíaca (electrocardiograma) se calcula la diferencia entre la frecuencia cardíaca máxima y mínima de cada ciclo respiratorio (Figura 5). Se promedian los resultados en seis ciclos respiratorios y se obtiene el índice de diferencia inspiración-expiración en latidos por minuto, cuyo valor normal debe estar por encima de 15. Una diferencia inspiración-expiración menor a 15, indica compromiso de la modulación vagal tónica. Para la interpretación de esta prueba es importante tener en cuenta variables como edad, género, volúmenes respiratorios y obesidad entre otras [33].
Figura 5. Prueba de respiración profunda controlada.
Maniobra de Valsalva
La maniobra de Valsalva se utiliza para evaluar la integridad de los arcos reflejos arteriales y cardiopulmonares. El incremento de la presión abdominal e intratorácica de manera voluntaria mediante un pujo fuerte contra resistencia durante 15 segundos soplando a través de un tubo conectado a un manómetro de mercurio manteniendo una presión de 40 mm Hg, produce una respuesta cardiovascular que se describe en cuatro fases (Figura 6):
Figura 6. Maniobra de Valsalva.
La respuesta a la prueba se cuantifica por medio del índice de Valsalva que corresponde a la frecuencia cardíaca máxima generada por la maniobra divida por la frecuencia cardíaca mínima después de 30 segundos del pico máximo. Valores menores de 1,2 se consideran anormales y representan una alteración en las vías aferentes y eferentes vagales. De otro lado, el análisis de la recuperación de la presión arterial sistólica durante el incremento de la presión intratorácica, permite evaluar el reflejo vasoconstrictor simpático. Cuando la presión arterial disminuye o no aumenta, se considera una falla simpática vasoconstrictora periférica. El análisis de la relación entre la presión arterial sistólica latido a latido y la frecuencia cardíaca, provee además información importante para medir el barorreflejocardiovagal durante el estímulo [33].
Evaluación farmacológica del sistema nervioso autónomo
La administración de sustancias agonistas y antagonistas permite evaluar la integridad de las vías autonómicas y la sensibilidad de receptores en diferentes órganos blanco. Las curvas de dosis respuesta junto con los bloqueos autonómicos, son las pruebas que se utilizan con más frecuencia en la práctica clínica.
La prueba de sensibilidad beta-adrenérgica evalúa la sensibilidad de los receptores simpáticos cardíacos al estímulo de un agonista beta específico. Bajo monitoreo no invasivo de presión arterial y electrocardiograma y teniendo en cuenta la frecuencia cardíaca basal, se administran dosis de isoproterenol, incrementales en bolo (0,25; 0,5; 1,0; 2,0 y 4,0 mg respectivamente) de manera sucesiva en intervalos de dos minutos hasta que se evidencie un aumento de la frecuencia cardíaca de más de 20 latidos por minuto [34].
Es indispensable que la frecuencia cardíaca retorne a su estado basal antes de proseguir con la siguiente infusión. La prueba se considera positiva si se produce un incremento mayor de 20 latidos por minuto en ritmo sinusal con una dosis menor de 0,5 mg.
El bloqueo completo autonómico cardíaco del nodo sinusal, permite evaluar la frecuencia cardíaca intrínseca del individuo. Mediante la administración de atropina (0,04 mg/kg) durante dos minutos y luego propranolol (0,2 mg/kg) durante tres minutos, se produce un bloqueo de la modulación parasimpática y simpática del nodo sinusal. Se registra la frecuencia cardíaca después de un minuto de bloqueo completo y se compara con la frecuencia cardíaca intrínseca esperada, calculada mediante la fórmula de José (118-0,54 x la edad del paciente). Una respuesta anormal de ± 2 desviaciones estándar (latidos por minuto), evidencia una alteración en el automatismo cardíaco [35].
Prueba de adenosina
El adenosíntrifosfato y su catabolito, la adenosina, son nucléosidos purínicos endógenos que intervienen en múltiples funciones del organismo. A nivel cardiovascular posee acciones sobre el miocardio, el sistema de conducción y la circulación periférica. Sus efectos principales son la inducción de cronotropismo y dromotropismo negativos, así como vasodilatación periférica e inhibición de la síntesis de renina-angiotensina-aldosterona. En la práctica clínica la adenosina se utiliza para la terminación de arritmias supraventriculares originadas por mecanismos de reentrada intranodal. La inducción de bloqueo AV durante taquicardia hace que una de las vías (la rápida o la lenta) se bloquee por completo, se interrumpa la reentrada y finalice la taquicardia. Resulta más controvertida su capacidad para mediar respuestas de hipotensión y bradicardia en pacientes con síncopes mediados neuralmente cuando se utiliza como fármaco inductor en la prueba de mesa basculante [36],[37],[38]. Además, en el laboratorio de fisiología autonómica, la adenosina se puede utilizar para investigar la conducción AV en pacientes con síncope de causa desconocida y con sospecha de bloqueo AV paroxístico. La dosis más utilizada para la valoración del sistema de conducción AV es 18 mg de adenosina endovenosa seguida de 20 ml de dextrosa al 5%, para asegurar la infusión completa de la dosis. Bajo monitoreo continuo electrocardiográfico, se evalúa la respuesta del sistema de conducción 30 segundos después de inyectado el medicamento. El efecto de la adenosina es transitorio debido a que la misma se metaboliza rápidamente (en cuestión de segundos) mediante degradación por termólisis. La respuesta típica a la adenosina consiste en cinco fases que son evaluables mediante el electrocardiograma [39],[40]:
Fase 1: bradicardia sinusal progresiva.
Fase 2: bloqueo AV de primero y segundo grado.
Fase 3: pausa de duración variable debido a bloqueo AV completo o bloqueo SA de tercer grado (esta fase puede no estar presente).
Fase 4: retorno a ritmo sinusal (vía bloqueo AV de primero o segundo grado).
Fase 5: taquicardia sinusal refleja (Figura 7).
Figura 7. Prueba de adenosina.
Los síntomas presentes durante la prueba van desde leve enrojecimiento facial, hasta dolor torácico, presíncope o síncope. La prueba se considera positiva cuando la fase tres es mayor a 10 segundos (considerando posibles escapes ventriculares) y es negativa cuando no existe fase 3 o la misma es menor a 10 segundos.
Desde el punto de vista fisiopatológico, una prueba positiva indica mayor susceptibilidad del sistema de conducción a presentar cambios súbitos en la velocidad de conducción y desarrollar bloqueo AV paroxístico [41]. Sin embargo, existe una constante controversia en cuanto al valor de la adenosina para identificar pacientes candidatos al implante de marcapasos.
Flammang y colaboradores publicaron un estudio aleatorizado en el que se evaluó el beneficio del implante de marcapasos definitivo en 10 pacientes con síncope y prueba de adenosina con pausa mayor a 10 segundos. El seguimiento promedio a 49,3 meses, demostró ausencia de recurrencias en el grupo con marcapasos y 40% de recurrencia en el grupo control (p<0,02) [42],[43]. Sin embargo, no existe evidencia sólida que demuestre el beneficio del uso de marcapasos definitivos en sujetos sensibles a la adenosina. Además, la positividad durante la prueba de adenosina identifica pacientes con mecanismos fisiopatológicos heterogéneos, y aún no del todo claros, que pueden producir síncope.
En resumen
Las pruebas de función autonómica son una herramienta no invasiva que evalúa la actividad del sistema nervioso autónomo y su relación con los cambios en el sistema de conducción del corazón, identificando el nivel de la lesión y el tipo de compromiso de dicho sistema. El monitoreo latido a latido de presión arterial y del electrocardiograma, permite identificar las alteraciones presentes en las diferentes entidades clínicas ayudando al clínico a orientar la estrategia terapéutica.
Según la clasificación del síncope, se pueden observar diferentes manifestaciones electrocardiográficas.
El análisis del electrocardiograma en el paciente que consulta a urgencias por un episodio sincopal debe ser muy cuidadoso ya que en estos casos es cuando se debe prestar mayor atención, dadas las implicaciones clínicas y terapéuticas que esto conlleva [44].
Cuando se piensa que el síncope es de etiología cardíaca, la primera aproximación serán las siguientes preguntas: ¿el paciente tiene una arritmia?, ¿tiene una enfermedad estructural cardíaca o una canalopatía? Es por eso que el electrocardiograma brindará información valiosa sobre el ritmo y la conducción AV. Aunque solo el 5% aproximadamente de los electrocardiogramas identificarán una causa específica de síncope, la presencia de bradicardia sinusal, PR prolongado o bloqueos de rama orientarán a pensar en disfunción sinusal o bloqueo AV intermitente; y la presencia de ondas Q o cambios en el segmento ST orientarán a una causa isquémica. El complejo QRS podrá indicar la presencia de onda delta (Δ) y la posibilidad de una vía accesoria, enfermedades congénitas de los canales iónicos, como el síndrome de Brugada, y la duración del QT con sus respectivos síndromes de QT largo y corto [45].
Bradiarritmias como causa de síncope
Las bradiarritmias resultan de la disfunción en cualquier parte del sistema de conducción. La disfunción sinusal (bradicardia sinusal, pausas y paros sinusales, síndrome de bradicardia taquicardia y bloqueos sinoauriculares) se deberá sospechar como causa de síncope cuando exista una correlación clara entre los síntomas y los cambios en el electrocardiograma, idealmente en los registros de 24 horas o en los dispositivos de monitorización implantables. Sin embargo, la presencia de bradicardia severa (<40 latidos por minuto) o las pausas mayores de 3 segundos, demostradas en el día, se deberán asumir como posibles causas de síncope (Figura 11). Los trastornos de conducción AV, usualmente los relacionados con bloqueos AV de 2º Mobitz II, bloqueos AV de 3º o bloqueos alternantes de rama derecha e izquierda, serán motivo suficiente para considerarlos como la causa del síncope. Otros hallazgos que requieren estudios adicionales, y no se deben asumir como causa de síncope, serán los bloqueos bifasciculares, trastornos de conducción intraventricular con QRS >120 ms o bloqueos AV de 1º o 2º Mobitz I (Figura 12) [45].
Figura 11. Bradicardia sinusal y paro sinusal en Holter 24 horas.
Taquiarritmias como causa de síncope
De todas las taquiarritmias, la fibrilación auricular es probablemente la causa más frecuente de síncope y de presíncopes (episodios cercanos al síncope). Suele ocurrir al inicio de la arritmia, cuando aún los mecanismos compensatorios no han actuado, o al final de la misma, cuando los tiempos de recuperación del nodo sinusal son muy prolongados. El aleteo (flutter) auricular puede tener el mismo comportamiento que la fibrilación auricular, en especial cuando su conducción ventricular es 1:1. Las taquicardias supraventriculares paroxísticas no suelen asociarse con síncope, excepto si se asocian con hipotensión arterial marcada. Dado que son arritmias de pacientes más jóvenes, los mecanismos compensatorios son más efectivos y esto protege contra la aparición del síncope. En pacientes con evidencia de preexitación (WPW), factores adicionales, como la presencia de fibrilación auricular paroxística, causarán no solo hipotensión y síncope, sino alto riesgo de fibrilación ventricular (Figuras 13 y 14) [46]. Las arritmias ventriculares pueden representar hasta el 20% de las causas de síncope y son las arritmias que se observan de manera más frecuente en pacientes con cardiopatía isquémica y dilatada. La sola presencia de complejos ventriculares prematuros o taquicardia ventricular no sostenida, en ausencia de síntomas, hace poco probable su asociación con síncope. Cabe recordar, que la presencia de taquicardia ventricular no sostenida asociada con una fracción de eyección por debajo del 40% aumenta el riesgo de muerte súbita (Figura 15).
Figura 14. Electrocardiograma poscardioversión.
Otras condiciones asociadas con síncope y muerte súbita
Un número importante de patologías, cuyo pronóstico dependerá del acertado diagnóstico electrocardiográfico, pueden tener como primera manifestación el síncope, muchas de ellas con recurrencia posterior, pero esta vez en forma de muerte súbita. Entre ellas están:
Figura 18. Derivaciones precordiales en síndrome de Brugada.
Figura 19. Derivaciones del plano frontal.
Por último, es importante tener presente que una variedad de condiciones estructurales cardíacas, vasculares y pulmonares se asocian con síncope. Esto resulta de una susceptibilidad aumentada a las arritmias, hipotensión asociada o síncope reflejo. Algunas de estas patologías son: infarto agudo de miocardio, estenosis aórtica, mixomas auriculares, disección aórtica aguda, tromboembolismo pulmonar, hipertensión pulmonar primaria, enfermedades pericárdicas, síndromes de robo vascular, marcapasos definitivo disfuncionante y estenosis mitral, entre otras.
Indicaciones para el implante de marcapasos y cardiodesfibriladores en pacientes con síncope
Exceptuando la presencia de bradiarritmias y su asociación clara con síncope, el uso de marcapasos en síncope reflejo (neuralmente mediado) ha sido motivo de discusión y por ende también sus grados de recomendación. Solo el síncope asociado con hipersensibilidad del seno carotídeo, con asistolia mayor de tres segundos (algunos autores exigen que sea mayor de seis segundos) tiene un grado de recomendación I para el implante de marcapasos. Las demás formas de síncope inducidas por tilt test, con respuesta cardioinhibitoria, poseen un grado de recomendación pobre (IIb B).
Con respecto a las indicaciones de implante de cardiodesfibrilador automático implantable (CDI), su uso será apropiado en pacientes con síncope inexplicado y las siguientes patologías de base asociadas:
Guía para la utilización de dispositivos de registro continuo (Implantable Loop Recorder - ILR) en el síncope inexplicado
Clase I
El implante de un ILR se indica en una fase inicial del estudio, en lugar de la realización de estudios completos convencionales en pacientes con síncope recurrente de origen incierto y en ausencia de criterios de alto riesgo que impliquen hospitalización inmediata o evaluación intensiva. Este es el caso en particular de pacientes con síncope recurrente de origen incierto quienes probablemente sufran una recurrencia mientras dure la batería del dispositivo (por ejemplo, tres episodios de síncope en los últimos dos años) (Nivel de evidencia A).
El implante de un ILR se indica en pacientes de alto riesgo en quienes una evaluación comprensiva no demostró una causa de síncope o condujo a un tratamiento específico o en quienes tengan características clínicas o electrocardiográficas que sugieran síncope secundario a una arritmia (Nivel de evidencia B).
Clase IIA
El implante de un ILR es razonable para valorar la contribución de la bradicardia antes de definir el implante de marcapaso en pacientes con sospecha o con síncope neuralmente mediado que manifiesten episodios sincopales frecuentes o traumáticos (Nivel de evidencia B).
Clase IIB
El implante de un ILR puede considerarse en casos seleccionados difíciles de pacientes con pérdida transitoria de la conciencia de origen sincopal incierto con el fin de excluir definitivamente un mecanismo arrítmico (Nivel de evidencia C).
El síncope es un síntoma complejo que requiere una historia clínica muy completa y detallada. El electrocardiograma seguirá siendo una herramienta fundamental en su estudio, pero se debe tener presente que un resultado normal, no excluye una causa arrítmica del síncope. El uso concomitante del ecocardiograma, la resonancia nuclear magnética, el estudio electrofisiológico y las monitorizaciones electrocardiográficas (Holter 24 horas o dispositivos de registro implantables) en aquellos pacientes donde la causa del síncope no es clara, aportarán, de acuerdo con el caso específico, la ayuda necesaria para descartar causas orgánicas específicas de síncope que usualmente implican riesgo de muerte súbita en un segundo episodio, que para el paciente puede ser el último
Puntos claves:
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos intereses del ICMJE traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.

 Tabla 1. Opciones terapéuticas en los síndromes de intolerancia ortostática
Tabla 1. Opciones terapéuticas en los síndromes de intolerancia ortostática

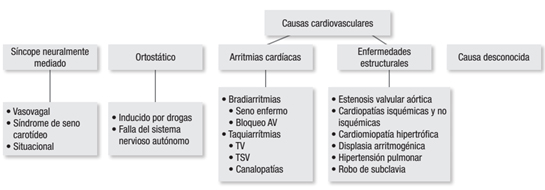 Figura 1. Algoritmo para el enfoque inicial del paciente con síncope.
Figura 1. Algoritmo para el enfoque inicial del paciente con síncope.

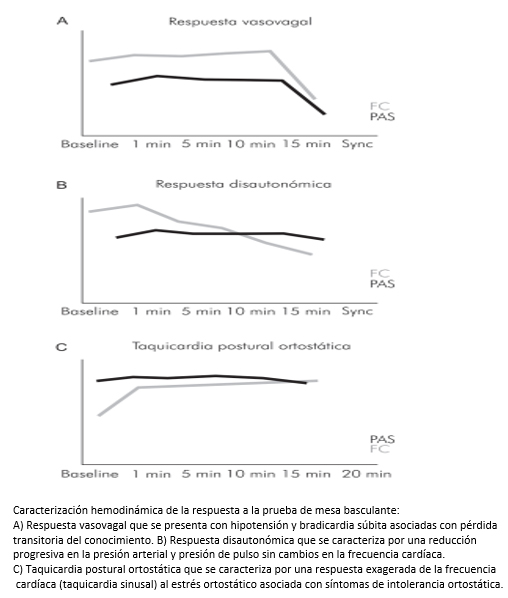 Figura 2. Patrones de respuesta durante la prueba de mesa basculante.
Figura 2. Patrones de respuesta durante la prueba de mesa basculante.

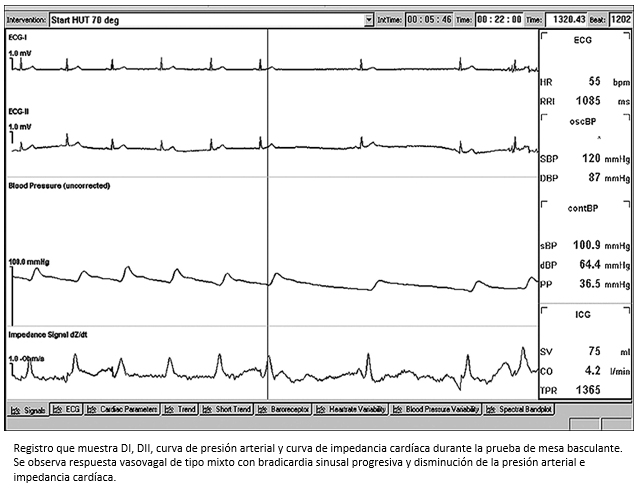 Figura 3. Respuesta vasovagal mixta durante la prueba de mesa basculante.
Figura 3. Respuesta vasovagal mixta durante la prueba de mesa basculante.

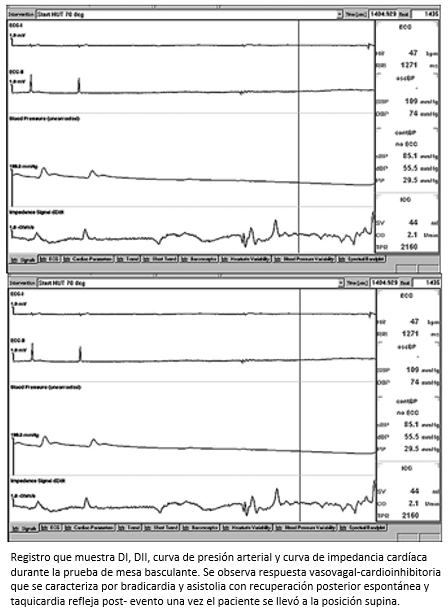 Figura 4. Respuesta vasovagal cardioinhibitoria durante la prueba de mesa basculante.
Figura 4. Respuesta vasovagal cardioinhibitoria durante la prueba de mesa basculante.

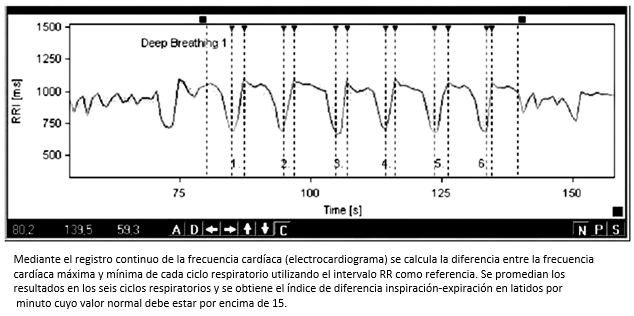 Figura 5. Prueba de respiración profunda controlada.
Figura 5. Prueba de respiración profunda controlada.

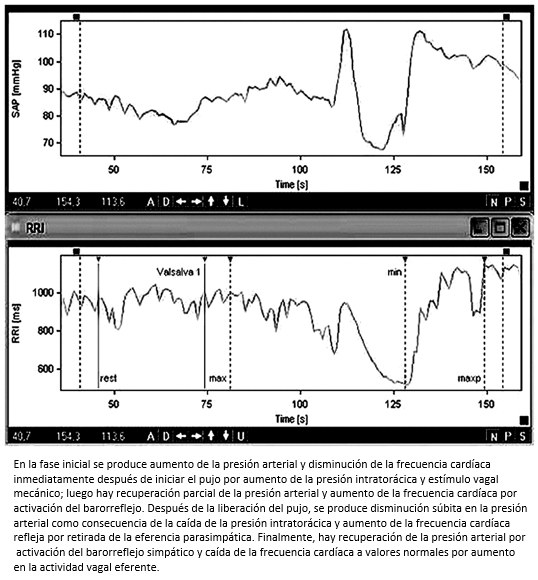 Figura 6. Maniobra de Valsalva.
Figura 6. Maniobra de Valsalva.

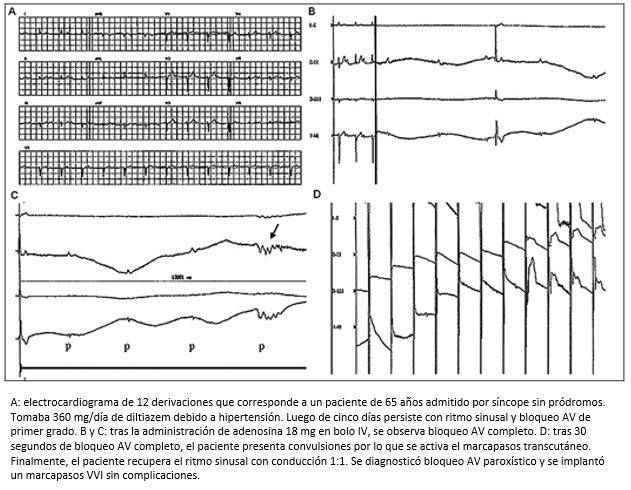 Figura 7. Prueba de adenosina.
Figura 7. Prueba de adenosina.

 Figura 8. Trazo del monitor Task Force utilizado para la realización de tilt test en el servicio de CES Cardiología.
Figura 8. Trazo del monitor Task Force utilizado para la realización de tilt test en el servicio de CES Cardiología.

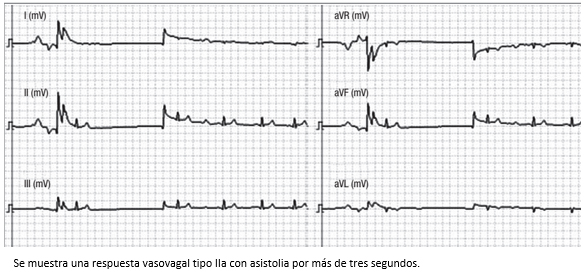 Figura 9. Trazo del monitor Task Force utilizado para la realización de tilt test en el servicio de CES Cardiología.
Figura 9. Trazo del monitor Task Force utilizado para la realización de tilt test en el servicio de CES Cardiología.

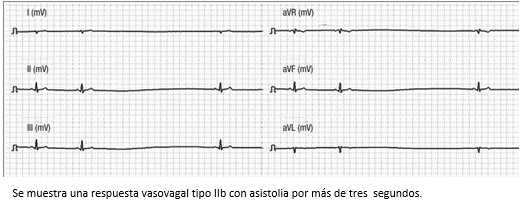 Figura 10. Trazo del monitor Task Force utilizado para la realización de tilt test en el servicio de CES Cardiología.
Figura 10. Trazo del monitor Task Force utilizado para la realización de tilt test en el servicio de CES Cardiología.

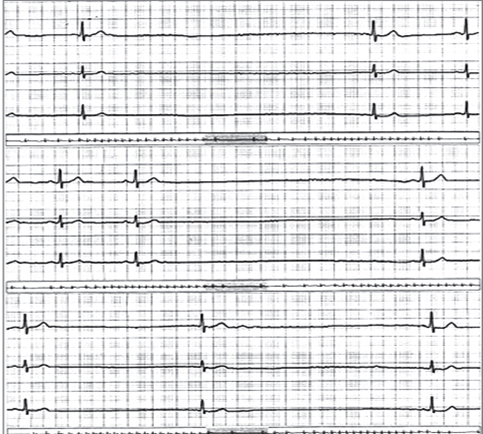 Figura 11. Bradicardia sinusal y paro sinusal en Holter 24 horas.
Figura 11. Bradicardia sinusal y paro sinusal en Holter 24 horas.

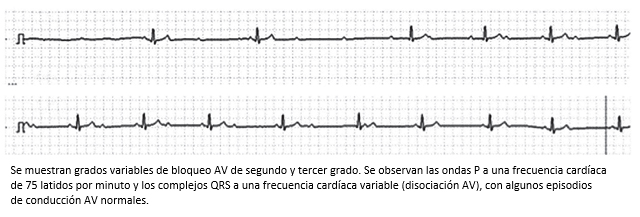 Figura 12. Trazo del monitor TaskForce utilizado para la realización de tilt test en el servicio de CES Cardiología.
Figura 12. Trazo del monitor TaskForce utilizado para la realización de tilt test en el servicio de CES Cardiología.

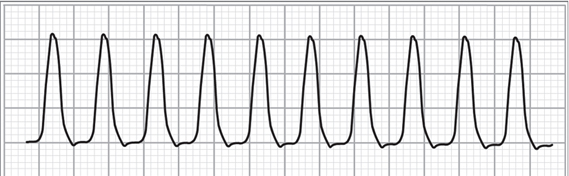 Figura 13. Derivación DII que muestra un trazo de una taquicardia de complejos anchos a una frecuencia cardíaca de 220 latidos por minuto (antes de cardioversión).
Figura 13. Derivación DII que muestra un trazo de una taquicardia de complejos anchos a una frecuencia cardíaca de 220 latidos por minuto (antes de cardioversión).

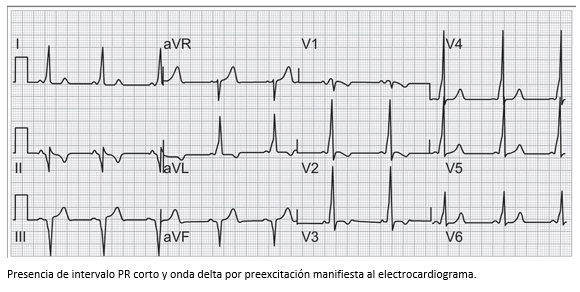 Figura 14. Electrocardiograma poscardioversión.
Figura 14. Electrocardiograma poscardioversión.

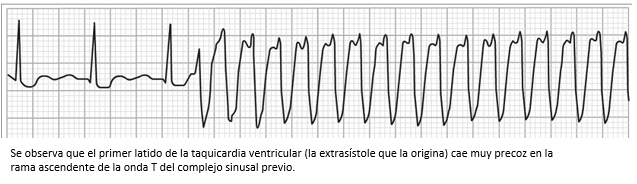 Figura 15. Trazo de electrocardiograma que muestra una taquicardia ventricular en paciente con isquemia miocárdica.
Figura 15. Trazo de electrocardiograma que muestra una taquicardia ventricular en paciente con isquemia miocárdica.

 Figura 16. Derivaciones precordiales que muestran en V1 a V3 la presencia de una onda al final de la despolarización conocida con el nombre de onda épsilon.
Figura 16. Derivaciones precordiales que muestran en V1 a V3 la presencia de una onda al final de la despolarización conocida con el nombre de onda épsilon.

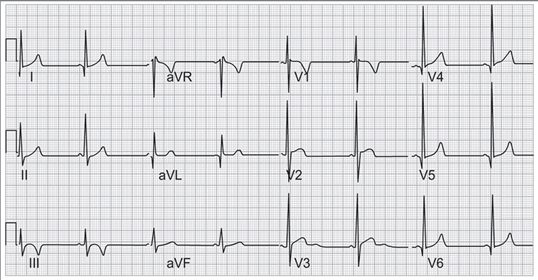 Figura 17. Cardiomiopatía hipertrófica. Aumento del voltaje de la onda R en derivaciones antero laterales.
Figura 17. Cardiomiopatía hipertrófica. Aumento del voltaje de la onda R en derivaciones antero laterales.

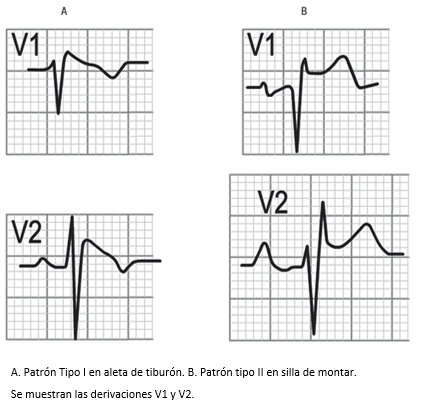 Figura 18. Derivaciones precordiales en síndrome de Brugada.
Figura 18. Derivaciones precordiales en síndrome de Brugada.

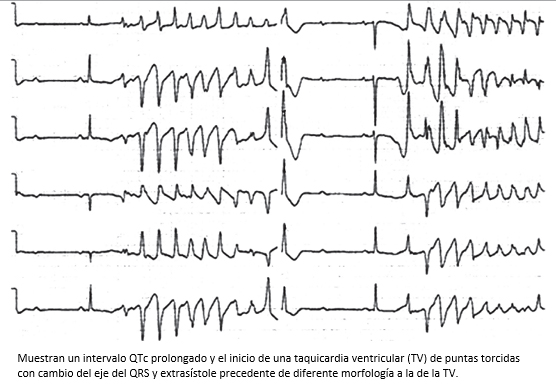 Figura 19. Derivaciones del plano frontal.
Figura 19. Derivaciones del plano frontal.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Syncope represents one of the most frequent reasons for consultation in the emergency department. A proper identification will allow a precise etiologic approach and the optimization of delivery of health resources. Once knowing the classification of syncope; it is the clinical interrogatory what enables to discriminate which of these patients present with a neurogenic mediated syncope or a cardiac mediated syncope. The use of diagnostic methods such as the tilt test, will clarify what type of neurally mediated syncope predominates in the patient. The electrocardiogram is the cornerstone in the identification of those patients who had a true episode of self-limited or aborted sudden death as the first manifestation of their syncope, a fact which provides prognostic and therapeutic information that will impact the morbidity and mortality
 Autores:
William Uribe[1,2,3], Adrián Baranchuk[4], Federico Botero[2]
Autores:
William Uribe[1,2,3], Adrián Baranchuk[4], Federico Botero[2]

Citación: Uribe W, Baranchuk A, Botero F. Syncope: electrocardiogram and autonomic function tests. Medwave 2016;16(Suppl 4):e6816 doi: 10.5867/medwave.2016.6816
Fecha de publicación: 23/12/2016
Origen: Este artículo forma parte del Suplemento 4 Especial de Cardiología cuyo editor invitado es el Dr. Alberto Morales Salinas, Cardiocentro "Ernesto Che Guevara", Villa Clara; Grupo Nacional de Cardiología, Ministerio de Salud Pública, Cuba

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Angaran P, Klein GJ, Yee R, Skanes AC, Gula LJ, Leong-Sit P, Krahn AD. Syncope. Neurol Clin. 2011 Nov;29(4):903-25. | CrossRef | PubMed |
Angaran P, Klein GJ, Yee R, Skanes AC, Gula LJ, Leong-Sit P, Krahn AD. Syncope. Neurol Clin. 2011 Nov;29(4):903-25. | CrossRef | PubMed | Grubb BP. Clinical practice. Neurocardiogenic syncope. N Engl J Med. 2005 Mar 10;352(10):1004-10. | PubMed |
Grubb BP. Clinical practice. Neurocardiogenic syncope. N Engl J Med. 2005 Mar 10;352(10):1004-10. | PubMed | Benditt DG. Cardiovascular Medicine. Syncope. Edinburgh: Churchill Livingstone; 2006:1925-35.
Benditt DG. Cardiovascular Medicine. Syncope. Edinburgh: Churchill Livingstone; 2006:1925-35.  Brignole M, Gianfranchi L, Menozzi C, Raviele A, Oddone D, Lolli G,et al. Role of autonomic reflexes in syncope associated with paroxysmal atrial
fibrillation. J Am Coll Cardiol. 1993 Oct;22(4):1123-9. | PubMed |
Brignole M, Gianfranchi L, Menozzi C, Raviele A, Oddone D, Lolli G,et al. Role of autonomic reflexes in syncope associated with paroxysmal atrial
fibrillation. J Am Coll Cardiol. 1993 Oct;22(4):1123-9. | PubMed | Hoefnagels WA, Padberg GW, Overweg J, van der Velde EA, Roos RA. Transient loss of consciousness: the value of the history for distinguishing seizure from syncope. J Neurol. 1991 Feb;238(1):39-43. | PubMed |
Hoefnagels WA, Padberg GW, Overweg J, van der Velde EA, Roos RA. Transient loss of consciousness: the value of the history for distinguishing seizure from syncope. J Neurol. 1991 Feb;238(1):39-43. | PubMed | Sheldon R, Rose S, Ritchie D, Connolly SJ, Koshman ML, Lee MA, et al. Historical criteria that distinguish syncope from seizures. J Am Coll Cardiol. 2002 Jul 3;40(1):142-8. | PubMed |
Sheldon R, Rose S, Ritchie D, Connolly SJ, Koshman ML, Lee MA, et al. Historical criteria that distinguish syncope from seizures. J Am Coll Cardiol. 2002 Jul 3;40(1):142-8. | PubMed | Kapoor WN, Hanusa BH. Is syncope a risk factor for poor outcomes? Comparison of patients with and without syncope. Am J Med. 1996 Jun;100(6):646-55. | PubMed |
Kapoor WN, Hanusa BH. Is syncope a risk factor for poor outcomes? Comparison of patients with and without syncope. Am J Med. 1996 Jun;100(6):646-55. | PubMed | Jardine DL. Vasovagal syncope: new physiologic insights. Cardiol Clin. 2013 Feb;31(1):75-87. | CrossRef | PubMed |
Jardine DL. Vasovagal syncope: new physiologic insights. Cardiol Clin. 2013 Feb;31(1):75-87. | CrossRef | PubMed | Kaufmann H. Neurally mediated syncope and syncope due to autonomic failure: differences and similarities. J Clin Neurophysiol. 1997 May;14(3):183-96. | PubMed |
Kaufmann H. Neurally mediated syncope and syncope due to autonomic failure: differences and similarities. J Clin Neurophysiol. 1997 May;14(3):183-96. | PubMed | Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G, et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace. 2013 Aug;15(8):1070-118. | CrossRef | PubMed |
Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G, et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace. 2013 Aug;15(8):1070-118. | CrossRef | PubMed | Leitch JW, Klein GJ, Yee R, Leather RA, Kim YH. Syncope associated with supraventricular tachycardia. An expression of tachycardia rate or vasomotor response? Circulation. 1992 Mar;85(3):1064-71. | PubMed |
Leitch JW, Klein GJ, Yee R, Leather RA, Kim YH. Syncope associated with supraventricular tachycardia. An expression of tachycardia rate or vasomotor response? Circulation. 1992 Mar;85(3):1064-71. | PubMed | Brignole M, Menozzi C, Del Rosso A, Costa S, Gaggioli G, Bottoni N, et al. New classification of haemodynamics of vasovagal syncope: beyond the VASIS classification. Analysis of the pre-syncopal phase of the tilt test without and with nitroglycerin challenge. Vasovagal Syncope International Study. Europace. 2000 Jan;2(1):66-76. | PubMed |
Brignole M, Menozzi C, Del Rosso A, Costa S, Gaggioli G, Bottoni N, et al. New classification of haemodynamics of vasovagal syncope: beyond the VASIS classification. Analysis of the pre-syncopal phase of the tilt test without and with nitroglycerin challenge. Vasovagal Syncope International Study. Europace. 2000 Jan;2(1):66-76. | PubMed | Morillo CA, Guzmán JC. [Inappropriate sinus tachycardia: an update]. Rev Esp Cardiol. 2007 Oct;60 Suppl 3:10-4. | PubMed |
Morillo CA, Guzmán JC. [Inappropriate sinus tachycardia: an update]. Rev Esp Cardiol. 2007 Oct;60 Suppl 3:10-4. | PubMed | Sidhu B, Obiechina N, Rattu N, Mitra S. Postural orthostatic tachycardia syndrome (POTS). BMJ Case Rep. 2013 Sep 16;2013. pii: bcr2013201244. | CrossRef | PubMed |
Sidhu B, Obiechina N, Rattu N, Mitra S. Postural orthostatic tachycardia syndrome (POTS). BMJ Case Rep. 2013 Sep 16;2013. pii: bcr2013201244. | CrossRef | PubMed | van Dijk JG, Sheldon R. Is there any point to vasovagal syncope? Clin Auton Res. 2008 Aug;18(4):167-9. | CrossRef | PubMed |
van Dijk JG, Sheldon R. Is there any point to vasovagal syncope? Clin Auton Res. 2008 Aug;18(4):167-9. | CrossRef | PubMed | Mathias CJ, Mallipeddi R, Bleasdale-Barr K. Symptoms associated with orthostatic hypotension in pure autonomic failure and multiple system atrophy. J Neurol. 1999 Oct;246(10):893-8. | PubMed |
Mathias CJ, Mallipeddi R, Bleasdale-Barr K. Symptoms associated with orthostatic hypotension in pure autonomic failure and multiple system atrophy. J Neurol. 1999 Oct;246(10):893-8. | PubMed | Moya A, Sutton R, Ammirati F, Blanc JJ, Brignole M, Dahm JB, et al. Guidelines for the diagnosis and management of syncope (version 2009). Eur Heart J. 2009 Nov;30(21):2631-71. | CrossRef | PubMed |
Moya A, Sutton R, Ammirati F, Blanc JJ, Brignole M, Dahm JB, et al. Guidelines for the diagnosis and management of syncope (version 2009). Eur Heart J. 2009 Nov;30(21):2631-71. | CrossRef | PubMed | Assessment: Clinical autonomic testing report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology. 1996 Mar;46(3):873-80. | PubMed |
Assessment: Clinical autonomic testing report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology. 1996 Mar;46(3):873-80. | PubMed | Brignole M, Alboni P, Benditt DG, Bergfeldt L, Blanc JJ, Bloch Thomsen PE, et al. Guidelines on management (diagnosis and treatment) of syncope--update 2004. Europace. 2004 Nov;6(6):467-537. | PubMed |
Brignole M, Alboni P, Benditt DG, Bergfeldt L, Blanc JJ, Bloch Thomsen PE, et al. Guidelines on management (diagnosis and treatment) of syncope--update 2004. Europace. 2004 Nov;6(6):467-537. | PubMed | Brignole M, Menozzi C, Del Rosso A, Costa S, Gaggioli G, Bottoni N, et al. New classification of haemodynamics of vasovagal syncope: beyond the VASIS classification. Analysis of the pre-syncopal phase of the tilt test without and with nitroglycerin challenge. Vasovagal Syncope International Study. Europace. 2000 Jan;2(1):66-76. | PubMed |
Brignole M, Menozzi C, Del Rosso A, Costa S, Gaggioli G, Bottoni N, et al. New classification of haemodynamics of vasovagal syncope: beyond the VASIS classification. Analysis of the pre-syncopal phase of the tilt test without and with nitroglycerin challenge. Vasovagal Syncope International Study. Europace. 2000 Jan;2(1):66-76. | PubMed | Benditt DG, Petersen M, Lurie KG, Grubb BP, Sutton R. Cardiac pacing for prevention of recurrent vasovagal syncope. Ann Intern Med. 1995 Feb 1;122(3):204-9. | PubMed |
Benditt DG, Petersen M, Lurie KG, Grubb BP, Sutton R. Cardiac pacing for prevention of recurrent vasovagal syncope. Ann Intern Med. 1995 Feb 1;122(3):204-9. | PubMed | Connolly SJ, Sheldon R, Roberts RS, Gent M. The North American Vasovagal Pacemaker Study (VPS). A randomized trial of permanent cardiac pacing for the prevention of vasovagal syncope. J Am Coll Cardiol. 1999 Jan;33(1):16-20. | PubMed |
Connolly SJ, Sheldon R, Roberts RS, Gent M. The North American Vasovagal Pacemaker Study (VPS). A randomized trial of permanent cardiac pacing for the prevention of vasovagal syncope. J Am Coll Cardiol. 1999 Jan;33(1):16-20. | PubMed | Connolly SJ, Sheldon R, Thorpe KE, Roberts RS, Ellenbogen KA, Wilkoff BL, et al. Pacemaker therapy for prevention of syncope in patients with recurrent severe vasovagal syncope: Second Vasovagal Pacemaker Study (VPS II): a randomized trial. JAMA. 2003 May 7;289(17):2224-9. | PubMed |
Connolly SJ, Sheldon R, Thorpe KE, Roberts RS, Ellenbogen KA, Wilkoff BL, et al. Pacemaker therapy for prevention of syncope in patients with recurrent severe vasovagal syncope: Second Vasovagal Pacemaker Study (VPS II): a randomized trial. JAMA. 2003 May 7;289(17):2224-9. | PubMed | Raviele A, Giada F, Menozzi C, Speca G, Orazi S, Gasparini G, et al. A randomized, double-blind, placebo-controlled study of permanent cardiac pacing for the treatment of recurrent tilt-induced vasovagal syncope. The vasovagal syncope and pacing trial (SYNPACE). Eur Heart J. 2004 Oct;25(19):1741-8. | PubMed |
Raviele A, Giada F, Menozzi C, Speca G, Orazi S, Gasparini G, et al. A randomized, double-blind, placebo-controlled study of permanent cardiac pacing for the treatment of recurrent tilt-induced vasovagal syncope. The vasovagal syncope and pacing trial (SYNPACE). Eur Heart J. 2004 Oct;25(19):1741-8. | PubMed | Sutton R, Brignole M, Menozzi C, Raviele A, Alboni P, Giani P, et al. Dual-chamber pacing in the treatment of neurally mediated tilt-positive cardioinhibitory syncope : pacemaker versus no therapy: a multicenter randomized study. The Vasovagal Syncope International Study (VASIS Investigators. Circulation. 2000 Jul 18;102(3):294-9. | PubMed |
Sutton R, Brignole M, Menozzi C, Raviele A, Alboni P, Giani P, et al. Dual-chamber pacing in the treatment of neurally mediated tilt-positive cardioinhibitory syncope : pacemaker versus no therapy: a multicenter randomized study. The Vasovagal Syncope International Study (VASIS Investigators. Circulation. 2000 Jul 18;102(3):294-9. | PubMed | Morillo CA, Klein GJ, Thakur RK, Li H, Zardini M, Yee R. Mechanism of 'inappropriate' sinus tachycardia. Role of sympathovagal balance. Circulation. 1994 Aug;90(2):873-7. | PubMed |
Morillo CA, Klein GJ, Thakur RK, Li H, Zardini M, Yee R. Mechanism of 'inappropriate' sinus tachycardia. Role of sympathovagal balance. Circulation. 1994 Aug;90(2):873-7. | PubMed | Hohnloser S, Klingenheben T. Basic autonomic test. En: Clinical Guide to Cardiac Autonomic Tests. London;1998:52-65.
Hohnloser S, Klingenheben T. Basic autonomic test. En: Clinical Guide to Cardiac Autonomic Tests. London;1998:52-65.  O'Mahony D. Pathophysiology of carotid sinus hypersensitivity in elderly patients. Lancet. 1995 Oct 7;346(8980):950-2. | PubMed |
O'Mahony D. Pathophysiology of carotid sinus hypersensitivity in elderly patients. Lancet. 1995 Oct 7;346(8980):950-2. | PubMed | Kenny RA, Traynor G. Carotid sinus syndrome--clinical characteristics in elderly patients. Age Ageing. 1991 Nov;20(6):449-54. | PubMed |
Kenny RA, Traynor G. Carotid sinus syndrome--clinical characteristics in elderly patients. Age Ageing. 1991 Nov;20(6):449-54. | PubMed | Morillo CA, Camacho ME, Wood MA, Gilligan DM, Ellenbogen KA. Diagnostic utility of mechanical, pharmacological and orthostatic stimulation of the carotid sinus in patients with unexplained syncope. J Am Coll Cardiol. 1999 Nov 1;34(5):1587-94. | PubMed |
Morillo CA, Camacho ME, Wood MA, Gilligan DM, Ellenbogen KA. Diagnostic utility of mechanical, pharmacological and orthostatic stimulation of the carotid sinus in patients with unexplained syncope. J Am Coll Cardiol. 1999 Nov 1;34(5):1587-94. | PubMed | Gregoratos G, Abrams J, Epstein AE, Freedman RA, Hayes DL, Hlatky MA, et al. ACC/AHA/NASPE 2002 guideline update for implantation of cardiac pacemakers and antiarrhythmia devices: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/NASPE Committee to Update the 1998 Pacemaker Guidelines). Circulation. 2002 Oct 15;106(16):2145-61. | PubMed |
Gregoratos G, Abrams J, Epstein AE, Freedman RA, Hayes DL, Hlatky MA, et al. ACC/AHA/NASPE 2002 guideline update for implantation of cardiac pacemakers and antiarrhythmia devices: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/NASPE Committee to Update the 1998 Pacemaker Guidelines). Circulation. 2002 Oct 15;106(16):2145-61. | PubMed | Healey J, Connolly SJ, Morillo CA. The management of patients with carotid sinus syndrome: is pacing the answer? Clin Auton Res. 2004 Oct;14 Suppl 1:80-6. | PubMed |
Healey J, Connolly SJ, Morillo CA. The management of patients with carotid sinus syndrome: is pacing the answer? Clin Auton Res. 2004 Oct;14 Suppl 1:80-6. | PubMed | Low PA. Laboratory evaluation of autonomic function. En: Clinical autonomic disorders: Evaluation and Management; 1997:179-208.
Low PA. Laboratory evaluation of autonomic function. En: Clinical autonomic disorders: Evaluation and Management; 1997:179-208.  Niño J, Villar JC, Tahvanainen KU, Kähönen M, Kuusela TA, Morillo CA. Vasovagal susceptibility to nitrate or isoproterenol head-up tilt. Am J Cardiol. 2001 Dec 1;88(11):1326-30. | PubMed |
Niño J, Villar JC, Tahvanainen KU, Kähönen M, Kuusela TA, Morillo CA. Vasovagal susceptibility to nitrate or isoproterenol head-up tilt. Am J Cardiol. 2001 Dec 1;88(11):1326-30. | PubMed | Jose AD, Collison D. The normal range and determinants of the intrinsic heart rate in man. Cardiovasc Res. 1970 Apr;4(2):160-7. | PubMed |
Jose AD, Collison D. The normal range and determinants of the intrinsic heart rate in man. Cardiovasc Res. 1970 Apr;4(2):160-7. | PubMed | Mittal S, Stein KM, Markowitz SM, Iwai S, Guttigoli A, Lerman BB. Single-stage adenosine tilt testing in patients with unexplained syncope. J Cardiovasc Electrophysiol. 2004 Jun;15(6):637-40. | PubMed |
Mittal S, Stein KM, Markowitz SM, Iwai S, Guttigoli A, Lerman BB. Single-stage adenosine tilt testing in patients with unexplained syncope. J Cardiovasc Electrophysiol. 2004 Jun;15(6):637-40. | PubMed | Mittal S, Stein KM, Markowitz SM, Slotwiner DJ, Rohatgi S, Lerman BB. Induction of neurally mediated syncope with adenosine. Circulation. 1999 Mar 16;99(10):1318-24. | PubMed |
Mittal S, Stein KM, Markowitz SM, Slotwiner DJ, Rohatgi S, Lerman BB. Induction of neurally mediated syncope with adenosine. Circulation. 1999 Mar 16;99(10):1318-24. | PubMed | Brignole M, Donateo P, Menozzi C. The diagnostic value of ATP testing in patients with unexplained syncope. Europace. 2003 Oct;5(4):425-8. | PubMed |
Brignole M, Donateo P, Menozzi C. The diagnostic value of ATP testing in patients with unexplained syncope. Europace. 2003 Oct;5(4):425-8. | PubMed | Brignole M, Gaggioli G, Menozzi C, Del Rosso A, Costa S, Bartoletti A, et al. Clinical features of adenosine sensitive syncope and tilt induced vasovagal syncope. Heart. 2000 Jan;83(1):24-8. | PubMed |
Brignole M, Gaggioli G, Menozzi C, Del Rosso A, Costa S, Bartoletti A, et al. Clinical features of adenosine sensitive syncope and tilt induced vasovagal syncope. Heart. 2000 Jan;83(1):24-8. | PubMed | Donateo P, Brignole M, Menozzi C, Bottoni N, Alboni P, Dinelli M, et al. Mechanism of syncope in patients with positive adenosine triphosphate tests. J Am Coll Cardiol. 2003 Jan 1;41(1):93-8. | PubMed |
Donateo P, Brignole M, Menozzi C, Bottoni N, Alboni P, Dinelli M, et al. Mechanism of syncope in patients with positive adenosine triphosphate tests. J Am Coll Cardiol. 2003 Jan 1;41(1):93-8. | PubMed | Pérez-Paredes M, Picó Aracil F, Sánchez Villanueva JG, Expósito Ordóñez E, Gonzálvez Ortega M, González Caballero E, et al.[Role of adenosine triphosphate (ATP) in head-up tilt-induced syncope]. Rev Esp Cardiol. 1998 Feb;51(2):129-35. | PubMed |
Pérez-Paredes M, Picó Aracil F, Sánchez Villanueva JG, Expósito Ordóñez E, Gonzálvez Ortega M, González Caballero E, et al.[Role of adenosine triphosphate (ATP) in head-up tilt-induced syncope]. Rev Esp Cardiol. 1998 Feb;51(2):129-35. | PubMed | Flammang D, Antiel M, Church T, et al. Is a pacemaker indicated for vasovagal patients with severe cardioinhibitory reflex as identified by the ATP test? A preliminary randomised trial. Europace 1999;1:140-145. | CrossRef |
Flammang D, Antiel M, Church T, et al. Is a pacemaker indicated for vasovagal patients with severe cardioinhibitory reflex as identified by the ATP test? A preliminary randomised trial. Europace 1999;1:140-145. | CrossRef | Flammang D, Erickson M, McCarville S, Church T, Hamani D, Donal E. Contribution of head-up tilt testing and ATP testing in assessing the mechanisms of vasovagal syndrome: preliminary results and potential therapeutic implications. Circulation. 1999 May 11;99(18):2427-33. | PubMed |
Flammang D, Erickson M, McCarville S, Church T, Hamani D, Donal E. Contribution of head-up tilt testing and ATP testing in assessing the mechanisms of vasovagal syndrome: preliminary results and potential therapeutic implications. Circulation. 1999 May 11;99(18):2427-33. | PubMed | Guzmán JC, Baranchuk A. Utilidad del Electrocardiograma en la interpretación de las pruebas de función autonómica.En: Electrocardiografía. Capítulo 22. Colombia: Sociedad Colombiana de Cardiología y Cirugía Cardiovascular;2008:213.
Guzmán JC, Baranchuk A. Utilidad del Electrocardiograma en la interpretación de las pruebas de función autonómica.En: Electrocardiografía. Capítulo 22. Colombia: Sociedad Colombiana de Cardiología y Cirugía Cardiovascular;2008:213.  Botero F, Uribe W. El ECG del síncope neurocardiogénico y del síncope de origen arrítmico. Electrocardiografía Clínica: de lo básico a lo complejo. Bogotá, Colombia: Distribuna; 2014:257-267.
Botero F, Uribe W. El ECG del síncope neurocardiogénico y del síncope de origen arrítmico. Electrocardiografía Clínica: de lo básico a lo complejo. Bogotá, Colombia: Distribuna; 2014:257-267.  Rosner MH, Brady WJ Jr, Kefer MP, Martin ML. Electrocardiography in the patient with the Wolff-Parkinson-White syndrome: diagnostic and initial therapeutic issues. Am J Emerg Med. 1999 Nov;17(7):705-14. | PubMed |
Rosner MH, Brady WJ Jr, Kefer MP, Martin ML. Electrocardiography in the patient with the Wolff-Parkinson-White syndrome: diagnostic and initial therapeutic issues. Am J Emerg Med. 1999 Nov;17(7):705-14. | PubMed | Marcus FI, McKenna WJ, Sherrill D, Basso C, Bauce B, Bluemke DA, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the task force criteria. Circulation. 2010 Apr 6;121(13):1533-41. | CrossRef | PubMed |
Marcus FI, McKenna WJ, Sherrill D, Basso C, Bauce B, Bluemke DA, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the task force criteria. Circulation. 2010 Apr 6;121(13):1533-41. | CrossRef | PubMed | Maron BJ, Maron MS. Hypertrophic cardiomyopathy. Lancet. 2013 Jan 19;381(9862):242-55. | CrossRef | PubMed |
Maron BJ, Maron MS. Hypertrophic cardiomyopathy. Lancet. 2013 Jan 19;381(9862):242-55. | CrossRef | PubMed | Antzelevitch C, Brugada P, Borggrefe M, Brugada J, Brugada R, Corrado D, et al. Brugada syndrome: report of the second consensus conference: endorsed by the Heart Rhythm Society and the European Heart Rhythm Association. Circulation. 2005 Feb 8;111(5):659-70. | PubMed |
Antzelevitch C, Brugada P, Borggrefe M, Brugada J, Brugada R, Corrado D, et al. Brugada syndrome: report of the second consensus conference: endorsed by the Heart Rhythm Society and the European Heart Rhythm Association. Circulation. 2005 Feb 8;111(5):659-70. | PubMed | Jackman WM, Friday KJ, Anderson JL, Aliot EM, Clark M, Lazzara R. The long QT syndromes: a critical review, new clinical observations and a unifying hypothesis. Prog Cardiovasc Dis. 1988 Sep-Oct;31(2):115-72. | PubMed |
Jackman WM, Friday KJ, Anderson JL, Aliot EM, Clark M, Lazzara R. The long QT syndromes: a critical review, new clinical observations and a unifying hypothesis. Prog Cardiovasc Dis. 1988 Sep-Oct;31(2):115-72. | PubMed |