 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: echocardiography, cardiac magnetic resonance imaging, heart failure, coronary computed tomography angiography, coronary artery disease
Se analiza la utilidad de la ecocardiografía y nuevas técnicas de dianóstico cardiológico no invasivo en la valoración de la insuficiencia cardiaca. Se valora la utilidad de la coronariografía no invasiva por tomografía computarizada, así como las crecientes aplicaciones de la resonancia magnética en el estudio de la cardiopatía isquémica, miocardiopatías y displasia arritmogénica del ventrículo derecho. Para este propósito, se utilizan algunos casos clínicos. Se enfatiza la importancia del uso combinado de estas técnicas, especialmente en los pacientes con insuficiencia cardiaca cuya etiología sea la cardiopatía isquémica o alguna miocardiopatía.
La insuficiencia cardiaca es la primera causa de hospitalización en mayores de 65 años, convirtiéndose en la nueva “epidemia del siglo XXI” con una mortalidad que alcanza aproximadamente al 50% de los pacientes un año después del diagnóstico [1],[2]. De esta manera, el pronóstico de la insuficiencia cardiaca es peor que el del cáncer independientemente del género [3].
En la actualidad, la imagenología cardiaca constituye una herramienta indispensable para el diagnóstico etiológico y el manejo de la insuficiencia cardiaca [4],[5]. La ecocardiografía y específicamente el Doppler tisular tienen un papel central en la evaluación de la función sistólica de los pacientes con esta enfermedad. A su vez, la resonancia cardiaca es ampliamente utilizada en la valoración de la insuficiencia cardiaca secundaria a miocardiopatías.
Función ventricular
En pacientes con insuficiencia cardiaca, el uso de la imagenología tiene como objetivo principal el estudio de la función ventricular, a través de la estimación de la fracción de eyección del ventrículo izquierdo, las características de llenado del ventrículo izquierdo, y la función del ventrículo derecho.
La evaluación de la función del ventrículo izquierdo mediante ecocardiografía modo M, es todavía una alternativa por su alta resolución temporal. Sin embargo, es inexacta en pacientes que presentan ventrículos con alteración segmentaria de la contracción y/o geometría no elíptica. En la actualidad, la ecocardiografía bidimensional sigue siendo la herramienta diagnóstica no invasiva principal en la evaluación de pacientes portadores de insuficiencia cardiaca, y es considerada la técnica de evaluación inicial en las actuales guías para el diagnóstico y manejo de esta condición clínica [6].
Si bien, la ecocardiografía bidimensional tiene alta sensibilidad y especificidad para evaluar la función del ventrículo izquierdo, es una técnica operador dependiente y requiere de competencias y experiencia en la obtención de planos ecocardiográficos adecuados, que permitan la estimación de la fracción de eyección con exactitud. Por otra parte, el método de discos apical biplano modificado de Simpson –ampliamente utilizado– requiere la definición precisa del endocardio ventricular, para la obtención de una fracción de eyección correcta (Figura 1). Por lo tanto, cuando las imágenes ecocardiográficas obtenidas no son adecuadas, el uso de contraste ecocardiográfico permite superar este problema. La ecocardiografía bidimensional también permite objetivar la existencia de alteración segmentaria de la contracción del ventrículo izquierdo, hallazgo que puede o no representar patología isquémica, como se discutirá más adelante.
El advenimiento de la ecocardiografía tridimensional –recientemente validada– permite la evaluación de la función global y regional volumétrica del ventrículo izquierdo en tiempo real [7],[8].
Figura 1. Estudio ecocardiográfi
La principal ventaja de la ecocardiografía tridimensional sobre la ecocardiografía modo M y la ecocardiografía bidimensional, es que no requiere un supuesto geométrico para la estimación de la fracción de eyección e incorpora el ápex del ventrículo izquierdo en el análisis, cuestión que por lo general no es posible con ecocardiografía bidimensional. Por lo tanto, la ecocardiografía tridimensional mejora la estimación de los volúmenes y la función del ventrículo izquierdo en pacientes con insuficiencia cardiaca [9].
Un porcentaje significativo de pacientes que desarrollan un síndrome de insuficiencia cardiaca tienen la función sistólica del ventrículo izquierdo normal o casi normal, como ocurre por ejemplo en la cardiopatía hipertensiva e isquémica, miocardiopatía hipertrófica, o en las miocardiopatías restrictivas [10]. Clínicamente, muchas veces no es posible discernir si la insuficiencia cardiaca es consecuencia de disfunción sistólica, diastólica, o la coexistencia de ambas. En este sentido, existen algunos criterios diagnósticos que permiten establecer la existencia de insuficiencia cardiaca diastólica. Estos son: signos y síntomas de insuficiencia cardiaca; FEVI ≥ 50% por ecocardiografía y elementos de disfunción diastólica en el Doppler cardiaco convencional y doppler tisular (Figura 2).
Figura 2. Doppler cardiaco convencional y doppler tisular.
En este escenario, el doppler tisular en combinación con el Doppler cardiaco convencional, permiten objetivar en estos pacientes la disfunción diastólica del ventrículo izquierdo y estimar su severidad [11]
El uso de las velocidades de flujo mitral mediante Doppler espectral pulsado y las velocidades del tejido miocárdico –a nivel del anillo mitral– mediante doppler tisular, permite diferenciar la disfunción diastólica leve (alteración de la relajación) del patrón de seudonormalización y patrón restrictivo, que representan disfunción diastólica más avanzada (Figura 3).
Figura 3. Diagrama que muestra la relación de la presión de fi
En individuos sin patología cardiaca, el Doppler tisular diastólico es una imagen en espejo del flujo diastólico transmural, con una primera onda e’ de mayor amplitud que la segunda onda a’ y con velocidades de la onda e’ > 8,5 cm/s [12]. En la disfunción diastólica del ventrículo izquierdo, existe una disminución de la onda e’ (< 8,5 cm/s), inversión de la relación e’/a’ que se hace < 1 [11].
Otro parámetro útil, es la medición de la relación E/e’ (onda E del flujo transmitral y onda e’ del doppler tisular del anillo mitral), que en individuos sanos y en las etapas iniciales de disfunción diastólica es < 10. Sin embargo, en la disfunción diastólica con patrón seudonormalizado del ventrículo izquierdo (estadio II) la relación se invierte y es > 10 [11] y supera los 15 cuando el patrón de llenado es restrictivo. Algunos autores ha demostrado que la relación E/e’ se correlaciona con la presión de llenado del ventrículo izquierdo [13],[14]. A su vez, una relación E/e’ > 15 es altamente específica de presiones elevadas en la aurícula izquierda, mientras que una relación E/e’ < 8, es altamente sensitiva para presiones normales en la aurícula izquierda [15]. Cabe destacar que la relación E/e’, ha sido validada en pacientes con taquicardia sinusal [16] y en pacientes con fibrilación auricular [17].
Por otra parte, las técnicas de deformación miocárdica, especialmente la deformación miocárdica por speckle tracking, que es ángulo independiente y por lo tanto es superior a la técnica de deformación miocárdica por Doppler, que es ángulo dependiente. No obstante, se requieren imágenes de ecocardiografía bidimensional de muy buena calidad que permitan el correcto delineamiento del endocardio. Los parámetros de deformación miocárdica que se obtienen son el strain (S) y strain rate (SR) (Figura 4). El primero de ellos representa la deformación del miocardio y el segundo la velocidad de la deformación. Ambos parámetros entregan información del estado contráctil del ventrículo izquierdo. El conocimiento de valores de referencia normales con deformación miocárdica por speckle tracking bidimensional [18] y tridimensional [19], han impulsado su uso en la práctica clínica rutinaria.
Figura 4. Speckle tracking bidimensional del ventrículo izquierdo (VI).
Como fue señalado previamente, la ecocardiografía tridimensional es una técnica imagenológica que permite la estimación de los volúmenes del ventrículo izquierdo con mayor certeza (Figura 5) y el strain tridimensional (S3D) (Figura 6), convirtiéndose progresivamente –en la práctica clínica– en el estándar de oro para la evaluación de pacientes con insuficiencia cardiaca [7],[8]. En la Figura 7, se muestra el caso de un paciente con insuficiencia cardiaca severa estudiado con strain tridimensional, antes y después de terapia de resincronización cardiaca.
Figura 5. Ecocardiografía tridimensional.
Figura 6. Strain tridimensional mediante speckle tracking.
Evaluación del ventrículo derecho
La evaluación del ventrículo derecho y la presión de la aurícula derecha [20] es de gran importancia para el manejo de los pacientes con insuficiencia cardiaca descompensada [21],[22].
El estudio del ventrículo derecho es difícil porque se trata de una cámara que posee una geometría compleja y asimétrica con tres regiones: tracto de entrada, tracto de salida y cuerpo o miocardio apical [23]. Lo anterior, impide evaluar la función sistólica del ventrículo derecho cuantitativamente mediante ecocardiografía bidimensional, técnica que utiliza fórmulas basadas en la morfología de un cilindro uniforme. Por lo tanto, la evaluación es habitualmente cualitativa. Sin embargo, existen algunos parámetros que permiten la estimación semicuantitativa de la función del ventrículo derecho, destacando entre estos el TAPSE (que por sus siglas en inglés corresponde a la excursión sistólica del anillo tricuspídeo). La excursión sistólica del anillo tricuspídeo, es una medición realizada con ecocardiografía modo M, que mide la distancia del desplazamiento del anillo tricuspídeo desde el final del diástole al final del sístole (figura 8). Para su obtención, se usa la visión apical de cuatro cámaras de la ecocardiografía bidimensional, afín de colocar el cursor en la zona lateral del anillo tricuspídeo relacionado con la pared libre del ventrículo derecho, lo más vertical posible respecto del ápex (figura 8). El TAPSE (excursión sistólica del anillo tricuspídeo), se correlaciona con la fracción de eyección [24] y se considera un predictor de sobrevida en pacientes con insuficiencia cardiaca avanzada [25],[26]. Cuando la función sistólica del ventrículo derecho es normal, la velocidad del TAPSE es > 16 cm/s [27].
Figura 8. Ecocardiograma bidimensional.
Otros parámetros actualmente usados son: el porcentaje del cambio del área del ventrículo derecho (diástole-sístole) (CAVD) y la técnica de deformación miocárdica mediante speckle tracking (figura 9). En el cambio del área del ventrículo derecho, se traza una línea recta en el plano del anillo tricuspídeo para luego delinear el endocardio del ventrículo derecho al final del diástole (VDD) y del sístole (VDS). Posteriormente, el cambio del área del ventrículo derecho, se calcula de la siguiente manera: VDD-VDS/VDD+100 (Figura 9). Valores > 44% se consideran normales. Sin embargo, no es una técnica recomendable para su uso rutinario en la práctica clínica por los supuestos geométricos que incorpora [27]. Actualmente, el método que permite obtener información más confiable, es la ecocardiografía tridimensional puesto que las mediciones cuantitativas que se obtienen con esta técnica no incorporan conjeturas geométricas [28],[29]. Además, la aparición y el desarrollo de la técnica de deformación miocárdica tridimensional, permite su utilización para la evaluación de la función del ventrículo derecho hoy en día [30] (Figura 9).
Figura 9. Técnica de deformación miocárdica tridimensional.
Sin embargo, la resonancia cardiaca es la técnica diagnóstica que con mayor certeza permite evaluar las características morfológicas y funcionales del ventrículo derecho [31],[32] (Figura 10). Actualmente, es la técnica de elección para calcular los volúmenes diastólicos y sistólicos del ventrículo derecho y evaluar su función. Además, permite identificar la existencia de un infarto de ventrículo derecho como causa de dilatación del ventrículo derecho y es diagnóstica en la displasia arritmogénica del ventrículo derecho.
Figura 10. Resonancia cardiaca, imagen de cuatro cavidades en secuencia de cine.
Estimación de la presión de la aurícula derecha
El cálculo de la presión aurícula derecha es fundamental para estimar la hemodinamia del ventrículo derecho y para cuantificar la presión sistólica de la arteria pulmonar (PSAP). El diámetro de la vena cava inferior y de su colapso inspiratorio, permite estimar los rangos de la presión en la aurícula derecha. La medición debe ser realizada a 1-3 cm de la unión de la vena cava inferior y la aurícula derecha (Figura 11). Un diámetro de vena cava inferior menor a 20 mm con colapso inspiratorio adecuado (>40%) indica una presión de aurícula derecha mayor a 10 mmHg. Un diámetro de vena cava inferior mayor de 20 mm con colapso inspiratorio inadecuado (<40%) indica una presión de aurícula derecha mayor a 10 mmHg. Por último, la presión de la aurícula derecha debe considerarse indeterminada, en pacientes con vena cava inferior menor de 20 mm y colapso inspiratorio inadecuado (<40%) [22]. Esta guía reemplaza al método tradicional que categorizaba la presión de la aurícula derecha en cinco grupos con rangos de 5 mmHg cada uno, según el tamaño de la vena cava inferior y el grado de colapso inspiratorio [33].
Para calcular la presión sistólica del ventrículo derecho, se utiliza la velocidad máxima del reflujo tricuspídeo, que representa el gradiente de presión entre VD-AD (Figura 12). A este valor, se le agrega la presión de la aurícula derecha. La suma indica la presión sistólica de la arteria pulmonar, en ausencia de estenosis pulmonar [34]. Una presión sistólica de la arteria pulmonar mayor de 38 mmHg se considera hipertensión pulmonar [35].
Figura 12. Doppler continuo con curva de refl
Evaluación con ecocardiografía de las causas de insuficiencia cardiaca
La ecocardiografía en sus distintas modalidades, juega un importante rol en la determinación de la etiología de la insuficiencia cardiaca, puesto que permite la evaluación de la estructura y la función cardíaca tal como se analizó previamente. Un ecocardiograma que demuestre un ventrículo izquierdo dilatado con una disminución de su función sistólica global en ausencia de patología valvular significativa, sugiere una miocardiopatía dilatada. Por otra parte, hallazgos similares en presencia de alteración segmentaria de la contracción ventricular sugieren una miocardiopatía isquémica. No obstante, un ventrículo izquierdo dilatado y pobremente contráctil con alteración segmentaria de la contracción ventricular, puede corresponder perfectamente a una miocardiopatía dilatada. De hecho, la ecocardiografía bidimensional y el Doppler convencional no son capaces de diferenciar entre una miocardiopatía dilatada y una miocardiopatía isquémica [36],[37] y como se discutirás más adelante, es necesario en estos casos, la utilización de otros métodos de diagnóstico para su correcta diferenciación.
Sin embargo, un ventrículo izquierdo dilatado e hipocontráctil asociado a insuficiencia mitral o aórtica severa, sugiere como causa una valvulopatía. Y, un paciente con insuficiencia cardiaca con ventrículo izquierdo hipertrófico no dilatado y función sistólica preservada, lo más probable es que sea producto de una la cardiopatía hipertensiva, una miocardiopatía hipertrófica o una miocardiopatía infiltrativa. Sin embargo, no hay que olvidar que la existencia de reflujo valvular leve o moderado, es un hallazgo frecuente en pacientes portadores de miocardiopatía dilatada [38], lo cual podría –ocasionalmente– ser considerado el factor causal de la insuficiencia cardiaca y no viceversa.
En aproximadamente dos tercios de los pacientes pacientes, la insuficiencia cardiaca tiene como causa la cardiopatía coronaria [39],[40]. Por otra parte, para la toma de decisiones clínicas la diferenciación entre insuficiencia cardiaca producto de una miocardiopatía isquémica o no isquémica, tiene importantes implicaciones terapéuticas. Desafortunadamente, el diagnóstico diferencial en muchas ocasiones no es posible realizarlo clínicamente, porque pacientes con insuficiencia cardiaca secundaria a cardiopatía coronaria no presentan angina, mientras pacientes con miocardiopatía dilatada pueden presentarse como un cuadro anginoso [41],[42].
A su vez, algunas técnicas de diagnóstico no-invasivo de amplio uso en la práctica clínica, como la ecocardiografía no permite la diferenciación entre ambas condiciones [36]. Lo anterior estimula la realización de angiografía coronaria, procedimiento invasivo que idealmente debería evitarse [43].
El diagnóstico diferencial es importante, porque el pronóstico de la insuficiencia cardiaca es diferente si la etiología es, o no isquémica [44],[45]. En este sentido, la tomografía computarizada de arterias coronarias tiene un rol esencial para el diagnóstico de la enfermedad coronaria (EC) por su elevado valor predictivo negativo [43],[46], técnica diagnóstica que se incluye actualmente en las guías para el diagnóstico y manejo de la insuficiencia cardiaca [47] -Figura 13-.
Figura 13. Imágenes de tomografía computarizada multicorte con reconstrucción volumétrica.
El alto valor predictivo negativo de la tomografía computarizada de arterias coronarias para la detección de enfermedad coronaria puede ser útil para la diferenciación entre la miocardiopatía isquémica y no isquémica, la distinción de los cuales tiene importantes implicaciones terapéuticas [48].
Viabilidad miocárdica
La detección de miocardio hibernado pero viable, en pacientes con insuficiencia cardiaca secundaria a una CC es fundamental, puesto que representa tejido que muy probablemente se recuperará luego de realizarse revascularización coronaria, mejorando la función ventricular y la capacidad funcional en estos pacientes [49]. En la actualidad, la resonancia cardiaca es el mejor método para determinar zonas de miocardio hibernado que con alta probabilidad se recuperarán luego de una revascularización, mejorando la función regional y global del ventrículo izquierdo [50]. A su vez, la resonancia cardiaca es capaz de predecir el pronóstico de pacientes con insuficiencia cardiaca secundaria a cardiopatía coronaria [51],[52].
Caso clínico
Hombre de 62 años con historia de infarto agudo de miocardio de pared anterior con supradesnivel del segmento ST. Hospitalizado a las cuatro horas de iniciados los síntomas. La coronariografía objetivó oclusión de la arteria descendente anterior en su tercio proximal. Luego de la aspiración de abundante material trombótico, se realizó angioplastía primaria con implantación de dos stents medicados. La ecocardiografía bidimensional, mostró un ventrículo izquierdo dilatado con una extensa área de acinesia anteroseptal y apical y disminución de la función sistólica global (fracción de eyección 40%). Dos meses después, el paciente inicia cuadro de insuficiencia cardiaca. Se solicitó resonancia cardiaca para evaluación morfofuncional del ventrículo izquierdo, que revela la existencia de un infarto transmural extenso en territorio de la arteria coronaria descendente anterior con zonas de obstrucción microvascular persistente, vale decir, territorio no viable (Figuras 14 y 15). Esto, traduce que la revascularización miocárdica realizada, se hizo en un territorio si posibilidades de recuperación y explican el desarrollo de su cuadro de insuficiencia cardiaca.
Figura 14. Imágenes de resonancia cardiaca en visión de cuatro cámaras.
Amiloidosis
La amiloidosis es el prototipo de las miocardiopatías infiltrativas, que causa insuficiencia cardiaca con una elevada mortalidad [53]. La ecocardiografía bidimensional permite sospecharla al pesquisarse algunos de los siguientes signos: ventrículo izquierdo hipertrófico y no dilatado con miocardio ecogénico de aspecto granular inespecífico y difuso (“vidrio esmerilado”), localizado fundamentalmente en el septo interventricular, ventrículo derecho engrosado, dilatación biauricular, derrame pericárdico y/o engrosamiento valvular o del septo interauricular. Pero, la resonancia cardiaca además de entregar información morfológica y funcional, permite la caracterización de los tejidos y en las imágenes posterior a la administración de gadolinio se observa hipercaptación subendocárdica difusa y realce parcheado con aspecto de cebra, patrón característico de la amiloidosis cardiaca con valor pronóstico (ver Figura 16) [54],[55],[56],[57].
Figura 16. Imágenes de resonancia cardiaca en visiones de eje corto.
Caso Clínico
Hombre 56, fumador 15 cigarrillos por día, hospitalizado por edema pulmonar agudo asociado a hipertensión arterial. Hermanos (mujer de 15 años y hombre de 42 años) fallecieron súbitamente. La ecocardiografía bidimensional reveló hipocinesia anteroseptal distal y apical del ventrículo izquierdo con una fracción de eyección 45%. Ventrículo derecho ligeramente dilatado con función sistólica preservada. Coronariografía demostró arterias coronarias sin lesiones de ateromatosas obstructivas. Un holter de ritmo de 24 horas, registró algunos breves episodios autolimitados de taquicardia ventricular. Se planteó el diagnóstico de displasia arritmogénica de ventrículo derecho, solicitándose resonancia cardiaca que la descartó, objetivándose una amiloidosis cardiaca (Figura 21).
Fibrosis endomiocárdica
La fibrosis endomiocárdica es una miocardiopatía restrictiva progresiva de etiología desconocida, que se observa con mayor frecuencia en regiones tropicales y subtropicales [58],[59],[60]. Su característica principal es la formación de trombosis fibrosa en la superficie endocárdica apical del ventrículo izquierdo y/o derecho.
La ecocardiografía bidimensional transtorácica, es útil para la evaluación de aspectos morfológicos como la obliteración del ápex del o los ventrículos afectados y la dilatación de las aurículas. Pero, la resonancia cardiaca es la técnica de elección para la evaluación de pacientes portadores de fibrosis endomiocárdica, porque entrega información morfológica y funcional, así como características tisulares del miocardio [61],[62],[63], permitiendo la pesquisa de fibrosis subendocárdica con buena correlación histopatológica, hallazgo característico de esta enfermedad [63]. Sin embargo, la ecocardiografía bidimensional transtorácica con Doppler color en combinación con ecocardiografía de contraste, puede ser una herramienta diagnóstica de gran valor en pacientes con fibrosis endomiocárdica [64].
Caso Clínico
Mujer de 42 años con insuficiencia cardiaca de 4 meses de evolución, CF III (NYHA). Auscultación cardiaca 3° y 4° ruido. Soplos (-). La ecocardiografía bidimensional, reveló función sistólica de ventrículo izquierdo preservada, obliteración del ápex por masa ecogénica con ausencia de flujo color más allá de la superficie de ésta (Figura 17 A-B) y patrón de llenado de ventrículo izquierdo seudonormal (flujo mitral E/A >1; Doppler tisular e´/a´ <1). Para diferenciar entre trombo y tumor, se realizó ecocardiografía de contraste miocárdico (ECM) que mostró una buena opacificación de la cavidad ventricular izquierda, contraste homogéneo en miocardio y existencia de un trombo obliterando el ápex del ventrículo izquierdo (Figura 17C). La evaluación se complementó con resonancia cardiaca. Las imágenes de cine mostraron engrosamiento apical del ventrículo izquierdo y dilatación de la aurícula izquierda (Figura 18). En las imágenes de eje corto con secuencias de perfusión post gadolinio, se observa opacificación homogénea normal del miocardio con ausencia de contraste al interior del ventrículo izquierdo hacia la región apical producto de material trombótico (flechas amarillas), y en las secuencias de realce tardío, se visualiza el miocardio con señal nula (normal), ausencia de contraste en la cavidad del ventrículo izquierdo por el trombo (flecha amarillas) con hipercaptación que lo rodea y representa fibrosis subendocárdica (flechas verdes) -Figura 19-. La imagen en cuatro cámaras con relace tardío muestra hipercaptación subendocárdica (fibrosis) que rodea el trombo apical con forma similar a la observada en ecocardiografía de contraste miocárdico (Figura 20). Coronariografía descartó enfermedad coronaria. Con el diagnóstico de fibrosis endomiocárdica, la paciente fue operada confirmándose la existencia de material trombótico y tejido fibroso subendocárdico del LV, realizándose endocardiectomía. El estudio histopatológico confirmó el diagnóstico. La paciente, retomó una vida sin restricciones en CF Clase I.
Figura 17. Ecocardiograma bidimensional (A) con Doppler color (B), visión de cuatro cámaras.
Miocardiopatía hipertrófica
La miocardiopatía hipertrófica es la forma más común de enfermedad cardíaca hereditaria, afectando al 0,2% de la población mundial [65],[66]. Aproximadamente el 50% de los pacientes desarrollan algún grado de insuficiencia cardiaca producto de distintos mecanismos fisiopatológicos, que incluyen la obstrucción del tracto de salida del ventrículo izquierdo, disfunción diastólica con función sistólica preservada, o disfunción sistólica global, la que se expresa fundamentalmente por disnea de esfuerzo [67].
La característica anatómica y funcional de la miocardiopatía hipertrófica es la hipertrofia miocárdica, la que es predominantemente asimétrica septal, sin embargo puede ser también concéntrica, estar localizada en la porción medioventricular, o en el ápex del ventrículo izquierdo [68],[69].
La ecocardiografía bidimensional más el Doppler cardiaco, son las técnicas diagnósticas de elección para la evaluación de pacientes con miocardiopatía hipertrófica, especialmente para evaluar el grado y localización de la hipertrofia ventricular, la función sistólica y diastólica del ventrículo izquierdo, la presencia de regurgitación mitral y también para el cálculo del gradiente en el tracto de salida del ventrículo izquierdo, presente en aproximadamente un 20 a 25% de los pacientes [70],[71]. Los pacientes con gradiente subaórtico dinámico ≥30 mm Hg en reposo, tienen mayor riesgo de desarrollar insuficiencia cardiaca [69]. Sin embargo, una minoría de pacientes sin obstrucción u obstrucción <30 mmHg, puede desarrollar insuficiencia cardiaca progresiva como consecuencia de la disfunción diastólica del ventrículo izquierdo [72]. Por ser un método no invasivo y relativamente económico, la ecocardiografía debe ser la técnica diagnóstica de primera línea en la evaluación de pacientes con sospecha de miocardiopatía hipertrófica. Sin embargo, la resonancia cardiaca es un método que permite objetivar con mayor precisión la diversidad fenotípica de la miocardiopatía hipertrófica, especialmente en aquellos casos en los que la ecocardiografía bidimensional no es diagnóstica, porque la hipertrofia puede estar localizada en zonas que escapan a la pesquisa ecocardiográfica. Por ejemplo, cuando la hipertrofia afecta exclusivamente a los segmentos anterolaterales del ventrículo izquierdo [73], o ante la presencia de criptas de miocardio [74]. A su vez, la resonancia cardiaca permite el diagnóstico de fibrosis miocárdica que está presente en aproximadamente 75-80% de los pacientes con miocardiopatía hipertrófica [75], se correlaciona con la histopatología [76],[77] y su extensión se asocia con dilatación progresiva del ventrículo izquierdo, insuficiencia cardiaca y muerte [78],[79]. La fibrosis en la miocardiopatía hipertrófica detectada por resonancia cardiaca en secuencias de realce tardío, se presenta con distintos patrones de distribución (patrón unifocal -Figura 21); patrón bifocal –característico- que afecta a la unión de ambos ventrículos; patrón multifocal (compromete diferentes segmentos del ventrículo izquierdo) -figura 22-; o un patrón difuso con afectación miocárdica extensa [78],[80].
Figura 21. Imágenes de resonancia cardiaca en visiones de eje corto proximales.
Figura 22. Imágenes de resonancia cardiaca en visiones de eje corto distales.
Caso Clínico
Hombre de 45 años es referido para evaluación cardiológica con disnea de esfuerzos y dolor torácico opresivo ocasional. En auscultación cardiaca tenía un soplo sistólico eyectivo paraesternal izquierdo y apical y 4° ruido prominente. Al examen pulmonar escasos estertores en ambos campos pulmonares. Electrocardiograma, onda T invertida en precordiales. La ecocardiografía bidimensional con Doppler reveló una miocardiopatía hipertrófica asimétrica con movimiento sistólico anterior de la válvula mitral, reflujo mitral leve al color (Figura 23) y obstrucción sub-aórtica severa (gradiente máximo 146 mmHg; medio 70 mmHg) y reflujo mitral leve al color (Figura 24). TAC de arterias coronarias mostró árbol coronario normal. La evaluación se complementó con resonancia cardiaca que demostró la existencia de fibrosis miocárdica parcheada con patrón unifocal localizada en el septo anterior y zona de unión del ventrículo izquierdo con ventrículo derecho (Figura 17).
Figura 23. A. Ecocardiograma bidimensional.
Figura 24. Curva de Doppler continuo.
Miocardiopatía dilatada
La miocardiopatía dilatada, es una enfermedad del músculo cardiaco de causa desconocida que afecta al ventrículo izquierdo, ventrículo derecho, o ambos ventrículos [81], y cuya mortalidad supera el 50% a cinco años de seguimiento [2].
La ecocardiografía bidimensional en combinación con el Doppler cardiaco convencional y doppler tisular, son técnicas que permiten la obtención de información relevante, como es la estimación de la severidad de la disfunción sistólica del ventrículo izquierdo y ventrículo derecho, el grado de disfunción diastólica (ver Figura 3), así como el cálculo de la presión sistólica de la arteria pulmonar (ver Figura 12). Sin embargo, estas técnicas diagnósticas no permiten diferenciar si la insuficiencia cardiaca es producto de una miocardiopatía dilatada genuina, o es secundaria a enfermedad coronaria severa [27], [36], cuestión que clínicamente no es posible en un alto porcentaje de los pacientes tal como fue previamente explicado [82],[83].
Actualmente, el diagnóstico diferencial puede ser hecho de manera no-invasiva, mediante la realización de una tomografía computarizada de arterias coronarias [43], evitándose la angiografía coronaria invasiva convencional (ver Figura 13).
El advenimiento de la resonancia cardiaca y su progresivo avance en los últimos años, nos permite contar en la práctica clínica actual con una herramienta diagnóstica no-invasiva robusta, para la evaluación exacta de la función ventricular de ambas cámaras, así como pesquisar la existencia de fibrosis miocárdica, determinando su ubicación y cuantificándola.
El patrón de localización de la fibrosis permite el diagnóstico diferencial entre la miocardiopatía dilatada y la miocardiopatía isquémica [84],[85]. En la miocardiopatía dilatada, el patrón de fibrosis típico lo constituye una banda intramiocárdica con compromiso septal, localizada habitualmente en la zona media de la pared miocárdica o en la región sub-epicárdica, aunque –ocasionalmente– se presenta con un patrón subendocárdico difuso pero sin corresponder a un determinado territorio coronario.
Por otra parte, se ha comunicado –recientemente– que la fibrosis se asocia de manera independiente con muerte cardíaca súbita, lo que sugiere la necesidad de un cardiodesfibrilador implantable (CDI) en estos pacientes, cuestión que implicaría un cambio en el paradigma actual [86],[87],[88],[89].
A su vez, se ha observado que los pacientes con miocardiopatía dilatada con ausencia de fibrosis –en estudio con resonancia cardiaca previo a la terapia de resincronización cardiaca (TRC)– es un predictor independiente de remodelación inversa de ventrículo izquierdo, hecho que es independiente de la situación clínica inicial y del grado de dilatación y disfunción del ventrículo izquierdo [90].
Por lo tanto, parece razonable utilizar la resonancia cardiaca en la evaluación de pacientes con insuficiencia cardiaca en los que se requiere establecer el diagnóstico diferencial con la miocardiopatía isquémica. Luego, una vez establecido el diagnóstico de miocardiopatía dilatada, la resonancia cardiaca nos entrega información que nos permitirá definir la indicación de resincronización cardiaca y cardiodesfibrilador implantable de manera más precisa resonancia cardiaca.
Caso Clínico
Hombre de 37 años, sin pasado cardiovascular, hospitalizado por cuadro de disnea de esfuerzos progresiva CF III-IV (NYHA). Al examen cardiaco se auscultó un ritmo de galope y signos congestivos en ambos campos pulmonares. El electrocardiograma mostraba un bloqueo completo de rama izquierda. Una ecocardiografía bidimensional mostró un ventrículo izquierdo dilatado con severa disminución de la contractilidad y un patrón de llenado del ventrículo izquierdo de tipo restrictivo. Estudio coronariográfico mostró un árbol coronario sin lesiones. Se realizó resonancia cardiaca para estudio de la causa etiológica de la insuficiencia cardiaca que mostró la existencia de una banda de fibrosis miocárdica localizada en la zona media de la pared del miocardio septal (Figura 25). El paciente recibió tratamiento farmacológico más la implantación de un resincronizador con cardiodesfibrilador. Su CF actual es I-II –NYHA-.
Miocardiopatía no compactada de ventrículo izquierdo
La miocardiopatía no compactada de ventrículo izquierdo, es una miocardiopatía primaria de baja prevalencia, genéticamente determinada [91] que fue comunicada por primera vez el año 1984 [92] y de acuerdo a la organización mundial de la salud, es considerada una miocardiopatía inclasificable [93]. Esta miocardiopatía se caracteriza porque las paredes del ventrículo izquierdo están constituida por dos capas, una capa externa delgada con miocardio compacto (MCC) de aspecto uniforme (epicárdica) y una capa interna (endocárdica) más gruesa no-compactada (MCNC) constituida por trabeculaciones prominentes y recesos intertrabeculares [94],[95]. La mayoría de las trabeculaciones se localizan en la región apical y los segmentos medioventriculares de las paredes lateral e inferíor del ventrículo izquierdo [95],[96]. El diagnóstico se puede realizar mediante ecocardiografía bidimensional, siguiendo los criterios de Jenni y col. [94],[95]. Entre estos, se debe verificar la existencia de trabéculas prominentes con una relación entre el grosor de MCNC/MCC >2 (medido en el eje corto del ventrículo izquierdo al final del sístole) -Figura 26- y flujo desde la cavidad ventricular hacia los espacios de los recesos intertrabeculares -mediante Doppler color- [94],[95] -Figura 27-. También, se pueden utilizar los criterios de Chin y col. [97], especialmente para la evaluación de las trabeculaciones apicales, utilizándose la relación de la distancia desde la superfice epicárdica hasta el receso trabecular/superfice epicárdica hasta la cúspide de las trabeculaciones, la que debe ser > 0,5.
Figura 27. A. Ecocardiograma bidimensional visión apical de cuatro cavidades.
Si bien la miocardiopatía no compactada del ventrículo izquierdo puede ser diagnosticada por ecocardiografía bidimensional, aplicándose los criterios previamente señalados, muchas veces no es posible la visualización de la región apical. Por lo tanto, la resonancia cardiaca es el método de diagnóstico de elección para la confirmación diagnóstica [96],[98],[99]. En comparación a la ecocardiografía bidimensional, la resonancia cardiaca es superior porque permite una mejor estimación de la extensión del MCNC, entregando al mismo tiempo información morfológica adicional [99]. En resonancia cardiaca, el criterio diagnóstico para la miocardiopatía no compactada del ventrículo izquierdo es la relación MCNC/MCC >2,3 (con medición realizada al final del diástole) [96]. En secuencias de realce tardío –luego de la administración de gadolinio– se puede observar hipercaptación (fibrosis) a nivel de las trabeculaciones y/o región subendocárdica del ventrículo izquierdo. La presencia de fibrosis está asociada a una mayor severidad de la enfermedad [100],[101].
Caso Clínico
Mujer de 49 años con historia de insuficiencia cardiaca rápidamente progresiva de aproximadamente un año de evolución. En CFIII-IV (NHHA), bajo tratamiento farmacológico intrahospitalario avanzado. Ecocardiograma mostró un ventrículo izquierdo dilatado con disfunción ventricular severa y elementos compatibles con miocardiopatía no compactada del ventrículo izquierdo (Figura 28). Para completar evaluación, se realizó estudio de resonancia cardiaca que confirmó esta patología (Figura 29).
Figura 28. Ecocardiograma bidimensional.
Displasia arritmogénica del ventrículo derecho
La displasia arritmogénica del ventrículo derecho, es una miocardiopatía progresiva con determinación genética que principalmente compromete el ventrículo derecho, pero también puede afectar el ventrículo izquierdo aumentando su severidad [102],[103],[104],[105]. Histopatológicamente se caracteriza por reemplazo graso o fibrograso del tejido miocardio que produce un daño estructural progresivo [104],[106], manifiestado comúnmente por taquicardia ventricular (TV) y muerte súbita [104],[107]. Aunque con menos frecuencia, la primera manifestación de la displasia arritmogénica del ventrículo derecho puede ser la insuficiencia cardíaca [108],[109].
Producto de la complejidad de esta enfermedad, el Grupo de Trabajo para displasia arritmogénica del ventrículo derecho de la Sociedad Europea de Cardiología, propuso criterios diagnósticos electrocardiográficos, arrítmicos, histopatológicos, genéticos y morfofuncionales, internacionalmente aceptados [110]. Para aumentar su sensibilidad diagnóstica, estos criterios fueron recientemente modificados incluyéndose hallazgos obtenidos en resonancia cardiaca [111]. De esta manera, para el diagnóstico de displasia arritmogénica del ventrículo derecho se deben cumplir 2 criterios mayores, 1 criterio mayor y 2 menores o bien 4 criterios menores de categorías diagnósticas diferentes [112]. En la actualidad, la resonancia cardiaca es el método de diagnóstico no-invasivo ideal porque permite evaluar con gran precisión la anatomía, la función y las características del tejido miocárdico de ambos ventrículos [113],[114].
La ecocardiografía bidimensional, es una herramienta de gran utilidad diagnóstica que eventualmente permite objetivar la existencia alteración segmentaria de la contractacion de ventrículo derecho, las que asociadas a dilatación ventricular derecha y/o cambios del área fraccional del ventrículo derecho ≤ 33%, constituyen criterios ecocardiográficos mayores para el diagnóstico de esta afección [111]. Sin embargo, la ecocardiografía tiene limitaciones para la valoración de las alteraciones segmentaria de la contractilidad del ventrículo derecho, incluso en manos experimentadas y más allá de las relacionadas con ventanas ecocardiográficas sub-óptimas [115].
A pesar de que el diagnóstico histológico es definitivo para la displasia arritmogénica del ventrículo derecho [116], la disponibilidad actual de la resonancia cardiaca que permite identificar la infiltración fibroadiposa del miocardio [113],[114],[117], hace innecesario la realización rutinaria de biopsia endo-miocárdica en busca de infiltración fibrograsa, más aún cuando la displasia arritmogénica del ventrículo derecho es una enfermedad segmentaria con escasa afectación del septo –sitio habitual para la obtención de la muestra histológica– y la biopsia es una técnica invasiva no exenta de complicaciones (perforación, taponamiento y perforación) en relación con el adelgazamiento de la pared miocárdica y la mayor dificultad técnica. A su vez, la resonancia cardiaca con gadolinio endovenoso (contraste), permite objetivar la presencia de fibrosis que se manifiesta por hipercaptación en imágenes tardías post-gadolinio. En consecuencia, la resonancia cardiaca debe ser considerada hoy en día, la técnica imagenológica de elección para la valoración diagnóstica de pacientes con sospecha de displasia arritmogénica del ventrículo derecho [104],[113]. En la modificación de los criterios diagnósticos para displasia arritmogénica del ventrículo derecho [111], los siguientes hallazgos en resonancia cardiaca constituyen criterios diagnósticos mayores: áreas de aquinesia, disquinesia o contracción disincrónica de ventrículo derecho, asociadas a dilatación ventricular con volumen final de diástole indexado ≥ 110 ml/m2 en varones y ≥ 100 ml/m2 en mujeres, y/o disfunción de ventrículo derecho (FE ≤ 40%).
Caso Clínico
Hombre de 53 años, sin pasado cardiológico, que ingresó a nuestro hospital por disnea progresiva de dos semanas de evolución, fatigabilidad y edema de extremidades inferiores. En el examen físico se objetivó ortopnea, ingurgitación yugular, pulso de 104 lpm, presión arterial de 100/55 mmHg. En la auscultación cardiaca, se escuchó un tercer ruido cardiaco y a nivel pulmonar estertores en ambos campos. En el electrocardiograma, se observó una taquicardia sinusal. La radiografía de tórax mostró un índice cardiotorácico aumentado y congestión pulmonar y el ecocardiograma un ventrículo izquierdo hipertrófico con función sistólica preservada y un venrrículo derecho con aumento de sus diámetros internos y disminución de su contractilidad. La presión sistólica de la arteria pulmonar se estimó en 30 mmHg. Para complementar el estudio se solicitó una resonancia cardiaca, cuyos hallazgos permitieron establecer el diagnóstico de una displasia arritmogénica del ventrículo derecho. En la Figura 30, las imágenes axiales de cine resonancia muestran un ventrículo derecho marcadamente dilatado con severa disminución de su contractilidad y presencia de zonas de discinesia y microaneurismas localizados en la pared libre del ventrículo derecho, hallazgos que constituyen criterios mayores de resonancia cardiaca para el diagnóstico de esta afección. Al mismo tiempo, se objetivó infiltración grasa subepicárdica en la pared libre del ventrículo derecho que contribuye a reforzar el diagnóstico (Figura 31).
Figura 30. Imágenes axiales de cine resonancia cardiaca en diástole (A) y sístole (B).
A pesar del papel central de la ecocardiografía en la evaluación primaria de la insuficiencia cardiaca, ésta es una condición patológica que requiere con frecuencia del uso de otras técnicas imagenológicas para definir el diagnóstico etiológico, el estado funcional y su manejo clínico en general.
Entre estos, el Doppler tisular tiene un rol central en la evaluación de insuficiencia cardiaca con función sistólica preservada y la resonancia cardiaca un rol primordial en la evaluación de la insuficiencia cardiaca, cuya etiología sea consecuencia de una cardiopatía isquémica o alguna miocardiopatía.
Del editor
Todas las imágenes que se muestran en el artículo proceden del archivo personal del autor, Dr. Rienzi Díaz Navarro, Cardiología Clínica Reñaca, Departamento de Medicina Interna, Universidad de Valparaíso.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos intereses del ICMJE traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.

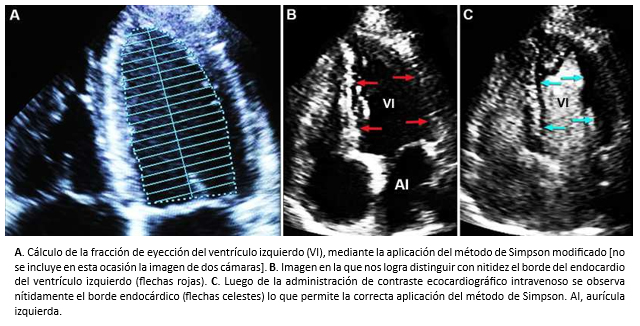 Figura 1. Estudio ecocardiográfi
Figura 1. Estudio ecocardiográfi

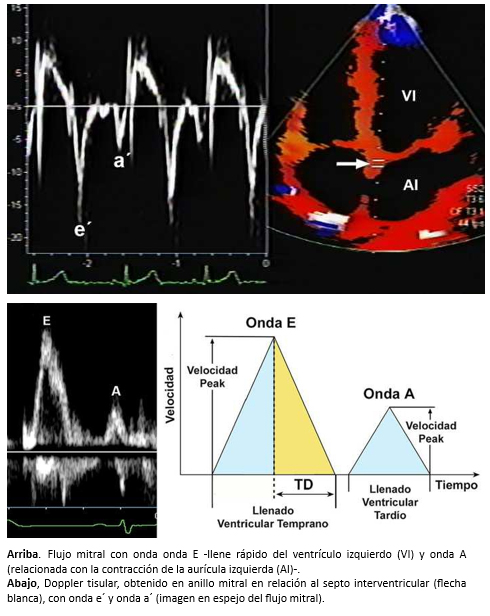 Figura 2. Doppler cardiaco convencional y doppler tisular.
Figura 2. Doppler cardiaco convencional y doppler tisular.

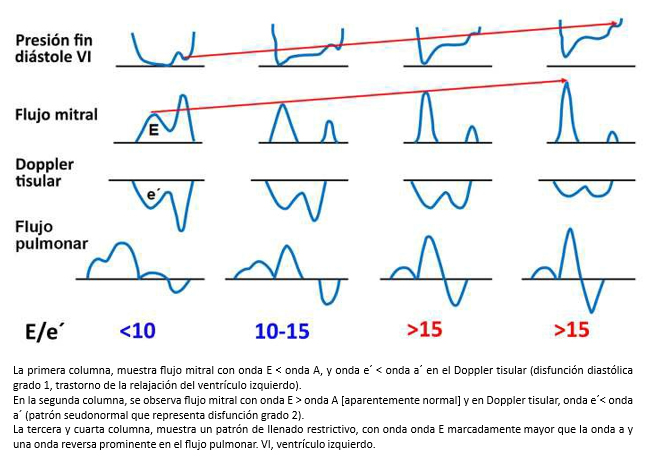 Figura 3. Diagrama que muestra la relación de la presión de fi
Figura 3. Diagrama que muestra la relación de la presión de fi

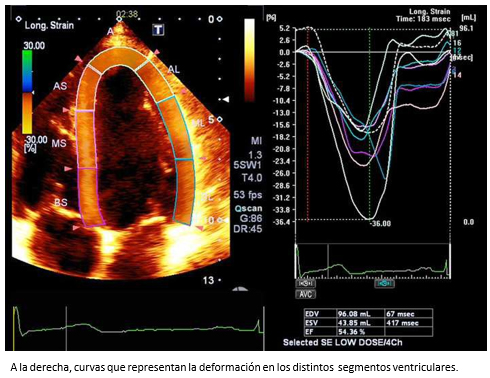 Figura 4. Speckle tracking bidimensional del ventrículo izquierdo (VI).
Figura 4. Speckle tracking bidimensional del ventrículo izquierdo (VI).

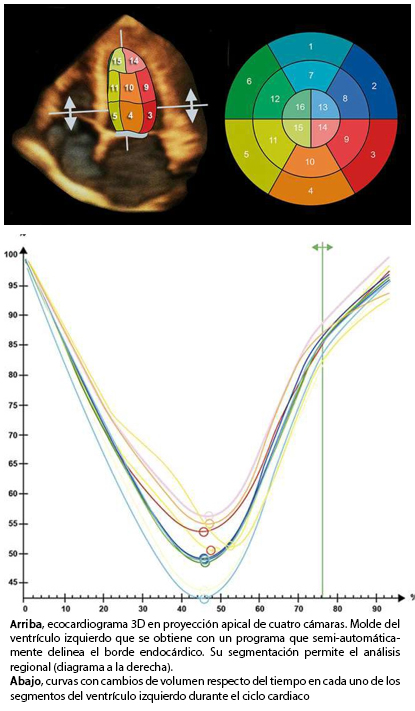 Figura 5. Ecocardiografía tridimensional.
Figura 5. Ecocardiografía tridimensional.

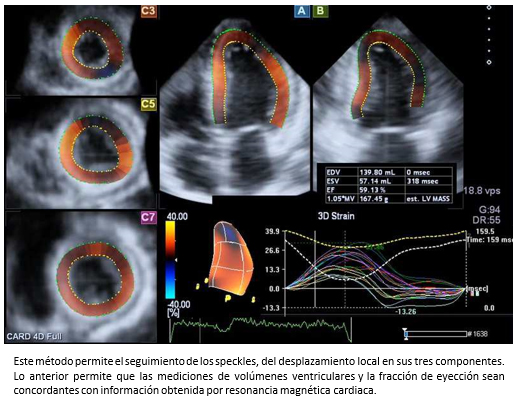 Figura 6. Strain tridimensional mediante speckle tracking.
Figura 6. Strain tridimensional mediante speckle tracking.

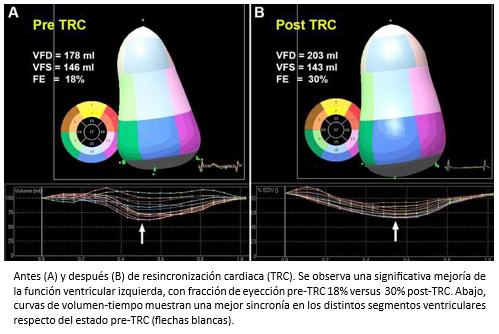 Figura 7. Strain tridimensional mediante speckle tracking en un paciente con insuficiencia cardiaca severa.
Figura 7. Strain tridimensional mediante speckle tracking en un paciente con insuficiencia cardiaca severa.

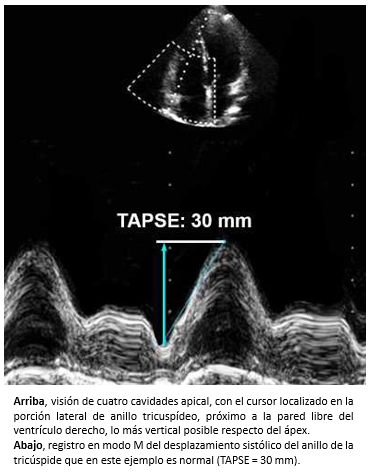 Figura 8. Ecocardiograma bidimensional.
Figura 8. Ecocardiograma bidimensional.

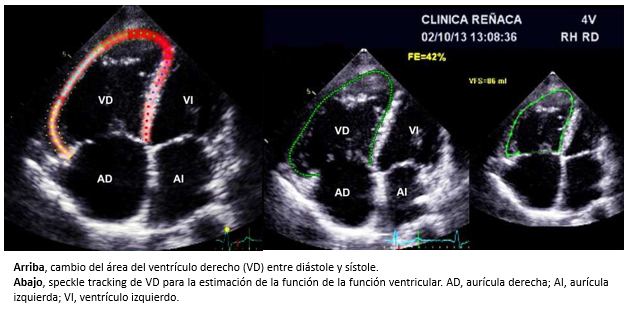 Figura 9. Técnica de deformación miocárdica tridimensional.
Figura 9. Técnica de deformación miocárdica tridimensional.

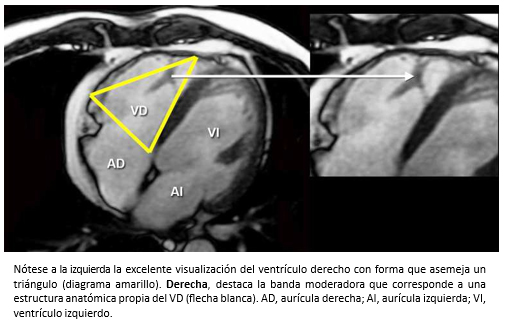 Figura 10. Resonancia cardiaca, imagen de cuatro cavidades en secuencia de cine.
Figura 10. Resonancia cardiaca, imagen de cuatro cavidades en secuencia de cine.

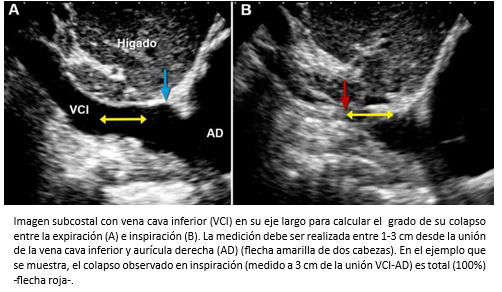 Figura 11. Ecocardiograma.
Figura 11. Ecocardiograma.

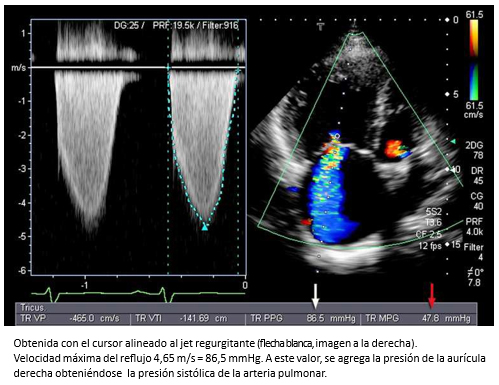 Figura 12. Doppler continuo con curva de refl
Figura 12. Doppler continuo con curva de refl

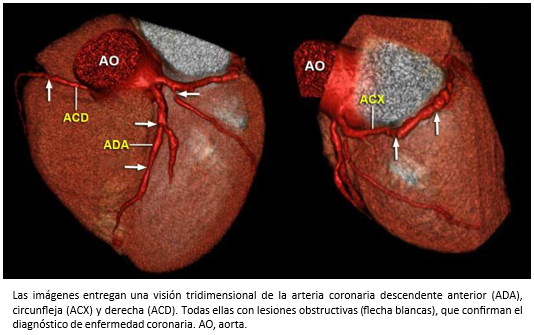 Figura 13. Imágenes de tomografía computarizada multicorte con reconstrucción volumétrica.
Figura 13. Imágenes de tomografía computarizada multicorte con reconstrucción volumétrica.

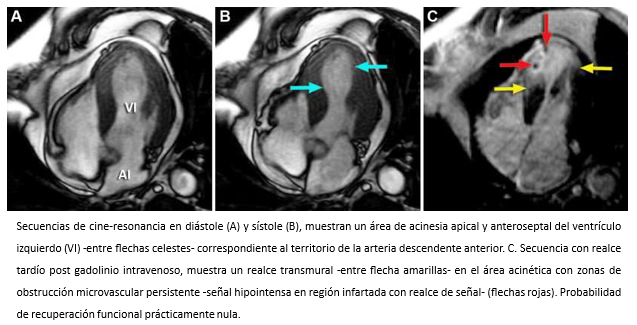 Figura 14. Imágenes de resonancia cardiaca en visión de cuatro cámaras.
Figura 14. Imágenes de resonancia cardiaca en visión de cuatro cámaras.

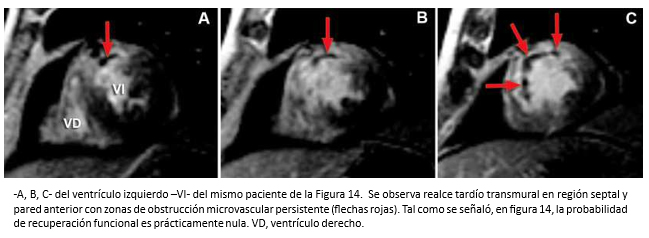 Figura 15. Imágenes de resonancia cardiaca en eje corto con secuencias de realce tardío en tres cortes mediales.
Figura 15. Imágenes de resonancia cardiaca en eje corto con secuencias de realce tardío en tres cortes mediales.

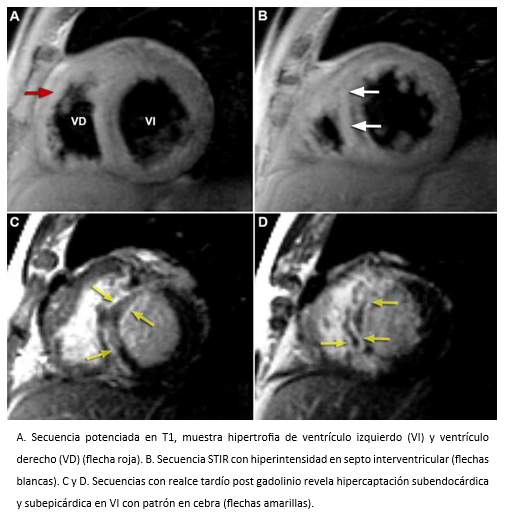 Figura 16. Imágenes de resonancia cardiaca en visiones de eje corto.
Figura 16. Imágenes de resonancia cardiaca en visiones de eje corto.

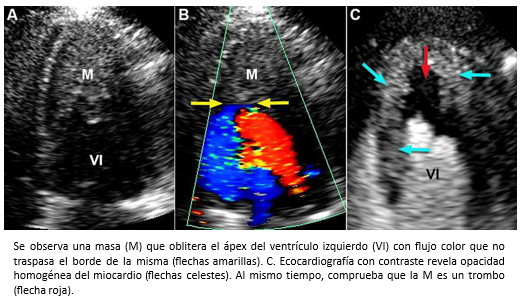 Figura 17. Ecocardiograma bidimensional (A) con Doppler color (B), visión de cuatro cámaras.
Figura 17. Ecocardiograma bidimensional (A) con Doppler color (B), visión de cuatro cámaras.

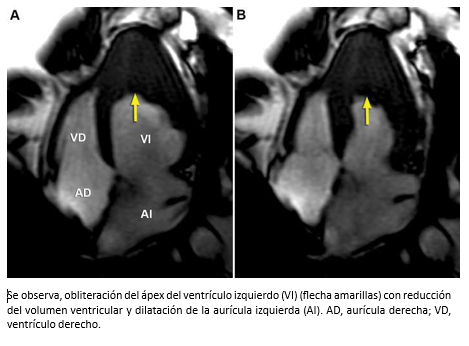 Figura 18. Imágenes de cine resonancia cardiaca en visión de cuatro cámaras en diástole (A) y sístole (B).
Figura 18. Imágenes de cine resonancia cardiaca en visión de cuatro cámaras en diástole (A) y sístole (B).

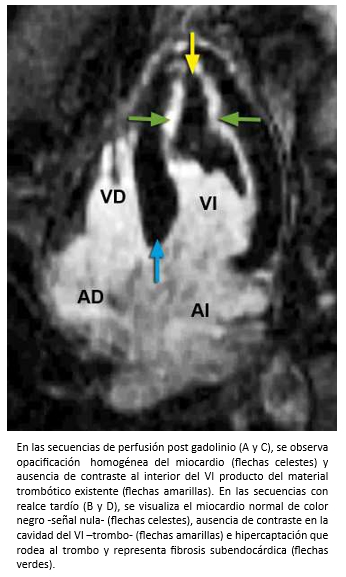 Figura 19. Imágenes de resonancia cardiaca en visiones de eje corto en la región apical del ventrículo izquierdo.
Figura 19. Imágenes de resonancia cardiaca en visiones de eje corto en la región apical del ventrículo izquierdo.

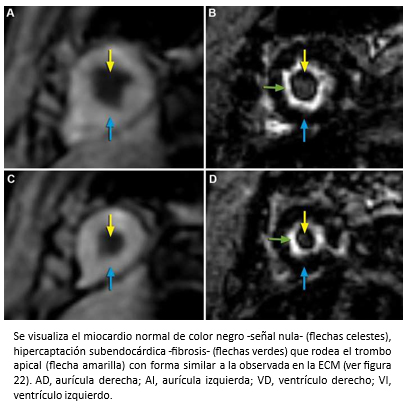 Figura 20. Imagen de resonancia cardiaca, visión de cuatro cámaras, con secuencia de realce tardío post gadolinio.
Figura 20. Imagen de resonancia cardiaca, visión de cuatro cámaras, con secuencia de realce tardío post gadolinio.

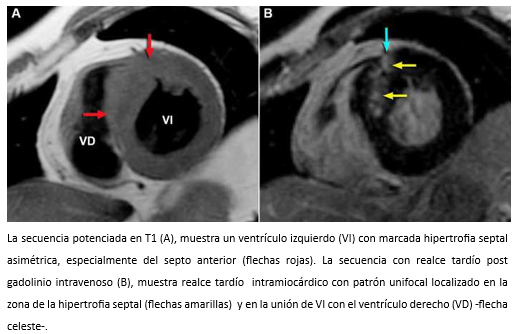 Figura 21. Imágenes de resonancia cardiaca en visiones de eje corto proximales.
Figura 21. Imágenes de resonancia cardiaca en visiones de eje corto proximales.

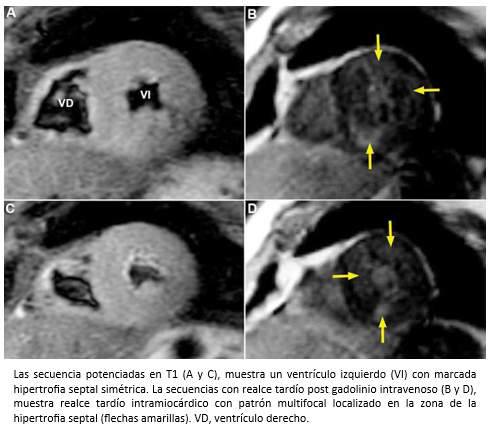 Figura 22. Imágenes de resonancia cardiaca en visiones de eje corto distales.
Figura 22. Imágenes de resonancia cardiaca en visiones de eje corto distales.

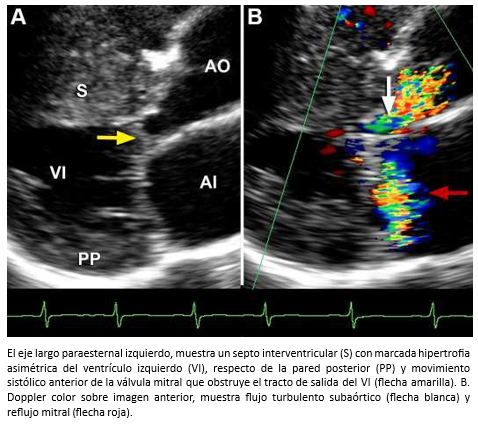 Figura 23. A. Ecocardiograma bidimensional.
Figura 23. A. Ecocardiograma bidimensional.

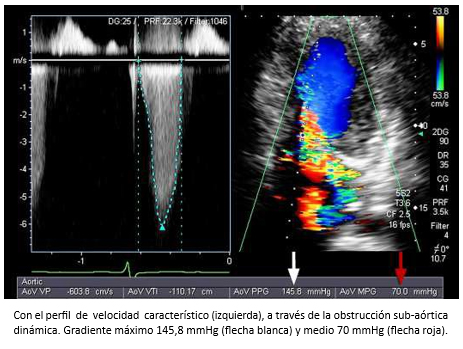 Figura 24. Curva de Doppler continuo.
Figura 24. Curva de Doppler continuo.

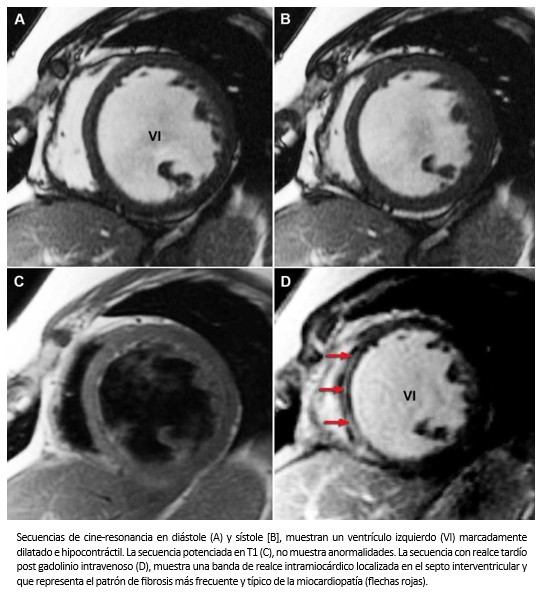 Figura 25. Imágenes de resonancia cardiaca en visiones de eje corto a nivel de los músculos papilares.
Figura 25. Imágenes de resonancia cardiaca en visiones de eje corto a nivel de los músculos papilares.

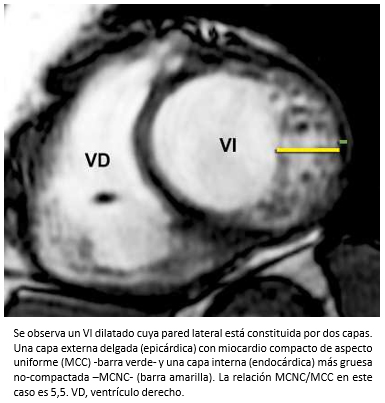 Figura 26. Ecocardiograma bidimensional, eje corto del ventrículo izquierdo (VI) por debajo de los músculos papilares.
Figura 26. Ecocardiograma bidimensional, eje corto del ventrículo izquierdo (VI) por debajo de los músculos papilares.

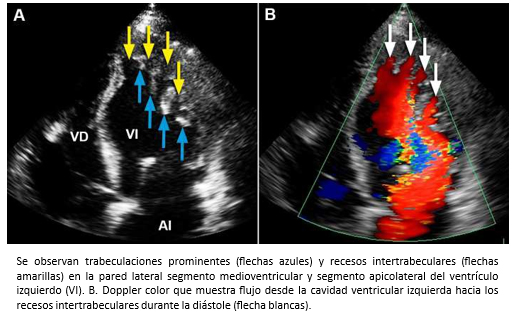 Figura 27. A. Ecocardiograma bidimensional visión apical de cuatro cavidades.
Figura 27. A. Ecocardiograma bidimensional visión apical de cuatro cavidades.

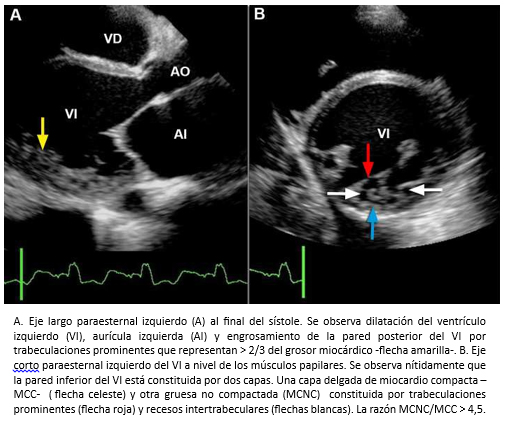 Figura 28. Ecocardiograma bidimensional.
Figura 28. Ecocardiograma bidimensional.

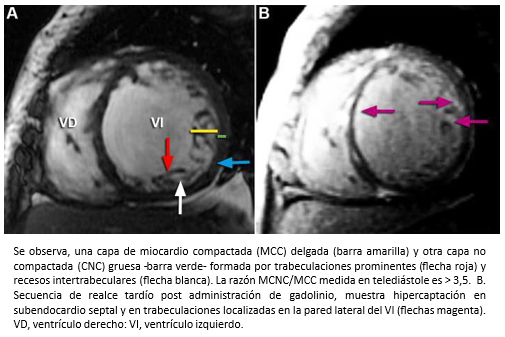 Figura 29. A. Resonancia cardiaca, eje corto, a nivel medio-ventricular por debajo de los músculos papilares.
Figura 29. A. Resonancia cardiaca, eje corto, a nivel medio-ventricular por debajo de los músculos papilares.

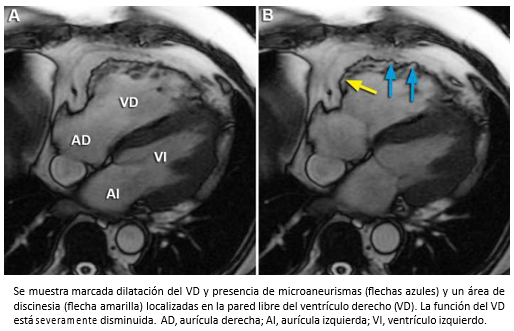 Figura 30. Imágenes axiales de cine resonancia cardiaca en diástole (A) y sístole (B).
Figura 30. Imágenes axiales de cine resonancia cardiaca en diástole (A) y sístole (B).

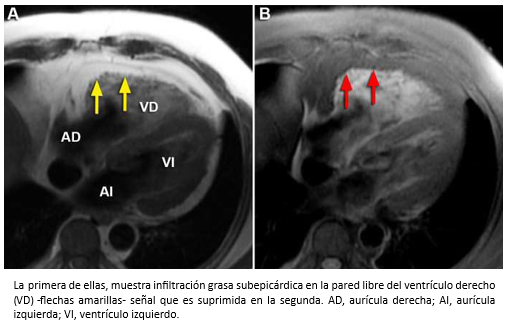 Figura 31. Imágenes axiales de resonancia cardiaca con secuencias potenciadas en T1 (A) y FATSAT (B).
Figura 31. Imágenes axiales de resonancia cardiaca con secuencias potenciadas en T1 (A) y FATSAT (B).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

The usefulness of echocardiography and the new noninvasive cardiac techniques in assessing heart failure is analyzed. The usefulness of non-invasive CT coronary angiography, as well as the growing applications of magnetic resonance imaging (MRI) in the study of ischemic heart disease, cardiomyopathy and arrhythmogenic right ventricular dysplasia is considered. For this puspose, some clinical cases are used. The combined use of these techniques, especially in patients in whom the etiology of heart failure is ischemic heart disease or cardiomyopathy is emphasized.
 Autor:
Rienzi Díaz Navarro[1,2]
Autor:
Rienzi Díaz Navarro[1,2]

Citación: Díaz Navarro R. Heart failure: role of cardiovascular imaging. Medwave 2016;16(Suppl4):e6552 doi: 10.5867/medwave.2016.6552
Fecha de publicación: 11/10/2016
Origen: Este artículo forma parte del Suplemento 4 Especial de Cardiología cuyo editor invitado es el Dr. Alberto Morales Salinas, Cardiocentro "Ernesto Che Guevara", Villa Clara; Grupo Nacional de Cardiología, Ministerio de Salud Pública, Cuba

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Diaz RA, Obasohan A, Oakley CM. Prediction of outcome in dilated cardiomyopathy. Br Heart J. 1987 Oct;58(4):393-9. | PubMed |
Diaz RA, Obasohan A, Oakley CM. Prediction of outcome in dilated cardiomyopathy. Br Heart J. 1987 Oct;58(4):393-9. | PubMed | Stewart S, MacIntyre K, Hole DJ, et al. More malignant’ than cancer? Five-year survival following a first admission for heart failure. Eur J Heart Fail 2001;3:315–22
Stewart S, MacIntyre K, Hole DJ, et al. More malignant’ than cancer? Five-year survival following a first admission for heart failure. Eur J Heart Fail 2001;3:315–22  Marwick TH, Schwaiger M. The future of cardiovascular imaging in the diagnosis and management of heart failure, part 2: clinical applications. Circ Cardiovasc Imaging. 2008 Sep;1(2):162-70. | CrossRef | PubMed |
Marwick TH, Schwaiger M. The future of cardiovascular imaging in the diagnosis and management of heart failure, part 2: clinical applications. Circ Cardiovasc Imaging. 2008 Sep;1(2):162-70. | CrossRef | PubMed | Karamitsos TD, Francis JM, Myerson S, Selvanayagam JB, Neubauer S. The role of cardiovascular magnetic resonance imaging in heart failure. J Am Coll Cardiol. 2009 Oct 6;54(15):1407-24. | CrossRef | PubMed |
Karamitsos TD, Francis JM, Myerson S, Selvanayagam JB, Neubauer S. The role of cardiovascular magnetic resonance imaging in heart failure. J Am Coll Cardiol. 2009 Oct 6;54(15):1407-24. | CrossRef | PubMed | Hunt SA. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol. 2005 Sep 20;46(6):e1-82. | PubMed |
Hunt SA. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol. 2005 Sep 20;46(6):e1-82. | PubMed | Lang RM, Badano LP, Tsang W, Adams DH, Agricola E, Buck T, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. J Am Soc Echocardiogr. 2012 Jan;25(1):3-46. | CrossRef | PubMed |
Lang RM, Badano LP, Tsang W, Adams DH, Agricola E, Buck T, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. J Am Soc Echocardiogr. 2012 Jan;25(1):3-46. | CrossRef | PubMed | Scali MC, Basso M, Gandolfo A, Bombardini T, Bellotti P, Sicari R. Real time 3D echocardiography (RT3D) for assessment of ventricular and vascular function in hypertensive and heart failure patients. Cardiovasc Ultrasound. 2012 Jun 28;10:27. | CrossRef | PubMed |
Scali MC, Basso M, Gandolfo A, Bombardini T, Bellotti P, Sicari R. Real time 3D echocardiography (RT3D) for assessment of ventricular and vascular function in hypertensive and heart failure patients. Cardiovasc Ultrasound. 2012 Jun 28;10:27. | CrossRef | PubMed | Mor-Avi V, Jenkins C, Kühl HP, Nesser HJ, Marwick T, Franke A, et al. Real-time 3-dimensional echocardiographic quantification of left ventricular volumes: multicenter study for validation with magnetic resonance imaging and investigation of sources of error. JACC Cardiovasc Imaging. 2008 Jul;1(4):413-23. | CrossRef | PubMed |
Mor-Avi V, Jenkins C, Kühl HP, Nesser HJ, Marwick T, Franke A, et al. Real-time 3-dimensional echocardiographic quantification of left ventricular volumes: multicenter study for validation with magnetic resonance imaging and investigation of sources of error. JACC Cardiovasc Imaging. 2008 Jul;1(4):413-23. | CrossRef | PubMed | García J. [Diagnosis and therapeutic guidance of diastolic heart failure]. Rev Esp Cardiol. 2003 Apr;56(4):396-406. | PubMed |
García J. [Diagnosis and therapeutic guidance of diastolic heart failure]. Rev Esp Cardiol. 2003 Apr;56(4):396-406. | PubMed | Khouri SJ, Maly GT, Suh DD, Walsh TE. A practical approach to the echocardiographic evaluation of diastolic function. J Am Soc Echocardiogr. 2004 Mar;17(3):290-7. | PubMed |
Khouri SJ, Maly GT, Suh DD, Walsh TE. A practical approach to the echocardiographic evaluation of diastolic function. J Am Soc Echocardiogr. 2004 Mar;17(3):290-7. | PubMed | Garcia MJ, Thomas JD, Klein AL. New Doppler echocardiographic applications for the study of diastolic function. J Am Coll Cardiol. 1998 Oct;32(4):865-75. | PubMed |
Garcia MJ, Thomas JD, Klein AL. New Doppler echocardiographic applications for the study of diastolic function. J Am Coll Cardiol. 1998 Oct;32(4):865-75. | PubMed | Nagueh SF, Middleton KJ, Kopelen HA, Zoghbi WA, Quiñones MA. Doppler tissue imaging: a noninvasive technique for evaluation of left ventricular relaxation and estimation of filling pressures. J Am Coll Cardiol. 1997 Nov 15;30(6):1527-33. | PubMed |
Nagueh SF, Middleton KJ, Kopelen HA, Zoghbi WA, Quiñones MA. Doppler tissue imaging: a noninvasive technique for evaluation of left ventricular relaxation and estimation of filling pressures. J Am Coll Cardiol. 1997 Nov 15;30(6):1527-33. | PubMed | Ommen SR, Nishimura RA, Appleton CP, Miller FA, Oh JK, Redfield MM, et al. Clinical utility of Doppler echocardiography and tissue Doppler imaging in the estimation of left ventricular filling pressures: A comparative simultaneous Doppler-catheterization study. Circulation. 2000 Oct 10;102(15):1788-94. | PubMed |
Ommen SR, Nishimura RA, Appleton CP, Miller FA, Oh JK, Redfield MM, et al. Clinical utility of Doppler echocardiography and tissue Doppler imaging in the estimation of left ventricular filling pressures: A comparative simultaneous Doppler-catheterization study. Circulation. 2000 Oct 10;102(15):1788-94. | PubMed | Garcia MJ, Ares MA, Asher C, Rodriguez L, Vandervoort P, Thomas JD. An index of early left ventricular filling that combined with pulsed Doppler peak E velocity may estimate capillary wedge pressure. J Am Coll Cardiol. 1997 Feb;29(2):448-54. | PubMed |
Garcia MJ, Ares MA, Asher C, Rodriguez L, Vandervoort P, Thomas JD. An index of early left ventricular filling that combined with pulsed Doppler peak E velocity may estimate capillary wedge pressure. J Am Coll Cardiol. 1997 Feb;29(2):448-54. | PubMed | Nagueh SF, Mikati I, Kopelen HA, Middleton KJ, Quiñones MA, Zoghbi WA. Doppler estimation of left ventricular filling pressure in sinus tachycardia. A new application of tissue doppler imaging. Circulation. 1998 Oct 20;98(16):1644-50. | PubMed |
Nagueh SF, Mikati I, Kopelen HA, Middleton KJ, Quiñones MA, Zoghbi WA. Doppler estimation of left ventricular filling pressure in sinus tachycardia. A new application of tissue doppler imaging. Circulation. 1998 Oct 20;98(16):1644-50. | PubMed | Nagueh SF, Kopelen HA, Quiñones MA. Assessment of left ventricular filling pressures by Doppler in the presence of atrial fibrillation. Circulation. 1996 Nov 1;94(9):2138-45. | PubMed |
Nagueh SF, Kopelen HA, Quiñones MA. Assessment of left ventricular filling pressures by Doppler in the presence of atrial fibrillation. Circulation. 1996 Nov 1;94(9):2138-45. | PubMed | Kocabay G, Muraru D, Peluso D, Cucchini U, Mihaila S, Padayattil-Jose S, et al. Normal left ventricular mechanics by two-dimensional speckle-tracking echocardiography. Reference values in healthy adults. Rev Esp Cardiol (Engl Ed). 2014 Aug;67(8):651-8. | CrossRef | PubMed |
Kocabay G, Muraru D, Peluso D, Cucchini U, Mihaila S, Padayattil-Jose S, et al. Normal left ventricular mechanics by two-dimensional speckle-tracking echocardiography. Reference values in healthy adults. Rev Esp Cardiol (Engl Ed). 2014 Aug;67(8):651-8. | CrossRef | PubMed | Muraru D, Cucchini U, Mihăilă S, Miglioranza MH, Aruta P, Cavalli G, et al. Left ventricular myocardial strain by three-dimensional speckle-tracking echocardiography in healthy subjects: reference values and analysis of their physiologic and technical determinants. J Am Soc Echocardiogr. 2014 Aug;27(8):858-871.e1. | CrossRef | PubMed |
Muraru D, Cucchini U, Mihăilă S, Miglioranza MH, Aruta P, Cavalli G, et al. Left ventricular myocardial strain by three-dimensional speckle-tracking echocardiography in healthy subjects: reference values and analysis of their physiologic and technical determinants. J Am Soc Echocardiogr. 2014 Aug;27(8):858-871.e1. | CrossRef | PubMed | Patel AR, Alsheikh-Ali AA, Mukherjee J, Evangelista A, Quraini D, Ordway LJ, et al. 3D echocardiography to evaluate right atrial pressure in acutely decompensated heart failure correlation with invasive hemodynamics. JACC Cardiovasc Imaging. 2011 Sep;4(9):938-45. | CrossRef | PubMed |
Patel AR, Alsheikh-Ali AA, Mukherjee J, Evangelista A, Quraini D, Ordway LJ, et al. 3D echocardiography to evaluate right atrial pressure in acutely decompensated heart failure correlation with invasive hemodynamics. JACC Cardiovasc Imaging. 2011 Sep;4(9):938-45. | CrossRef | PubMed | Kircher BJ, Himelman RB, Schiller NB. Noninvasive estimation of right atrial pressure from the inspiratory collapse of the inferior vena cava. Am J Cardiol. 1990 Aug 15;66(4):493-6. | PubMed |
Kircher BJ, Himelman RB, Schiller NB. Noninvasive estimation of right atrial pressure from the inspiratory collapse of the inferior vena cava. Am J Cardiol. 1990 Aug 15;66(4):493-6. | PubMed | Brennan JM, Blair JE, Goonewardena S, Ronan A, Shah D, Vasaiwala S, et al. Reappraisal of the use of inferior vena cava for estimating right atrial pressure. J Am Soc Echocardiogr. 2007 Jul;20(7):857-61. | PubMed |
Brennan JM, Blair JE, Goonewardena S, Ronan A, Shah D, Vasaiwala S, et al. Reappraisal of the use of inferior vena cava for estimating right atrial pressure. J Am Soc Echocardiogr. 2007 Jul;20(7):857-61. | PubMed | Haddad F, Hunt SA, Rosenthal DN, Murphy DJ. Right ventricular function in cardiovascular disease, part I: Anatomy, physiology, aging, and functional assessment of the right ventricle. Circulation. 2008 Mar 18;117(11):1436-48. | CrossRef | PubMed |
Haddad F, Hunt SA, Rosenthal DN, Murphy DJ. Right ventricular function in cardiovascular disease, part I: Anatomy, physiology, aging, and functional assessment of the right ventricle. Circulation. 2008 Mar 18;117(11):1436-48. | CrossRef | PubMed | Kaul S, Tei C, Hopkins JM, Shah PM. Assessment of right ventricular function using two-dimensional echocardiography. Am Heart J. 1984 Mar;107(3):526-31. | PubMed |
Kaul S, Tei C, Hopkins JM, Shah PM. Assessment of right ventricular function using two-dimensional echocardiography. Am Heart J. 1984 Mar;107(3):526-31. | PubMed | Karatasakis GT, Karagounis LA, Kalyvas PA, Manginas A, Athanassopoulos GD, Aggelakas SA, et al. Prognostic significance of echocardiographically estimated right ventricular shortening in advanced heart failure. Am J Cardiol. 1998 Aug 1;82(3):329-34. | PubMed |
Karatasakis GT, Karagounis LA, Kalyvas PA, Manginas A, Athanassopoulos GD, Aggelakas SA, et al. Prognostic significance of echocardiographically estimated right ventricular shortening in advanced heart failure. Am J Cardiol. 1998 Aug 1;82(3):329-34. | PubMed | Kjaergaard J, Akkan D, Iversen KK, Køber L, Torp-Pedersen C, Hassager C. Right ventricular dysfunction as an independent predictor of short- and long-term mortality in patients with heart failure. Eur J Heart Fail. 2007 Jun-Jul;9(6-7):610-6. | PubMed |
Kjaergaard J, Akkan D, Iversen KK, Køber L, Torp-Pedersen C, Hassager C. Right ventricular dysfunction as an independent predictor of short- and long-term mortality in patients with heart failure. Eur J Heart Fail. 2007 Jun-Jul;9(6-7):610-6. | PubMed | Rudski LG, Lai WW, Afilalo J, Hua L, Handschumacher MD, Chandrasekaran K, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2010 Jul;23(7):685-713; quiz 786-8. | CrossRef | PubMed |
Rudski LG, Lai WW, Afilalo J, Hua L, Handschumacher MD, Chandrasekaran K, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2010 Jul;23(7):685-713; quiz 786-8. | CrossRef | PubMed | Grison A, Maschietto N, Reffo E, Stellin G, Padalino M, Vida V, et al. Three-dimensional echocardiographic evaluation of right ventricular volume and function in pediatric patients: validation of the technique. J Am Soc Echocardiogr. 2007 Aug;20(8):921-9. | PubMed |
Grison A, Maschietto N, Reffo E, Stellin G, Padalino M, Vida V, et al. Three-dimensional echocardiographic evaluation of right ventricular volume and function in pediatric patients: validation of the technique. J Am Soc Echocardiogr. 2007 Aug;20(8):921-9. | PubMed | Jenkins C, Chan J, Bricknell K, Strudwick M, Marwick TH. Reproducibility of right ventricular volumes and ejection fraction using real-time three-dimensional echocardiography: comparison with cardiac MRI. Chest. 2007 Jun;131(6):1844-51. | PubMed |
Jenkins C, Chan J, Bricknell K, Strudwick M, Marwick TH. Reproducibility of right ventricular volumes and ejection fraction using real-time three-dimensional echocardiography: comparison with cardiac MRI. Chest. 2007 Jun;131(6):1844-51. | PubMed | Smith BC, Dobson G, Dawson D, Charalampopoulos A, Grapsa J, Nihoyannopoulos P. Three-dimensional speckle tracking of the right ventricle: toward optimal quantification of right ventricular dysfunction in pulmonary hypertension. J Am Coll Cardiol. 2014 Jul 8;64(1):41-51. | CrossRef | PubMed |
Smith BC, Dobson G, Dawson D, Charalampopoulos A, Grapsa J, Nihoyannopoulos P. Three-dimensional speckle tracking of the right ventricle: toward optimal quantification of right ventricular dysfunction in pulmonary hypertension. J Am Coll Cardiol. 2014 Jul 8;64(1):41-51. | CrossRef | PubMed | Goetschalckx K, Rademakers F, Bogaert J. Right ventricular function by MRI. Curr Opin Cardiol. 2010 Sep;25(5):451-5. | CrossRef | PubMed |
Goetschalckx K, Rademakers F, Bogaert J. Right ventricular function by MRI. Curr Opin Cardiol. 2010 Sep;25(5):451-5. | CrossRef | PubMed | Pavlicek M, Wahl A, Rutz T, de Marchi SF, Hille R, Wustmann K, et al. Right ventricular systolic function assessment: rank of echocardiographic methods vs. cardiac magnetic resonance imaging. Eur J Echocardiogr. 2011 Nov;12(11):871-80. | CrossRef | PubMed |
Pavlicek M, Wahl A, Rutz T, de Marchi SF, Hille R, Wustmann K, et al. Right ventricular systolic function assessment: rank of echocardiographic methods vs. cardiac magnetic resonance imaging. Eur J Echocardiogr. 2011 Nov;12(11):871-80. | CrossRef | PubMed | Nagueh SF, Kopelen HA, Zoghbi WA. Relation of mean right atrial pressure to echocardiographic and Doppler parameters of right atrial and right ventricular function. Circulation. 1996 Mar 15;93(6):1160-9. | PubMed |
Nagueh SF, Kopelen HA, Zoghbi WA. Relation of mean right atrial pressure to echocardiographic and Doppler parameters of right atrial and right ventricular function. Circulation. 1996 Mar 15;93(6):1160-9. | PubMed | Berger M, Haimowitz A, Van Tosh A, Berdoff RL, Goldberg E. Quantitative assessment of pulmonary hypertension in patients with tricuspid regurgitation using continuous wave Doppler ultrasound. J Am Coll Cardiol. 1985 Aug;6(2):359-65. | PubMed |
Berger M, Haimowitz A, Van Tosh A, Berdoff RL, Goldberg E. Quantitative assessment of pulmonary hypertension in patients with tricuspid regurgitation using continuous wave Doppler ultrasound. J Am Coll Cardiol. 1985 Aug;6(2):359-65. | PubMed | Lafitte S, Pillois X, Reant P, Picard F, Arsac F, Dijos M, et al. Estimation of pulmonary pressures and diagnosis of pulmonary hypertension by Doppler echocardiography: a retrospective comparison of routine echocardiography and invasive hemodynamics. J Am Soc Echocardiogr. 2013 May;26(5):457-63. | CrossRef | PubMed |
Lafitte S, Pillois X, Reant P, Picard F, Arsac F, Dijos M, et al. Estimation of pulmonary pressures and diagnosis of pulmonary hypertension by Doppler echocardiography: a retrospective comparison of routine echocardiography and invasive hemodynamics. J Am Soc Echocardiogr. 2013 May;26(5):457-63. | CrossRef | PubMed | Diaz RA, Nihoyannopoulos P, Athanassopoulos G, Oakley CM. Usefulness of echocardiography to differentiate dilated cardiomyopathy from coronary-induced congestive heart failure. Am J Cardiol. 1991 Nov 1;68(11):1224-7. | PubMed |
Diaz RA, Nihoyannopoulos P, Athanassopoulos G, Oakley CM. Usefulness of echocardiography to differentiate dilated cardiomyopathy from coronary-induced congestive heart failure. Am J Cardiol. 1991 Nov 1;68(11):1224-7. | PubMed | Díaz RA, Nihoyannopoulos P, Oakley CM. [Differential diagnosis of congestive cardiomyopathy and myocardial ischemia: two-dimensional echocardiography has a limited value]. Rev Med Chil. 1991 Jul;119(7):772-7. | PubMed |
Díaz RA, Nihoyannopoulos P, Oakley CM. [Differential diagnosis of congestive cardiomyopathy and myocardial ischemia: two-dimensional echocardiography has a limited value]. Rev Med Chil. 1991 Jul;119(7):772-7. | PubMed | Díaz RA, Nihoyannopoulos P, Oakley CM. [Valvular insufficiency in dilated cardiomyopathy diagnosed by color Doppler echocardiography]. Rev Med Chil. 1989 Nov;117(11):1232-5. | PubMed |
Díaz RA, Nihoyannopoulos P, Oakley CM. [Valvular insufficiency in dilated cardiomyopathy diagnosed by color Doppler echocardiography]. Rev Med Chil. 1989 Nov;117(11):1232-5. | PubMed | Gheorghiade M, Bonow RO. Chronic heart failure in the United States: a manifestation of coronary artery disease. Circulation. 1998 Jan 27;97(3):282-9. | PubMed |
Gheorghiade M, Bonow RO. Chronic heart failure in the United States: a manifestation of coronary artery disease. Circulation. 1998 Jan 27;97(3):282-9. | PubMed | Fox KF, Cowie MR, Wood DA, Coats AJ, Gibbs JS, Underwood SR, et al. Coronary artery disease as the cause of incident heart failure in the population. Eur Heart J. 2001 Feb;22(3):228-36. | PubMed |
Fox KF, Cowie MR, Wood DA, Coats AJ, Gibbs JS, Underwood SR, et al. Coronary artery disease as the cause of incident heart failure in the population. Eur Heart J. 2001 Feb;22(3):228-36. | PubMed | Raftery EB, Banks DC, Oram S. Occlusive disease of the coronary arteries presenting as primary congestive cardiomyopathy. Lancet. 1969 Nov 29;2(7631):1146-50. | PubMed |
Raftery EB, Banks DC, Oram S. Occlusive disease of the coronary arteries presenting as primary congestive cardiomyopathy. Lancet. 1969 Nov 29;2(7631):1146-50. | PubMed | Felker GM, Shaw LK, O'Connor CM. A standardized definition of ischemic cardiomyopathy for use in clinical research. J Am Coll Cardiol. 2002 Jan 16;39(2):210-8. | PubMed |
Felker GM, Shaw LK, O'Connor CM. A standardized definition of ischemic cardiomyopathy for use in clinical research. J Am Coll Cardiol. 2002 Jan 16;39(2):210-8. | PubMed | Budoff MJ, Achenbach S, Blumenthal RS, Carr JJ, Goldin JG, Greenland P, et al. Assessment of coronary artery disease by cardiac computed tomography: a scientific statement from the American Heart Association Committee on Cardiovascular Imaging and Intervention, Council on Cardiovascular Radiology and Intervention, and Committee on Cardiac Imaging, Council on Clinical Cardiology. Circulation. 2006 Oct 17;114(16):1761-91. | PubMed |
Budoff MJ, Achenbach S, Blumenthal RS, Carr JJ, Goldin JG, Greenland P, et al. Assessment of coronary artery disease by cardiac computed tomography: a scientific statement from the American Heart Association Committee on Cardiovascular Imaging and Intervention, Council on Cardiovascular Radiology and Intervention, and Committee on Cardiac Imaging, Council on Clinical Cardiology. Circulation. 2006 Oct 17;114(16):1761-91. | PubMed | Franciosa JA, Wilen M, Ziesche S, Cohn JN. Survival in men with severe chronic left ventricular failure due to either coronary heart disease or idiopathic dilated cardiomyopathy. Am J Cardiol. 1983 Mar 1;51(5):831-6. | PubMed |
Franciosa JA, Wilen M, Ziesche S, Cohn JN. Survival in men with severe chronic left ventricular failure due to either coronary heart disease or idiopathic dilated cardiomyopathy. Am J Cardiol. 1983 Mar 1;51(5):831-6. | PubMed | Fuster V, Gersh BJ, Giuliani ER, Tajik AJ, Brandenburg RO, Frye RL. The natural history of idiopathic dilated cardiomyopathy. Am J Cardiol. 1981 Mar;47(3):525-31. | PubMed |
Fuster V, Gersh BJ, Giuliani ER, Tajik AJ, Brandenburg RO, Frye RL. The natural history of idiopathic dilated cardiomyopathy. Am J Cardiol. 1981 Mar;47(3):525-31. | PubMed | Mowatt G, Cook JA, Hillis GS, Walker S, Fraser C, Jia X, Waugh N. 64-Slice computed tomography angiography in the diagnosis and assessment of coronary artery disease: systematic review and meta-analysis. Heart. 2008 Nov;94(11):1386-93.
| CrossRef | PubMed |
Mowatt G, Cook JA, Hillis GS, Walker S, Fraser C, Jia X, Waugh N. 64-Slice computed tomography angiography in the diagnosis and assessment of coronary artery disease: systematic review and meta-analysis. Heart. 2008 Nov;94(11):1386-93.
| CrossRef | PubMed | Hunt SA. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to update the 2001 Guidelines for the Evaluation and Mana- gement of Heart Failure). J Am Coll Cardiol. 2005 Sep 20;46(6):e1-82. | CrossRef | PubMed |
Hunt SA. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to update the 2001 Guidelines for the Evaluation and Mana- gement of Heart Failure). J Am Coll Cardiol. 2005 Sep 20;46(6):e1-82. | CrossRef | PubMed | Ghostine S, Caussin C, Habis M, Habib Y, Clément C, Sigal-Cinqualbre A, et al. Non-invasive diagnosis of ischaemic heart failure using 64-slice computed tomography. Eur Heart J. 2008 Sep;29(17):2133-40. | CrossRef | PubMed |
Ghostine S, Caussin C, Habis M, Habib Y, Clément C, Sigal-Cinqualbre A, et al. Non-invasive diagnosis of ischaemic heart failure using 64-slice computed tomography. Eur Heart J. 2008 Sep;29(17):2133-40. | CrossRef | PubMed | Camici PG, Prasad SK, Rimoldi OE. Stunning, hibernation, and assessment of myocardial viability. Circulation. 2008 Jan 1;117(1):103-14. | CrossRef | PubMed |
Camici PG, Prasad SK, Rimoldi OE. Stunning, hibernation, and assessment of myocardial viability. Circulation. 2008 Jan 1;117(1):103-14. | CrossRef | PubMed | Gerber BL, Rousseau MF, Ahn SA, le Polain de Waroux JB, Pouleur AC, Phlips T, et al. Prognostic value of myocardial viability by delayed-enhanced magnetic resonance in patients with coronary artery disease and low ejection fraction: impact of revascularization therapy. J Am Coll Cardiol. 2012 Feb 28;59(9):825-35. | CrossRef | PubMed |
Gerber BL, Rousseau MF, Ahn SA, le Polain de Waroux JB, Pouleur AC, Phlips T, et al. Prognostic value of myocardial viability by delayed-enhanced magnetic resonance in patients with coronary artery disease and low ejection fraction: impact of revascularization therapy. J Am Coll Cardiol. 2012 Feb 28;59(9):825-35. | CrossRef | PubMed | Kwon DH, Halley CM, Carrigan TP, Zysek V, Popovic ZB, Setser R, et al. Extent of left ventricular scar predicts outcomes in ischemic cardiomyopathy patients with significantly reduced systolic function: a delayed hyperenhancement cardiac magnetic resonance study. JACC Cardiovasc Imaging. 2009 Jan;2(1):34-44. | CrossRef | PubMed |
Kwon DH, Halley CM, Carrigan TP, Zysek V, Popovic ZB, Setser R, et al. Extent of left ventricular scar predicts outcomes in ischemic cardiomyopathy patients with significantly reduced systolic function: a delayed hyperenhancement cardiac magnetic resonance study. JACC Cardiovasc Imaging. 2009 Jan;2(1):34-44. | CrossRef | PubMed | Cheong BY, Muthupillai R, Wilson JM, Sung A, Huber S, Amin S, et al. Prognostic significance of delayed-enhancement magnetic resonance imaging: survival of 857 patients with and without left ventricular dysfunction. Circulation. 2009 Nov 24;120(21):2069-76. | CrossRef | PubMed |
Cheong BY, Muthupillai R, Wilson JM, Sung A, Huber S, Amin S, et al. Prognostic significance of delayed-enhancement magnetic resonance imaging: survival of 857 patients with and without left ventricular dysfunction. Circulation. 2009 Nov 24;120(21):2069-76. | CrossRef | PubMed | Falk RH. Diagnosis and management of the cardiac amyloidoses. Circulation. 2005 Sep 27;112(13):2047-60. | PubMed |
Falk RH. Diagnosis and management of the cardiac amyloidoses. Circulation. 2005 Sep 27;112(13):2047-60. | PubMed | Vogelsberg H, Mahrholdt H, Deluigi CC, Yilmaz A, Kispert EM, Greulich S, et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol. 2008 Mar 11;51(10):1022-30. | CrossRef | PubMed |
Vogelsberg H, Mahrholdt H, Deluigi CC, Yilmaz A, Kispert EM, Greulich S, et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol. 2008 Mar 11;51(10):1022-30. | CrossRef | PubMed | Maceira AM, Joshi J, Prasad SK, Moon JC, Perugini E, Harding I, et al. Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation. 2005 Jan 18;111(2):186-93. | PubMed |
Maceira AM, Joshi J, Prasad SK, Moon JC, Perugini E, Harding I, et al. Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation. 2005 Jan 18;111(2):186-93. | PubMed | Austin BA, Tang WH, Rodriguez ER, Tan C, Flamm SD, Taylor DO, et al. Delayed hyper-enhancement magnetic resonance imaging provides incremental diagnostic and prognostic utility in suspected cardiac amyloidosis. JACC Cardiovasc Imaging. 2009 Dec;2(12):1369-77. | CrossRef | PubMed |
Austin BA, Tang WH, Rodriguez ER, Tan C, Flamm SD, Taylor DO, et al. Delayed hyper-enhancement magnetic resonance imaging provides incremental diagnostic and prognostic utility in suspected cardiac amyloidosis. JACC Cardiovasc Imaging. 2009 Dec;2(12):1369-77. | CrossRef | PubMed | Syed IS, Glockner JF, Feng D, Araoz PA, Martinez MW, Edwards WD, et al. Role of cardiac magnetic resonance imaging in the detection of cardiac amyloidosis. JACC Cardiovasc Imaging. 2010 Feb;3(2):155-64. | CrossRef | PubMed |
Syed IS, Glockner JF, Feng D, Araoz PA, Martinez MW, Edwards WD, et al. Role of cardiac magnetic resonance imaging in the detection of cardiac amyloidosis. JACC Cardiovasc Imaging. 2010 Feb;3(2):155-64. | CrossRef | PubMed | Sliwa K, Damasceno A, Mayosi BM. Epidemiology and etiology of cardiomyopathy in Africa. Circulation. 2005 Dec 6;112(23):3577-83. | PubMed |
Sliwa K, Damasceno A, Mayosi BM. Epidemiology and etiology of cardiomyopathy in Africa. Circulation. 2005 Dec 6;112(23):3577-83. | PubMed | Denfield SW, Webber SA. Restrictive cardiomyopathy in childhood. Heart Fail Clin. 2010 Oct;6(4):445-52, viii. | CrossRef | PubMed |
Denfield SW, Webber SA. Restrictive cardiomyopathy in childhood. Heart Fail Clin. 2010 Oct;6(4):445-52, viii. | CrossRef | PubMed | Verma VK, Zafar KS. Tropical endomyocardial fibrosis: an overview. Int J Res Med Sci. 2014 Nov;2(4):1267-1277. | Link |
Verma VK, Zafar KS. Tropical endomyocardial fibrosis: an overview. Int J Res Med Sci. 2014 Nov;2(4):1267-1277. | Link | Rochitte CE, Tassi EM, Shiozaki AA. The emerging role of MRI in the diagnosis and management of cardiomyopathies. Curr Cardiol Rep. 2006 Feb;8(1):44-52. | PubMed |
Rochitte CE, Tassi EM, Shiozaki AA. The emerging role of MRI in the diagnosis and management of cardiomyopathies. Curr Cardiol Rep. 2006 Feb;8(1):44-52. | PubMed | Estornell J, López MP, Dicenta F, Igual B, Martínez V, Sonlleva A. [Usefulness of magnetic resonance imaging in the assessment of endomyocardial disease]. Rev Esp Cardiol. 2003 Mar;56(3):321-4. | PubMed |
Estornell J, López MP, Dicenta F, Igual B, Martínez V, Sonlleva A. [Usefulness of magnetic resonance imaging in the assessment of endomyocardial disease]. Rev Esp Cardiol. 2003 Mar;56(3):321-4. | PubMed | Cury RC, Abbara S, Sandoval LJ, Houser S, Brady TJ, Palacios IF. Images in cardiovascular medicine. Visualization of endomyocardial fibrosis by delayed-enhancement magnetic resonance imaging. Circulation. 2005 Mar 8;111(9):e115-7. | PubMed |
Cury RC, Abbara S, Sandoval LJ, Houser S, Brady TJ, Palacios IF. Images in cardiovascular medicine. Visualization of endomyocardial fibrosis by delayed-enhancement magnetic resonance imaging. Circulation. 2005 Mar 8;111(9):e115-7. | PubMed | Diaz RA, Aranguiz E, Pedemonte O. Complementary roles of transthoracic two-dimensional color Doppler imaging and myocardial contrast echocardiography in diagnosis of endomyocardial fibrosis. Echocardiography. 2009 May;26(5):589-92. | PubMed |
Diaz RA, Aranguiz E, Pedemonte O. Complementary roles of transthoracic two-dimensional color Doppler imaging and myocardial contrast echocardiography in diagnosis of endomyocardial fibrosis. Echocardiography. 2009 May;26(5):589-92. | PubMed | Ashrafian H, Watkins H. Reviews of translational medicine and genomics in cardiovascular disease: new disease taxonomy and therapeutic implications cardiomyopathies: therapeutics based on molecular phenotype. J Am Coll Cardiol. 2007 Mar 27;49(12):1251-64.
| PubMed |
Ashrafian H, Watkins H. Reviews of translational medicine and genomics in cardiovascular disease: new disease taxonomy and therapeutic implications cardiomyopathies: therapeutics based on molecular phenotype. J Am Coll Cardiol. 2007 Mar 27;49(12):1251-64.
| PubMed | Frey N, Luedde M, Katus HA. Mechanisms of disease: hypertrophic cardiomyopathy. Nat Rev Cardiol. 2011 Oct 25;9(2):91-100. | CrossRef | PubMed |
Frey N, Luedde M, Katus HA. Mechanisms of disease: hypertrophic cardiomyopathy. Nat Rev Cardiol. 2011 Oct 25;9(2):91-100. | CrossRef | PubMed | Melacini P, Basso C, Angelini A, Calore C, Bobbo F, Tokajuk B, et al. Clinicopathological profiles of progressive heart failure in hypertrophic cardiomyopathy. Eur Heart J. 2010 Sep;31(17):2111-23. | CrossRef | PubMed |
Melacini P, Basso C, Angelini A, Calore C, Bobbo F, Tokajuk B, et al. Clinicopathological profiles of progressive heart failure in hypertrophic cardiomyopathy. Eur Heart J. 2010 Sep;31(17):2111-23. | CrossRef | PubMed | Shapiro LM, McKenna WJ. Distribution of left ventricular hypertrophy in hypertrophic cardiomyopathy: a two-dimensional echocardiographic study. J Am Coll Cardiol. 1983 Sep;2(3):437-44. | PubMed |
Shapiro LM, McKenna WJ. Distribution of left ventricular hypertrophy in hypertrophic cardiomyopathy: a two-dimensional echocardiographic study. J Am Coll Cardiol. 1983 Sep;2(3):437-44. | PubMed | Maron MS, Olivotto I, Betocchi S, Casey SA, Lesser JR, Losi MA, et al. Effect of left ventricular outflow tract obstruction on clinical outcome in hypertrophic cardiomyopathy. N Engl J Med. 2003 Jan 23;348(4):295-303. | PubMed |
Maron MS, Olivotto I, Betocchi S, Casey SA, Lesser JR, Losi MA, et al. Effect of left ventricular outflow tract obstruction on clinical outcome in hypertrophic cardiomyopathy. N Engl J Med. 2003 Jan 23;348(4):295-303. | PubMed | Maron BJ. Hypertrophic cardiomyopathy: a systematic review. JAMA. 2002 Mar 13;287(10):1308-20. | PubMed |
Maron BJ. Hypertrophic cardiomyopathy: a systematic review. JAMA. 2002 Mar 13;287(10):1308-20. | PubMed | Spirito P, Autore C. Management of hypertrophic cardiomyopathy. BMJ. 2006 May 27;332(7552):1251-5. | PubMed |
Spirito P, Autore C. Management of hypertrophic cardiomyopathy. BMJ. 2006 May 27;332(7552):1251-5. | PubMed | Rowin E.J., Maron B.J., Olivotto I., et al; Progressive heart failure is uncommon in patients with nonobstructive hypertrophic cardiomyopathy. Circulation 2013; 128:A14979
Rowin E.J., Maron B.J., Olivotto I., et al; Progressive heart failure is uncommon in patients with nonobstructive hypertrophic cardiomyopathy. Circulation 2013; 128:A14979  Maron MS, Maron BJ, Harrigan C, Buros J, Gibson CM, Olivotto I, et al. Hypertrophic cardiomyopathy phenotype revisited after 50 years with cardiovascular magnetic resonance. J Am Coll Cardiol. 2009 Jul 14;54(3):220-8. | CrossRef | PubMed |
Maron MS, Maron BJ, Harrigan C, Buros J, Gibson CM, Olivotto I, et al. Hypertrophic cardiomyopathy phenotype revisited after 50 years with cardiovascular magnetic resonance. J Am Coll Cardiol. 2009 Jul 14;54(3):220-8. | CrossRef | PubMed | Maron MS, Rowin EJ, Lin D, Appelbaum E, Chan RH, Gibson CM, et al. Prevalence and clinical profile of myocardial crypts in hypertrophic cardiomyopathy. Circ Cardiovasc Imaging. 2012 Jul;5(4):441-7. | CrossRef | PubMed |
Maron MS, Rowin EJ, Lin D, Appelbaum E, Chan RH, Gibson CM, et al. Prevalence and clinical profile of myocardial crypts in hypertrophic cardiomyopathy. Circ Cardiovasc Imaging. 2012 Jul;5(4):441-7. | CrossRef | PubMed | Desai MY, Ommen SR, McKenna WJ, Lever HM, Elliott PM. Imaging phenotype versus genotype in hypertrophic cardiomyopathy. Circ Cardiovasc Imaging. 2011 Mar;4(2):156-68. | CrossRef | PubMed |
Desai MY, Ommen SR, McKenna WJ, Lever HM, Elliott PM. Imaging phenotype versus genotype in hypertrophic cardiomyopathy. Circ Cardiovasc Imaging. 2011 Mar;4(2):156-68. | CrossRef | PubMed | Kwon DH, Smedira NG, Rodriguez ER, Tan C, Setser R, Thamilarasan M, et al. Cardiac magnetic resonance detection of myocardial scarring in hypertrophic cardiomyopathy: correlation with histopathology and prevalence of ventricular tachycardia. J Am Coll Cardiol. 2009 Jul 14;54(3):242-9. | CrossRef | PubMed |
Kwon DH, Smedira NG, Rodriguez ER, Tan C, Setser R, Thamilarasan M, et al. Cardiac magnetic resonance detection of myocardial scarring in hypertrophic cardiomyopathy: correlation with histopathology and prevalence of ventricular tachycardia. J Am Coll Cardiol. 2009 Jul 14;54(3):242-9. | CrossRef | PubMed | Moravsky G, Ofek E, Rakowski H, Butany J, Williams L, Ralph-Edwards A, et al. Myocardial fibrosis in hypertrophic cardiomyopathy: accurate reflection of histopathological findings by CMR. JACC Cardiovasc Imaging. 2013 May;6(5):587-96. | CrossRef | PubMed |
Moravsky G, Ofek E, Rakowski H, Butany J, Williams L, Ralph-Edwards A, et al. Myocardial fibrosis in hypertrophic cardiomyopathy: accurate reflection of histopathological findings by CMR. JACC Cardiovasc Imaging. 2013 May;6(5):587-96. | CrossRef | PubMed | Moon JC, McKenna WJ, McCrohon JA, Elliott PM, Smith GC, Pennell DJ. Toward clinical risk assessment in hypertrophic cardiomyopathy with gadolinium cardiovascular magnetic resonance. J Am Coll Cardiol. 2003 May 7;41(9):1561-7. | PubMed |
Moon JC, McKenna WJ, McCrohon JA, Elliott PM, Smith GC, Pennell DJ. Toward clinical risk assessment in hypertrophic cardiomyopathy with gadolinium cardiovascular magnetic resonance. J Am Coll Cardiol. 2003 May 7;41(9):1561-7. | PubMed | O'Hanlon R, Grasso A, Roughton M, Moon JC, Clark S, Wage R, et al. Prognostic significance of myocardial fibrosis in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2010 Sep 7;56(11):867-74. | CrossRef | PubMed |
O'Hanlon R, Grasso A, Roughton M, Moon JC, Clark S, Wage R, et al. Prognostic significance of myocardial fibrosis in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2010 Sep 7;56(11):867-74. | CrossRef | PubMed | Elliott P, McKenna WJ. Hypertrophic cardiomyopathy. Lancet. 2004 Jun 5;363(9424):1881-91. | PubMed |
Elliott P, McKenna WJ. Hypertrophic cardiomyopathy. Lancet. 2004 Jun 5;363(9424):1881-91. | PubMed | Dec GW, Fuster V. Idiopathic dilated cardiomyopathy. N Engl J Med. 1994 Dec 8;331(23):1564-75. | PubMed |
Dec GW, Fuster V. Idiopathic dilated cardiomyopathy. N Engl J Med. 1994 Dec 8;331(23):1564-75. | PubMed | Raftery EB, Banks DC, Oram S. Occlusive disease of the coronary arteries presenting as primary congestive cardiomyopathy. Lancet. 1969 Nov 29;2(7631):1146-50. | PubMed |
Raftery EB, Banks DC, Oram S. Occlusive disease of the coronary arteries presenting as primary congestive cardiomyopathy. Lancet. 1969 Nov 29;2(7631):1146-50. | PubMed | Felker GM, Shaw LK, O'Connor CM. A standardized definition of ischemic cardiomyopathy for use in clinical research. J Am Coll Cardiol. 2002 Jan 16;39(2):210-8. | PubMed |
Felker GM, Shaw LK, O'Connor CM. A standardized definition of ischemic cardiomyopathy for use in clinical research. J Am Coll Cardiol. 2002 Jan 16;39(2):210-8. | PubMed | Hunold P, Schlosser T, Vogt FM, Eggebrecht H, Schmermund A, Bruder O, et al. Myocardial late enhancement in contrast-enhanced cardiac MRI: distinction between infarction scar and non-infarction-related disease. AJR Am J Roentgenol. 2005 May;184(5):1420-6. | PubMed |
Hunold P, Schlosser T, Vogt FM, Eggebrecht H, Schmermund A, Bruder O, et al. Myocardial late enhancement in contrast-enhanced cardiac MRI: distinction between infarction scar and non-infarction-related disease. AJR Am J Roentgenol. 2005 May;184(5):1420-6. | PubMed | Bluemke DA. MRI of nonischemic cardiomyopathy. AJR Am J Roentgenol. 2010 Oct;195(4):935-40. | CrossRef | PubMed |
Bluemke DA. MRI of nonischemic cardiomyopathy. AJR Am J Roentgenol. 2010 Oct;195(4):935-40. | CrossRef | PubMed | Leyva F, Taylor RJ, Foley PW, Umar F, Mulligan LJ, Patel K, et al. Left ventricular midwall fibrosis as a predictor of mortality and morbidity after cardiac resynchronization therapy in patients with nonischemic cardiomyopathy. J Am Coll Cardiol. 2012 Oct 23;60(17):1659-67. | CrossRef | PubMed |
Leyva F, Taylor RJ, Foley PW, Umar F, Mulligan LJ, Patel K, et al. Left ventricular midwall fibrosis as a predictor of mortality and morbidity after cardiac resynchronization therapy in patients with nonischemic cardiomyopathy. J Am Coll Cardiol. 2012 Oct 23;60(17):1659-67. | CrossRef | PubMed | Gulati A, Jabbour A, Ismail TF, Guha K, Khwaja J, Raza S, et al. Association of fibrosis with mortality and sudden cardiac death in patients with nonischemic dilated cardiomyopathy. JAMA. 2013 Mar 6;309(9):896-908. | CrossRef | PubMed |
Gulati A, Jabbour A, Ismail TF, Guha K, Khwaja J, Raza S, et al. Association of fibrosis with mortality and sudden cardiac death in patients with nonischemic dilated cardiomyopathy. JAMA. 2013 Mar 6;309(9):896-908. | CrossRef | PubMed | Kuruvilla S, Adenaw N, Katwal AB, Lipinski MJ, Kramer CM, Salerno M. Late gadolinium enhancement on cardiac magnetic resonance predicts adverse cardiovascular outcomes in nonischemic cardiomyopathy: a systematic review and meta-analysis. Circ Cardiovasc Imaging. 2014 Mar;7(2):250-8. | CrossRef | PubMed |
Kuruvilla S, Adenaw N, Katwal AB, Lipinski MJ, Kramer CM, Salerno M. Late gadolinium enhancement on cardiac magnetic resonance predicts adverse cardiovascular outcomes in nonischemic cardiomyopathy: a systematic review and meta-analysis. Circ Cardiovasc Imaging. 2014 Mar;7(2):250-8. | CrossRef | PubMed | Pöyhönen P, Kivistö S, Holmström M, Hänninen H. Quantifying late gadolinium enhancement on CMR provides additional prognostic information in early risk-stratification of nonischemic cardiomyopathy: a cohort study. BMC Cardiovasc Disord. 2014 Aug 27;14:110. | CrossRef | PubMed |
Pöyhönen P, Kivistö S, Holmström M, Hänninen H. Quantifying late gadolinium enhancement on CMR provides additional prognostic information in early risk-stratification of nonischemic cardiomyopathy: a cohort study. BMC Cardiovasc Disord. 2014 Aug 27;14:110. | CrossRef | PubMed | Masci PG, Schuurman R, Barison A, Ripoli A, Coceani M, Chiappino S, et al. Response to letters regarding article, "Myocardial fibrosis as a key determinant of left ventricular remodeling in idiopathic dilated cardiomyopathy: a contrast-enhanced cardiovascular magnetic study". Circ Cardiovasc Imaging. 2013 Nov;6(6):e79. | CrossRef | PubMed |
Masci PG, Schuurman R, Barison A, Ripoli A, Coceani M, Chiappino S, et al. Response to letters regarding article, "Myocardial fibrosis as a key determinant of left ventricular remodeling in idiopathic dilated cardiomyopathy: a contrast-enhanced cardiovascular magnetic study". Circ Cardiovasc Imaging. 2013 Nov;6(6):e79. | CrossRef | PubMed | Maron BJ, Towbin JA, Thiene G, Antzelevitch C, Corrado D, Arnett D, et al. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Councilon Epidemiology and Prevention. Circulation. 2006 Apr 11;113(14):1807-16. | PubMed |
Maron BJ, Towbin JA, Thiene G, Antzelevitch C, Corrado D, Arnett D, et al. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Councilon Epidemiology and Prevention. Circulation. 2006 Apr 11;113(14):1807-16. | PubMed | Engberding R, Bender F. Identification of a rare congenital anomaly of the myocardium by two-dimensional echocardiography: persistence of isolated myocardial sinusoids. Am J Cardiol. 1984 Jun 1;53(11):1733-4.
| PubMed |
Engberding R, Bender F. Identification of a rare congenital anomaly of the myocardium by two-dimensional echocardiography: persistence of isolated myocardial sinusoids. Am J Cardiol. 1984 Jun 1;53(11):1733-4.
| PubMed | Richardson P, McKenna W, Bristow M, Maisch B, Mautner B, O'Connell J, et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies. Circulation. 1996 Mar 1;93(5):841-2. | PubMed |
Richardson P, McKenna W, Bristow M, Maisch B, Mautner B, O'Connell J, et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies. Circulation. 1996 Mar 1;93(5):841-2. | PubMed | Jenni R, Oechslin E, Schneider J, Attenhofer Jost C, Kaufmann PA. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart. 2001 Dec;86(6):666-71. | PubMed |
Jenni R, Oechslin E, Schneider J, Attenhofer Jost C, Kaufmann PA. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart. 2001 Dec;86(6):666-71. | PubMed | Jenni R, Oechslin EN, van der Loo B. Isolated ventricular non-compaction of the myocardium in adults. Heart. 2007 Jan;93(1):11-5. Epub 2006 May 2. | PubMed |
Jenni R, Oechslin EN, van der Loo B. Isolated ventricular non-compaction of the myocardium in adults. Heart. 2007 Jan;93(1):11-5. Epub 2006 May 2. | PubMed | Petersen SE, Selvanayagam JB, Wiesmann F, Robson MD, Francis JM, Anderson RH, Watkins H, et al. Left ventricular non-compaction: insights from cardiovascular magnetic resonance imaging. J Am Coll Cardiol. 2005 Jul 5;46(1):101-5. | PubMed |
Petersen SE, Selvanayagam JB, Wiesmann F, Robson MD, Francis JM, Anderson RH, Watkins H, et al. Left ventricular non-compaction: insights from cardiovascular magnetic resonance imaging. J Am Coll Cardiol. 2005 Jul 5;46(1):101-5. | PubMed | Chin TK, Perloff JK, Williams RG, Jue K, Mohrmann R. Isolated noncompaction of left ventricular myocardium. A study of eight cases. Circulation. 1990 Aug;82(2):507-13. | PubMed |
Chin TK, Perloff JK, Williams RG, Jue K, Mohrmann R. Isolated noncompaction of left ventricular myocardium. A study of eight cases. Circulation. 1990 Aug;82(2):507-13. | PubMed | Daimon Y, Watanabe S, Takeda S, Hijikata Y, Komuro I. Two-layered appearance of noncompaction of the ventricular myocardium on magnetic resonance imaging. Circ J. 2002 Jun;66(6):619-21. | PubMed |
Daimon Y, Watanabe S, Takeda S, Hijikata Y, Komuro I. Two-layered appearance of noncompaction of the ventricular myocardium on magnetic resonance imaging. Circ J. 2002 Jun;66(6):619-21. | PubMed | Thuny F, Jacquier A, Jop B, Giorgi R, Gaubert JY, Bartoli JM, et al. Assessment of left ventricular non-compaction in adults: side-by-side comparison of cardiac magnetic resonance imaging with echocardiography. Arch Cardiovasc Dis. 2010 Mar;103(3):150-9. | CrossRef | PubMed |
Thuny F, Jacquier A, Jop B, Giorgi R, Gaubert JY, Bartoli JM, et al. Assessment of left ventricular non-compaction in adults: side-by-side comparison of cardiac magnetic resonance imaging with echocardiography. Arch Cardiovasc Dis. 2010 Mar;103(3):150-9. | CrossRef | PubMed | Dodd JD, Holmvang G, Hoffmann U, Ferencik M, Abbara S, Brady TJ, et al. Quantification of left ventricular noncompaction and trabecular delayed hyperenhancement with cardiac MRI: correlation with clinical severity. AJR Am J Roentgenol. 2007 Oct;189(4):974-80. | PubMed |
Dodd JD, Holmvang G, Hoffmann U, Ferencik M, Abbara S, Brady TJ, et al. Quantification of left ventricular noncompaction and trabecular delayed hyperenhancement with cardiac MRI: correlation with clinical severity. AJR Am J Roentgenol. 2007 Oct;189(4):974-80. | PubMed | Nucifora G, Aquaro GD, Pingitore A, Masci PG, Lombardi M. Myocardial fibrosis in isolated left ventricular non-compaction and its relation to disease severity. Eur J Heart Fail. 2011 Feb;13(2):170-6. | CrossRef | PubMed |
Nucifora G, Aquaro GD, Pingitore A, Masci PG, Lombardi M. Myocardial fibrosis in isolated left ventricular non-compaction and its relation to disease severity. Eur J Heart Fail. 2011 Feb;13(2):170-6. | CrossRef | PubMed | Hulot JS, Jouven X, Empana JP, Frank R, Fontaine G. Natural history and risk stratification of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Circulation. 2004 Oct 5;110(14):1879-84. | PubMed |
Hulot JS, Jouven X, Empana JP, Frank R, Fontaine G. Natural history and risk stratification of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Circulation. 2004 Oct 5;110(14):1879-84. | PubMed | Dalal D, Nasir K, Bomma C, Prakasa K, Tandri H, Piccini J, et al. Arrhythmogenic right ventricular dysplasia: a United States experience. Circulation. 2005 Dec 20;112(25):3823-32. | PubMed |
Dalal D, Nasir K, Bomma C, Prakasa K, Tandri H, Piccini J, et al. Arrhythmogenic right ventricular dysplasia: a United States experience. Circulation. 2005 Dec 20;112(25):3823-32. | PubMed | Corrado D, Basso C, Thiene G, McKenna WJ, Davies MJ, Fontaliran F, et al. Spectrum of clinicopathologic manifestations of arrhythmogenic right ventricular cardiomyopathy/dysplasia: a multicenter study. J Am Coll Cardiol. 1997 Nov 15;30(6):1512-20. | PubMed |
Corrado D, Basso C, Thiene G, McKenna WJ, Davies MJ, Fontaliran F, et al. Spectrum of clinicopathologic manifestations of arrhythmogenic right ventricular cardiomyopathy/dysplasia: a multicenter study. J Am Coll Cardiol. 1997 Nov 15;30(6):1512-20. | PubMed | Pinamonti B, Sinagra G, Salvi A, Di Lenarda A, Morgera T, Silvestri F, et al. Left ventricular involvement in right ventricular dysplasia. Am Heart J. 1992 Mar;123(3):711-24. | PubMed |
Pinamonti B, Sinagra G, Salvi A, Di Lenarda A, Morgera T, Silvestri F, et al. Left ventricular involvement in right ventricular dysplasia. Am Heart J. 1992 Mar;123(3):711-24. | PubMed | Thiene G, Corrado D, Nava A, Rossi L, Poletti A, Boffa GM, et al. Right ventricular cardiomyopathy: is there evidence of an inflammatory aetiology? Eur Heart J. 1991 Aug;12 Suppl D:22-5. | PubMed |
Thiene G, Corrado D, Nava A, Rossi L, Poletti A, Boffa GM, et al. Right ventricular cardiomyopathy: is there evidence of an inflammatory aetiology? Eur Heart J. 1991 Aug;12 Suppl D:22-5. | PubMed | Basso C, Corrado D, Thiene G. Arrhythmogenic right ventricular cardiomyopathy in athletes: diagnosis, management, and recommendations for sport activity. Cardiol Clin. 2007 Aug;25(3):415-22, vi. | PubMed |
Basso C, Corrado D, Thiene G. Arrhythmogenic right ventricular cardiomyopathy in athletes: diagnosis, management, and recommendations for sport activity. Cardiol Clin. 2007 Aug;25(3):415-22, vi. | PubMed | Lemola K, Brunckhorst C, Helfenstein U, Oechslin E, Jenni R, Duru F. Predictors of adverse outcome in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy: long term experience of a tertiary care centre. Heart. 2005 Sep;91(9):1167-72. | PubMed |
Lemola K, Brunckhorst C, Helfenstein U, Oechslin E, Jenni R, Duru F. Predictors of adverse outcome in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy: long term experience of a tertiary care centre. Heart. 2005 Sep;91(9):1167-72. | PubMed | Kullo IJ, Edwards WD, Seward JB. Right ventricular dysplasia: the Mayo Clinic experience. Mayo Clin Proc. 1995 Jun;70(6):541-8. | PubMed |
Kullo IJ, Edwards WD, Seward JB. Right ventricular dysplasia: the Mayo Clinic experience. Mayo Clin Proc. 1995 Jun;70(6):541-8. | PubMed | McKenna WJ, Thiene G, Nava A, Fontaliran F, Blomstrom-Lundqvist C, Fontaine G, et al. Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Task Force of the Working Group Myocardial and Pericardial Disease of the European Society of Cardiology and of the Scientific Council on Cardiomyopathies of the International Society and Federation of Cardiology. Br Heart J. 1994 Mar;71(3):215-8. | PubMed |
McKenna WJ, Thiene G, Nava A, Fontaliran F, Blomstrom-Lundqvist C, Fontaine G, et al. Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Task Force of the Working Group Myocardial and Pericardial Disease of the European Society of Cardiology and of the Scientific Council on Cardiomyopathies of the International Society and Federation of Cardiology. Br Heart J. 1994 Mar;71(3):215-8. | PubMed | Marcus FI, McKenna WJ, Sherrill D, Basso C, Bauce B, Bluemke DA, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the Task Force Criteria. Eur Heart J. 2010 Apr;31(7):806-14. | CrossRef | PubMed |
Marcus FI, McKenna WJ, Sherrill D, Basso C, Bauce B, Bluemke DA, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the Task Force Criteria. Eur Heart J. 2010 Apr;31(7):806-14. | CrossRef | PubMed | Quarta G, Elliott PM. Diagnostic criteria for arrhythmogenic right ventricular cardiomyopathy. Rev Esp Cardiol (Engl Ed). 2012 Jul;65(7):599-605. | CrossRef | PubMed |
Quarta G, Elliott PM. Diagnostic criteria for arrhythmogenic right ventricular cardiomyopathy. Rev Esp Cardiol (Engl Ed). 2012 Jul;65(7):599-605. | CrossRef | PubMed | Tandri H, Calkins H, Nasir K, Bomma C, Castillo E, Rutberg J, et al. Magnetic resonance imaging findings in patients meeting task force criteria for arrhythmogenic right ventricular dysplasia. J Cardiovasc Electrophysiol. 2003 May;14(5):476-82. | PubMed |
Tandri H, Calkins H, Nasir K, Bomma C, Castillo E, Rutberg J, et al. Magnetic resonance imaging findings in patients meeting task force criteria for arrhythmogenic right ventricular dysplasia. J Cardiovasc Electrophysiol. 2003 May;14(5):476-82. | PubMed | Tandri H, Saranathan M, Rodriguez ER, Martinez C, Bomma C, Nasir K, et al. Noninvasive detection of myocardial fibrosis in arrhythmogenic right ventricular cardiomyopathy using delayed-enhancement magnetic resonance imaging. J Am Coll Cardiol. 2005 Jan 4;45(1):98-103. | PubMed |
Tandri H, Saranathan M, Rodriguez ER, Martinez C, Bomma C, Nasir K, et al. Noninvasive detection of myocardial fibrosis in arrhythmogenic right ventricular cardiomyopathy using delayed-enhancement magnetic resonance imaging. J Am Coll Cardiol. 2005 Jan 4;45(1):98-103. | PubMed | Yoerger DM, Marcus F, Sherrill D, Calkins H, Towbin JA, Zareba W, et al. Echocardiographic findings in patients meeting task force criteria for arrhythmogenic right ventricular dysplasia: new insights from the multidisciplinary study of right ventricular dysplasia. J Am Coll Cardiol. 2005 Mar 15;45(6):860-5. | PubMed |
Yoerger DM, Marcus F, Sherrill D, Calkins H, Towbin JA, Zareba W, et al. Echocardiographic findings in patients meeting task force criteria for arrhythmogenic right ventricular dysplasia: new insights from the multidisciplinary study of right ventricular dysplasia. J Am Coll Cardiol. 2005 Mar 15;45(6):860-5. | PubMed | Cruz FE, Havenith M, Brugada P, Atie J, Cheriex EC, Smeets JL, et al. Pathologic findings after sudden death in arrhythmogenic right ventricular dysplasia. Am J Cardiovasc Pathol. 1990;3(4):329-32. | PubMed |
Cruz FE, Havenith M, Brugada P, Atie J, Cheriex EC, Smeets JL, et al. Pathologic findings after sudden death in arrhythmogenic right ventricular dysplasia. Am J Cardiovasc Pathol. 1990;3(4):329-32. | PubMed |