 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La insuficiencia cardíaca crónica se ha convertido en uno de los mayores problemas de salud a nivel global; 23 millones de personas padecen esta patología en todo el mundo y su edad de aparición ha variado notablemente en los últimos cinco decenios, coincidiendo incluso con otras comorbilidades en la medida en que aumenta la longevidad en la población. El tratamiento de la insuficiencia cardíaca también ha mostrado variaciones impresionantes durante los últimos años. Tal es el caso del cambio en el tratamiento de las drogas simpaticomiméticas por los agentes betabloqueadores, que implica sobre todo un cambio conceptual en la interpretación fisiopatológica de este síndrome. La incorporación al tratamiento de la insuficiencia cardíaca de los fármacos inhibidores de la enzima convertidora de la angiotensina y de los bloqueadores de los receptores de la angiotensina ha significado un gran paso de avance en el tratamiento de pacientes con esta patología al disminuir significativamente su mortalidad y morbilidad. La más reciente introducción de la droga identificada como angiotensin receptor–neprilysin inhibitor (LCZ696), lanzada en agosto 2014, con una aun mayor disminución de la mortalidad y morbilidad de la insuficiencia cardíaca y menos efectos secundarios, ofrece una valedera esperanza para el tratamiento de esta patología. El entrenamiento y la actividad física es otra área de tratamiento que está siendo completamente revalorada. Se revisan aquí aspectos fisiopatológicos que vinculan la práctica del ejercicio físico sistemático con la insuficiencia cardíaca y cómo se relacionan con la evolución clínica, morbilidad y mortalidad del paciente entrenado.
La insuficiencia cardíaca crónica se ha convertido en uno de los mayores problemas de salud a nivel global; 23 millones de personas padecen esta patología en todo el mundo y su edad de aparición ha variado notablemente en los últimos cinco decenios [1], en la medida en que aumenta la longevidad en la población, coincidiendo incluso con otras comorbilidades [2].
El tratamiento de la insuficiencia cardíaca también ha mostrado variaciones impresionantes durante los últimos años. Tal es el caso, por ejemplo, del cambio en el tratamiento de las drogas simpaticomiméticas por los agentes betabloqueadores [3],[4], que implica sobre todo un cambio conceptual en la interpretación fisiopatológica de este síndrome y por consiguiente, en su terapéutica [5]. La incorporación al tratamiento de la insuficiencia cardíaca de los fármacos inhibidores de la enzima convertidora de la angiotensina [6],[7] y de los bloqueadores de los receptores de la angiotensina [8],[9] han aportado un gran paso de avance en el tratamiento de pacientes con esta patología al disminuir significativamente su mortalidad y morbilidad. La más reciente introducción de la droga identificada como angiotensin receptor–neprilysin inhibitor (LCZ696), lanzada a la opinión médica internacional en el recientemente concluido Congreso Europeo de Cardiología, en Barcelona, en agosto 2014, conlleva una aun mayor disminución de la mortalidad y morbilidad de la insuficiencia cardíaca y menos efectos secundarios y ofrece por tanto una valedera esperanza en el tratamiento de los pacientes portadores de esta patología [10].
El entrenamiento y la actividad física es otra área de tratamiento que, en este marco, está siendo completamente revisada y revalorada, aun hoy en día.
Hace alrededor de dos décadas, el crecimiento cardíaco, la disminución de la función sistólica ventricular izquierda y la insuficiencia cardíaca eran consideradas contraindicaciones absolutas o relativas para el entrenamiento físico. Antiguas estrategias de tratamiento consideraban restricción casi absoluta de la actividad física y reposo en cama prolongado para todas las formas de insuficiencia cardíaca [11].
De acuerdo a la American Heart Association [12], la insuficiencia cardíaca puede ser definida como la incapacidad del corazón para cumplimentar las demandas de los tejidos corporales, la cual resulta en síntomas como fatiga o disnea de esfuerzo progresiva que puede evolutivamente estar presente también en reposo. Esta incapacidad para realizar esfuerzos físicos incluso ligeros, puede ser el primer síntoma experimentado por el paciente con insuficiencia cardíaca y con frecuencia es el motivo principal de consulta médica. Por tanto, la intolerancia al ejercicio está estrechamente vinculada al diagnóstico de esta entidad. Generalmente de inicio se indican pruebas para evaluar la función cardíaca en reposo -como el ecocardiograma- suponiendo que existe relación entre los índices de función ventricular en condiciones basales y la capacidad funcional o de realizar ejercicios. Sin embargo, es bien conocida la pobre correlación existente entre tales índices de función ventricular en reposo (como la fracción de eyección de ventrículo izquierdo) y la capacidad física del paciente [13].
La intolerancia al ejercicio es definida como la reducción de la capacidad para realizar actividades que incluyan movimientos dinámicos de grandes grupos musculares, debido a síntomas (disnea o fatiga) [12].
A) Cardiovasculares
La capacidad para realizar ejercicio físico aeróbico depende de la posibilidad de que el corazón aumente su gasto hacia los músculos ejercitados así como la capacidad de que esos músculos utilicen el oxígeno de la sangre que reciben. Ello determina el consumo máximo de oxígeno (Vo2máx) que se puede precisar mediante esta fórmula:
Vo2máx = gasto cardíaco x diferencia arterio-venosa de oxígeno
Durante el ejercicio máximo en posición vertical el gasto cardíaco comúnmente se incrementa de 4 a 6 veces en los sujetos sanos, lo que se acompaña de un aumento de la frecuencia cardíaca en 2 a 4 veces, así como un incremento del volumen sistólico de un 20 a un 50% debido a una contractilidad aumentada del ventrículo izquierdo que se consigue mediante la aplicación de la Ley de Frank-Starling y la vasodilatación periférica [12]. Ambos mecanismos facilitan el mayor vaciamiento del ventrículo izquierdo observado durante el ejercicio.
La principal característica de la insuficiencia cardíaca es la reducción en la capacidad para realizar ejercicio aeróbico, lo cual es resultado de un insuficiente flujo de sangre hacia los músculos esqueléticos que participan de la actividad y que es debido a un gasto cardíaco disminuido [12].
Los pacientes con insuficiencia cardíaca usualmente pueden alcanzar menos del 50% del gasto cardíaco máximo alcanzado por sujetos sanos en el pico del ejercicio. El volumen sistólico, que está ya disminuido en reposo, puede incrementarse solamente a 50 ó 65 ml/latido, en comparación con los 100 ml que pueden alcanzar los sujetos sanos. La insuficiencia para incrementar el vaciamiento sistólico del ventrículo izquierdo, así como su fracción de eyección, depende de una combinación de factores: disminución de la contractilidad miocárdica y de la respuesta β-adrenérgica, elevación de la resistencia vascular sistémica debido a un aumento de la actividad simpática y del sistema renina-angiotensina, así como a una pobre respuesta vasodilatadora arterial periférica al ejercicio.
En pacientes con cardiopatía isquémica el volumen sistólico puede caer durante el ejercicio si se desarrolla isquemia como resultado de una demanda de oxígeno miocárdica excesiva. Además con frecuencia se presenta regurgitación mitral durante el ejercicio en pacientes con insuficiencia cardíaca y disfunción sistólica debido a dilatación del anillo mitral. Esta regurgitación mitral relacionada con el ejercicio –que disminuye el volumen sistólico- puede ser atenuada con diversas drogas (vasodilatadores, diuréticos o inhibidores de la enzima convertidora de la angiotensina).
Existe una evidente correlación entre el grado de limitación de la capacidad aeróbica y la reducción del gasto cardíaco máximo: en pacientes con insuficiencia cardíaca puede observarse un consumo de oxígeno pico (Vo2pico) entre 10 y 20 ml/kg/min, mientras que en sujetos normales de alrededor de la quinta década de la vida, puede oscilar entre 30 y 40 ml/kg/min.
B) Factores periféricos:
La participación de factores periféricos en la limitación de la capacidad funcional en la insuficiencia cardíaca ha sido planteada debido a las siguientes evidencias:
Por tanto se considera que los trastornos de la función hemodinámica central no son suficientes para explicar la intolerancia al ejercicio en la insuficiencia cardíaca.
Dentro de los factores periféricos que provocan tal limitación a los ejercicios en pacientes con insuficiencia cardíaca se incluyen trastornos de los siguientes aspectos:
Anormalidades del flujo sanguíneo
En pacientes con insuficiencia cardíaca se observa una limitación para el incremento fisiológico del flujo sanguíneo muscular durante el ejercicio, lo cual es debido no solamente a una reducción del gasto cardíaco, sino además a un trastorno de la vasodilatación periférica.
Este deterioro de la capacidad vasodilatadora periférica ha sido atribuido a un aumento de la estimulación simpática, que causa vasoconstricción, activación del sistema renina-angiotensina en plasma y elevación de los niveles de endotelina [18],[19]. Un mecanismo adicional se atribuye a un endurecimiento vascular debido a un incremento del contenido vascular de sodio que se basa en que las membranas capilares basales pueden estar engrosadas y endurecidas en la insuficiencia cardíaca [20] y que la respuesta vascular es parcialmente mejorada por la terapia diurética [21].
Ha sido demostrado que los inhibidores de la enzima convertidora de la angiotensina normalizan parcialmente el deterioro de la vasodilatación después de su empleo a largo plazo [17],[22]. La mejoría del flujo sanguíneo periférico después de la inhibición de la enzima convertidora de la angiotensina produce un incremento proporcional de la capacidad de realizar ejercicios [22].
La hipótesis del “deacondicionamiento vascular” sugiere que el trastorno de la capacidad vasodilatadora se relaciona con la ausencia del uso de los músculos y que el entrenamiento de un miembro específico puede incrementar la respuesta vasodilatadora en la insuficiencia cardíaca [23],[24].
Función endotelial
El endotelio vascular libera sustancias vasoactivas que desempeñan un importante papel regulatorio del tono vasomotor periférico. Tales sustancias incluyen el óxido nítrico, las endotelinas y las prostaglandinas que son liberadas en respuesta a estímulos químicos, farmacológicos, mecánicos, así como por el ejercicio físico. El óxido nítrico es un importante mediador de vasodilatación dependiente de flujo y su liberación endotelial es estimulada por el ejercicio en sujetos sanos, sin embargo está atenuada en pacientes con insuficiencia cardíaca. Esto puede contribuir a una reducción de la vasodilatación periférica y en consecuencia de la perfusión tisular [12].
El deterioro de la vasodilatación dependiente del endotelio se correlaciona con el grado de intolerancia al ejercicio y con la severidad de la limitación funcional determinada por la precisión de la clase de la New York Heart Association [25]. Se ha demostrado que el entrenamiento físico incrementa la formación de óxido nítrico endotelial y por tanto de la vasodilatación dependiente del endotelio a nivel del músculo esquelético [26].
Trastornos en el metabolismo del músculo esquelético
En la insuficiencia cardíaca el metabolismo anaeróbico ocurre tempranamente durante el ejercicio, independientemente de la reducción del flujo sanguíneo; ésta es una causa importante de intolerancia al esfuerzo físico. En pacientes con insuficiencia cardíaca se presentan anormalidades en el metabolismo del músculo esquelético bajo condiciones de isquemia [27] que limitan la utilización de oxígeno durante el ejercicio. Enzimas mitocondriales con importante participación metabólica a nivel muscular esquelético se han encontrado disminuidas en estos casos [28]. Así, Sullivan y colaboradores [29] desde 1991encontraron una relación inversa entre la actividad de enzimas oxidativas y la acumulación de ácido láctico sanguíneo durante el ejercicio submáximo.
Estos hallazgos, entre otros, sugieren que diversos tipos de alteraciones en el músculo esquelético pueden contribuir a una extracción o utilización anormal del oxígeno acarreando una mayor limitación de la tolerancia al ejercicio y de la capacidad funcional en la insuficiencia cardíaca.
Distribución del gasto cardíaco
La tolerancia al ejercicio depende no solamente de la capacidad del sistema cardiopulmonar para distribuir oxígeno hacia el músculo ejercitado, sino además del flujo regional, o sea de la capacidad del sistema vascular para redistribuir el gasto cardíaco hacia los músculos durante el ejercicio. Alrededor del 85% del gasto cardíaco es redistribuido hacia los músculos ante ejercicios intensos en sujetos sanos [12]. Algunas evidencias sugieren que el flujo sanguíneo muscular se reduce paralelamente a la reducción del gasto cardíaco en la insuficiencia cardíaca [30], a lo que habría que añadir que la resistencia vascular a nivel muscular no disminuye normalmente en pacientes con esta patología y que el flujo hacia los tejidos no ejercitados puede ser mantenido sobre todo a expensas de una hipoperfusión de los músculos que participan del ejercicio [31]. Todo ello explica algunos de los motivos de la fatiga muscular presente en pacientes con insuficiencia cardíaca.
Activación de los ergorreflejos
En los músculos esqueléticos hay presentes fibras nerviosas aferentes que son sensibles a los cambios metabólicos relacionados con el trabajo muscular, denominados ergorreceptores, los cuales propician cambios o adaptaciones circulatorias que ocurren desde los estadios iniciales del ejercicio y que están anormalmente exacerbados en la insuficiencia cardíaca [32]. Tales receptores son estimulados por la acidosis metabólica y son parcialmente responsables de la vasoconstricción periférica simpática y el aumento de la frecuencia cardíaca presente en esta patología [33]. La activación de este reflejo contribuye a la respuesta hemodinámica, autonómica y ventilatoria anormal durante el ejercicio que caracterizan a la insuficiencia cardíaca.
El resultado de la activación de este ergorreflejo, que incluye también a los músculos respiratorios, es hiperventilación e incremento del tono simpático que causa un aumento de la resistencia periférica y en consecuencia una disminución de la perfusión muscular. La activación de estos ergorreflejos puede ser atenuada por la realización de entrenamiento físico sistemático [32].
Capacidad de ejercicios
La Figura 1 expresa la respuesta de varias adaptaciones fisiológicas a un programa de entrenamiento físico cardiorrespiratorio. Debido a la naturaleza del entrenamiento físico aeróbico resultan modificadas favorablemente las adaptaciones fisiológicas centrales y periféricas de manera que se incrementa la capacidad funcional y puede también modificarse la patología básica por sí misma.
Los pacientes portadores de insuficiencia cardíaca con fracción de eyección de ventrículo izquierdo disminuida presentan como característica clínica la disnea y fatiga prematura al ejercicio, tanto de miembros superiores como inferiores y por consiguiente una capacidad funcional reducida [34]. Esta disminución en la tolerancia al ejercicio usualmente es cuantificada mediante la determinación del Vo2pico [35] y es causada por trastornos de la función cardíaca, pulmonar o vascular periférica, así como de la función muscular esquelética y respiratoria [36],[37],[38]. La mejoría de la capacidad de ejercicios es consistente con el incremento del Vo2pico, lo cual ha sido reportado en estudios de meta-análisis ejecutados por Hwang y Marwick [39].
Adaptaciones centrales
Hace algunos decenios se consideraba que el ejercicio físico, incluyendo el aeróbico, en pacientes con insuficiencia cardíaca y fracción de eyección de ventrículo izquierdo disminuida podía producir un incremento adicional del daño de la función de ventrículo izquierdo. Sin embargo, un meta-análisis de Haykowsky y colaboradores [40] demostró que el ejercicio físico regular produjo una reversión moderada de la remodelación de ventrículo izquierdo en pacientes con infarto cardíaco en comparación con un grupo control que no se ejercitaba. Esto se evidenció por un incremento medio de la fracción de eyección de ventrículo izquierdo de 2,6 puntos porcentuales (intervalo de confianza de 95%: 1,4%-3,7%; 9 ensayos, n = 538 pacientes), así como por una reducción media de 12 ml del volumen telediastólico de ventrículo izquierdo (intervalo de confianza de 95%: -20 a −3 mL; 5 ensayos, 85 pacientes). Wisloff y colaboradores [41] también encontraron un incremento de un 10% de la fracción de eyección y una reducción de un 18% del volumen telediastólico del ventrículo izquierdo al emplear un régimen de ejercicios a intervalos y de alta intensidad y compararlo con un régimen continuo de moderada intensidad en pacientes con insuficiencia cardíaca.
Diversos artículos han reportado un incremento del gasto cardíaco pico de hasta un 21% después de un régimen de entrenamiento físico en pacientes con insuficiencia cardíaca y fracción de eyección de ventrículo izquierdo reducida lo cual ha sido relacionado con un aumento de la frecuencia cardíaca y del volumen sistólico en tales pacientes [42],[43].
Adaptaciones periféricas
Durante la realización de ejercicio físico hay presencia de un aumento del flujo sanguíneo hacia el músculo esquelético y de la demanda de oxígeno lo cual es normalmente garantizado por una dilatación arterial y un incremento del gasto cardíaco. Sin embargo, en pacientes con insuficiencia cardíaca crónica el aporte de sangre y sus nutrientes durante el ejercicio se encuentra disminuido debido a una reducción de la dilatación arteriolar y del gasto cardíaco, lo cual es consecuencia de una vasoconstricción mediada por mecanismos neurohormonales [44],[45] y a una disfunción endotelial.
Normalmente el flujo sanguíneo incrementado durante el ejercicio es causante del conocido shear stress a nivel endotelial que produce liberación de óxido nítrico. En presencia de insuficiencia cardíaca este mecanismo está alterado debido a la disminución del flujo sanguíneo, aumento del estrés oxidativo [46] y daño consecuente de la médula ósea debido a la afectación de las células progenitoras que son responsables en parte de la reparación del daño vascular [47].
Según diversos autores [26],[41], tanto el entrenamiento aeróbico como el de resistencia revierten parcialmente tal disminución del flujo sanguíneo local debido a la disfunción endotelial, efecto que parece representar más bien una adaptación sistémica que una solamente local. Además se observó en pacientes con insuficiencia cardíaca una mejoría de la función endotelial de los vasos de los miembros más activos durante el ejercicio como también en los miembros menos activos [48],[49]. En pacientes con insuficiencia cardíaca en Clase IIIb de la New York Heart Association, con una fracción de eyección de ventrículo izquierdo media de 24%, el entrenamiento físico produjo un incremento de un 7% de la dilatación mediada por flujo, como expresión de la mejoría de la disfunción endotelial [50].
En pacientes con insuficiencia cardíaca están elevados los niveles séricos y tisulares de citoquinas proinflamatorias, los que se asocian con progresión de la enfermedad [51]; tales niveles son reducidos por el entrenamiento físico [52],[53],[54]. Aplicando un programa de 20 minutos diarios de bicicleta ergométrica estacionaria durante seis meses, Gielen y colaboradores [52],[53] demostraron que el factor de necrosis tumoral α, la interleukina-1β y la interleukina-6, estuvieron disminuidas en 38, 48 y 42% respectivamente, comprobando una correlación positiva entre el entrenamiento físico en la insuficiencia cardíaca con una reducción local de la inflamación y una mejoría de la capacidad oxidativa a nivel del músculo esquelético.
Un hallazgo consistente se manifiesta en el incremento de la actividad de la enzima oxidativa en el interior de la mitocondria del músculo esquelético [34],[53], contribuyendo a una mejor utilización del oxígeno circulante. También se ha relacionado el ejercicio físico regular con la densidad capilar, así como con la disminución de fibra muscular tipo I, con lenta capacidad oxidativa, que se desarrolla en la insuficiencia cardíaca [55].
Usualmente se han excluido los ejercicios de resistencia dentro del entrenamiento físico de pacientes con insuficiencia cardíaca y fracción de eyección de ventrículo izquierdo disminuida [12],[34],[56],[57], sin embargo dichos ejercicios pueden ser considerados en pacientes seleccionados. En estos pacientes la fuerza y tamaño muscular suelen estar reducidos lo que contribuye a su capacidad física disminuida e incapacidad para realizar diversas actividades de la vida diaria [58],[59]. El entrenamiento regular de resistencia incrementa la fuerza muscular sin efectos hemodinámicos adversos o cambios en las características de ventrículo izquierdo [58],[60]. Mediante el empleo del entrenamiento de resistencia en estos pacientes ha sido reportado un incremento mayor de un 20 a un 30% de la fuerza muscular [59], sin embargo la mejoría de la capacidad funcional aeróbica aún no ha sido definitivamente confirmada [58],[59].
Diversos estudios han comprobado que pacientes portadores de insuficiencia cardíaca con fracción de eyección de ventrículo izquierdo comprometida e incorporados a programas de entrenamiento físico supervisado, han obtenido un incremento de su capacidad física y de otros parámetros fisiológicos sin afectaciones a su seguridad personal. Así Smart y Marwick [61] no reportaron fallecidos en más de 60 000 horas de entrenamiento físico en estos casos y en el estudio multicéntrico HF-ACTION [62]. De acuerdo a sus resultados, concluyeron que el ejercicio aeróbico regular es seguro en pacientes con insuficiencia cardíaca estable crónica. En este estudio, con un tiempo de seguimiento medio de 30 meses, se comprobó la eficacia clínica del entrenamiento físico en pacientes con insuficiencia cardíaca en comparación con un grupo que sólo siguió un régimen de tratamiento y cuidados habituales. Se observó una modesta pero significativa reducción (11%) en la mortalidad general u hospitalización (adjusted HR 0,89; intervalo de confianza de 95%: 0,81-0,99; p=0,03), así como una reducción no significativa en la hospitalización y mortalidad cardiovascular (adjusted HR, 0,91; intervalo de confianza de 95%: 0,82-1,01; p=0,09) [62]. En relación con el importante objetivo combinado de disminución de la hospitalización y mortalidad cardiovascular, HF-ACTION demostró una reducción de un 15% en su riesgo ajustado (adjusted HR 0,85; intervalo de confianza de 95%: 0,74-0,99; p=0,03), lo cual fue atribuido al entrenamiento físico [62]. Otros autores han reportado resultados favorables similares [63].
Teniendo en cuenta la totalidad de los datos hasta el presente parece apropiado concluir que el entrenamiento físico aeróbico en pacientes con insuficiencia cardíaca ejerce un efecto favorable, aunque quizás modesto, sobre variados parámetros clínicos importantes, como mortalidad y hospitalización cardiovascular entre otros.
Calidad de vida
Van Tol y colaboradores [43], en un meta-análisis publicado en 2006, señalaron un efecto favorable significativo del ejercicio físico sobre la calidad de vida relacionada con salud (evaluado mediante el cuestionario de Minnesota), en pacientes con insuficiencia cardíaca.
En el estudio HF-ACTION [64], mediante el empleo del cuestionario de Kansas City, también se reportó un incremento significativo de la calidad de vida como efecto del entrenamiento físico en pacientes con insuficiencia cardíaca a los tres meses del inicio del programa de ejercicios, en comparación con similares pacientes a los que se les proporcionaron cuidados habituales; esta mejoría del grupo entrenado se mantuvo evolutivamente.
Prescripción de ejercicios
Uno de los principales objetivos del entrenamiento físico en la insuficiencia cardíaca es revertir la intolerancia al ejercicio que presentan estos pacientes, lo que se evidencia mediante la determinación del Vo2pico. Por tanto, deben ser indicados ejercicios que estimulen el sistema cardio-respiratorio (caminata, trote, carrera, bicicleta, etcétera). Otros beneficios clínicos adicionales han sido comprobados en pacientes con disfunción ventricular severa o insuficiencia cardíaca incorporados a un régimen de ejercicios físicos. Estos se han reportado en diversas publicaciones médicas [34],[61],[62],[65],[66],[67] utilizando las mismas modalidades de ejercicios.
Para conseguir tales efectos funcionales favorables mediante el entrenamiento físico es indispensable el cumplimiento de los principios fundamentales que deben regir todo programa de ejercicios físicos, tanto en pacientes con insuficiencia cardíaca como con otra patología cardiovascular [34],[68],[69]. Tales principios fundamentales del entrenamiento físico son: intensidad, duración, frecuencia, tipo de ejercicio e individualización.
El progreso de las sesiones de ejercicios debe hacerse de manera individualizada en cada paciente de manera que se incrementen lenta y progresivamente la intensidad del esfuerzo, la duración del ejercicio y la frecuencia semanal de las sesiones. La duración y frecuencia óptimas a alcanzar ha de ser de 30 minutos continuos de ejercicios por sesión, realizadas cuatro o cinco veces por semana respectivamente. En pacientes con insuficiencia cardíaca y muy baja capacidad funcional puede iniciarse con sesiones intermitentes de ejercicios de manera que puedan ofrecerse tres o cuatro tandas separadas por breves períodos de “reposo activo” que finalmente sumen los 30 minutos referidos [70], o más. El procedimiento ideal consiste en disminuir los períodos de reposo y aumentar el tiempo de ejercicio continuo hasta alcanzar los 30 minutos, en el transcurso de varias semanas. Keteyian [34] sugiere incrementar progresivamente la duración y frecuencia de los ejercicios hasta los niveles deseados antes de aumentar la intensidad del esfuerzo.
En relación al manejo de la intensidad del esfuerzo, el método empleado más generalizado es el conocido como “frecuencia cardíaca de reserva”, que determinará el “pulso de entrenamiento”, que debe ser progresivamente ajustado o incrementado hasta que alcance un rango de 60 a 80% de la fórmula empleada: (frecuencia cardíaca pico – frecuencia cardíaca basal) 0,6 a 0,8 + frecuencia cardíaca basal [34], [68],[69],[70],[71]. En pacientes con arritmias cardíacas, como fibrilación auricular o con contracciones ventriculares prematuras frecuentes, que interfieren con una medición segura de la frecuencia cardíaca durante el ejercicio, su intensidad puede ser guiada mediante la escala de esfuerzo percibido de Borg [70],[72].
En la insuficiencia cardíaca también se observan alteraciones de la función muscular esquelética (tamaño y fuerza) lo que contribuye a la reducción de la capacidad física de estos pacientes, por tanto puede considerarse la incorporación de ejercicios de resistencia al programa de entrenamiento general en casos seleccionados.
Esta revisión se ha centrado en pacientes con insuficiencia cardíaca debida a disfunción sistólica, sin embargo en presencia de esta patología con fracción de eyección conservada se manifiestan similares síntomas de intolerancia al ejercicio (disnea y fatiga temprana) y los riesgos de mortalidad y re-hospitalización son similares [73],[74], por tanto es de esperar que los ejercicios físicos también jueguen un papel positivo en el tratamiento de estos pacientes.
Recientes estudios comprobaron que el entrenamiento físico incrementó la capacidad de ejercicios y la calidad de vida en pacientes con insuficiencia cardíaca y fracción de eyección de ventrículo izquierdo conservada sin cambios en la función diastólica de ventrículo izquierdo [75],[76].
Como conclusión de la presente revisión podemos afirmar que el entrenamiento físico en pacientes con insuficiencia cardíaca crónica adecuadamente seleccionados es seguro, incrementa la capacidad funcional y la calidad de vida, así como que atenúa muchas de las respuestas fisiopatológicas que se desarrollan en estos casos. Además proporciona una modesta pero significativa reducción de eventos clínicos tales como mortalidad y morbilidad cardiovascular, con menos nuevas hospitalizaciones.
Se requieren investigaciones futuras, algunas ya en ejecución, para identificar los subgrupos de pacientes con insuficiencia cardíaca, incluyendo aquellos con fracción de eyección conservada, que se podrían beneficiar más del entrenamiento físico, así como precisar la dosis óptima necesaria para disminuir los síntomas relacionados con esta patología e incrementar al máximo los beneficios clínicos.
Manuscrito publicado previamente en Research Gate.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos intereses del ICMJE traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.

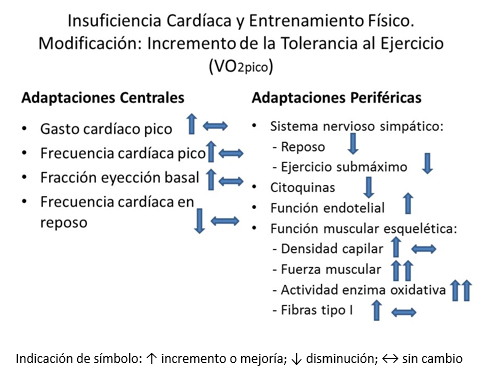 Figura 1. Resumen de principales adaptaciones fisiológicas relacionadas con ejercicio físico regular de tipo aeróbico en pacientes con insuficiencia cardíaca.
Figura 1. Resumen de principales adaptaciones fisiológicas relacionadas con ejercicio físico regular de tipo aeróbico en pacientes con insuficiencia cardíaca.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Chronic heart failure has become one of the main global health problems; 23 million people suffer from this disease worldwide and age of onset has varied considerably over the past five decades, coinciding with other co-morbidities as longevity in the population increases. Treatment of heart failure has also shown striking variations in recent years. Such is the case of the substitution of sympathomimetic drugs by beta-blocking agents, which primarily means a conceptual change in the pathophysiological interpretation of this syndrome. Incorporating to the treatment of heart failure drugs such as angiotensin converting enzyme inhibitors and angiotensin receptor blockers has meant a great step forward in the treatment of patients with this condition that significantly has decreased mortality and morbidity. The latest introduction of the drug identified as angiotensin receptor-neprilysin inhibitor (LCZ696), launched in August 2014 with an even greater reduction in mortality and morbidity of heart failure and fewer side effects, offers a valid hope in the treatment of this pathology. Training and physical activity is another area of treatment being completely reassessed. Pathophysiological aspects that link the practice of systematic physical exercise with heart failure and how they both relate to clinical outcomes, morbidity and mortality in the trained patient are reviewed in this paper.
 Autores:
Eduardo Rivas Estany[1], Susana Hernández García[1]
Autores:
Eduardo Rivas Estany[1], Susana Hernández García[1]

Citación: Rivas Estany E, Hernández García S. Physical training in chronic heart failure: pathophysiology and clinical evolution. Medwave 2016 Sep;16(Suppl4):e6517 doi: 10.5867/medwave.2016.6517
Fecha de publicación: 5/9/2016
Origen: Este artículo forma parte del Suplemento 4 Especial de Cardiología cuyo editor invitado es el Dr. Alberto Morales Salinas, Cardiocentro "Ernesto Che Guevara", Villa Clara; Grupo Nacional de Cardiología, Ministerio de Salud Pública, Cuba

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Hunt SA. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol. 2005 Sep 20;46(6):e1-82. | CrossRef | PubMed |
Hunt SA. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol. 2005 Sep 20;46(6):e1-82. | CrossRef | PubMed | Rivas E. Cáncer e insuficiencia cardíaca. ¿Hay relación entre ellos?. Rev Cubana Cardiol Cir Cardiovasc. 2014;20:75-7. | Link |
Rivas E. Cáncer e insuficiencia cardíaca. ¿Hay relación entre ellos?. Rev Cubana Cardiol Cir Cardiovasc. 2014;20:75-7. | Link | Packer M, Coats AJ, Fowler MB, Katus HA, Krum H, Mohacsi P, et al. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med. 2001 May 31;344(22):1651-8. | PubMed |
Packer M, Coats AJ, Fowler MB, Katus HA, Krum H, Mohacsi P, et al. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med. 2001 May 31;344(22):1651-8. | PubMed | Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999 Jun 12;353(9169):2001-7. | PubMed |
Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999 Jun 12;353(9169):2001-7. | PubMed | Working Group on Cardiac Rehabilitation & Exercice Physiology and Working Group on Heart Failure of the European Society of Cardiology. Recommendations for exercise training in chronic heart failure patients. Eur Heart J. 2001 Jan;22(2):125-35. | PubMed |
Working Group on Cardiac Rehabilitation & Exercice Physiology and Working Group on Heart Failure of the European Society of Cardiology. Recommendations for exercise training in chronic heart failure patients. Eur Heart J. 2001 Jan;22(2):125-35. | PubMed | The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure: results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N N Engl J Med. 1987 Jun 4;316(23):1429-35.
| CrossRef | PubMed |
The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure: results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N N Engl J Med. 1987 Jun 4;316(23):1429-35.
| CrossRef | PubMed | Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. The SOLVD Investigators. N Engl J Med. 1991 Aug 1;325(5):293-302. | PubMed |
Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. The SOLVD Investigators. N Engl J Med. 1991 Aug 1;325(5):293-302. | PubMed | Young JB, Dunlap ME, Pfeffer MA, Probstfield JL, Cohen-Solal A, Dietz R,. Mortality and morbidity reduction with Candesartan in patients with chronic heart failure and left ventricular systolic dysfunction: results of the CHARM low-left ventricular ejection fraction trials. Circulation. 2004 Oct 26;110(17):2618-26. | PubMed |
Young JB, Dunlap ME, Pfeffer MA, Probstfield JL, Cohen-Solal A, Dietz R,. Mortality and morbidity reduction with Candesartan in patients with chronic heart failure and left ventricular systolic dysfunction: results of the CHARM low-left ventricular ejection fraction trials. Circulation. 2004 Oct 26;110(17):2618-26. | PubMed | Cohn JN, Tognoni G; Valsartan Heart Failure Trial Investigators. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med. 2001 Dec 6;345(23):1667-75. | PubMed |
Cohn JN, Tognoni G; Valsartan Heart Failure Trial Investigators. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med. 2001 Dec 6;345(23):1667-75. | PubMed | McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014 Sep 11;371(11):993-1004. | CrossRef | PubMed |
McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014 Sep 11;371(11):993-1004. | CrossRef | PubMed | Burch GE, McDonald CD, Walsh JJ. The effect of prolonged bed rest on postpartal cardiomyopathy. Am Heart J. 1971 Feb;81(2):186-201. | PubMed |
Burch GE, McDonald CD, Walsh JJ. The effect of prolonged bed rest on postpartal cardiomyopathy. Am Heart J. 1971 Feb;81(2):186-201. | PubMed | Piña IL, Apstein CS, Balady GJ, Belardinelli R, Chaitman BR, Duscha BD,. Exercise and heart failure: A statement from the American Heart Association Committee on exercise, rehabilitation, and prevention. Circulation. 2003 Mar 4;107(8):1210-25. | PubMed |
Piña IL, Apstein CS, Balady GJ, Belardinelli R, Chaitman BR, Duscha BD,. Exercise and heart failure: A statement from the American Heart Association Committee on exercise, rehabilitation, and prevention. Circulation. 2003 Mar 4;107(8):1210-25. | PubMed | Franciosa JA, Park M, Levine TB. Lack of correlation between exercise capacity and indexes of resting left ventricular performance in heart failure. Am J Cardiol. 1981 Jan;47(1):33-9. | PubMed |
Franciosa JA, Park M, Levine TB. Lack of correlation between exercise capacity and indexes of resting left ventricular performance in heart failure. Am J Cardiol. 1981 Jan;47(1):33-9. | PubMed | Sullivan MJ, Hawthorne MH. Exercise intolerance in patients with chronic heart failure. Prog Cardiovasc Dis. 1995 Jul-Aug;38(1):1-22. | PubMed |
Sullivan MJ, Hawthorne MH. Exercise intolerance in patients with chronic heart failure. Prog Cardiovasc Dis. 1995 Jul-Aug;38(1):1-22. | PubMed | Myers J, Froelicher VF. Hemodynamic determinants of exercise capacity in chronic heart failure. Ann Intern Med. 1991 Sep 1;115(5):377-86. | PubMed |
Myers J, Froelicher VF. Hemodynamic determinants of exercise capacity in chronic heart failure. Ann Intern Med. 1991 Sep 1;115(5):377-86. | PubMed | Wilson JR, Martin JL, Ferraro N. Impaired skeletal muscle nutritive flow during exercise in patients with congestive heart failure: role of cardiac pump dysfunction as determined by the effect of dobutamine. Am J Cardiol. 1984 May 1;53(9):1308-15. | PubMed |
Wilson JR, Martin JL, Ferraro N. Impaired skeletal muscle nutritive flow during exercise in patients with congestive heart failure: role of cardiac pump dysfunction as determined by the effect of dobutamine. Am J Cardiol. 1984 May 1;53(9):1308-15. | PubMed | Drexler H, Banhardt U, Meinertz T, Wollschläger H, Lehmann M, Just H. Contrasting peripheral short-term and long-term effects of converting enzyme inhibition in patients with congestive heart failure. A double-blind,placebo-controlled trial. Circulation. 1989 Mar;79(3):491-502. | PubMed |
Drexler H, Banhardt U, Meinertz T, Wollschläger H, Lehmann M, Just H. Contrasting peripheral short-term and long-term effects of converting enzyme inhibition in patients with congestive heart failure. A double-blind,placebo-controlled trial. Circulation. 1989 Mar;79(3):491-502. | PubMed | Zelis R, Sinoway LI, Musch TI, Davis D, Just H. Regional blood flow in congestive heart failure: concept of compensatory mechanisms with short and long time constants. Am J Cardiol. 1988 Sep 9;62(8):2E-8E. | PubMed |
Zelis R, Sinoway LI, Musch TI, Davis D, Just H. Regional blood flow in congestive heart failure: concept of compensatory mechanisms with short and long time constants. Am J Cardiol. 1988 Sep 9;62(8):2E-8E. | PubMed | McMurray JJ, Ray SG, Abdullah I, Dargie HJ, Morton JJ. Plasma endothelin in chronic heart failure. Circulation. 1992 Apr;85(4):1374-9. | PubMed |
McMurray JJ, Ray SG, Abdullah I, Dargie HJ, Morton JJ. Plasma endothelin in chronic heart failure. Circulation. 1992 Apr;85(4):1374-9. | PubMed | Longhurst J, Capone RJ, Zelis R. Evaluation of skeletal muscle capillary basement membrane thickness in congestive heart failure. Chest. 1975 Feb;67(2):195-8. | PubMed |
Longhurst J, Capone RJ, Zelis R. Evaluation of skeletal muscle capillary basement membrane thickness in congestive heart failure. Chest. 1975 Feb;67(2):195-8. | PubMed | Sinoway L, Minotti J, Musch T, Goldner D, Davis D, Leaman D, Zelis R. Enhanced metabolic vasodilation secondary to diuretic therapy in decompensated congestive heart failure secondary to coronary artery disease. Am J Cardiol. 1987 Jul 1;60(1):107-11. | PubMed |
Sinoway L, Minotti J, Musch T, Goldner D, Davis D, Leaman D, Zelis R. Enhanced metabolic vasodilation secondary to diuretic therapy in decompensated congestive heart failure secondary to coronary artery disease. Am J Cardiol. 1987 Jul 1;60(1):107-11. | PubMed | Wilson JR, Ferraro N. Effect of the renin-angiotensin system on limb circulation and metabolism during exercise in patients with heart failure. J Am Coll Cardiol. 1985 Sep;6(3):556-63. | PubMed |
Wilson JR, Ferraro N. Effect of the renin-angiotensin system on limb circulation and metabolism during exercise in patients with heart failure. J Am Coll Cardiol. 1985 Sep;6(3):556-63. | PubMed | Sinoway LI, Shenberger J, Wilson J, McLaughlin D, Musch T, Zelis R. A 30-day forearm work protocol increases maximal forearm blood flow. J Appl Physiol (1985). 1987 Mar;62(3):1063-7. | PubMed |
Sinoway LI, Shenberger J, Wilson J, McLaughlin D, Musch T, Zelis R. A 30-day forearm work protocol increases maximal forearm blood flow. J Appl Physiol (1985). 1987 Mar;62(3):1063-7. | PubMed | Sinoway LI. Effect of conditioning and deconditioning stimuli on metabolically determined blood flow in humans and implications for congestive heart failure. Am J Cardiol. 1988 Sep 9;62(8):45E-48E. | PubMed |
Sinoway LI. Effect of conditioning and deconditioning stimuli on metabolically determined blood flow in humans and implications for congestive heart failure. Am J Cardiol. 1988 Sep 9;62(8):45E-48E. | PubMed | Nakamura M, Ishikawa M, Funakoshi T, Hashimoto K, Chiba M, Hiramori K. Attenuated endothelium-dependent peripheral vasodilation and clinical characteristics in patients with chronic heart failure. Am Heart J. 1994 Dec;128(6 Pt 1):1164-9. | PubMed |
Nakamura M, Ishikawa M, Funakoshi T, Hashimoto K, Chiba M, Hiramori K. Attenuated endothelium-dependent peripheral vasodilation and clinical characteristics in patients with chronic heart failure. Am Heart J. 1994 Dec;128(6 Pt 1):1164-9. | PubMed | Hambrecht R, Fiehn E, Weigl C, Gielen S, Hamann C, Kaiser R, et al. Regular physical exercise corrects endothelial dysfunction and improves exercise capacity in patients with chronic heart failure. Circulation. 1998 Dec 15;98(24):2709-15. | PubMed |
Hambrecht R, Fiehn E, Weigl C, Gielen S, Hamann C, Kaiser R, et al. Regular physical exercise corrects endothelial dysfunction and improves exercise capacity in patients with chronic heart failure. Circulation. 1998 Dec 15;98(24):2709-15. | PubMed | Massie BM, Conway M, Rajagopalan B, Yonge R, Frostick S, Ledingham J, Sleight P, Radda G. Skeletal muscle metabolism during exercise under ischemic conditions in congestive heart failure. Evidence for abnormalities unrelated to blood flow. Circulation. 1988 Aug;78(2):320-6. | PubMed |
Massie BM, Conway M, Rajagopalan B, Yonge R, Frostick S, Ledingham J, Sleight P, Radda G. Skeletal muscle metabolism during exercise under ischemic conditions in congestive heart failure. Evidence for abnormalities unrelated to blood flow. Circulation. 1988 Aug;78(2):320-6. | PubMed | Sullivan MJ, Green HJ, Cobb FR. Skeletal muscle biochemistry and histology in ambulatory patients with long-term heart failure. Circulation. 1990 Feb;81(2):518-27. | PubMed |
Sullivan MJ, Green HJ, Cobb FR. Skeletal muscle biochemistry and histology in ambulatory patients with long-term heart failure. Circulation. 1990 Feb;81(2):518-27. | PubMed | Sullivan MJ, Green HJ, Cobb FR. Altered skeletal muscle metabolic response to exercise in chronic heart failure. Relation to skeletal muscle aerobic enzyme activity. Circulation. 1991 Oct;84(4):1597-607. | PubMed |
Sullivan MJ, Green HJ, Cobb FR. Altered skeletal muscle metabolic response to exercise in chronic heart failure. Relation to skeletal muscle aerobic enzyme activity. Circulation. 1991 Oct;84(4):1597-607. | PubMed | Yamabe H, Itoh K, Yasaka Y, Takata T, Yokoyama M. The role of cardiac output response in blood flow distribution during exercise in patients with chronic heart failure. Eur Heart J. 1995 Jul;16(7):951-60. | PubMed |
Yamabe H, Itoh K, Yasaka Y, Takata T, Yokoyama M. The role of cardiac output response in blood flow distribution during exercise in patients with chronic heart failure. Eur Heart J. 1995 Jul;16(7):951-60. | PubMed | Wada O, Asanoi H, Miyagi K, Ishizaka S, Kameyama T, Ishise H, et al. Quantitative evaluation of blood flow distribution to exercising and resting skeletal muscles in patients with cardiac dysfunction using whole-body thallium-201 scintigraphy. Clin Cardiol. 1997 Sep;20(9):785-90. | PubMed |
Wada O, Asanoi H, Miyagi K, Ishizaka S, Kameyama T, Ishise H, et al. Quantitative evaluation of blood flow distribution to exercising and resting skeletal muscles in patients with cardiac dysfunction using whole-body thallium-201 scintigraphy. Clin Cardiol. 1997 Sep;20(9):785-90. | PubMed | Piepoli M, Clark AL, Volterrani M, Adamopoulos S, Sleight P, Coats AJ. Contribution of muscle afferents to the hemodynamic, autonomic, and ventilatory responses to exercise in patients with chronic heart failure: effects of physical training. Circulation. 1996 Mar 1;93(5):940-52. | PubMed |
Piepoli M, Clark AL, Volterrani M, Adamopoulos S, Sleight P, Coats AJ. Contribution of muscle afferents to the hemodynamic, autonomic, and ventilatory responses to exercise in patients with chronic heart failure: effects of physical training. Circulation. 1996 Mar 1;93(5):940-52. | PubMed | Rowell LB, O'Leary DS. Reflex control of the circulation during exercise: chemoreflexes and mechanoreflexes. J Appl Physiol (1985). 1990 Aug;69(2):407-18. | PubMed |
Rowell LB, O'Leary DS. Reflex control of the circulation during exercise: chemoreflexes and mechanoreflexes. J Appl Physiol (1985). 1990 Aug;69(2):407-18. | PubMed | Keteyian SJ. Exercise training in congestive heart failure: risks and benefits. Prog Cardiovasc Dis. 2011 May-Jun;53(6):419-28. | CrossRef | PubMed |
Keteyian SJ. Exercise training in congestive heart failure: risks and benefits. Prog Cardiovasc Dis. 2011 May-Jun;53(6):419-28. | CrossRef | PubMed | Rivas E, López N. Evaluación objetiva de la capacidad funcional: el papel de la prueba de esfuerzo cardiorrespiratoria. CorSalud. 2013;5:232-6. | Link |
Rivas E, López N. Evaluación objetiva de la capacidad funcional: el papel de la prueba de esfuerzo cardiorrespiratoria. CorSalud. 2013;5:232-6. | Link | Duscha BD, Annex BH, Green HJ, Pippen AM, Kraus WE. Deconditioning fails to explain peripheral skeletal muscle alterations in men with chronic heart failure. J Am Coll Cardiol. 2002 Apr 3;39(7):1170-4. | PubMed |
Duscha BD, Annex BH, Green HJ, Pippen AM, Kraus WE. Deconditioning fails to explain peripheral skeletal muscle alterations in men with chronic heart failure. J Am Coll Cardiol. 2002 Apr 3;39(7):1170-4. | PubMed | Piepoli MF, Kaczmarek A, Francis DP, Davies LC, Rauchhaus M, Jankowska EA, et al. Reduced peripheral skeletal muscle mass and abnormal reflex physiology in chronic heart failure. Circulation. 2006 Jul 11;114(2):126-34. | PubMed |
Piepoli MF, Kaczmarek A, Francis DP, Davies LC, Rauchhaus M, Jankowska EA, et al. Reduced peripheral skeletal muscle mass and abnormal reflex physiology in chronic heart failure. Circulation. 2006 Jul 11;114(2):126-34. | PubMed | Olson TP, Snyder EM, Johnson BD. Exercise-disordered breathing in chronic heart failure. Exerc Sport Sci Rev. 2006 Oct;34(4):194-201. | PubMed |
Olson TP, Snyder EM, Johnson BD. Exercise-disordered breathing in chronic heart failure. Exerc Sport Sci Rev. 2006 Oct;34(4):194-201. | PubMed | Hwang R, Marwick T. Efficacy of home-based exercise programmes for people with chronic heart failure: a meta-analysis. Eur J Cardiovasc Prev Rehabil. 2009 Oct;16(5):527-35. | CrossRef | PubMed |
Hwang R, Marwick T. Efficacy of home-based exercise programmes for people with chronic heart failure: a meta-analysis. Eur J Cardiovasc Prev Rehabil. 2009 Oct;16(5):527-35. | CrossRef | PubMed | Haykowsky MJ, Liang Y, Pechter D, Jones LW, McAlister FA, Clark AM. A meta-analysis of the effect of exercise training on left ventricular remodeling
in heart failure patients: the benefit depends on the type of training performed.
J Am Coll Cardiol. 2007 Jun 19;49(24):2329-36. | PubMed |
Haykowsky MJ, Liang Y, Pechter D, Jones LW, McAlister FA, Clark AM. A meta-analysis of the effect of exercise training on left ventricular remodeling
in heart failure patients: the benefit depends on the type of training performed.
J Am Coll Cardiol. 2007 Jun 19;49(24):2329-36. | PubMed | Wisløff U, Støylen A, Loennechen JP, Bruvold M, Rognmo Ø, Haram PM, et al. Superior cardiovascular effect of aerobic interval training versus moderate continuous training in heart failure patients: a randomized study. Circulation. 2007 Jun 19;115(24):3086-94. | PubMed |
Wisløff U, Støylen A, Loennechen JP, Bruvold M, Rognmo Ø, Haram PM, et al. Superior cardiovascular effect of aerobic interval training versus moderate continuous training in heart failure patients: a randomized study. Circulation. 2007 Jun 19;115(24):3086-94. | PubMed | Mezzani A, Corrà U, Giannuzzi P. Central adaptations to exercise training in patients with chronic heart failure. Heart Fail Rev. 2008 Feb;13(1):13-20. | PubMed |
Mezzani A, Corrà U, Giannuzzi P. Central adaptations to exercise training in patients with chronic heart failure. Heart Fail Rev. 2008 Feb;13(1):13-20. | PubMed | van Tol BA, Huijsmans RJ, Kroon DW, Schothorst M, Kwakkel G. Effects of exercise training on cardiac performance, exercise capacity and quality of life in patients with heart failure: a meta-analysis. Eur J Heart Fail. 2006 Dec;8(8):841-50. | PubMed |
van Tol BA, Huijsmans RJ, Kroon DW, Schothorst M, Kwakkel G. Effects of exercise training on cardiac performance, exercise capacity and quality of life in patients with heart failure: a meta-analysis. Eur J Heart Fail. 2006 Dec;8(8):841-50. | PubMed | Triposkiadis F, Karayannis G, Giamouzis G, Skoularigis J, Louridas G, Butler J. The sympathetic nervous system in heart failure physiology, pathophysiology, and clinical implications. J Am Coll Cardiol. 2009 Nov 3;54(19):1747-62. | CrossRef | PubMed |
Triposkiadis F, Karayannis G, Giamouzis G, Skoularigis J, Louridas G, Butler J. The sympathetic nervous system in heart failure physiology, pathophysiology, and clinical implications. J Am Coll Cardiol. 2009 Nov 3;54(19):1747-62. | CrossRef | PubMed | Itoh K, Osada N, Inoue K, Samejima H, Seki A, Omiya K, Miyake F. Relationship between exercise intolerance and levels of neurohormonal factors and proinflammatory cytokines in patients with stable chronic heart failure. Int Heart J. 2005 Nov;46(6):1049-59. | PubMed |
Itoh K, Osada N, Inoue K, Samejima H, Seki A, Omiya K, Miyake F. Relationship between exercise intolerance and levels of neurohormonal factors and proinflammatory cytokines in patients with stable chronic heart failure. Int Heart J. 2005 Nov;46(6):1049-59. | PubMed | Landmesser U, Spiekermann S, Dikalov S, Tatge H, Wilke R, Kohler C, et al. Vascular oxidative stress and endothelial dysfunction in patients with chronic heart failure: role of xanthine-oxidase and extracellular superoxide dismutase. Circulation. 2002 Dec 10;106(24):3073-8.
| PubMed |
Landmesser U, Spiekermann S, Dikalov S, Tatge H, Wilke R, Kohler C, et al. Vascular oxidative stress and endothelial dysfunction in patients with chronic heart failure: role of xanthine-oxidase and extracellular superoxide dismutase. Circulation. 2002 Dec 10;106(24):3073-8.
| PubMed | Friedrich EB, Walenta K, Scharlau J, Nickenig G, Werner N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 2006 Feb 17;98(3):e20-5. | PubMed |
Friedrich EB, Walenta K, Scharlau J, Nickenig G, Werner N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 2006 Feb 17;98(3):e20-5. | PubMed | Linke A, Schoene N, Gielen S, Hofer J, Erbs S, Schuler G, et al. Endothelial dysfunction in patients with chronic heart failure: systemic effects of lower-limb exercise training. J Am Coll Cardiol. 2001 Feb;37(2):392-7. | PubMed |
Linke A, Schoene N, Gielen S, Hofer J, Erbs S, Schuler G, et al. Endothelial dysfunction in patients with chronic heart failure: systemic effects of lower-limb exercise training. J Am Coll Cardiol. 2001 Feb;37(2):392-7. | PubMed | Maiorana A, O'Driscoll G, Cheetham C, Dembo L, Stanton K, Goodman C, et al. The effect of combined aerobic and resistance exercise training on vascular function in type 2 diabetes. J Am Coll Cardiol. 2001 Sep;38(3):860-6. | PubMed |
Maiorana A, O'Driscoll G, Cheetham C, Dembo L, Stanton K, Goodman C, et al. The effect of combined aerobic and resistance exercise training on vascular function in type 2 diabetes. J Am Coll Cardiol. 2001 Sep;38(3):860-6. | PubMed | Erbs S, Höllriegel R, Linke A, Beck EB, Adams V, Gielen S, et al. Exercise training in patients with advanced chronic heart failure (NYHA IIIb) promotes restoration of peripheral vasomotor function, induction of endogenous regeneration, and improvement of left ventricular function. Circ Heart Fail. 2010 Jul;3(4):486-94. | CrossRef | PubMed |
Erbs S, Höllriegel R, Linke A, Beck EB, Adams V, Gielen S, et al. Exercise training in patients with advanced chronic heart failure (NYHA IIIb) promotes restoration of peripheral vasomotor function, induction of endogenous regeneration, and improvement of left ventricular function. Circ Heart Fail. 2010 Jul;3(4):486-94. | CrossRef | PubMed | Rauchhaus M, Doehner W, Francis DP, Davos C, Kemp M, Liebenthal C, et al. Plasma cytokine parameters and mortality in patients with chronic heart failure. Circulation. 2000 Dec 19;102(25):3060-7. | PubMed |
Rauchhaus M, Doehner W, Francis DP, Davos C, Kemp M, Liebenthal C, et al. Plasma cytokine parameters and mortality in patients with chronic heart failure. Circulation. 2000 Dec 19;102(25):3060-7. | PubMed | Gielen S, Adams V, Möbius-Winkler S, Linke A, Erbs S, Yu J, et al. Anti-inflammatory effects of exercise training in the skeletal muscle of patients with chronic heart failure. J Am Coll Cardiol. 2003 Sep 3;42(5):861-8. | PubMed |
Gielen S, Adams V, Möbius-Winkler S, Linke A, Erbs S, Yu J, et al. Anti-inflammatory effects of exercise training in the skeletal muscle of patients with chronic heart failure. J Am Coll Cardiol. 2003 Sep 3;42(5):861-8. | PubMed | Gielen S, Adams V, Linke A, Erbs S, Möbius-Winkler S, Schubert A, et al. Exercise training in chronic heart failure: correlation between reduced local inflammation and improved oxidative capacity in the skeletal muscle. Eur J Cardiovasc Prev Rehabil. 2005 Aug;12(4):393-400. | PubMed |
Gielen S, Adams V, Linke A, Erbs S, Möbius-Winkler S, Schubert A, et al. Exercise training in chronic heart failure: correlation between reduced local inflammation and improved oxidative capacity in the skeletal muscle. Eur J Cardiovasc Prev Rehabil. 2005 Aug;12(4):393-400. | PubMed | LeMaitre JP, Harris S, Fox KA, Denvir M. Change in circulating cytokines after 2 forms of exercise training in chronic stable heart failure. Am Heart J. 2004 Jan;147(1):100-5. | PubMed |
LeMaitre JP, Harris S, Fox KA, Denvir M. Change in circulating cytokines after 2 forms of exercise training in chronic stable heart failure. Am Heart J. 2004 Jan;147(1):100-5. | PubMed | Duscha BD, Schulze PC, Robbins JL, Forman DE. Implications of chronic heart failure on peripheral vasculature and skeletal muscle before and after exercise training. Heart Fail Rev. 2008 Feb;13(1):21-37. | PubMed |
Duscha BD, Schulze PC, Robbins JL, Forman DE. Implications of chronic heart failure on peripheral vasculature and skeletal muscle before and after exercise training. Heart Fail Rev. 2008 Feb;13(1):21-37. | PubMed | Arnold JMO, Liu P, Demers C, Dorian P, Giannetti N, Haddad H, et al: Canadian Cardiovascular Society consensus conference recommendations on heart failure2006: diagnosis and management. Can J Cardiol. 2006 Jan;22(1):23-45. | PubMed |
Arnold JMO, Liu P, Demers C, Dorian P, Giannetti N, Haddad H, et al: Canadian Cardiovascular Society consensus conference recommendations on heart failure2006: diagnosis and management. Can J Cardiol. 2006 Jan;22(1):23-45. | PubMed | Jessup M, Abraham WT, Casey DE, Feldman AM, Francis GS, Ganiats TG, et al: Focused update: ACCF/AHA guidelines for the diagnosis and management of heart failure in adults: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Circulation. 2009 Apr 14;119(14):1977-2016.
| CrossRef | PubMed |
Jessup M, Abraham WT, Casey DE, Feldman AM, Francis GS, Ganiats TG, et al: Focused update: ACCF/AHA guidelines for the diagnosis and management of heart failure in adults: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Circulation. 2009 Apr 14;119(14):1977-2016.
| CrossRef | PubMed | Feiereisen P, Delagardelle C, Vaillant M, Lasar Y, Beissel J. Is strength training the more efficient training modality in chronic heart failure? Med Sci Sports Exerc. 2007 Nov;39(11):1910-7. | PubMed |
Feiereisen P, Delagardelle C, Vaillant M, Lasar Y, Beissel J. Is strength training the more efficient training modality in chronic heart failure? Med Sci Sports Exerc. 2007 Nov;39(11):1910-7. | PubMed | Braith RW, Beck DT. Resistance exercise: training adaptations and developing a safe exercise prescription. Heart Fail Rev. 2008 Feb;13(1):69-79. | PubMed |
Braith RW, Beck DT. Resistance exercise: training adaptations and developing a safe exercise prescription. Heart Fail Rev. 2008 Feb;13(1):69-79. | PubMed | Palevo G, Keteyian SJ, Kang M, Caputo JL. Resistance exercise training improves heart function and physical fitness in stable patients with heart failure. J Cardiopulm Rehabil Prev. 2009 Sep-Oct;29(5):294-8. | CrossRef | PubMed |
Palevo G, Keteyian SJ, Kang M, Caputo JL. Resistance exercise training improves heart function and physical fitness in stable patients with heart failure. J Cardiopulm Rehabil Prev. 2009 Sep-Oct;29(5):294-8. | CrossRef | PubMed | Smart N, Marwick TH. Exercise training for patients with heart failure: a systematic review of factors that improve mortality and morbidity. Am J Med. 2004 May 15;116(10):693-706. | PubMed |
Smart N, Marwick TH. Exercise training for patients with heart failure: a systematic review of factors that improve mortality and morbidity. Am J Med. 2004 May 15;116(10):693-706. | PubMed | O'Connor CM, Whellan DJ, Lee KL, Keteyian SJ, Cooper LS, Ellis SJ, et al. Efficacy and safety of exercise training in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA. 2009 Apr 8;301(14):1439-50. | CrossRef | PubMed |
O'Connor CM, Whellan DJ, Lee KL, Keteyian SJ, Cooper LS, Ellis SJ, et al. Efficacy and safety of exercise training in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA. 2009 Apr 8;301(14):1439-50. | CrossRef | PubMed | Hammill BG, Curtis LH, Schulman KA, Whellan DJ. Relationship between cardiac rehabilitation and long-term risks of death and myocardial infarction among elderly Medicare beneficiaries. Circulation. 2010 Jan 5;121(1):63-70. | CrossRef | PubMed |
Hammill BG, Curtis LH, Schulman KA, Whellan DJ. Relationship between cardiac rehabilitation and long-term risks of death and myocardial infarction among elderly Medicare beneficiaries. Circulation. 2010 Jan 5;121(1):63-70. | CrossRef | PubMed | Flynn KE, Piña IL, Whellan DJ, Lin L, Blumenthal JA, Ellis SJ, et al. Effects of exercise training on health status in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA. 2009 Apr 8;301(14):1451-9. | CrossRef | PubMed |
Flynn KE, Piña IL, Whellan DJ, Lin L, Blumenthal JA, Ellis SJ, et al. Effects of exercise training on health status in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA. 2009 Apr 8;301(14):1451-9. | CrossRef | PubMed | Belardinelli R, Georgious D, Cianci G, Porcaro A. Randomized, controlled trial of long-term moderate exercise training in chronic heart failure effects on functional capacity, quality of life, and clinical outcome. Circulation. 1999 Mar 9;99(9):1173-82. | PubMed |
Belardinelli R, Georgious D, Cianci G, Porcaro A. Randomized, controlled trial of long-term moderate exercise training in chronic heart failure effects on functional capacity, quality of life, and clinical outcome. Circulation. 1999 Mar 9;99(9):1173-82. | PubMed | Belardinelli R, Georgiou D, Cianci G, Purcaro A. 10-year exercise training in chronic heart failure: a randomized controlled trial. J Am Coll Cardiol. 2012 Oct 16;60(16):1521-8. | CrossRef | PubMed |
Belardinelli R, Georgiou D, Cianci G, Purcaro A. 10-year exercise training in chronic heart failure: a randomized controlled trial. J Am Coll Cardiol. 2012 Oct 16;60(16):1521-8. | CrossRef | PubMed | Rivas-Estany E, Sixto-Fernández S, Barrera-Sarduy J, Hernández-García S, González-Guerra R, Stusser-Beltranena R. [Effects of long-term exercise training on left ventricular function and remodeling in patients with anterior wall myocardial infarction]. Arch Cardiol Mex. 2013 Jul-Sep;83(3):167-73. | CrossRef | PubMed |
Rivas-Estany E, Sixto-Fernández S, Barrera-Sarduy J, Hernández-García S, González-Guerra R, Stusser-Beltranena R. [Effects of long-term exercise training on left ventricular function and remodeling in patients with anterior wall myocardial infarction]. Arch Cardiol Mex. 2013 Jul-Sep;83(3):167-73. | CrossRef | PubMed | Rivas Estany E. Rehabilitación cardíaca prolongada. En: Rehabilitación Cardiovascular, Capítulo 32, Madrid, España: Panamericana; 2011:463-72.
Rivas Estany E. Rehabilitación cardíaca prolongada. En: Rehabilitación Cardiovascular, Capítulo 32, Madrid, España: Panamericana; 2011:463-72.  Rivas Estany E. El ejercicio físico en la prevención y la rehabilitación cardiovascular. Rev Esp Cardiol.Supl. 2011;11(E):18-22. | Link |
Rivas Estany E. El ejercicio físico en la prevención y la rehabilitación cardiovascular. Rev Esp Cardiol.Supl. 2011;11(E):18-22. | Link | Rivas Estany E. Entrenamiento con Ejercicios en Rehabilitación Cardíaca. En: Rehabilitación Cardíaca. Estrategia de prevención secundaria para la aterosclerosis, Barcelona: Profármaco2, Comunicación Científico-Médica; 2012.
Rivas Estany E. Entrenamiento con Ejercicios en Rehabilitación Cardíaca. En: Rehabilitación Cardíaca. Estrategia de prevención secundaria para la aterosclerosis, Barcelona: Profármaco2, Comunicación Científico-Médica; 2012.  American College of Sports Medicine's Guidelines for Exercise Testing and Prescription, 8th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2010:156.
American College of Sports Medicine's Guidelines for Exercise Testing and Prescription, 8th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2010:156.  Kang J, Chaloupka EC, Biren GB, Mastrangelo MA, Hoffman JR. Regulating intensity using perceived exertion: effect of exercise duration. Eur J Appl Physiol. 2009 Feb;105(3):445-51. | CrossRef | PubMed |
Kang J, Chaloupka EC, Biren GB, Mastrangelo MA, Hoffman JR. Regulating intensity using perceived exertion: effect of exercise duration. Eur J Appl Physiol. 2009 Feb;105(3):445-51. | CrossRef | PubMed | Fonarow GC, Stough WG, Abraham WT, Albert NM, Gheorghiade M, Greenberg BH, et al. Characteristics, treatments, and outcomes of patients with preserved systolic function hospitalized for heart failure; a report of the OPTIMNIZE-HF Registry. J Am Coll Cardiol. 2007 Aug 21;50(8):768-77. | CrossRef | PubMed |
Fonarow GC, Stough WG, Abraham WT, Albert NM, Gheorghiade M, Greenberg BH, et al. Characteristics, treatments, and outcomes of patients with preserved systolic function hospitalized for heart failure; a report of the OPTIMNIZE-HF Registry. J Am Coll Cardiol. 2007 Aug 21;50(8):768-77. | CrossRef | PubMed | Rivas Estany E. Insuficiencia cardíaca con fracción de eyección preservada: Efectos cardiovasculares del entrenamiento físico. Rev Fed Arg Cardiol. 2015; 44:190-2. | Link |
Rivas Estany E. Insuficiencia cardíaca con fracción de eyección preservada: Efectos cardiovasculares del entrenamiento físico. Rev Fed Arg Cardiol. 2015; 44:190-2. | Link |