 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada y revisada de una conferencia dictada en el marco del Simposio Esquemas Actuales y Futuros para Optimizar el Tratamiento con Ácido Micofenólico y sus Resultados, organizado por Novartis el 17 de abril de 2008, cuyo Chairman fue el Dr. Jorge Morales, profesor agregado de la Universidad de Chile y nefrólogo de Clínica Las Condes.
En esta exposición se tratarán principalmente los inhibidores de la calcineurina (CNI) y las estrategias de desarrollo a futuro.
En 2003 Nankivell demostró que, algún tiempo después de que se efectúa el trasplante de un riñón sano, empieza a haber pérdida de nefrones, fibrosis y cicatrices, fenómeno que durante mucho tiempo se conoció como nefropatía crónica del aloinjerto. Hoy se habla de toxicidad por ciclosporina (CsA) o toxicidad por inhibidores de calcineurina, pero el mecanismo subyacente sigue significando pérdida de nefrones. Se ha planteado que se debe impedir la fibrosis, pero ésta es sólo una reacción ante la pérdida nefronal: después de que sana una herida queda una cicatriz, pero no se trata de impedir que la herida sane, sino de evitar que se produzca la herida.
La Fig. 1 muestra la evolución de los pacientes del estudio de Nankivell (1). Fueron 120 receptores de trasplante renal y pancreático en quienes se determinó periódicamente el grado de hialinosis arteriolar, fibrosis y calcificación tubular, además de signos típicos de nefrotoxicidad anti-calcineurínica; todos estos elementos fueron aumentando con el tiempo y al cabo de diez años, todos los pacientes estaban afectados, aunque hay que considerar que se trataba de trasplantes de riñón y páncreas, por lo que el riesgo inmunológico era mayor. Además, hubo un detalle notable: se utilizaron dosis muy altas de CsA, 204 ng/ml en promedio durante más de diez años, es decir, dosis exageradamente altas. Los pacientes sobrevivieron a la toxicidad solamente porque los donantes eran ideales: jóvenes, de edad promedio 25 años, víctimas de accidentes en motocicleta, capaces de resistir estas dosis excesivas de CsA. Por otra parte, aunque el aspecto histológico era malo, el resultado del trasplante fue bueno, ya que a los diez años postrasplante la tasa de sobrevivencia era 84% y el nivel de creatinina sérica, 1,62 mg/dl.
La Fig. 2 muestra que el riesgo de rechazo disminuye con el tiempo mientras la fibrosis va aumentando. Habría una “ventana de oportunidad” cuya duración puede ser de días, meses o años; no está claro cuánto dura ni en qué momento sería aceptable retirar los CNI sin aumentar excesivamente el riesgo de rechazo (1).
Hay tres posibles estrategias a largo plazo. La primera es administrar los CNI hasta que se produzca la nefrotoxicidad. La segunda es hacer profilaxis para prevenir la nefrotoxicidad y suspender los inhibidores antes de que ella aparezca, pero es difícil determinar cuándo va a ocurrir. La tercera opción es reducir al mínimo el uso de los CNI y administrarlos sólo cuando realmente se los necesita. Esta última ha sido la actitud durante veinte años, ya que desde entonces se sabe que la CsA es nefrotóxica y se ha aprovechado esta “ventana terapéutica” para evitar la toxicidad; por lo tanto, el concepto de reducción al mínimo se está aplicando desde hace veinte años, así la dosis se ha reducido de 120 a 80 en la actualidad y el concepto en general ha ido cambiando.
Otro enfoque sería evitar del todo los CNI. Existe un importante estudio de Flavio Vincenti y otros investigadores, sobre esteroides y daclizumab, en el que se planteó la posibilidad de abandonar la CsA y reemplazarla por este fármaco, pero la tasa de rechazo a los doce meses fue de 50%, por lo que se concluyó que daclizumab no funciona como profilaxis de rechazo (2) (Fig. 3).
Otro grupo diseñó un amplio estudio, el estudio CAESAR (Cyclosporine Avoidance Eliminates Serious Adverse Renal-toxicity), con el objetivo de determinar si la administración de una dosis reducida de CsA, continua o seguida por un retiro anticipado a los 6 meses, en receptores primarios de trasplante renal con inducción con daclizumab, micofenolato mofetil (MMF) y corticosteroides (CS), puede reducir al mínimo la nefrotoxicidad y mejorar a largo plazo la función renal sin un aumento inaceptable en las tasas de rechazo agudo. En la rama de control, en la que se administró CsA en dosis normal, se observó gran número de rechazos dentro de los dos primeros meses, pero después casi no hubo más rechazos y la curva se aplanó. En el grupo que recibió CsA en dosis bajas y daclizumab el beneficio fue evidente y la tasa de rechazo disminuyó notablemente, pero el beneficio del bloqueo del receptor de IL-2 duró sólo tres meses como lo muestra la Fig. 4: la primera línea de puntos vertical marca un período de tres meses en que se usó CsA en niveles de 120 a 130; luego se redujo a 100 y se perdió toda la utilidad del bloqueador de IL-2, que es de alto costo, porque a los seis meses la incidencia de rechazos fue exactamente la misma que en el primer grupo. En el siguiente período de tres meses, el nivel de 100 resultó demasiado bajo. Si se suspende la CsA a los seis meses hay consecuencias que pagar: la tasa de rechazos sube en 13%. Se pensó inicialmente que valía la pena pagar este precio, siempre que mejorara la función renal, pero esto no ocurrió; se monitorizó con mucho cuidado, pero no se observó mejoría de la función renal en ninguno de los tres grupos. En este estudio se concluyó que la dosis estándar de CsA no fue superior, en cuanto a prevención precoz, CsA a los 4-6 meses postrasplante se asoció con un mayor riesgo de rechazo. Una mínima dosis de CsA, que obtenga un nivel de 50-100 ng/ml, asociada a daclizumab, MMF y esteroides sería un régimen inmunosupresor seguro y efectivo en los receptores de trasplante renal (3).
El riñón no discrimina entre la pérdida nefronal por rechazo o por toxicidad: cuando el nefrón se pierde, no se recupera. El estudio de Smak Gregoor (4) demostró que si no se usa un bloqueador del receptor de IL-2 y dosis normal de CsA, existe una eficacia 28% menor y al cabo de un año la tasa de rechazo es de 24%. Todos los estudios muestran que el no uso de terapia de inducción se relaciona con una mayor incidencia de episodios de rechazo agudo del orden de 20% a 25%.
El estudio SYMPHONY (5) ha sido motivo de extenso debate, pero es el estudio más amplio que se ha hecho sobre este tema y aclara diversos problemas conceptuales. Los pacientes fueron divididos en cuatro ramas, cada una con 350 a 400 receptores que se evaluaron durante doce meses. Todos recibieron 2 g de MMF y esteroides. En la primera rama, los pacientes recibieron dosis normales de CsA (150–300 ng/ml por 3 meses , dosis que fue posteriormente reducida a100–200 ng/ml), además de MMF y esteroides. En la segunda rama los receptores fueron tratados con CsA en dosis baja (50 a 100 ng/ml), daclizumab, MMF y esteroides. Se cometió el mismo error que en el estudio CAESAR: mantener los mismos niveles durante todo el primer año. En la tercera rama los pacientes recibieron daclizumab, dosis bajas de tacrolimus (TAC) de 3-7 ng/ml, más MMF y esteroides. Por último, en la cuarta rama, TAC fue reemplazado por sirolimus en dosis bajas (Fig. 5).
Figura 5. Estudio SYMPHONY: diseño.
La Fig. 6 muestra los niveles efectivos de los inmunosupresores. CsA no estuvo entre 50 y 100, sino que la media fue 100, el nivel de TAC no estuvo entre 3 y 7, sino que fue 7; en cambio, el nivel de sirolimus estuvo dentro del rango buscado. La CsA se mantuvo en forma permanente y, si no se usa terapia de inducción, el nivel es un poco más alto y llega a 120 al final de la primera semana, pero luego baja, cometiéndose nuevamente el error de mantener desde los tres meses el nivel en 100, que es muy bajo. Por lo tanto, la CsA se mantuvo en alrededor de 100 constantemente y sirolimus fue el único con el que se cumplió con la media prevista. TAC, durante los tres primeros meses, no tuvo un nivel de 7 sino superior: el promedio fue de alrededor de 7 y bajó a 6,8 al término de un año (Figs. 6 y 7).
Figura 6. Estudio SYMPHONY: niveles de CsA (A y B).
Figura 7. Estudio SYMPHONY: niveles de tacrolimus (TAC) y sirolimus (SRL).
El estudio se publicó hace un año. En cuanto a la sobrevida del injerto, el peor resultado fue el del grupo con sirolimus y CsA, ya que la sobrevida del injerto fue inferior a 90%; en cambio, el mejor resultado se obtuvo con los dos grupos que recibieron dosis bajas de inhibidor de calcineurina. Éste es el primer estudio que demuestra el beneficio derivado de la inhibición de la IL-2, quienes no utilizan esta inhibición tienen un buen argumento, porque un metaanálisis demostró que aunque disminuye la incidencia de episodios de rechazo, no mejora la sobrevida del injerto; éste es el primer estudio que demuestra que aunque puede haber un efecto sobre la eficacia, éste puede no ser significativo (Fig. 8).
Figura 8. Estudio SYMPHONY: sobrevida del injerto.
En cuanto a la tasa de rechazo, el peor grupo fue el grupo de sirolimus en baja dosis, en el que hubo 40% de rechazo, de modo que no se puede prescindir de los inhibidores de calcineurina durante los cuatro primeros meses, o bien sirolimus no es capaz de reemplazarlos: es la primera lección. La otra lección es que los estudios pequeños, que suelen ser ampliamente publicados y citados en numerosas conferencias, suelen no ser verídicos o reproducibles. Los mejores resultados se obtuvieron con TAC, con 15% de incidencia de rechazo; usando dosis normal de CsA el rechazo fue 30% en tanto que con dosis baja fue de 27%, pero nuevamente los autores se equivocaron y los rechazos comenzaron a aumentar desde los tres meses. Evidentemente, 100 mg de CsA es una dosis muy baja y todo el beneficio del fármaco de alto costo se perdió (Fig. 9).
Figura 9. Estudio SYMPHONY: Eficacia: rechazo agudo confirmado por biopsia.
En resumen, el bloqueo de IL-2 + TAC en dosis bajas sería lo mejor, pero se debe tener siempre presente que los estudios investigan regímenes, no fármacos, es decir, se investiga la eficacia de un “cóctel” y estos resultados no significan que éste sea el mejor “cóctel” posible, sino que fue el mejor en este estudio (5).
Otro estudio muy bueno es el estudio DIRECT (Diabetes Incidence after Renal Transplantation: Neoral® C2 monitoring versus Tacrolimus), cuya potencia es la misma que en el estudio SYMPHONY con la mitad del tamaño, ya que tiene 700 pacientes en dos ramas. En este estudio sólo se planteó un objetivo: determinar si TAC es tan bueno como CsA para evitar los episodios de rechazo agudo en el trasplante y cuál es la incidencia de diabetes con ambos fármacos, es decir, qué precio se paga por los resultados. Con tal fin. El criterio primario de seguridad fue un completo análisis del metabolismo de la glucosa, con pruebas orales, y se utilizó como definición de diabetes el criterio de la OMS. Se sabe que TAC causa diabetes y aquí se confirmó: uno de cada tres pacientes que recibieron este fármaco presentó diabetes, lo mismo ocurrió en uno de cada dos pacientes mayores de 55 años y alrededor de uno de cada cuatro pacientes tuvo alteraciones del metabolismo de la glucosa; 26% de los pacientes tratados con CsA desarrollaron la enfermedad frente a 33% del grupo de enfermos que recibieron TAC. También hubo una alta proporción de pacientes con alteración de la glucosa en ayunas entre los pacientes tratados con TAC (6).
Por otra parte, TAC fue eficaz con baja incidencia de rechazos. En el estudio SYMPHONY la tasa de rechazo fue 15%, en el DIRECT, en la rama de TAC en dosis más alta, la incidencia de rechazos no llegó a 7%. Con dosis normales de CsA acompañadas de inhibición de IL-2 la cifra también bajó a 10%, de modo que la tasa de rechazo depende de la exposición a CsA o a TAC (Tabla I).
Una problema que se debe tener presente, aunque no es estadísticamente significativo, es el que muestra la Figura 10: Aunque a seis meses postrasplante con dosis más alta de TAC hay una incidencia baja de rechazos, con una curva casi plana, esto se consigue a costa de más polioma y más diabetes, de modo que se puede especular que posiblemente la dosis de TAC esté muy alta y convendría bajarla.
Figura 10. Estudio DIRECT: los niveles más altos de CNI se asocian con menos rechazos.
Pero el estudio es muy útil, ya que ofrece una opción para equilibrar el régimen y considerar el balance entre evitar el rechazo y el riesgo de infección por polioma y desarrollo de diabetes con TAC.
En el estudio FDCC (Fixed-Dose Concentration-Controlled) existe una diferencia en la exposición a ácido micofenólico (mycophenolic acid, MPA), medida por el área bajo la curva (Area Under the Curve, AUC) entre los pacientes tratados con CsA y con TAC (7) (Fig.11).
Figura 11. Estudio FDCC: exposición a MPA (AUC = área bajo la curva): CsA versus TAC.
Lo mismo ocurrió en el estudio de Bruce Kaplan, en que se observó que la exposición a MPA fue 19% más alta en los pacientes tratados con TAC, lo que podría explicar la mayor eficacia, así como la mayor incidencia de efectos colaterales de este fármaco (8). Tal vez CsA y TAC sólo inhiben la actividad de la calcineurina, pero la potencia de TAC y quizás también la presencia de polioma pueden tener relación con la exposición a MPA. Es una nueva interrogante y para responderla habrá que realizar un estudio de gran tamaño.
Una teoría muy popular en Estados Unidos y en Francia es que si el injerto no funciona bien hay que administrar un fármaco nefrotóxico y que para disminuir esta toxicidad hay que introducir tardíamente la CsA. Para comprobar lo anterior se diseñó el estudio MYRIAD, de un año de duración, prospectivo, aleatorio, multicéntrico, dirigido a establecer el efecto de la introducción temprana o tardía de un régimen de CNI (CsA) combinado con Myfortic® + bloqueo de receptor de IL-2 + esteroides, sobre la función renal. Se hizo una estratificación de los pacientes según el riesgo de función tardía del injerto, basándose en los criterios USRDS, y se asignó a cada paciente desde el primer día, aleatoriamente, a CsA temprana (día 0; 97 pacientes) o a CsA tardía (día 6; 100 pacientes). Fue un estudio de gran tamaño y muy bueno, porque se concentró en un solo aspecto específico. Las dosis fueron: 1300 ng/ml durante las semanas 0 a 6, 1100 ng/ml en las semanas 6 a 12 y 900 ó 700 ng/ml posteriormente. La hipótesis era que si la CsA se administraba en forma tardía, la función del injerto también debería ser tardía, pero no fue así: la cifra de función tardía fue similar en ambos grupos, alrededor de 25%. El puntaje de riesgo de función tardía del injerto no fue un buen predictor, porque de 32 pacientes que tuvieron puntaje de alto riesgo, sólo 14 presentaron función tardía.
Además se monitorizó estrechamente la función renal en ambas ramas y no se encontró diferencia en la depuración de creatinina si se administraba CsA en forma precoz o tardía. Hubo diferencia en la incidencia de rechazos, pero no fue significativa y ya se habló de la diferencia entre CsA y TAC de sólo3% a 5% en la incidencia de rechazo; entre CSA iniciada en forma precoz o tardía, la diferencia en la incidencia de rechazo, fue de 11%, así cuando se usa CsA en el período inicial, la tasa de rechazo es de 15,5%. En los estudios descritos más arriba, en que probablemente se utilizó un nivel más alto de CsA, la tasa de rechazo fue 10%. En el estudio SYMPHONY la rama de TAC tuvo 15% de rechazos, es decir, un resultado similar. En la rama CsA del mismo estudio hubo una incidencia de episodios de rechazo de 27%; lo que constituye un resultado subóptimo, pero también es subóptimo cuando se retarda la introducción de CsA (9).
El estudio De01 fue un estudio multicéntrico, en el que participaron cuatro centros alemanes y dos belgas, con el objeto de comparar el efecto de dosis normal y baja de CsA sobre la función renal y la incidencia de BPAR a los 12 meses. Los pacientes se asignaron en forma aleatoria antes del trasplante; el día de la intervención fue el día cero. Se trató a los pacientes con Myfortic®, Simulect® y esteroides en dosis habituales, más Neoral® en dosis habitual o reducida. El estudio fue pequeño, tuvo sólo 44 ó 45 pacientes en cada grupo, hubo predominio de hombres, con trasplantes previos, la mayoría tenía título de PRA (Panel-Reactive Antibody) bajo, aunque hubo algunos con título más alto; la edad fue de alrededor de 50 años. Más de la mitad de los donantes en Alemania tienen alrededor de 50 años y, en ese país, 20% de los donantes son donantes vivos; en este estudio hubo 26%. En 20% de los casos el injerto calzó bien, en otros casos el calce no fue tan bueno (10) (Fig. 12).
Figura 12. Diseño del estudio De01: CsA normal versus baja con Myfortic® y Simulect®.
La Fig. 13 se muestra los niveles de CsA C2 alcanzados y en las casillas están los niveles propuestos. En ese momento la monitorización de CsA C2 era muy popular y todo el mundo decía que se necesitaba obtener estos niveles elevados. En Alemania apenas se alcanzó la meta durante un breve lapso, porque se pensó que se estaba administrando CsA en exceso, de modo que casi todos los pacientes, lamentablemente, se incluyeron en el grupo de dosis baja. Se pensó que la dosis alta, de más de 1000, durante los seis primeros meses, era excesiva y los grupos no se estratificaron bien, de modo que al final hubo una diferencia de sólo 10% a 15% en los niveles.
Figura 13. Estudio De01: niveles de ciclosporina C2 (ng/mL).
En los niveles valle pasó lo mismo: a los tres meses hubo diferencia, pero no fue significativa hasta llegar a los nueve o doce meses y nunca fue superior a 10-15%. Lo cierto es que no se logró hacer una buena separación, pero al menos en este estudio se trató a todos los pacientes con dosis bajas de CsA.
Nuestro centro participó en este estudio con 41 pacientes: 40 de ellos sobrevivían un año después y sólo uno había muerto debido a un trauma, de modo que los resultados fueron muy buenos. La mortalidad fue 2,2% y no hubo más pérdida de injertos en los seis primeros meses. A los 12 meses, la incidencia de pérdida de injertos o muerte fue de 4,5% en ambos grupos sin diferencia entre ellos: la supervivencia de pacientes e injertos fue superior a 95%, lo que constituye un excelente resultado que sin duda puede competir con el estudio SYMPHONY. Tampoco hubo diferencia en la tasa de rechazo entre ambos grupos, que tuvieron en conjunto una tasa de rechazo de alrededor de 16%. Cabe recordar que en el estudio MYRIAD la tasa fue 15,5% y en el SYMPHONY, la mejor rama obtuvo 15%. Es probable que con niveles más altos de CsA se pueda llegar a 10% de rechazo, como en el estudio DIRECT, pero con estos resultados tan buenos habría que preguntarse si sería conveniente someter a los pacientes a niveles más altos con el costo de mayor toxicidad. Prácticamente todos los rechazos ocurrieron durante los tres primeros meses. La función renal de los pacientes se mantuvo adecuada y no hubo diferencia entre los grupos; lo mismo se observó con los parámetros de seguridad: hubo algunos eventos adversos, pero muy pocos que condujeran a discontinuar el estudio.
Las conclusiones de este estudio son las siguientes:
Los estudios descritos son todos de novo, pero el período de novo es de sólo un año; dentro de los diez años de sobrevida que se esperan para el injerto, quedan aún nueve años y, lamentablemente, hay pocos estudios de población posteriores a un año, entre ellos está el estudio de conversión con Myfortic®, en el cual, cuando los pacientes llevaban tres años postrasplante, el nivel promedio de CSA era 189; se trataba de centros estadounidenses con pacientes negros, pero estos niveles de CsA se acercan al de CsA de Nankivell: 204 ng/ml. En la subpoblación de nuestro centro, los pacientes recibíeron niveles de CsA de 102 y 22% de ellos recibían esteroides. En cuanto a los niveles de TAC, en el estudio de Pascua, el nivel medio de este fármaco pasado el tercer año fue 8,4; es decir, aun después del tercer año aún se administra una dosis apreciable de TAC; 60% de los pacientes recibían esteroides y este grupo tuvo dosis de MMF más bajas (Tabla II).
Tabla II. ¿Qué ocurre con la inmunosupresión después del tercer año?
La tasa de rechazo fue 0% con dosis muy altas de CsA (Nankivell); en nuestro centro fue 1% a 3%; en el de Pascual, 1,2%; y en nuestros pacientes, que eran muy pocos, no hubo ningún rechazo (Budde). Lo importante es que, durante este período de mantención, todos los estudios indican que hay 2% de rechazos; con más pacientes, se pueden observar rechazos subclínicos. Con todo, 95% de inmunosupresión es una cifra excesiva y probablemente indica que los pacientes están excesivamente inmunosuprimidos; es cierto que no hay rechazos, pero quizás este nivel sea demasiado elevado para muchos pacientes.
Es necesario efectuar más estudios que investiguen esta situación en la población de pacientes en mantención, como el estudio francés Référence (11), que tuvo sólo a 100 pacientes que se repartieron en forma aleatoria, a razón de 2 por 1 para recibir CsA, MMF, después de cuya introducción se redujo la CsA a 50%, y esteroides (n=70 pacientes). Los 30 receptores restantes siguieron con el régimen normal del centro (Fig. 14).
La Fig. 15 muestra los resultados. Los niveles de CsA fueron 130 y 140 seis años postrasplante; si se hubiera preguntado a estos médicos, todos hubieran dicho que usaban dosis bajas, de 130 y 140, pero en nuestro centro se usaron niveles de sólo 100; en todo caso, con la monitorización en el grupo control los niveles bajaron y la creatinina sérica permaneció estable, aunque la función renal y la depuración de creatinina fueron en descenso en las primeras 48 semanas; lo cierto es que los médicos pensaron que el nivel estaba un poco alto y bajaron la dosis. Más interesante es el otro grupo, en que la dosis inicial fue 130 y fue bajando a 80, 60, 60, 70, es decir, niveles verdaderamente bajos, a pesar de lo cual no hubo rechazos y la función renal mejoró. Es una regresión positiva y al final del año la diferencia fue de 11 ml/min. Por lo tanto, con la minimización de dosis y niveles de CsA se pueden obtener resultados mucho mejores en eficacia y con menor toxicidad, a largo plazo.
Figura 15. Estudio Référence: Mejoría de la función renal en el grupo de CsA bajo.
También hubo dificultades: en el grupo MMF la tolerancia no fue buena, hubo que retirarlo en uno de cada cuatro pacientes y se presentaron diversos efectos colaterales, principalmente diarrea (Tabla III). Este trabajo estimula a mejorar los resultados y enfoca la atención en la población con terapia de mantención, en la cual es necesario determinar cuáles son los niveles más bajos (11).
Tabla III. Estudio Référence: suspensiones y episodios adversos.

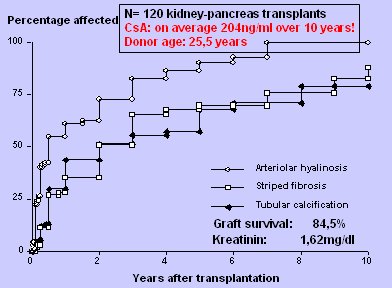 Figura 1. A pesar de nefrotoxicidad por inhibidores de calcineurina, los resultados a largo plazo son razonables.
Figura 1. A pesar de nefrotoxicidad por inhibidores de calcineurina, los resultados a largo plazo son razonables.

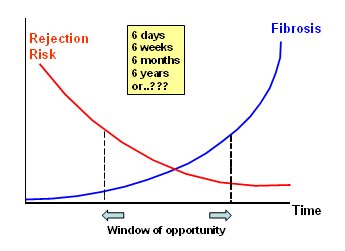 Figura 2. El riesgo de rechazo y fibrosis es dependiente del tiempo. ¿Existe una “ventana de oportunidad” óptima?
Figura 2. El riesgo de rechazo y fibrosis es dependiente del tiempo. ¿Existe una “ventana de oportunidad” óptima?

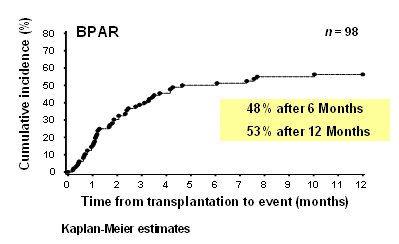 Figura 3. Estudio piloto con MMF, corticosteroides y daclizumab: tasa de rechazo inaceptablemente alta.
Figura 3. Estudio piloto con MMF, corticosteroides y daclizumab: tasa de rechazo inaceptablemente alta.

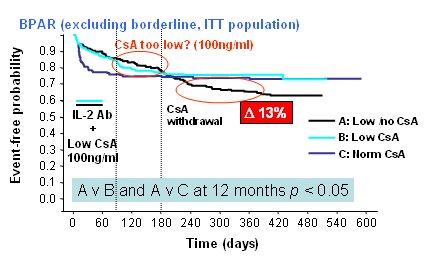 Figura 4. Estudio CAESAR: la tasa de rechazo es significativamente más alta después del retiro de CsA al tercer mes.
Figura 4. Estudio CAESAR: la tasa de rechazo es significativamente más alta después del retiro de CsA al tercer mes.

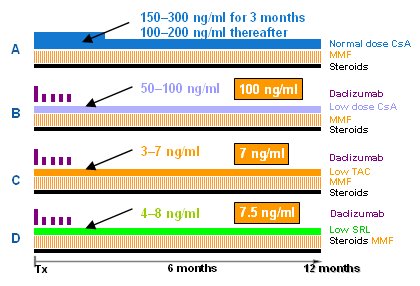 Figura 5. Estudio SYMPHONY: diseño.
Figura 5. Estudio SYMPHONY: diseño.

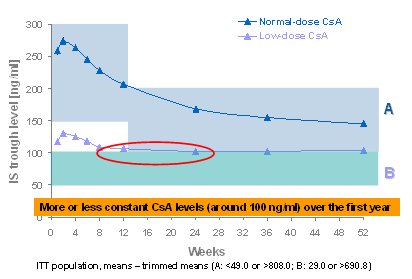 Figura 6. Estudio SYMPHONY: niveles de CsA (A y B).
Figura 6. Estudio SYMPHONY: niveles de CsA (A y B).

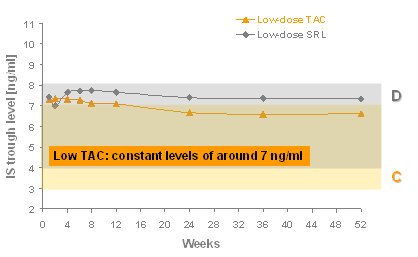 Figura 7. Estudio SYMPHONY: niveles de tacrolimus (TAC) y sirolimus (SRL).
Figura 7. Estudio SYMPHONY: niveles de tacrolimus (TAC) y sirolimus (SRL).

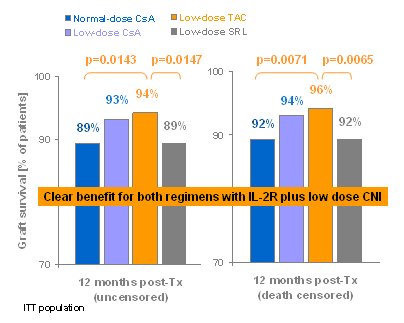 Figura 8. Estudio SYMPHONY: sobrevida del injerto.
Figura 8. Estudio SYMPHONY: sobrevida del injerto.

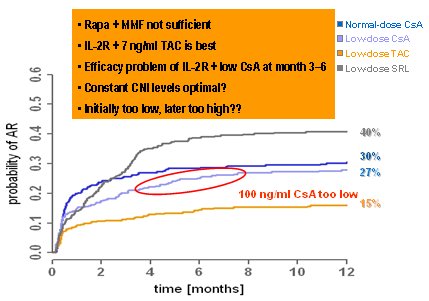 Figura 9. Estudio SYMPHONY: Eficacia: rechazo agudo confirmado por biopsia.
Figura 9. Estudio SYMPHONY: Eficacia: rechazo agudo confirmado por biopsia.

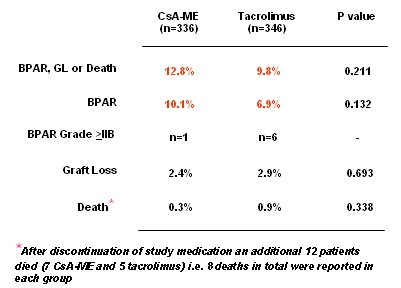 Tabla I. Estudio DIRECT. Objetivo primario de eficacia: BPAR (Biopsy-Proven Acute Rejection), pérdida de injerto o muerte en 6 meses.
Tabla I. Estudio DIRECT. Objetivo primario de eficacia: BPAR (Biopsy-Proven Acute Rejection), pérdida de injerto o muerte en 6 meses.

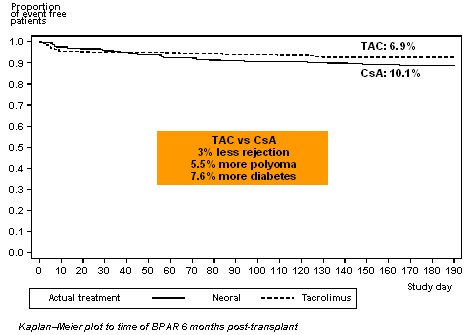 Figura 10. Estudio DIRECT: los niveles más altos de CNI se asocian con menos rechazos.
Figura 10. Estudio DIRECT: los niveles más altos de CNI se asocian con menos rechazos.

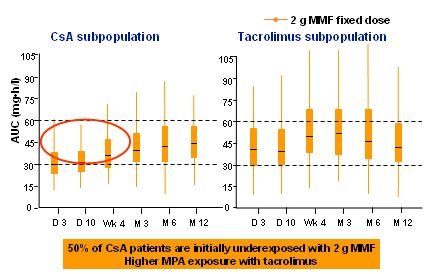 Figura 11. Estudio FDCC: exposición a MPA (AUC = área bajo la curva): CsA versus TAC.
Figura 11. Estudio FDCC: exposición a MPA (AUC = área bajo la curva): CsA versus TAC.

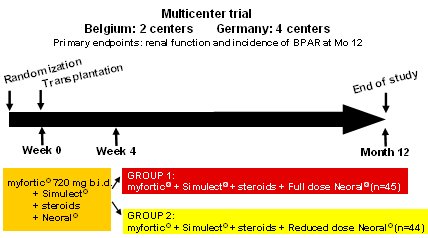 Figura 12. Diseño del estudio De01: CsA normal versus baja con Myfortic® y Simulect®.
Figura 12. Diseño del estudio De01: CsA normal versus baja con Myfortic® y Simulect®.

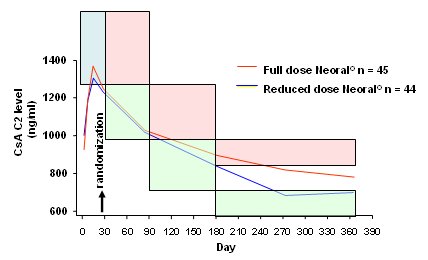 Figura 13. Estudio De01: niveles de ciclosporina C2 (ng/mL).
Figura 13. Estudio De01: niveles de ciclosporina C2 (ng/mL).

 Tabla II. ¿Qué ocurre con la inmunosupresión después del tercer año?
Tabla II. ¿Qué ocurre con la inmunosupresión después del tercer año?

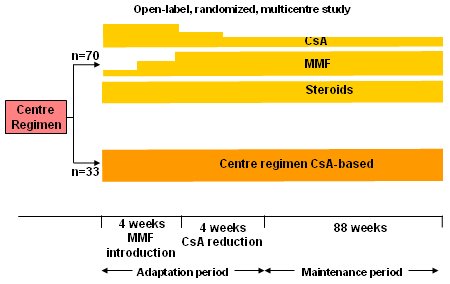 Figura 14. Estudio Référence: reducción al mínimo de CsA combinada con MPA, en pacientes en mantención.
Figura 14. Estudio Référence: reducción al mínimo de CsA combinada con MPA, en pacientes en mantención.

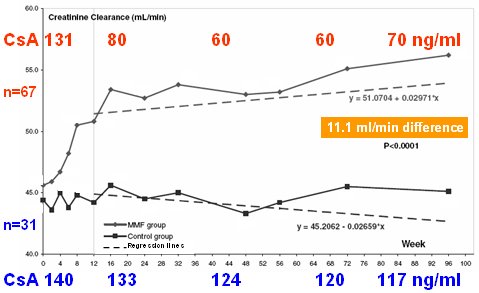 Figura 15. Estudio Référence: Mejoría de la función renal en el grupo de CsA bajo.
Figura 15. Estudio Référence: Mejoría de la función renal en el grupo de CsA bajo.

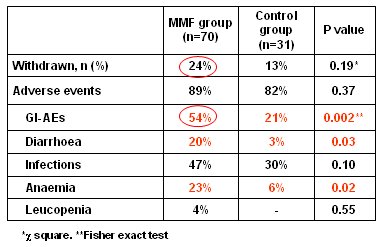 Tabla III. Estudio Référence: suspensiones y episodios adversos.
Tabla III. Estudio Référence: suspensiones y episodios adversos.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de una conferencia dictada en el marco del Simposio Esquemas Actuales y Futuros para Optimizar el Tratamiento con Ácido Micofenólico y sus Resultados, organizado por Novartis el 17 de abril de 2008, cuyo Chairman fue el Dr. Jorge Morales, profesor agregado de la Universidad de Chile y nefrólogo de Clínica Las Condes.
 Expositor:
Klemens Budde[1]
Expositor:
Klemens Budde[1]

Citación: Budde K. Receivers of de novo renal transplant treated with Myfortic, Simulect and reduced exposure to CsA. Medwave 2008 sep;8(8):e1668 doi: 10.5867/medwave.2008.08.1668
Fecha de publicación: 1/9/2008

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Nankivell BJ, Borrows RJ, Fung CL, O'Connell PJ, Allen RD, Chapman JR. The natural history of chronic allograft nephropathy. N Engl J Med. 2003 Dec 11;349(24):2326-33. | CrossRef | PubMed |
Nankivell BJ, Borrows RJ, Fung CL, O'Connell PJ, Allen RD, Chapman JR. The natural history of chronic allograft nephropathy. N Engl J Med. 2003 Dec 11;349(24):2326-33. | CrossRef | PubMed | Vincenti F, Ramos E, Brattstrom C, Cho S, Ekberg H, Grinyo J, et al. Multicenter trial exploring calcineurin inhibitors avoidance in renal transplantation. Transplantation. 2001 May 15;71(9):1282-7. | CrossRef | PubMed |
Vincenti F, Ramos E, Brattstrom C, Cho S, Ekberg H, Grinyo J, et al. Multicenter trial exploring calcineurin inhibitors avoidance in renal transplantation. Transplantation. 2001 May 15;71(9):1282-7. | CrossRef | PubMed | Ekberg H, Grinyó J, Nashan B, Vanrenterghem Y, Vincenti F, Voulgari A, et al Cyclosporine sparing with mycophenolate mofetil, daclizumab and corticosteroids in renal allograft recipients: the CAESAR Study. Am J Transplant. 2007 Mar;7(3):560-70. Epub 2007 Jan 22. | CrossRef | PubMed |
Ekberg H, Grinyó J, Nashan B, Vanrenterghem Y, Vincenti F, Voulgari A, et al Cyclosporine sparing with mycophenolate mofetil, daclizumab and corticosteroids in renal allograft recipients: the CAESAR Study. Am J Transplant. 2007 Mar;7(3):560-70. Epub 2007 Jan 22. | CrossRef | PubMed | Smak Gregoor PJ, de Sévaux RG, Ligtenberg G, Hoitsma AJ, Hené RJ, Weimar W, Withdrawal of cyclosporine or prednisone six months after kidney transplantation in patients on triple drug therapy: a randomized, prospective, multicenter study. J Am Soc Nephrol. 2002 May;13(5):1365-73. | CrossRef | PubMed |
Smak Gregoor PJ, de Sévaux RG, Ligtenberg G, Hoitsma AJ, Hené RJ, Weimar W, Withdrawal of cyclosporine or prednisone six months after kidney transplantation in patients on triple drug therapy: a randomized, prospective, multicenter study. J Am Soc Nephrol. 2002 May;13(5):1365-73. | CrossRef | PubMed | Ekberg H, Tedesco-Silva H, Demirbas A, Vítko S, Nashan B, Gürkan A, et al. Reduced exposure to calcineurin inhibitors in renal transplantation. N Engl J Med. 2007 Dec 20;357(25):2562-75. | CrossRef | PubMed |
Ekberg H, Tedesco-Silva H, Demirbas A, Vítko S, Nashan B, Gürkan A, et al. Reduced exposure to calcineurin inhibitors in renal transplantation. N Engl J Med. 2007 Dec 20;357(25):2562-75. | CrossRef | PubMed | Vincenti F, Friman S, Scheuermann E, Rostaing L, Jenssen T, Campistol JM, et al. Results of an international, randomized trial comparing glucose metabolism disorders and outcome with cyclosporine versus tacrolimus. Am J Transplant. 2007 Jun;7(6):1506-14. Epub 2007 Mar 12. | CrossRef | PubMed |
Vincenti F, Friman S, Scheuermann E, Rostaing L, Jenssen T, Campistol JM, et al. Results of an international, randomized trial comparing glucose metabolism disorders and outcome with cyclosporine versus tacrolimus. Am J Transplant. 2007 Jun;7(6):1506-14. Epub 2007 Mar 12. | CrossRef | PubMed | Kaplan B, Meier-Kriesche HU, Minnick P, Bastien MC, Sechaud R, Yeh CM, et al. Randomized calcineurin inhibitor cross over study to measure the pharmacokinetics of co-administered enteric-coated mycophenolate sodium. Clin Transplant. 2005 Aug;19(4):551-8. | CrossRef | PubMed |
Kaplan B, Meier-Kriesche HU, Minnick P, Bastien MC, Sechaud R, Yeh CM, et al. Randomized calcineurin inhibitor cross over study to measure the pharmacokinetics of co-administered enteric-coated mycophenolate sodium. Clin Transplant. 2005 Aug;19(4):551-8. | CrossRef | PubMed | Budde K, Bosmans JL, Sennesael J, Zeier M, Pisarski P, Schütz M, et al. Reduced-exposure cyclosporine is safe and efficacious in de novo renal transplant recipients treated with enteric-coated mycophenolic acid and basiliximab. Clin Nephrol. 2007 Mar;67(3):164-75. | PubMed |
Budde K, Bosmans JL, Sennesael J, Zeier M, Pisarski P, Schütz M, et al. Reduced-exposure cyclosporine is safe and efficacious in de novo renal transplant recipients treated with enteric-coated mycophenolic acid and basiliximab. Clin Nephrol. 2007 Mar;67(3):164-75. | PubMed | Frimat L, Cassuto-Viguier E, Charpentier B, Noël C, Provôt F, Rostaing L, et al. Impact of cyclosporine reduction with MMF: a randomized trial in chronic allograft dysfunction. The 'reference' study. Am J Transplant. 2006 Nov;6(11):2725-34. | CrossRef | PubMed |
Frimat L, Cassuto-Viguier E, Charpentier B, Noël C, Provôt F, Rostaing L, et al. Impact of cyclosporine reduction with MMF: a randomized trial in chronic allograft dysfunction. The 'reference' study. Am J Transplant. 2006 Nov;6(11):2725-34. | CrossRef | PubMed | Budde K, Curtis J, Knoll G, Chan L, Neumayer HH, Seifu Y, et al. Enteric-coated mycophenolate sodium can be safely administered in maintenance renal transplant patients: results of a 1-year study. Am J Transplant. 2004 Feb;4(2):237-43. | CrossRef | PubMed |
Budde K, Curtis J, Knoll G, Chan L, Neumayer HH, Seifu Y, et al. Enteric-coated mycophenolate sodium can be safely administered in maintenance renal transplant patients: results of a 1-year study. Am J Transplant. 2004 Feb;4(2):237-43. | CrossRef | PubMed | Budde K, Knoll G, Curtis J, Chan L, Pohanka E, Gentil M, et al. Long-term safety and efficacy after conversion of maintenance renal transplant recipients from mycophenolate mofetil (MMF) to enteric-coated mycophenolate sodium (EC-MPA, myfortic). Clin Nephrol. 2006 Aug;66(2):103-11. | PubMed |
Budde K, Knoll G, Curtis J, Chan L, Pohanka E, Gentil M, et al. Long-term safety and efficacy after conversion of maintenance renal transplant recipients from mycophenolate mofetil (MMF) to enteric-coated mycophenolate sodium (EC-MPA, myfortic). Clin Nephrol. 2006 Aug;66(2):103-11. | PubMed | Budde K, Glander P, Krämer BK, Fischer W, Hoffmann U, Bauer S, et al. Conversion from mycophenolate mofetil to enteric-coated mycophenolate sodium in maintenance renal transplant recipients receiving tacrolimus: clinical, pharmacokinetic, and pharmacodynamic outcomes. Transplantation. 2007 Feb 27;83(4):417-24. | CrossRef | PubMed |
Budde K, Glander P, Krämer BK, Fischer W, Hoffmann U, Bauer S, et al. Conversion from mycophenolate mofetil to enteric-coated mycophenolate sodium in maintenance renal transplant recipients receiving tacrolimus: clinical, pharmacokinetic, and pharmacodynamic outcomes. Transplantation. 2007 Feb 27;83(4):417-24. | CrossRef | PubMed |