 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
El ideal siempre es estudiar a aquellos pacientes que tengan probabilidad intermedia de enfermedad coronaria (EC) basado en edad, sexo, factores de riesgo y síntomas. Tras la prueba de perfusión con estrés, los resultados pueden indicar una baja probabilidad de EC lo que incita sólo a la modificación de los factores de riesgo, o a una alta probabilidad lo que hace perentoria la utilización de la angiografía coronaria según la extensión de la isquemia. Los pacientes con alta probabilidad de EC se benefician de la prueba, porque se estratifica su riesgo (1,2).
En cuanto a estratificación de riesgo en angina de pecho, la utilidad del test de perfusión miocárdica está en que puede diferenciar según la sobrevida en el tiempo. Si se analizan las tasas de sobrevida por causas de mortalidad general o por eventos cardiacos mayores, es posible apreciar un mayor sobrevida en aquellos pacientes con un estudio normal que en aquellos que muestran perfusión anormal en un vaso único o en múltiples vasos sanguíneos (3) (Figura 1A y B).
Isquemia silente. La diabetes mellitus es un equivalente coronario similar a haber tenido un infarto al miocardio. Hay diversos factores involucrados, entre ellos la disfunción endotelial, en que existe una enfermedad de pequeños vasos. Además de la EC tradicional, existen posiciones contradictorias en cómo enfrentar a estos pacientes asintomáticos o a poblaciones de alto riesgo de EC con factores de riesgo no tradicionales como los insuficientes renales.
El efectuar en forma rutinaria la pesquisa de EC en pacientes asintomáticos no está claro, pero sí lo está en diabéticos asintomáticos de alto riesgo con enfermedad de múltiples vasos, pues tienen mejor pronostico si se realiza revascularización con puentes en lugar de angioplastia, ya que la revascularización mejorar la sobrevida (4). Sin embargo, existen autores que afirman que un SPECT de perfusión miocárdica no cambiaría el pronóstico. Aunque también se ha publicado que aquellos pacientes con mayor riesgo de eventos cardiovasculares, medidos como extensión de anormalidad con estrés de perfusión, tienen un peor pronóstico (5).
Respecto a esto, existe el estudio DIAD, acerca de detección de isquemia silente en pacientes diabéticos asintomáticos. Se estudiaron a más de 1.100 pacientes, y se concluyó que el 22% de los pacientes tenían isquemia silente en SPECT con vasodilatador y, de estos pacientes anormales con isquemia, casi 30% tenían defectos moderados a graves que se consideran de alto riesgo, y fueron predictores de SPECT anormal la presencia de valsalva, ser de sexo masculino y la duración de diabetes. Los factores de riesgo tradicionales y emergentes no se asociaron con una prueba de estrés anormal, sin embargo la disfunción autonómica cardíaca fue un potente predictor de isquemia (6).
Tres años después, los mismos pacientes fueron seguidos y sometidos a una nueva prueba de perfusión con adenosina, en donde se demostró que la mayoría tenía resolución de la isquemia, en donde se plantea que pudiera ser debido a que en ese subgrupo se intensifico la terapia de factores de riesgo cardiovascular (7).
Por lo anterior, el organismo internacional de energía atómica evaluó a grupos multicéntricos de 14 países para estudiar diabéticos sintomáticos sin infarto y compararlos con controles de la misma edad (sobre 40 años), con factores de riesgo tradicionales de EC, los cuales demostraron que los diabéticos tenían mayor proporción de estudios anormales que los controles. En el análisis preliminar, hasta este momento están involucrados 439 pacientes y 200 controles. Al analizar sólo a los anormales, los diabéticos tienen mayor defecto de perfusión promedio que los controles. En un estudio nacional, realizado en el hospital clínico de la Universidad de Chile, se evidenció que el 32.5% de los diabéticos tienen enfermedad coronaria silente versus 11.4% de los controles, además que un bajo porcentaje presenta alteraciones al electrocardiograma de esfuerzo.
Si se analizan las curvas de sobrevida según localización de los defectos reversibles en los pacientes con infarto de miocardio previo, se ha visto que hay peor sobrevida en el tiempo en aquellos pacientes con isquemia peri-infarto respecto a los que tienen isquemia en territorio alejado del infarto, lo cual puede explicar que la isquemia peri- infarto pudiera producir arritmias. Si un infarto es de pared inferior en un hombre, o es anterior en una mujer, tienen el riesgo de subestimar la isquemia por problemas de atenuación (8) (Figura 2A y B).
Figura 2A. Probabilidad de sobrevivencia en años según localización del defecto.
En la actualidad, existen equipos de SPECT que tienen incorporado un tomógrafo, lo cual permite hacer estudios paralelos o inmediatamente previo, en que se resta la mayor densidad de las paredes para lograr sin problemas de atenuación, lo que mejora la sensibilidad en casos de atenuación de infarto de pared inferior en hombres o en la zona mamaria en mujeres con infarto de pared anterior (Figura 3).
También existen nuevos equipos conocidos como Di-SPECT, que son más pequeños, con tecnología de cristales, que permiten hacer estudios más completos y a la vez permiten disminuir las dosis de radiación (especial para pacientes que necesitan estudios continuados) y lograr buenas imágenes. No poseen el problema de defecto de atenuación y disminuyen la dosis de Talio y metoxi-isobutil-isonitrilo a la décima parte.
El equipo de la Universidad de Chile está involucrado principalmente en trabajos con tumores neuroendocrinos que tengan en su superficie receptores de somatostatina, para lo cual se han realizado estudios de diagnostico y terapia. Las técnicas de medicina nuclear también están disponibles para los linfomas, que pueden marcar anticuerpos anti-CD20; y coloides en tumores hepáticos primarios y secundarios; aunque por el precio son menos utilizados.
Los radionúclidos con uso terapéutico son los alfa; los beta que son electrones que producen energía continua con distintos rangos y alcances y los EC/IC nivel K. La distribución de radionúclido es heterogénea en un órgano solido, pero para partículas de corta penetración implica dosimetría no homogénea, en donde el blanco principal es dañar por ionización el ADN nuclear lo que impide que la célula se duplique (9) (Tabla 1).
Tabla 1. Radionúclidos con uso terapéutico.
Se sabe que se utiliza el ion I131, con vida media de 8 días, para las terapias de hipertiroidismo y de cáncer funcionante diferenciado, pero para los tumores neuroendocrinos existen dos opciones: itrio 90 (Y90) o lutecio 177 (Lu177), que tienen vida media de 2,7 y 6,7 días, respectivamente; con un rango menor en el lutecio (Tabla 2).
Tabla 2. Características de los distintos radioisótopos.
En tumores neuroendocrinos lo que se hace es tomar la molécula del péptido análogo de la somatostatina, que son los octeótridos de ocho átomos, al cual se le inserta un quelante que puede ser DTPA (Diethylene triamine pentaacetic acid) o DOTA (ácido 1,4,7,10-tetraazaciclododecano-N,N',N'',N''' tetraacético), para servir como puente con el radioisótopo marcador; lo cual permite obtener imágenes diagnosticas (10).
Terapia de tumores neuroendocrinos. Los criterios de inclusión para esta terapia implica que el tumor sea inoperable y metastásico, que tenga receptores de somatostatina en todos o por lo menos la mayoría de los sitios comprometidos, que tenga buena reserva medular (hemoglobina mayor a 10 gr/dl; glóbulos blancos mayor a 3.000/mm3; plaquetas mayor a 100.000 Pm3), reserva renal adecuada con un clearence de creatinina mayor a 40 ml/minuto, buena reserva hepática, buen performance status y que ya se haya recuperado por lo menos tres meses después de la ultima quimio o radioterapia. Las contraindicaciones son el extenso compromiso metastásico de la medula ósea, embarazo, lactancia y la mielosupresión. Se requiere de una protección renal adecuada, con aminoácidos, para no dañar los riñones al concentrar el isotopo captado.
La Figura 4 representa el estudio en un paciente de 48 años con un tumor retroperitoneal resecado parcialmente, cuyo diagnóstico fue tumor neuroendocrino maligno (carcinoide). En la imagen se puede notar la distribución habitual del octeótrido en hígado, bazo, riñones, vejiga, en donde existe una gran zona anormal que, luego de tres terapias en diciembre del 2004 y abril y octubre del 2005, la masa se reduce y para volver a crecer parcialmente. Como terapia se utilizó DOTA-Y90, la cual en ningún caso logra mejorías, pues está pensada para alargar la sobrevida o disminuir la progresión.
Figura 4. TAC y estudio con DOTA en paciente con masa retroperitoneal.
Es posible utilizar lutecio en forma segura después de terapia con DOTATOC (11).
En un paciente chileno, estudiado con galio 68 Dotatate (radiofármaco PET), se evidenció la presencia de múltiples lesiones abdominales. El diagnóstico histológico fue un tumor carcinoide de origen desconocido. Las imágenes revelan lesiones captantes y no captantes de Dotatate, es decir, algunas tienen receptores y otras no. Actualmente el paciente recibe dosis de Y90 y Lu177 a modo de tratamiento (Figura 5).
Figura 5. Tumor carcinoide de origen desconocido tratado con Y90 y Lu177.
Un estudio nacional, actualmente en proceso, consta de 17 pacientes con 70 dosis, con una media de 3,5 ± 1,6 dosis por paciente; con una actividad hasta entre 75 a 650 mili Curie y un seguimiento entre 5 y 48 meses. Hasta el momento, las lesiones tumorales han permanecido estables o han disminuido en 7 pacientes y han progresado en otros 5 según a las imágenes anatómicas; no obstante, se ha establecido que es una modalidad segura en el medio. El protocolo estándar incluye hospitalización durante 24 horas, protección renal con hidratación intensa, aminoácidos parenterales pre y post terapia Y corticoides al día siguiente, para luego proceder con controles de imágenes de 24 horas para evaluar la biodistribución in vivo. La respuesta tumoral ha sido de regresión parcial en 44% de los casos, estabilidad de la enfermedad en 35% y progresión en 20% de ellos (12).
RIT: radioinmunoterapia. La inmunoterapia para linfoma utiliza dos anticuerpos, uno marcado con Y90 y el otro con I131, ambos de origen murino y utilizados de manera principal en linfoma de células B.
Estos tumores son radiosensibles, por lo que responden a radiación beta y tienen terapia especifica; la terapia isotópica se recomienda en casos resistentes, ya que permiten imágenes preterapia, no invalidan las terapias posteriores, son de seguridad relativa, aunque producen mielotoxicidad bastante intensa; no se requiere hospitalización para su procedimiento. Además están en etapa de evaluación para su aceptación oficial, pues la marcación es compleja y necesita integración con el grupo de hematólogos.
Las indicaciones terapéuticas de RIA corresponden a linfomas no Hodgkin (LNH) de bajo grado con recaída o refractario, linfomas foliculares o LNH transformados a células B en donde se incluye a pacientes con LNH foliculares refractarios a Rituximab. En pacientes con linfoma de células B, la respuesta que se obtiene con este tipo de terapia es más duradera en pacientes de alto riesgo y no presenta mayor toxicidad que los regímenes habituales de quimioterapia. Al ser una radiación localizada, es diez veces más potente que la obtenida por irradiación de cuerpo entero y, por lo tanto, se logran remisiones más duraderas (13).
El I131 Tositumomab (Bexxar®) permite imágenes de dosimetría, pues se liberan 75cGy a cuerpo entero; en tanto el Y90 Ibritutomab tiuxetan (Zevalin®) produce imágenes que evalúan la biodistribución, en cuyo estudio sólo arrojó 0,6% de imágenes alteradas (14) (Figura 6).
En un estudio que evaluó la respuesta al régimen terapéutico de Zevalin en 54 pacientes con LNH de células B folicular refractarios a Rituximab, se encontró que la duración media de respuesta fue de 6,4 mese y el rango de progresión de 6,8 meses (15).
Tumores hepáticos. Los tumores hepáticos presentan un aumento de la incidencia de compromiso secundario. La vascularización hepática normal ocurre en el 75% a través de la vena porta, en tanto las metástasis y los tumores primarios se diseminan casi en su totalidad por la arteria hepática. Las opciones terapéuticas en estos casos son la resección quirúrgica o el trasplante hepático.
Cuando un tumor no es resecable, es posible recurrir a la quimioterapia sistémica o a la ablación con radiofrecuencia, irradiación externa, quimio-embolización transarterial o a la radio-embolización con microesferas (16) (Figura 7).
Las microesferas de Y90 son emisores beta de 0,93 Megaelectronvoltios (MeV), con una penetración de cuatro a 11 mm, miden de 25 a 35 micras de diámetro y requieren de angiografía hepática selectiva (17).

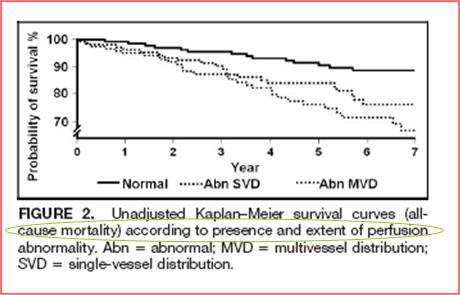 Figura 1A. Curva de sobrevivencia no ajustada según presencia y tipo de anormalidad en la perfusión para toda causa de mortalidad.
Figura 1A. Curva de sobrevivencia no ajustada según presencia y tipo de anormalidad en la perfusión para toda causa de mortalidad.

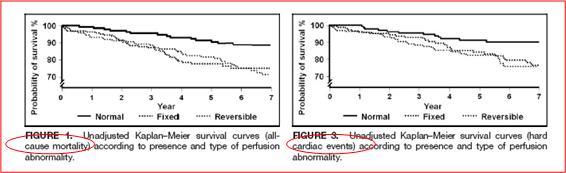 Figura 1B. Curva de sobrevivencia no ajustada según presencia y tipo de anormalidad en la perfusión para eventos cardiacos mayores.
Figura 1B. Curva de sobrevivencia no ajustada según presencia y tipo de anormalidad en la perfusión para eventos cardiacos mayores.

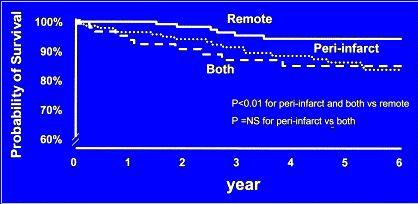 Figura 2A. Probabilidad de sobrevivencia en años según localización del defecto.
Figura 2A. Probabilidad de sobrevivencia en años según localización del defecto.

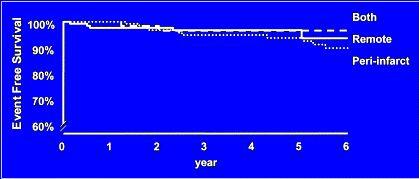 Figura 2B. Sobrevida libre de eventos cardiovasculares (reinfarto) en años según localización del defecto.
Figura 2B. Sobrevida libre de eventos cardiovasculares (reinfarto) en años según localización del defecto.

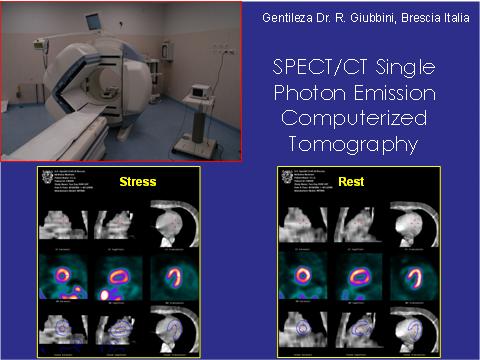 Figura 3. SPECT.
Figura 3. SPECT.

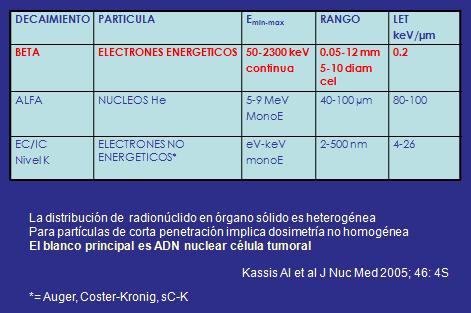 Tabla 1. Radionúclidos con uso terapéutico.
Tabla 1. Radionúclidos con uso terapéutico.

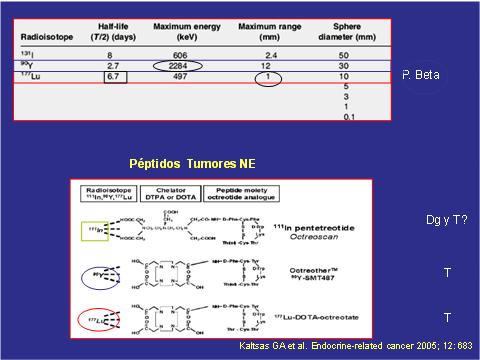 Tabla 2. Características de los distintos radioisótopos.
Tabla 2. Características de los distintos radioisótopos.

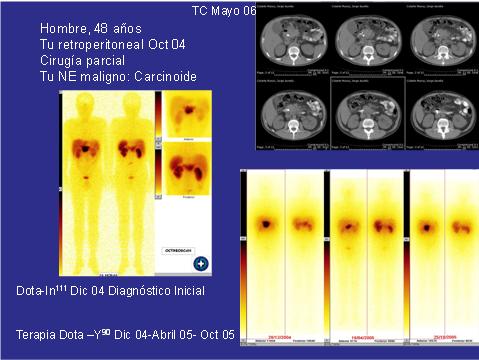 Figura 4. TAC y estudio con DOTA en paciente con masa retroperitoneal.
Figura 4. TAC y estudio con DOTA en paciente con masa retroperitoneal.

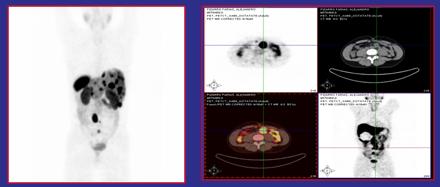 Figura 5. Tumor carcinoide de origen desconocido tratado con Y90 y Lu177.
Figura 5. Tumor carcinoide de origen desconocido tratado con Y90 y Lu177.

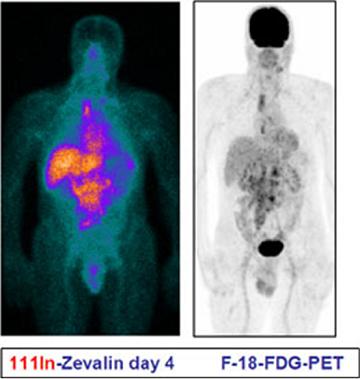 Figura 6. Imagen de estudio con Zevalin en comparación con F-18-FDG (fluorine 18-deoxyglucose) PET. Se aprecian linfonodos en abdomen y mediastino.
Figura 6. Imagen de estudio con Zevalin en comparación con F-18-FDG (fluorine 18-deoxyglucose) PET. Se aprecian linfonodos en abdomen y mediastino.

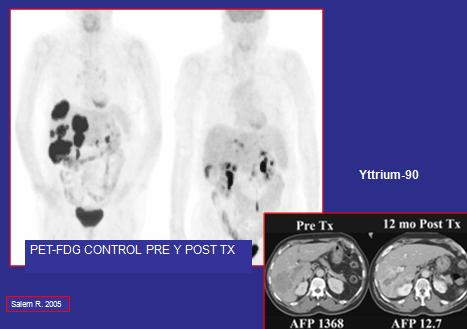 Figura 7. Radio- embolización con microesferas de tumores hepáticos. Se aprecia además disminución del tamaño tumoral al TAC de abdomen después de un año del tratamiento.
Figura 7. Radio- embolización con microesferas de tumores hepáticos. Se aprecia además disminución del tamaño tumoral al TAC de abdomen después de un año del tratamiento.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
 Expositora:
Teresa Massardo[1]
Expositora:
Teresa Massardo[1]

Citación: Massardo T. Current topics in nuclear medicine for the internist. Medwave 2010 Jun;10(6):e4592 doi: 10.5867/medwave.2010.06.4592
Fecha de publicación: 1/6/2010

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Gibbons RJ, Abrams J, Chatterjee K, Daley J, Deedwania PC, Douglas JS, et al. ACC/AHA 2002 guideline update for the management of patients with chronic stable angina--summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Chronic Stable Angina). Circulation 2003;107(1):149-58. | CrossRef | PubMed |
Gibbons RJ, Abrams J, Chatterjee K, Daley J, Deedwania PC, Douglas JS, et al. ACC/AHA 2002 guideline update for the management of patients with chronic stable angina--summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Chronic Stable Angina). Circulation 2003;107(1):149-58. | CrossRef | PubMed | Klocke FJ, Baird MG, Lorell BH, Bateman TM, Messer JV, Berman DS, et al. ACC/AHA/ASNC guidelines for the clinical use of cardiac radionuclide imaging--executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASNC Committee to Revise the 1995 Guidelines for the Clinical Use of Cardiac Radionuclide Imaging).Circulation 2003;108(11):1404-18. | CrossRef | PubMed |
Klocke FJ, Baird MG, Lorell BH, Bateman TM, Messer JV, Berman DS, et al. ACC/AHA/ASNC guidelines for the clinical use of cardiac radionuclide imaging--executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASNC Committee to Revise the 1995 Guidelines for the Clinical Use of Cardiac Radionuclide Imaging).Circulation 2003;108(11):1404-18. | CrossRef | PubMed | Elhendy A, Schinkel AF, van Domburg RT, Bax JJ, Valkema R, Huurman A, et al. Risk stratification of patients with angina pectoris by stress 99mTc-tetrofosmin myocardial perfusion imaging. J Nucl Med 2005;46(12):2003-8. | PubMed |
Elhendy A, Schinkel AF, van Domburg RT, Bax JJ, Valkema R, Huurman A, et al. Risk stratification of patients with angina pectoris by stress 99mTc-tetrofosmin myocardial perfusion imaging. J Nucl Med 2005;46(12):2003-8. | PubMed | Sorajja P, Chareonthaitawee P, Rajagopalan N, Miller TD, Frye RL, Hodge DO, et al. Improved survival in asymptomatic diabetic patients with high-risk SPECT imaging treated with coronary artery bypass grafting. Circulation 2005;112(9 Suppl):I311-6. | PubMed |
Sorajja P, Chareonthaitawee P, Rajagopalan N, Miller TD, Frye RL, Hodge DO, et al. Improved survival in asymptomatic diabetic patients with high-risk SPECT imaging treated with coronary artery bypass grafting. Circulation 2005;112(9 Suppl):I311-6. | PubMed | Berman DS, Rozanski A, Rana JS, Shaw LJ, Wong ND, Min JK. Screening for coronary artery disease in diabetic patients: a commentary. J Nucl Cardiol 2009;16(6):851-4. Epub 2009 Aug 19. | CrossRef | PubMed | PMC |
Berman DS, Rozanski A, Rana JS, Shaw LJ, Wong ND, Min JK. Screening for coronary artery disease in diabetic patients: a commentary. J Nucl Cardiol 2009;16(6):851-4. Epub 2009 Aug 19. | CrossRef | PubMed | PMC | Wackers FJ, Young LH, Inzucchi SE, Chyun DA, Davey JA, Barrett EJ, et al. Detection of silent myocardial ischemia in asymptomatic diabetic subjects: the DIAD study. Diabetes Care. 2004;27(8):1954-61. | CrossRef | PubMed |
Wackers FJ, Young LH, Inzucchi SE, Chyun DA, Davey JA, Barrett EJ, et al. Detection of silent myocardial ischemia in asymptomatic diabetic subjects: the DIAD study. Diabetes Care. 2004;27(8):1954-61. | CrossRef | PubMed | Wackers FJ, Chyun DA, Young LH, Heller GV, Iskandrian AE, Davey JA, et al. Resolution of asymptomatic myocardial ischemia in patients with type 2 diabetes in the Detection of Ischemia in Asymptomatic Diabetics (DIAD) study. Diabetes Care 2007;30(11):2892-8. Epub 2007 Aug 6. | CrossRef | PubMed |
Wackers FJ, Chyun DA, Young LH, Heller GV, Iskandrian AE, Davey JA, et al. Resolution of asymptomatic myocardial ischemia in patients with type 2 diabetes in the Detection of Ischemia in Asymptomatic Diabetics (DIAD) study. Diabetes Care 2007;30(11):2892-8. Epub 2007 Aug 6. | CrossRef | PubMed | Elhendy A, Schinkel AF, van Domburg RT, Bax JJ, Poldermans D. Differential prognostic significance of peri-infarction versus remote myocardial ischemia on stress technetium-99m sestamibi tomography in patients with healed myocardial infarction. Am J Cardiol2004;94(3):289-93. | CrossRef | PubMed |
Elhendy A, Schinkel AF, van Domburg RT, Bax JJ, Poldermans D. Differential prognostic significance of peri-infarction versus remote myocardial ischemia on stress technetium-99m sestamibi tomography in patients with healed myocardial infarction. Am J Cardiol2004;94(3):289-93. | CrossRef | PubMed | Kassis AI, Adelstein SJ. Radiobiologic principles in radionuclide therapy. J Nucl Med 2005;46 Suppl 1:4S-12S. | PubMed |
Kassis AI, Adelstein SJ. Radiobiologic principles in radionuclide therapy. J Nucl Med 2005;46 Suppl 1:4S-12S. | PubMed | Kaltsas GA, Papadogias D, Makras P, Grossman AB. Treatment of advanced neuroendocrine tumours with radiolabelled somatostatin analogues. Endocr Relat Cancer 2005;12(4):683-99. | PubMed |
Kaltsas GA, Papadogias D, Makras P, Grossman AB. Treatment of advanced neuroendocrine tumours with radiolabelled somatostatin analogues. Endocr Relat Cancer 2005;12(4):683-99. | PubMed | Forrer F, Uusijärvi H, Storch D, Maecke HR, Mueller-Brand J. Treatment with 177Lu-DOTATOC of patients with relapse of neuroendocrine tumors after treatment with 90Y-DOTATOC. J Nucl Med 2005;46(8):1310-6. | PubMed |
Forrer F, Uusijärvi H, Storch D, Maecke HR, Mueller-Brand J. Treatment with 177Lu-DOTATOC of patients with relapse of neuroendocrine tumors after treatment with 90Y-DOTATOC. J Nucl Med 2005;46(8):1310-6. | PubMed | Kwekkeboom DJ, de Herder WW, Kam BL, van Eijck CH, van Essen M, Kooij PP, et al. Treatment with the radiolabeled somatostatin analog [177 Lu-DOTA 0,Tyr3]octreotate: toxicity, efficacy, and survival. J Clin Oncol 2008;26(13):2124-30. | CrossRef | PubMed |
Kwekkeboom DJ, de Herder WW, Kam BL, van Eijck CH, van Essen M, Kooij PP, et al. Treatment with the radiolabeled somatostatin analog [177 Lu-DOTA 0,Tyr3]octreotate: toxicity, efficacy, and survival. J Clin Oncol 2008;26(13):2124-30. | CrossRef | PubMed | Cilley J, Winter JN. Radioimmunotherapy and autologous stem cell transplantation for the treatment of B-cell lymphomas. Haematologica 2006;91(1):114-20. | PubMed |
Cilley J, Winter JN. Radioimmunotherapy and autologous stem cell transplantation for the treatment of B-cell lymphomas. Haematologica 2006;91(1):114-20. | PubMed | Conti PS, White C, Pieslor P, Molina A, Aussie J, Foster P. The role of imaging with (111)In-ibritumomab tiuxetan in the ibritumomab tiuxetan (zevalin) regimen: results from a Zevalin Imaging Registry. J Nucl Med 2005;46(11):1812-8. | PubMed |
Conti PS, White C, Pieslor P, Molina A, Aussie J, Foster P. The role of imaging with (111)In-ibritumomab tiuxetan in the ibritumomab tiuxetan (zevalin) regimen: results from a Zevalin Imaging Registry. J Nucl Med 2005;46(11):1812-8. | PubMed | Juweid ME. Radioimmunotherapy of B-cell non-Hodgkin's lymphoma: from clinical trials to clinical practice. J Nucl Med 2002;43(11):1507-29. | PubMed |
Juweid ME. Radioimmunotherapy of B-cell non-Hodgkin's lymphoma: from clinical trials to clinical practice. J Nucl Med 2002;43(11):1507-29. | PubMed | Salem R, Lewandowski RJ, Atassi B, Gordon SC, Gates VL, Barakat O, et al. Treatment of unresectable hepatocellular carcinoma with use of 90Y microspheres (TheraSphere): safety, tumor response, and survival. J Vasc Interv Radiol 2005;16(12):1627-39. | PubMed |
Salem R, Lewandowski RJ, Atassi B, Gordon SC, Gates VL, Barakat O, et al. Treatment of unresectable hepatocellular carcinoma with use of 90Y microspheres (TheraSphere): safety, tumor response, and survival. J Vasc Interv Radiol 2005;16(12):1627-39. | PubMed | Salem R. Ytrium-90 for the treatment of primary and secondary hepatic malignancies: early results and future directions. SNM Annual Meeting handouts, Toronto 2005.
Salem R. Ytrium-90 for the treatment of primary and secondary hepatic malignancies: early results and future directions. SNM Annual Meeting handouts, Toronto 2005.