 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el marco de las reuniones clínicas del Servicio de Pediatría del Complejo de Salud San Borja-Arriarán. La publicación de estas actas científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría. El jefe de Servicio es el Dr. Francisco Barrera y el coordinador de las Reuniones Clínicas es el Dr. Luis Delpiano.
El rinovirus (RV) fue aislado por primera vez en 1956 por Pelon y colaboradores. Clásicamente es asociado a resfrío común, del cual se dice es la infección más frecuente en humanos. Pertenece a la familia Picornaviridae a la cual pertenece también el polio virus, los enterovirus y el virus hepatitis A. Es un virus pequeño, de 30 nm, del que se han descrito dos especies (A y B) y se han identificados 102 serotipos que se dividen en dos familias dependiendo del receptor a que se unen en la célula huésped. 90% pertenece a la familia que se une a ICAM-1 y 10% se une a LDL y proteínas relacionadas. Es un virus que carece de envoltura, cuya cápside icosaédrica tiene varias proteínas que pueden ser blancos de acción terapéutica y que envuelve una hebra única de RNA
El mecanismo de inoculación ha sido bastante discutido y hay dos corrientes, una dice que se transmite a través de la autoinoculación en nariz y ojos por manos contaminadas y otra plantea que la transmisión se efectúa mediante inhalación de aerosoles. Es transportado a la nasofaringe posterior por las células ciliadas y en la zona adenoidea de la nariz, el virus se une a células epiteliales mediante ICAM-1 (90% de los virus), lo que produce cambios conformacionales en la cápside, internalización por medio de endosomas y liberación del RNA dentro de la célula huésped.
Los viriones maduros son liberados por lisis celular, ocho a diez horas después de haber ingresado a la célula, sin embargo, se ha descrito que afecta sólo a un número pequeño de células (alrededor de 10%) y con eso es capaz de hacer lisis, reproducirse y producir la infección. Se produce también la liberación de citoquinas pro-inflamatorias que se han descrito como las responsables de los síntomas del resfrío común, la rinorrea, entre otros. Estas citoquinas son IL-1b, TNF, IL-8, IL-6, IL-11 y bradiquininas. También se liberan quimioquinas que son importantes en el reclutamiento de células inflamatorias: RANTES, IP-10, VEGF (1).
Las infecciones respiratorias son la principal causa de morbimortalidad en niños y en adultos. Se ha descrito clásicamente al virus respiratorio sinsicial (VRS) y al para influenza (PI) como los principales patógenos respiratorios, pero la mayoría de estos trabajos están basados en niños hospitalizados en aquellos lugares donde no se reciben otros virus, ni siquiera el adenovirus.
El RV es el virus respiratorio más común en escolares y en adultos: dos tercios de los resfríos comunes son responsabilidad del RV y hasta la mitad de las exacerbaciones asmáticas se han reconocido como consecuencia de la infección por éste. La epidemiología de este agente fue descrita inicialmente en aislamiento por cultivos que no son muy sensibles. Se describieron peaks estacionales entre otoño y primavera, pero posteriormente con el advenimiento de técnicas más modernas y sensibles, como el RT-PCR, se confirmó esta estacionalidad, sin embargo, también se describieron una buena cantidad de casos en verano y en invierno. Tiene una alta incidencia en personas asintomáticas, hasta 20% de las personas pueden estar infectadas y no tener ningún síntoma. Esto se ha descrito porque el RNA viral puede estar presente en secreción nasal dos o tres semanas antes de presentar los síntomas y hasta cinco semanas después de haber tenido un resfrío. Los adultos tienen hasta un episodio sintomático al año por RV y en menores de un año esta cifra se dobla.
Este agente está clásicamente descrito como el responsable del resfrío común y se decía que era incapaz de reproducirse en la vía aérea baja y que tenía especial preponderancia por la vía aérea superior, ya que sólo se reproducía a temperaturas bajas, de 33º C y no a 37ºC. Sin embargo, ya desde 1965 se describió que era capaz de producir una traqueobronquitis en voluntarios sanos, en los que se indujo la infección por RV. En el año 1969 se describió el aislamiento del RV en tejido pulmonar post mortem, lo cual fue un indicio importante de que era capaz de infectar la vía aérea inferior. Posteriormente se describió en cultivos de células epiteliales bronquiales infectadas, luego de la exposición por RV. En 1999 en cultivos experimentales se describió que los 37º C de la vía aérea baja no son protectores de replicación del virus. En el año 2000 por hibridación in situ, se logró una prueba fehaciente de que el virus infecta el pulmón humano y que no era recogido de la vía aérea superior cuando se tomaba la muestra en voluntarios sanos e infectados por RV, a los cuales se les tomó después biopsias bronquiales (2).
Otro paradigma era que este agente no tenía ninguna relevancia médica, porque lo único que causaba era el resfrío común, sin embargo, hoy se sabe que un importante número de exacerbaciones asmáticas son producidas por este agente, que es capaz de producir otitis, sinusitis y neumonía en distintos grupos etarios y distintos tipos de patologías en los niños.
El resfrío común, es el prototipo de infección por RV. Los síntomas se pueden iniciar muy tempranamente, de 24 a 48 horas, puede durar entre nueve y once días y en general empieza con odinofagia, se le agrega rinorrea, congestión nasal, cefalea y tos. También se ha descrito la otitis media aguda y la sinusitis como infección directa o asociada a sobreinfección bacteriana después de un resfrío común, aislándose el virus mediante punciones timpánicas.
Respecto a las exacerbaciones asmáticas, se realizó un estudio en el que se siguió a 108 niños entre nueve y once años con diagnóstico de asma, durante un año, observando los síntomas clínicos y haciendo medición de flujo espiratorio. Se hizo un estudio completo con cultivo, IFI, serología y PCR para coronavirus y RV. Éste evidenció, como se observa en la Fig. 1, que los virus estaban relacionados hasta en 85% de estos episodios de exacerbaciones asmáticas y el RV era el responsable de 2/3 de ellas. También se vió que hay una fuerte correlación entre los periodos en que se aísla con mas frecuencia el RV y los periodos en que se hospitalizan más personas, adultos y niños, con exacerbaciones asmáticas (2).
Un estudio muy interesante se realizó en Australia entre julio de 1996 y julio de 1999, en el que se reclutaron 263 niños prenatalmente, en los que se sabía que tendrían alto riesgo de atopia, ya que los padres eran asmáticos y tenían un hermano asmático. Estos niños se siguieron durante un año, se les otorgó un diario de vida a los padres en el que iban registrando los síntomas respiratorios junto con la indicación de dar aviso a los investigadores para que tomaran una muestra de aspirado nasofaríngeo en cada uno de estos episodios, además de dos muestras control cuando los niños tenían cuatro semanas sin síntomas. Se les realizó RT-PCR para RV y otros virus y se descubrió que 58,1% de las infecciones respiratorias altas eran causadas por RV, 40,7% de las infecciones respiratorias bajas eran de responsabilidad del RV y 45% de los episodios bronquiales obstructivos también eran responsables el RV. Tal como se observa en la Fig. 2, el VRS se queda atrás con respecto al RV. Una vez que el niño era infectado por el RV tenía dos veces más posibilidades de hacer una infección respiratoria alta que una baja. Entonces ese trabajo describe que el RV es diez veces más frecuente que el VRS en infecciones respiratorias agudas (IRA) altas y tres veces más frecuente en IRA bajas. No describe sin embargo, cuántos de esos niños se hospitalizaron (3).
Otro estudio realizado en USA, consistió en tomar aspirados nasofaríngeos en niños menores de dos años, entre enero y diciembre del año 2004, dando un total de 540 muestras, porque dividieron a los pacientes en cuatro categorías. 165 niños estaban en la que tenían evidencia de infección respiratoria ya fuera alta o baja, pero sin sibilancias; 80 niños que tenían episodios de síndrome bronquial obstructivo (SBO); 93 niños asintomáticos, que fueron los controles; y por último 202 muestras históricas que fueron aportadas por el laboratorio, negativas para VRS, adenovirus, parainfluenza y bocavirus. A todos se les hizo RT-PCR para RV. Se encontró que de los controles, 3,2% eran positivos para RV; de los que tenían episodios de infecciones respiratorias no sibilantes 17% lo eran; de las muestras aportadas por el laboratorio que eran negativas para los otros virus, 23% también eran positivas; y 26% de los niños que tenían SBO. En la descripción de la estacionalidad, se encontraron los especímenes de RV en otoño y primavera. De las muestras que fueron aportadas por el laboratorio, 55% de estos niños estaban hospitalizados por IRA baja y al compararlos con los resultados por VRS, no había una diferencia significativa entre los niños que se hospitalizaban por VRS y los que se hospitalizaban por RV. (4) En Chile, no se tiene presente como causa de IRA baja, pero sí se considera al VRS, pero al parecer el RV puede ser aun más frecuente.
Otro estudio, también realizado en USA, analizó a 591 niños menores de cinco años, hospitalizados por IRA baja. 26% de ellos tenían RV positivo, con una tasa asociada a hospitalización de 4,8 por mil que variaba dependiendo de la edad y de las patologías concomitantes. Los lactantes menores se hospitalizaban mucho más y los niños con SBO recurrente o asma, tenían una tasa de hospitalización de 25,3 por mil por RV. En España, en los niños menores de dos años, hospitalizados por IRA baja, fue el segundo más común después de VRS. En Hong Kong fue el virus detectado con mayor frecuencia en niños hospitalizados y en Finlandia, 28% de los niños hospitalizados por IRA baja tenían RV y de ellos el 61% SBO.
El diagnóstico es controversial, el cultivo viral se considera el gold standard en el diagnóstico por infección de RV, sin embargo, tiene altos porcentajes de falsos negativos y de falsos positivos. Se hace aislamiento en cultivos de fibroblastos de distintas líneas celulares y se demora entre tres y siete días en obtener resultados, lo cual claramente no es adecuado en la práctica. Tiene una sensibilidad variable y requiere experiencia tanto en la toma de muestra y procesamiento, siendo además una técnica costosa. Hay otras técnicas que son menos usadas, como la detección de antígenos mediante Elisa o la serología mediante teste de neutralización viral y Elisa (5).
El advenimiento de nuevas técnicas como el RT-PCR permite un diagnostico rápido, con resultados en cinco a ocho horas, tiene un costo similar al del cultivo y mucho mayor sensibilidad. Es probable que el RT-PCR sea demasiado sensible y no se sabe si estas muestras indicarán que efectivamente está infectado y el virus se está replicando o simplemente es portación. Por eso el cultivo pese a no ser muy sensible, sigue siendo el gold standard (6).
Hay muchos blancos en el virus que pueden ser estudiados como posibles estrategias terapéuticas para impedir la infección: la susceptibilidad celular que tiene la célula huésped para adquirir esta infección, la unión y el ensamblamiento viral, la inhibición de la replicación del RNA viral, la síntesis proteica y finalmente la función de la cápsula.
Se ha estudiado el interferón, con posible efecto antiviral, antiproliferativo e inmunológico, además de un probable impacto sobre la susceptibilidad de la célula. De acuerdo a esto, se ha encontrado que no tiene ninguna implicancia en el tratamiento, pero sí en la profilaxis al usar el interferón alfa-2 nasal; no obstante la irritación nasal y el sangrado frecuente, han limitado su uso como armas terapéuticas (5).
Como ya se mencionó, 90% de los RV se unen a las moléculas de ICAM-1. Se ha estudiado la variante soluble, que se supone ocuparía los sitios de unión del RV y evitaría así que se una a la célula huésped, no obstante los estudios que se han hecho han mostrado una eficacia más bien marginal.
Los tratamientos más usados son aquellos compuestos que se unen a la cápside viral e impiden su reordenamiento y acoplamiento a los receptores de la célula huésped, cambiando además, la conformación espacial del virus y prohibiendo la replicación viral. Las limitaciones que han encontrado son las dosis que se debe usar, la tolerancia, la solubilidad, la biodisponibilidad y la seguridad.
El Pleconaril es el compuesto que más se ha estudiado en RV y en laringitis por enterovirus. Se trata de un agente antiviral que se administra por vía oral y es capaz de introducirse en los bolsillos de la cápside viral, impidiendo su reordenamiento, su unión a la célula y la replicación celular.
Un estudio consistió en que a 33 voluntarios sanos se les administró 400 mg de Pleconaril, 14 horas antes de infectarlos con Coxsackie A-21, que es un tipo de picornavirus que da síntomas similares a los del RV. El fármaco fue evaluado como prevención de la infección y mostró una eficacia importante en disminuir síntomas respiratorios y sistémicos.
El estudio fase dos, fueron 1024 voluntarios sanos infectados experimentalmente con RV, a los que se les dio tratamiento con Pleconaril 400 mg, dos veces al día por siete días. Esto mostró una disminución promedio de 3,5 días de duración de los síntomas, todos con resultados significativos.
Otro estudio, randomizado doble ciego placebo controlado, incluyó a 1044 pacientes que tenían síntomas respiratorios de menos de 36 horas de evolución y durante otoño, lo que coincidía con el alza de RV. Ellos recibieron 400 mg de Pleconaril, 3 veces por día por 5 días. Mostraron una disminución de 1,5 días en la duración de los síntomas y una menor intensidad de los mismos en comparación con los que recibieron placebo (5).
Otras armas terapéuticas son los inhibidores de RNA viral, como el enviroxime, que inhibe la región codificante 3A del DNA y la replicación viral. Sin embargo, tiene la desventaja importante de no ser bien tolerado por vía oral y que la actividad al aplicarlo por vía intranasal, es muy limitada. Hay agentes derivados del enviroxime que están bajo investigación actualmente.
Otro método es inhibir la síntesis de proteínas virales. El virus tiene una proteína que es la proteasa 3C, codificada por el RV y que produce el clivaje de las poli proteínas de la cápside, que permitirán la unión en la célula huésped y son esenciales para la replicación viral y el ensamblaje de los viriones. El agente AG7088, que está bajo investigación, es una droga de bajo peso molecular que inhibe esta proteasa, con buena actividad in vitro y que hasta el momento en las investigaciones ha demostrado ser bien tolerada (5).
Se ha demostrado en todo cuadro viral, que el lavado de manos, asociado a limpiar los juguetes y abrir las ventanas, permite una reducción significativa de la infección respiratoria en niños menores de dos años.
La vigilancia y el feedback en conjunto con la gente encargada de las infecciones intrahospitalarias (IIH) también produjo una reducción significativa en la infección por VRS, que tiene una forma similar de transmisión que el RV. El uso de guantes y delantal, también mostró una disminución de las IIH por VRS.
El uso en el lavado de manos de soluciones con ácido acetilsalicílico, soluciones yodadas, con alcohol gel y pañuelos viricidas, no mostró una reducción significativa de la infección (7).
Es entonces el RV ¿Algo más que un resfrío común? Definitivamente, sí.

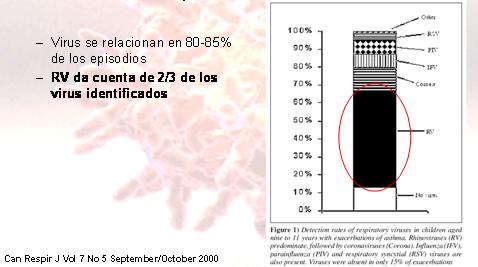 Figura 1. Detección de virus respiratorios en niños entre nueve y once años con exacerbaciones de asma.
Figura 1. Detección de virus respiratorios en niños entre nueve y once años con exacerbaciones de asma.

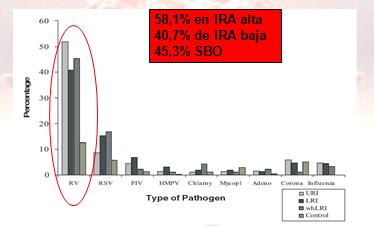 Figura 2. Porcentajes de virus respiratorios, en la infección aguda del tracto respiratorio superior e inferior, en el primer año de vida.
Figura 2. Porcentajes de virus respiratorios, en la infección aguda del tracto respiratorio superior e inferior, en el primer año de vida.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el marco de las reuniones clínicas del Servicio de Pediatría del Complejo de Salud San Borja-Arriarán. La publicación de estas actas científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Servicio de Pediatría. El jefe de Servicio es el Dr. Francisco Barrera y el coordinador de las Reuniones Clínicas es el Dr. Luis Delpiano.
 Expositora:
Daniela Martínez[1]
Expositora:
Daniela Martínez[1]

Citación: Martínez D. Rhinovirus: more than a common cold?. Medwave 2010 May;10(5):e4523 doi: 10.5867/medwave.2010.05.4523
Fecha de publicación: 1/5/2010

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Kirchberger, S., Majdic, O., Stöckl, J., Modulation of the Immune System by Human Rhinoviruses. Int Arch Allergy Immunol. 2007;142(1):1-10. Epub 2006 Sep 29. | CrossRef | PubMed |
Kirchberger, S., Majdic, O., Stöckl, J., Modulation of the Immune System by Human Rhinoviruses. Int Arch Allergy Immunol. 2007;142(1):1-10. Epub 2006 Sep 29. | CrossRef | PubMed | Papadopoulos NG, Moustaki M, Tsolia M, Bossios A, Astra E, Prezerakou A, et al. Association of rhinovirus infection with increased disease severity in acute bronchiolitis. Am J Respir Crit Care Med. 2002 May 1;165(9):1285-9. | CrossRef | PubMed |
Papadopoulos NG, Moustaki M, Tsolia M, Bossios A, Astra E, Prezerakou A, et al. Association of rhinovirus infection with increased disease severity in acute bronchiolitis. Am J Respir Crit Care Med. 2002 May 1;165(9):1285-9. | CrossRef | PubMed | Kusel MM, de Klerk NH, Holt PG, Role of respiratory viruses in acute upper and lower respiratory tract illness in the first year of life: a birth cohort study. Pediatr Infect Dis J. 2006 Aug;25(8):680-6. | CrossRef | PubMed |
Kusel MM, de Klerk NH, Holt PG, Role of respiratory viruses in acute upper and lower respiratory tract illness in the first year of life: a birth cohort study. Pediatr Infect Dis J. 2006 Aug;25(8):680-6. | CrossRef | PubMed | Piotrowska Z, Vázquez M, Rhinoviruses are a major cause of wheezing and hospitalization in children less than 2 years of age. Pediatr Infect Dis J. 2009 Jan;28(1):25-9. | CrossRef | PubMed |
Piotrowska Z, Vázquez M, Rhinoviruses are a major cause of wheezing and hospitalization in children less than 2 years of age. Pediatr Infect Dis J. 2009 Jan;28(1):25-9. | CrossRef | PubMed | 19057454Anzueto A., Niederman M., Diagnosis and Treatment of Rhinovirus Respiratory Infections. Chest. 2003 May;123(5):1664-72.
| CrossRef | PubMed |
19057454Anzueto A., Niederman M., Diagnosis and Treatment of Rhinovirus Respiratory Infections. Chest. 2003 May;123(5):1664-72.
| CrossRef | PubMed |