 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
El hierro es un elemento muy abundante en la naturaleza, sin embargo el estado en que se encuentra hace que para los organismos vivos sea muy difícil obtenerlo; por esta razón los individuos están provistos de eficaces mecanismos para ahorrar el hierro que poseen al nacer.
El hierro es un elemento esencial para la vida: participa en procesos vitales como la síntesis del grupo hem, constituyente de la molécula de hemoglobina que se encarga del transporte de oxígeno por el organismo; además interviene en todas las reacciones con transferencias de electrones, especialmente la fosforilación oxidativa y contribuye en otros procesos de biosíntesis, incluyendo el de los ácidos nucleicos. No obstante, el hierro también es potencialmente muy tóxico, por lo que nunca se encuentra en su estado de ion libre circulando por el organismo: a través de todo el proceso de absorción, utilización y almacenamiento el hierro siempre se encuentra ligado a proteínas, especialmente en su forma ferrosa; de lo contrario podría desencadenar la producción de radicales superóxidos muy dañinos, tanto para las proteínas como para los ácidos nucleicos. El hierro circula unido a su transportador, la transferrina; entra a la célula a través de los receptores de transferrina; sale desde los endosomas lisosomales en un proceso mediado por la proteína DMT1, que es una proteína transportadora de metales bivalentes; se almacena por medio de la ferritina y finalmente sale de las células gracias a la mediación de otra proteína de membrana, la ferroportina, que es una exportadora de membrana también llamada IREG 1 u OMTP. Todo el proceso está conducido por alguna proteína, sea transportadora o de depósito.
Todas las proteínas que participan en el metabolismo del hierro están reguladas a su vez por los niveles de este elemento, tanto a nivel de la inducción de los genes que las codifican como en su regulación post-transcripcional, es decir, cuando ya se ha sintetizado el ácido ribonucleico mensajero (ARNm). Esto es especialmente válido para la síntesis de la ferritina, que es la proteína de depósito y para la molécula del receptor de transferrina, que tienen una regulación antagónica entre ellas, de modo que cuando el organismo dispone de abundante cantidad de hierro aumenta la síntesis de ferritina y, por el contrario, si disminuye la cantidad de hierro aumenta la síntesis del receptor de transferrina. Esta regulación se realiza a nivel del ARNm de ambas proteínas por acción de las moléculas “respondedoras al hierro”, que actúan como sensores del hierro intracelular. Este es un mecanismo de regulación recíproca muy complejo e interesante. Las otras proteínas que participan en el transporte intracelular del hierro y que son responsables de la absorción, salida del endosoma (proteína DMT1) y salida celular mediada por ferroportina también tienen una regulación dependiente de hierro, pero por otros mecanismos.
El primer paso del metabolismo del hierro es la absorción en el intestino, específicamente en el duodeno, a nivel de los enterocitos ubicados en el ápice de las vellosidades, llamados enterocitos maduros. En los enterocitos de la cripta se ubicarían los censores de niveles de hierro en el organismo, cuya información llega de alguna manera al enterocito para regular la absorción.
El hierro que ingresa al organismo es tipo no hem, inorgánico y se debe reducir desde su estado normalmente férrico, trivalente, hacia su estado ferroso para ser absorbido; en este proceso intervienen dos factores: el primero es la acidez gástrica, y aunque se sabe que la aquilia gástrica conduce a anemia ferropriva, se suele olvidar este concepto que ha adquirido relevancia nuevamente en el último tiempo; el otro factor que interviene en la reducción del hierro férrico a ferroso es la proteína de membrana Dcytb, una enzima reductasa que pertenece a la familia de citocromos b56 cuya síntesis es fuertemente inducida por la deficiencia de hierro, al igual que la proteína DMT1 transportadora de cationes y se postula que sería la única capaz de absorber el hierro desde el intestino. Actualmente se sabe que la mutación homocigótica de DMT1 induce un cuadro de anemia microcítica hipocroma congénita severa y que se asocia a sobrecarga de hierro en los macrófagos, porque DMT1 también es muy importante en el reciclamiento del hierro a través de éstos. Finalmente, como esta célula recibe señales de la cantidad de hierro que existe en el individuo, el hierro que sale de la célula a través de la ferroportina se almacena en la ferritina, lo que constituye un mecanismo de regulación, ya que ese hierro unido a la ferritina se perderá por las deposiciones con la descamación intestinal normal.
El hierro no sale de la célula en forma libre, sino unido a la proteína exportadora de membrana ferroportina, que cumple un rol fundamental. Una vez que el hierro sale de la célula nuevamente se debe convertir desde hierro ferroso, que es el estado intracelular, hacia hierro férrico, que es menos perjudicial que el ferroso; además la transferrina, proteína transportadora plasmática del hierro, sólo acepta al hierro en su estado férrico. El proceso lo realiza la proteína haphaestin, que comparte 50% de homología con la ceruloplasmina, ya que cumple la misma función en el macrófago cuando el hierro debe salir de éste.
El círculo del metabolismo del hierro se completa con el reciclamiento de este elemento gracias a la fagocitosis de los eritrocitos senescentes, proceso que se lleva a cabo bajo la acción de una serie de enzimas y cambios de PH que ocurren en el interior del fagosoma, el que finalmente libera el hierro, entre otras moléculas, a partir de otra enzima que es la hem-oxigenasa. Este proceso protagonizado por el macrófago libera alrededor de 20 a 25 miligramos diarios de hierro elemental y sirve de sustrato para que la médula ósea produzca 300 billones de eritrocitos diarios en el ser humano normal; el mecanismo de absorción intestinal tiene como función reponer las pérdidas diarias de hierro, que ascienden a 1 a 2 mg aproximadamente, mientras que el hierro que se utiliza en la producción de los eritrocitos es el que se está reciclando. Por eso se dice que organismo humano es muy ahorrador de hierro.
El equilibrio entre absorción intestinal y reciclamiento es el único mecanismo de regulación de los niveles de hierro en el organismo, ya que no existe un mecanismo de excreción; sólo la sincronización muy fina entre ambos procesos permite mantener la cantidad de hierro estable dentro del cuerpo. Actualmente se sabe que la hormona que regula esta coordinación entre el enterocito y el macrófago es la hepcidina, cuyo nombre se compone de hep, porque se sintetiza a nivel hepático, y cidina, porque se descubrió cuando se estaban estudiando factores con propiedades antimicrobianas de la inmunidad innata.
La hepcidina, molécula peptídica de 25 aminoácidos, regula la mantención de la cantidad de hierro del organismo; para ejercer este efecto se une a la ferroportina e induce su internalización y posterior degradación, es decir, la hepcidina bloquea la entrega de hierro desde el enterocito hacia el plasma y también desde el macrófago hacia el plasma, lo que se traduce en menor disponibilidad de hierro para ser utilizado por el organismo. En resumen, la hepcidina es la proteína que regula la disponibilidad de hierro en el individuo: cuando aumenta su nivel disminuye el hierro disponible y cuando su nivel disminuye, la cantidad de hierro disponible aumenta.
La expresión del gen de la hepcidina es controlada tanto por los niveles de hierro como por la inflamación, que permiten ajustar la cantidad de hierro circulante según los requerimientos. Con respecto a la inflamación, las citoquinas inflamatorias probablemente convergen en una vía final común con la interleuquina 6, que desencadena una cascada de señales que permiten que el gen de la hepcidina se exprese. Por otra parte, la sobre expresión de la hepcidina explica el patrón que se observa en la inflamación de hiposideremia, es decir, niveles de hierro circulante disminuidos, con ferritina aumentada como expresión de los depósitos aumentados en los macrófagos; lo anterior se explica por la degradación de la ferroportina, lo que impide la salida del hierro desde los enterocitos y macrófagos. En resumen, hipoferremia y ferritina aumentada es el patrón típico de la anemia inflamatoria. Aparte de lo señalado existen otros factores que regulan la síntesis de hepcidina: disminuyen su producción la anemia, la hipoxia y la actividad eritropoyética. Un fenómeno interesante es que los pacientes talasémicos o con síndrome mielodisplásico que tienen hierro en exceso tienen niveles de hepcidina inadecuadamente bajos; esto se explica porque la síntesis de esta última es inhibida por la actividad eritropoyética, lo que provoca una sobrecarga de hierro a pesar de que éste se encuentre en niveles excesivos, es decir, la absorción de hierro continúa debido a que los niveles de hepcidina se encuentran inadecuadamente bajos. Esto demuestra que el estímulo eritropoyético es un factor inhibidor de la síntesis de hepcidina mucho más potente que el estímulo de sobrecarga de hierro, por mecanismos que aún se desconocen.
Más interesante aún es el hecho de que la hepcidina es el factor común de todas las variedades de hemocromatosis: las cuatro variantes de hemocromatosis recesiva y la única presentación dominante, que implica la mutación de la ferroportina, tienen en común bajos niveles de hepcidina, debido a que todas las proteínas que mutan en la hemocromatosis participan en la regulación que el hierro ejerce sobre la expresión del gen de hepcidina a nivel de la membrana del hepatocito y la mayoría de estas proteínas funcionan como co-receptores, en un mecanismo de señalización muy complejo. Cuanto más bajos son los niveles de hepcidina, más grave es la sobrecarga de hierro. Por otra parte, las cuatro principales proteínas mutadas en la forma clásica de esta patología, dentro de las cuales destaca la HFE, pero también las del gen de la hepcidina, del receptor II de la transferrina y la hemosiderina, participan en la regulación de la síntesis de hepcidina por el hierro. Desde un punto de vista filogenético es más problemática la sobrecarga de hierro que la deficiencia de éste, como lo demuestran los estudios efectuados en ratas expuestas a infusiones de hepcidina, en las cuales disminuye en forma importante la sobrecarga de hierro, lo que sugiere que esta terapia sería mucho más eficaz que utilizar quelantes de hierro en estas condiciones clínicas.
En la figura 1 se observa el proceso completo del metabolismo del hierro. En el paso 1, el hierro que se requiere para la eritropoyesis, en cantidad de 20 a 25 mg/día, es provisto por la destrucción de los glóbulos rojos senescentes a través de los macrófagos. En la etapa 2, el hierro liberado al plasma por la ferroportina es oxidado por la ceruloplasmina y transportado por la transferrina a los precursores eritroides de la médula ósea. En el paso 3, el hierro es absorbido a nivel intestinal por los enterocitos del duodeno, lo que compensa las pérdidas diarias de 1 a 2 mg/día. La hepcidina, péptido rico en cisteína sintetizado por los hepatocitos y representado en la etapa 4, regula negativamente la exportación de hierro desde los enterocitos (fase 5) y desde los macrófagos a través de la unión a ferroportina (fase 6), induciendo la internalización y degradación.
Figura 1. Metabolismo del hierro.
La anemia ferropriva y la de las enfermedades crónicas, o anemia inflamatoria, son las anemias que se observan con mayor frecuencia en la práctica clínica. La deficiencia de fierro es muy común: la OMS señala que hasta 23% de las mujeres embarazadas tienen deficiencia de hierro, lo cual no significa que estén anémicas; además se encuentra este problema en 4% de los hombres entre 15 y 59 años, en 10% de las mujeres entre 15 y 59 años y en 12% de los mayores de 60 años. En la actualidad es muy raro observar las características clínicas clásicas de la deficiencia grave de hierro, como glositis, queilitis, disfagia y coiloniquia; el reconocimiento clínico de la deficiencia de hierro hoy en día se basa en determinaciones de laboratorio. En la población adulta, las mujeres en edad reproductiva son las más susceptibles, ya que la pérdida menstrual puede llegar a 42 mg de hierro por ciclo y un embarazo consume 700 mg.
Es importante recordar que la deficiencia de hierro ocurre cuando se produce un desbalance entre las necesidades y el suministro. Esto puede ocurrir, en primer lugar, debido a demandas no cubiertas por el hierro absorbido, como ocurre cuando hay aumento de los requerimientos, dietas demasiado estrictas y en presencia de síndromes de malaabsorción; por ejemplo, puede haber aumento de requerimientos en niños, mujeres embarazadas, adolescentes en crecimiento rápido o personas bajo entrenamiento muscular intenso. El desbalance entre necesidades y suministro se puede deber, en segundo lugar, a aumento de las pérdidas de hierro, sea fisiológicas, como las que ocurren por la menstruación y el embarazo, o por pérdidas gastrointestinales que se manifiestan como pérdida de sangre oculta en las deposiciones, que explicaría 62% de los casos de anemia en la población adulta. También puede haber pérdidas de hierro por otras vías, no gastrointestinales, pero son menos frecuentes. Por lo tanto, el diagnóstico de anemia ferropriva no es definitivo sino que es el punto de inicio de un estudio que debe continuar hasta que se identifique la causa.
La anemia ferropriva es el estado final de la deficiencia de hierro, por lo tanto cuando se trata al paciente se corrige primero la anemia, luego se recuperan los niveles de hemoglobina y finalmente se rellenan los depósitos. Desde el punto de vista clínico, hay dos etapas importantes de reconocer en este proceso: una es la depleción de los depósitos, en la cual el paciente no tiene anemia y se evidencia por la disminución de la ferritina sérica, que es el parámetro que tiene mejor correlación con los depósitos de hierro; además, se considera que un valor de ferritina menor de 12 mcg/L es muy específico de deficiencia de hierro, pues sólo existen dos situaciones en las cuales este valor se encuentra bajo sin alteración de los depósitos: el hipotiroidismo, que es muy fácil de reconocer clínicamente y la deficiencia de ácido ascórbico, que es muy poco frecuente. Sin embargo todos los autores recomiendan emplear un valor de corte más alto en la práctica clínica: algunos sugieren 30 mcg/L y otros, 40 mcg/L, para aumentar la sensibilidad. La gran limitación de este parámetro es que se trata de un reactante de fase aguda, por lo tanto aumenta en forma inespecífica cuando hay inflamación y pierde su valor como reflejo de los depósitos.
La siguiente etapa en el proceso de pérdida de hierro es lo que se conoce como eritropoyesis deficiente en hierro, en la cual no sólo disminuye la ferritina, sino también la sideremia o ferremia. Habitualmente esto se acompaña de aumento compensatorio de los niveles de transferrina, que es la proteína transportadora, y de disminución de la saturación de transferrina; este patrón no sólo refleja una deficiencia de los depósitos, sino también una repercusión sobre la producción de glóbulos rojos, pero habitualmente el paciente aún no tiene anemia; cuando ésta aparece, por supuesto que ya existen las dos condiciones señaladas previamente. Sin embargo, la ferremia y la transferrina no sólo se alteran por la inflamación, sino también por otras condiciones, lo que determina que su rendimiento diagnóstico, sensibilidad y especificidad sean relativamente bajos; por ello se considera que el examen más confiable para evaluar el estado de eritropoyesis deficiente en hierro, es la cuantificación de los niveles del receptor soluble de la transferrina, que no se modifica frente a la inflamación y aumenta muy precozmente cuando el hierro disponible para la síntesis de glóbulos rojos disminuye.
El diagnóstico de anemia ferropriva se establece en presencia de anemia microcítica e hipocroma, es decir, con volumen corpuscular medio disminuido, habitualmente menor de 80 um3 y hemoglobina corpuscular media disminuida, que indica menor carga de hemoglobina en los glóbulos rojos. Un parámetro que se cita con frecuencia, pero se utiliza poco es el ancho de distribución eritrocitario (ADE), que en la talasemia, la otra gran causa de anemia microcítica e hipocroma, está disminuido. En la anemia ferropriva el perfil de hierro se caracteriza por ferremia disminuida, capacidad de fijación de hierro aumentada y ferritina disminuida. La muestra se debe tomar siempre en ayunas por la mañana, ya que hay un ritmo circadiano para la ferremia. Finalmente, lo más importante es el diagnóstico de la causa.
Dentro del diagnóstico diferencial de la anemia ferropriva se debe considerar a las anemias microcíticas hipocrómicas no hiposiderémicas, fundamentalmente las talasemias, que no son frecuentes en Chile pero sí en otros países. Para los pacientes talasémicos el aporte de hierro es perjudicial, ya que tienen una sobrecarga basal, por lo tanto es importante tener en mente esta posibilidad y ante cualquier duda confirmar que la anemia es por deficiencia de hierro antes de iniciar el tratamiento.
El gran problema se presenta frente a la anemia de la enfermedad crónica, que se caracteriza por hiposideremia y cuando es de larga evolución también es microcítica e hipocrómica, debido a una deficiencia de hierro de tipo funcional; por lo tanto es difícil hacer el diagnóstico diferencial, especialmente cuando el paciente que tiene anemia por enfermedad crónica tiene además una deficiencia de hierro sobreagregada: en general se puede diferenciar una anemia pura por deficiencia de hierro de una anemia inflamatoria, pero el problema es cuando ambas coexisten. En estos enfermos se recomienda determinar el cociente entre el receptor soluble de la transferrina y el logaritmo de la ferritina; si el resultado es menor que uno es una anemia inflamatoria pura y si es mayor que dos significa que además hay una deficiencia de hierro. Muchas condiciones inflamatorias crónicas se benefician al corregir la deficiencia de hierro asociada.
De los exámenes señalados previamente, el que tiene mayor rendimiento es la ferritina: valores menores de 15 mcg/L se asocian a deficiencia de hierro con una probabilidad muy superior a cualquiera de las otras determinaciones, como volumen corpuscular medio, hemoglobina, hemoglobina corpuscular media y saturación de transferrina, tanto en población general como en ancianos (2).
En la segunda parte de esta conferencia se hablará sobre el diagnóstico etiológico de la anemia ferropriva y su tratamiento.

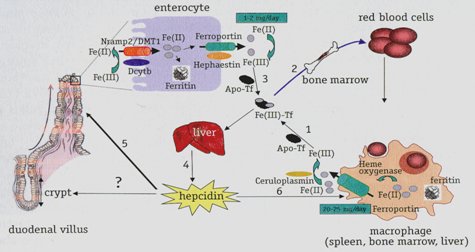 Figura 1. Metabolismo del hierro.
Figura 1. Metabolismo del hierro.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera y la coordinadora de las reuniones clínicas es la Dra. Miriam Alvo.
 Author:
Daniel Araos H.[1]
Author:
Daniel Araos H.[1]

Citación: Araos D. Iron deficiency anemia I: iron metabolism, diagnosis of iron deficiency anemia. Medwave 2009 Sep;9(9):e4154 doi: 10.5867/medwave.2009.09.4154
Fecha de publicación: 1/9/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.