 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada de una conferencia dictada en el marco de las reuniones clínicas de la Unidad General de Cuidados del Niño del Hospital Padre Hurtado. El jefe de la UGCN es el Dr. Alejandro Donoso y el Encargado de las Reuniones Clínicas es el Dr. Mario Vildoso.
Las parasitosis aún son prevalentes a nivel mundial, especialmente en países en vías de desarrollo, a pesar del progreso sanitario y cultural que se ha logrado en las últimas décadas. La desnutrición y las inmunodeficiencias favorecen la morbimortalidad provocada por las parasitosis, cuya prevalencia es mayor en las regiones tropicales, específicamente en aquellas que se ubican entre el trópico de Cáncer y el trópico de Capricornio, zona que incluye a casi toda África, Asia, América Central y la mayor parte de América del Sur. En Chile la zona tropical es desértica, razón por la cual no existen problemas de parásitos, ya que éstos necesitan condiciones especiales de humedad y calor. La modernización se asocia a aumento de las migraciones y del turismo, lo que favorece la diseminación de las enfermedades tropicales; si a esto se agrega un insuficiente control sanitario se explica la persistencia de las zoonosis, enfermedades transmitidas al ser humano por los animales.
Las parasitosis se clasifican según diferentes criterios:
Se denomina hospedero o huésped al portador del parásito, que puede ser simple o complejo; el ser humano es un huésped complejo, ya que en condiciones naturales permite la sobrevivencia y alojamiento de agentes infecciosos. Los hospederos se pueden clasificar en: accidentales o circunstanciales, que son aquellos que se infectan, pero no permiten el desarrollo completo del ciclo biológico del parásito; los definitivos, en los cuales el parásito alcanza la madurez o fase de actividad sexual; los intermediarios, en los cuales se desarrolla la fase larvaria o asexuada; y los paraténicos, que son hospederos accidentales en los cuales se corta el ciclo del parásito.
Los parásitos pueden producir síntomas respiratorios mediante tres mecanismos:
Durante años el principal parásito pulmonar fue Pneumocysitis carinii, que cambió de nombre a Pneumocysitis jirovecii con la aparición del SIDA, hasta que las modernas técnicas de biología molecular permitieron establecer que se trata de un agente fúngico y no de un parásito.
A continuación se revisarán los principales parásitos que afectan al pulmón, según su clasificación morfológica.
A este grupo pertenecen Entamoeba histolytica, que provoca la amebiasis y Plasmodium vivax, causante de la malaria, que en conjunto son los más importantes a nivel mundial, pues afectan a 10% de la población; Plasmodium falciparum, que también causa malaria; Toxoplasma gondii, responsable de la toxoplasmosis y Leishmania infantum, agente causal de leishmaniosis y kala-azar, leishmaniosis visceral que se transmite del perro al hombre por picadura de mosquito.
La amebiasis tiene como forma de presentación más común un cuadro gastrointestinal, pero también puede dar síntomas causados por abscesos amebianos que se desarrollan en distintos órganos a partir de una diseminación hematógena. Si el absceso se produce en el pulmón y drena hacia la vía aérea, el paciente puede presentar la característica vómica de aspecto achocolatado.
La malaria puede producir distrés respiratorio secundario a inflamación y microinfartos pulmonares. Esta patología fue un gran problema en el norte chileno hace muchos años.
La toxoplasmosis, secundaria a interacción con gatos, también puede producir problemas pulmonares en inmunodeprimidos tras la ingestión de carne cruda, como se ha visto en pacientes VIH que cursan con neumonitis grave e indistinguible clínicamente de la provocada por Pneumocysitis carinii u otros agentes infecciosos.
La leishmaniosis o kala-azar es una patología frecuente en Brasil, India y otros países tercermundistas asiáticos, secundaria a la infección por Leishmania infantum que produce lesiones ulcerativas en piel y cara. El kala-azar es la forma sistémica; su cuadro clínico se caracteriza por compromiso del estado general, fiebre, hepatoesplenomegalia, diarrea y en ocasiones, hemorragia de las mucosas gingival y nasal. Esta enfermedad causa la muerte de alrededor de dos millones de personas al año en el mundo, pues no tiene tratamiento eficaz. En Chile el vector es el mosquito Flebotomus perniciosus.
En este grupo se encuentran los pentastómidos, que son artrópodos aberrantes puesto que en su estado adulto toman la apariencia de helmintos cilíndricos o aplanados, generalmente anillados, sin patas y de color blanco, pero en su estado larvario inicial se asemejan a ácaros. Las pentastomiasis pueden ser causadas por Armillifer armillatus o Linguatula serrata, que viven en las fosas nasales y faringe de mamíferos como los perros y reptiles, como las serpientes. El ser humano se puede contagiar por contacto con las mascotas (Fig. 1).
Figura 1. Artrópodos pentastómidos. A: Armillifer armillatus. B: Linguatula serrata.
Posteriormente el artrópodo se distribuye por vía hematógena y se enquista en órganos como los pulmones, donde se calcifica y produce lesiones. No es mortal, pero puede ser difícil llegar al diagnóstico (Fig. 2).
Figura 2. Lesiones pulmonares provocadas por artrópodos.
Es el grupo más importante en Medicina. Estos se dividen en nematelmintos o nematodos y platelmintos.
Los nematelmintos son gusanos redondos en la sección horizontal de sus cuerpos. En este subgrupo destacan Áscaris lumbricoides, Enterobius vermicularis (pidulle), Trichuris trichiura, Trichinella spiralis y Toxocara spp; este último puede ser variedad canis o catis y la más importante es la canis, que se transmite por vía indirecta al ser humano al manipular las heces de los perros en forma accidental. El síndrome de Löffler es un cuadro inflamatorio pulmonar asociado a eosinofilia, causado por la diseminación hematógena de los nematodos durante su ciclo vital, gracias a la cual las larvas llegan al pulmón y producen focos inflamatorios migratorios que se resuelven sin dejar secuelas. El paciente de la Fig. 3 presentó un cuadro respiratorio y en las cuatro semanas siguientes presentó focos neumónicos con patrón migratorio, con resolución completa y sin secuelas posteriores.
Figura 3. Síndrome de Löffler.
Los nematodos pueden ocasionar patología pulmonar por migración, fenómenos inmunológicos o invasión luminal; también pueden causar trastornos gastrointestinales. La Fig. 4 corresponde a un caso de invasión esofágica producida por Áscaris lumbricoides, el cual migró desde el intestino.
Figura 4. Invasión esofágica por Áscaris lumbricoides.
Otras zoonosis importantes son la dirofilariasis y la toxocariasis. La primera es producida por Dirofilaria immitis, helminto que se ubica en el corazón de los perros y pueden tener al hombre como hospedero accidental, ocasionando pequeños infartos pulmonares que evolucionan hacia granulomas; cuando se produce un granuloma único se puede presentar como un nódulo pulmonar solitario. La toxocariasis es producida por la migración de formas larvales de toxocaras hacia distintos órganos, entre ellos el pulmón, ocasionando tos, expectoración y disnea con infiltrados intersticiales; también puede afectar a nivel ocular y provocar alteración en la visión (Fig. 5).
Figura 5. Dirofilarias en corazón canino y toxocariasis pulmonar.
Los platelmintos, gusanos planos a la sección horizontal, se subdividen en dos grupos: cestodos y trematodos. Los cestodos tienen forma acintada y entre ellos se encuentran: Taenia solium y Taenia saginata, cuyas fases intermedias transcurren en el cerdo y el vacuno respectivamente, Hymenolepis nana, Diphilobotrium latum y Echinococcus granulosus. Los trematodos tienen una morfología semejante a una hoja y entre los más conocidos están Fasciola hepática, que produce distomatosis hepática, y Paragonimus westermani, responsable de la paragonimiasis, enfermedad común en las zonas tropicales que cursa con compromiso pulmonar, con tos y hemoptisis (Fig. 6).
Figura 6. Fasciola hepática y Paragonimus wetermani.
Los trematodos tienen un ciclo vital complejo, dentro del cual parasitan a varios hospederos vertebrados e invertebrados; los huevos pasan del hospedero a las heces y una vez que llegan a aguas dulces eclosionan en larvas nadadoras libres, llamadas miracidios, las que penetran en un hospedero intermediario como el caracol, la almeja u otro molusco, para transformarse en esporocistos en su interior. Los esporocistos se dividen para formar redias y éstas a su vez originan a las cercarias, las formas nadadoras libres que salen del primer hospedador intermediario y perforan la cubierta del segundo hospedador intermediario, que suele ser un artrópodo, mediante enzimas; de esta forma penetran en él, se enquistan y se transforman en metacercarias. En este estado las ingiere el hospedador definitivo, en general un vertebrado depredador del hospedador anterior y en el cual el parásito completa su desarrollo. En el caso de Paragonimus la etapa intermedia ocurre en caracoles y posteriormente la cercaria se transmite a cangrejos y camarones de agua dulce, que son la fuente de infección para el hombre; en cambio la Fasciola hepática penetra en berros de agua dulce, cuya ingesta ocasiona la distomatosis en el ser humano (Fig. 7).
Figura 7. Ciclo vital de los Trematodos.
Las tenias solium y saginata tienen diferencias morfológicas importantes. La primera tiene una longitud aproximada de 2 a 4 metros y está constituida por 700 a 1000 proglótidas, como se denomina a los segmentos del tronco de las tenias, que cuando maduran presentan ovarios trilobulados y en estado grávido tienen menos de 10 ramas o úteros; el escólex de esta tenia mide 0,5 a 1 mm y posee cuatro ventosas provistas de 22 a 32 ganchos en una estructura conocida como rostelo. La tenia saginata mide 5 a 7 metros, se compone de 200 proglótidas con ovarios bilobulados, tiene más de 10 ramas y su escólex tiene cuatro ventosas, pero no armadas con rostelo. El Echinococcus granulosus o tenia del perro tiene una longitud de 5 mm y posee tres proglótidas, una inmadura, otra madura y la última grávida, además de un escólex con rostelo de 45 ganchos (Fig. 8).
La hidatidosis es producida por el agente Echinococcus granulosus, cuyo ciclo biológico contempla a un hospedero definitivo carnívoro, en donde desarrolla su forma adulta y en general corresponde a cánidos, sea perros, dingos, chacales, zorros o lobos, y un hospedero intermediario herbívoro, como oveja, de gran importancia en la zona austral de Chile (Magallanes y Aysén), cerdo o vacuno. El hombre es sólo un hospedero accidental, se infecta al ingerir huevos embrionados que están en la tierra y permite el desarrollo del parásito hacia una fase larval intermedia (Fig. 10). La hidatidosis se disemina cuando se da a comer a los perros los bofes y panitas, que son el pulmón y el hígado respectivamente, contaminados con quistes; de esta forma los perros se contaminan y diseminan los huevos al continuar con el ciclo biológico del parásito. Esta práctica era muy frecuente hace algunos años en los mataderos clandestinos.
Figura 9. Ciclo biológico de Echinococcus granulosus.
Los perros parasitados albergan 1.000 tenias de Echinococcus, en promedio, en el intestino El parásito en su forma adulta mide 5 mm de longitud y su proglótida final o grávida, que mide 2 mm y contiene en su interior 1.000 a 1.500 huevos, se desprende cada dos semanas liberando los huevos al lumen intestinal, desde donde son eliminados junto con el material fecal. Por eso es importante que quienes tengan perros como mascotas, más aún si éstos interactúan con niños, sepan que deben desparasitarlos cada 45 días en la etapa de cachorros y tres veces al año en la edad adulta.
El quiste hidatídico o hidátide, que en griego significa gota de agua, es una estructura que se forma por reacción adventicial entre el hospedero y la larva parasitaria y que se compone de continente y contenido. El continente abarca una capa externa fibrosa, adventicia o periquística formada por la reacción inflamatoria del huésped; una capa media o cutícula y una capa interna, germinativa o prolígera, que es el epitelio en donde se forman los parásitos. El contenido, o líquido hidatídico, es transparente como agua de roca; tiene propiedades antigénicas; su densidad oscila entre 1007 y 1012 y su pH es neutro (7,4). Está compuesto en 98% por agua y además contiene cloruro de sodio, glucosa, ácido úrico, vestigios de albúmina y lípidos y elementos figurados macroscópicos, como las vesículas hijas y microscópicos, como vesículas prolígeras, protoescólices a razón de 500.000/ml en quistes fértiles, y ganchos.
En cuanto a la epidemiología, a pesar de que la hidatidosis es una enfermedad de notificación obligatoria se estima que existe una subnotificación de 3 a 7 por cada caso notificado, por lo que las estimaciones de prevalencia no son muy exactas. En Chile varía entre 2,5 a 3 por 100.000 habitantes, hasta 7,5 a 8,3 por 100.000 habitantes; sin embargo en la región de la Araucanía la cifra alcanza a 35 por 100.000 y se piensa que es aún mayor en el extremo sur del país (1).
Aunque se ha observado una clara disminución de la equinococosis en la masa ganadera desde que entró en vigencia la aplicación de medidas sanitarias, el último informe anual de salud animal realizado por el Servicio Agrícola y Ganadero (SAG) en 2008 describe 272 casos de contagio humano (2).
La fase hematógena del Echinococcus le permite llegar y establecerse en cualquier parénquima, si bien muestra preferencia por los órganos filtro: en 50 a 70% de los casos se aloja en el hígado, de preferencia en el lóbulo derecho, dando lesiones únicas en 80% de los casos y múltiples, en el 20% restante; en 20 a 40% de los casos se ubica en el pulmón, de preferencia en el pulmón derecho (60%), aunque en 13% de los infectados se observa compromiso bilateral. En 10% de los enfermos se encuentra en otras localizaciones. 60% de los pacientes con infecciones pulmonares tiene el antecedente de hidatidosis hepática, pero sólo en 20% de los casos se encuentra un quiste hepático en forma simultánea. 50% de los enfermos de hidatidosis tiene menos de 30 años de edad (3).
En niños, las localizaciones de los quistes hidatídicos pulmonares según frecuencia son: lóbulo superior derecho, 15%; superior izquierdo, 23%; lóbulo inferior derecho, 28%; inferior izquierdo, 22% y lóbulo medio, 11%.
Según la patogenia la hidatidosis puede ser primaria o secundaria; en el primer caso la enfermedad se inicia con la ingestión del huevo, mientras que la forma secundaria se desarrolla después de una siembra metastásica o broncógena por ruptura del quiste o debido a persistencia local de vesículas hijas.
El quiste hidatídico por lo general es asintomático y suele ser un hallazgo radiológico; cuando produce sintomatología se observa tos irritativa, en 56% de los casos; dolor vago en 40%; disnea en quistes de gran tamaño, en 21% de los casos y fiebre, en 19%. También puede producir hemoptisis y con menor frecuencia reacciones urticariales, baja de peso y otros síntomas inespecíficos (4).
En la Fig. 10 se muestra el estudio radiológico inicial de un paciente de once años de edad que consultó por un cuadro de compromiso de conciencia, sin otros síntomas; en la radiografía de tórax se encontró una gran masa en el hemitórax derecho.
Figura 10. Radiografía de tórax en paciente de once años de edad con hidatidosis pulmonar.
En la Fig. 11 se observa la TAC de tórax del mismo paciente y una reconstrucción de imágenes después de extraer la lesión, donde se aprecia la presencia de restos pulmonares.
Figura 11. TAC de tórax con reconstrucción de imágenes en paciente con hidatidosis pulmonar.
El quiste hidatídico pulmonar complicado puede originar signos radiológicos característicos, como el signo del camalote o Water Lily, en el cual se observa un nivel líquido intraquístico con ondulaciones en su superficie debido a la presencia de la membrana cuticular, que se desprende y sumerge dentro del quiste (5).
En la Fig. 12 la radiografía y TAC de tórax muestran el nivel aéreo y debajo de éste, el nivel líquido irregular que corresponde a la membrana.
Figura 12. Signo del camalote.
El diagnóstico de hidatidosis pulmonar se realiza mediante estudio radiológico convencional, pero cuando las lesiones son pequeñas se requiere TAC de tórax. La prueba de doble difusión arco 5 de caprón, o DD5, es una reacción de inmunoprecipitación en agar del antígeno 5 del Echinococcus, 100% específica pero muy poco sensible, mientras que el examen ELISA para determinación de anticuerpos IgG es más sensible. En el hemograma, el hallazgo más frecuente es la eosinofilia mayor de 5%, que se encuentra en 30% de los casos, o de más de 300 células por mm3, pero esto puede variar según la fase del ciclo biológico del parásito.
El tratamiento de la hidatidosis pulmonar es quirúrgico y su objetivo es tratar al binomio parásito-pulmón; para ello, previo a la extirpación se procede a matar el quiste con solución de cloruro de sodio al 33%; existen técnicas para eliminar el quiste sin matar al parásito, pero en 15 a 30% de los casos se produce estallido del quiste. Después de esto se trata la cavidad, con extirpación total o parcial de la adventicia y luego se procede a obliterar la cavidad residual y el escape de aire. Finalmente se drena el espacio pleural. La cirugía debe ser conservadora. Si existe sospecha de diseminación o el quiste es gran tamaño se inicia tratamiento farmacológico, antes y después de la cirugía, con albendazol 400 mg al día por un mes.
Entre las complicaciones del quiste hidatídico pulmonar, la que se describe con más frecuencia es la rotura del quiste, con drenaje de su contenido hacia la vía aérea o la cavidad pleural. La rotura hacia vía aérea puede ser total, dando lugar a un proceso de curación con formación de un neumoquiste, o parcial, con retención de membranas secas o húmedas, dando origen a quistes abscedados. La rotura del quiste se caracteriza clínicamente por la vómica, que es la expectoración de gran cantidad de material procedente del absceso, acompañada de náuseas y a veces de fenómenos urticariales, asfixia, diseminación broncógena e incluso muerte del paciente por shock anafiláctico. Otras complicaciones son la infección del quiste, con formación de un absceso pulmonar secundario o parasitario, y el desarrollo de secuelas pulmonares como neumonitis crónica, neumopatías agudas a repetición por alteración anatómica, bronquiectasias y formación de cavernas hidatídicas que se pueden colonizar con Aspergillus.

 Figura 1. Artrópodos pentastómidos. A: Armillifer armillatus. B: Linguatula serrata.
Figura 1. Artrópodos pentastómidos. A: Armillifer armillatus. B: Linguatula serrata.

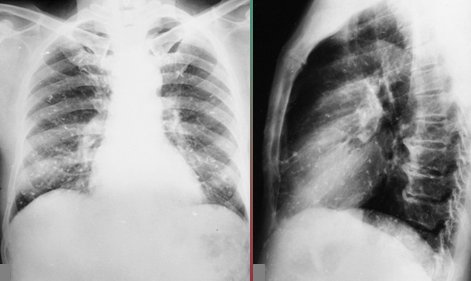 Figura 2. Lesiones pulmonares provocadas por artrópodos.
Figura 2. Lesiones pulmonares provocadas por artrópodos.

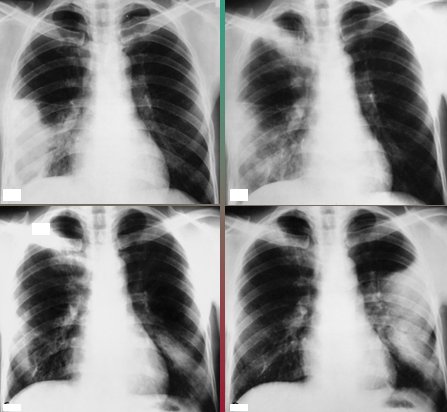 Figura 3. Síndrome de Löffler.
Figura 3. Síndrome de Löffler.

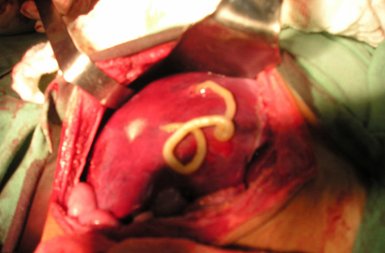 Figura 4. Invasión esofágica por Áscaris lumbricoides.
Figura 4. Invasión esofágica por Áscaris lumbricoides.

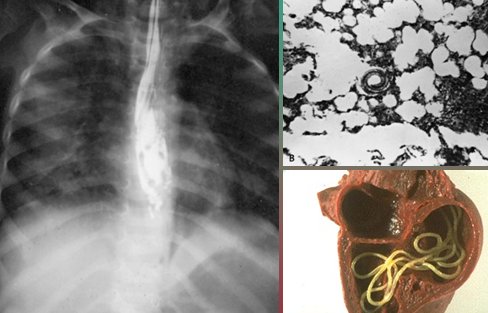 Figura 5. Dirofilarias en corazón canino y toxocariasis pulmonar.
Figura 5. Dirofilarias en corazón canino y toxocariasis pulmonar.

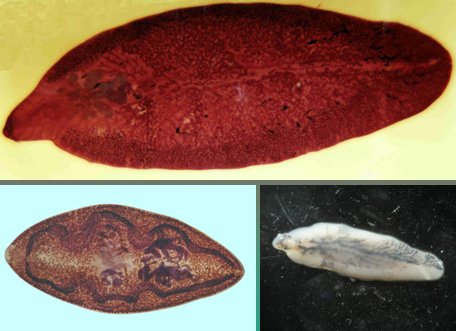 Figura 6. Fasciola hepática y Paragonimus wetermani.
Figura 6. Fasciola hepática y Paragonimus wetermani.

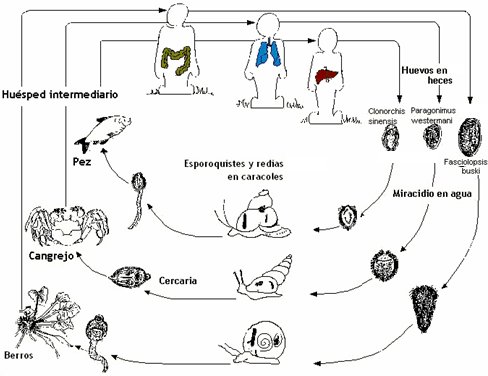 Figura 7. Ciclo vital de los Trematodos.
Figura 7. Ciclo vital de los Trematodos.

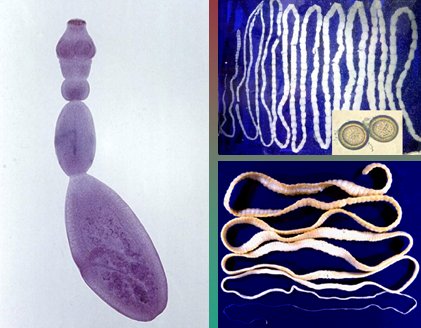 Figura 8. A derecha: Tenias saginata (arriba) y solium (abajo). A izquierda: Echinococcus granulosus.
Figura 8. A derecha: Tenias saginata (arriba) y solium (abajo). A izquierda: Echinococcus granulosus.

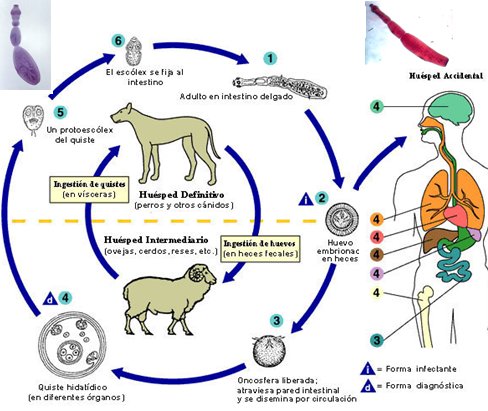 Figura 9. Ciclo biológico de Echinococcus granulosus.
Figura 9. Ciclo biológico de Echinococcus granulosus.

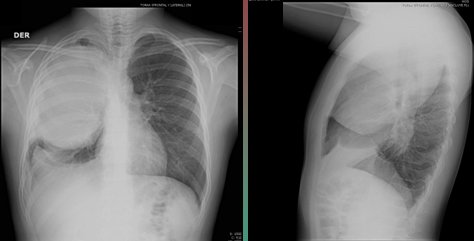 Figura 10. Radiografía de tórax en paciente de once años de edad con hidatidosis pulmonar.
Figura 10. Radiografía de tórax en paciente de once años de edad con hidatidosis pulmonar.

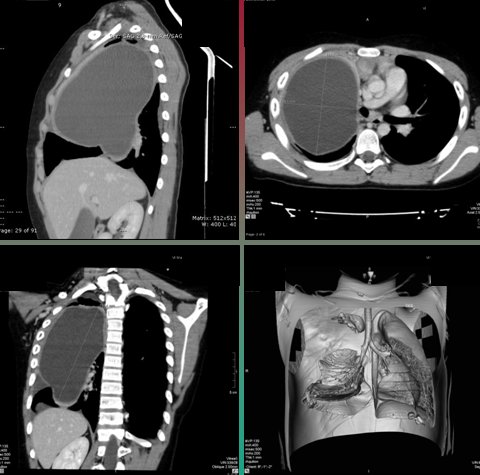 Figura 11. TAC de tórax con reconstrucción de imágenes en paciente con hidatidosis pulmonar.
Figura 11. TAC de tórax con reconstrucción de imágenes en paciente con hidatidosis pulmonar.

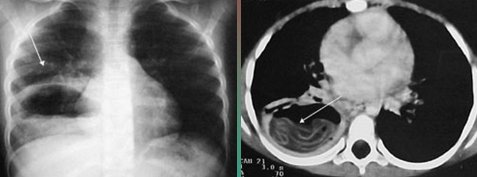 Figura 12. Signo del camalote.
Figura 12. Signo del camalote.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada de una conferencia dictada en el marco de las reuniones clínicas de la Unidad General de Cuidados del Niño del Hospital Padre Hurtado. El jefe de la UGCN es el Dr. Alejandro Donoso y el Encargado de las Reuniones Clínicas es el Dr. Mario Vildoso.
 Author:
Pedro Pablo Cox[1]
Author:
Pedro Pablo Cox[1]

Citación: Cox PP. Parasites and lung. Medwave 2009 Sep;9(9):e4152 doi: 10.5867/medwave.2009.09.4152
Fecha de publicación: 1/9/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Aliaga F, Oberg C. Epidemiología de la hidatidosis humana en la IX región de la Araucanía, Chile. 1991-1998. Bol Chil Parasitol. 2000 Jul-Dec;55(3-4):54-8. | CrossRef | PubMed |
Aliaga F, Oberg C. Epidemiología de la hidatidosis humana en la IX región de la Araucanía, Chile. 1991-1998. Bol Chil Parasitol. 2000 Jul-Dec;55(3-4):54-8. | CrossRef | PubMed | Gobierno de Chile. Informe anual de salud animal para la notificación de la ausencia o presencia de todas las enfermedades. Chile: Servicio Agricola Ganadero (SAG), 2007.
Gobierno de Chile. Informe anual de salud animal para la notificación de la ausencia o presencia de todas las enfermedades. Chile: Servicio Agricola Ganadero (SAG), 2007.  Manterola C, Vial M, Carrasco R, Bustos L, Losada H, Fonseca F, et al. Hidatidosis abdominal de localización extrahepática: características clínicas y evolución de una serie de casos. Rev Chil Cir 2002; 54(2):128-34. | Link |
Manterola C, Vial M, Carrasco R, Bustos L, Losada H, Fonseca F, et al. Hidatidosis abdominal de localización extrahepática: características clínicas y evolución de una serie de casos. Rev Chil Cir 2002; 54(2):128-34. | Link | Kurkcuoglu IC, Eroglu A, Karaoglanoglu N, Turkyilmaz A, Tekinbas C, Basoglu A. Surgical approach of pulmonary hydatidosis in childhood. Int J Clin Pract. 2005 Feb;59(2):168-72. | CrossRef | PubMed |
Kurkcuoglu IC, Eroglu A, Karaoglanoglu N, Turkyilmaz A, Tekinbas C, Basoglu A. Surgical approach of pulmonary hydatidosis in childhood. Int J Clin Pract. 2005 Feb;59(2):168-72. | CrossRef | PubMed | Ramírez M, Donoso A, Daza C, Bravo P. Caso clínico radiológico para diagnóstico. Rev Chil Pediatr 2002; 73(3):287-290.
Ramírez M, Donoso A, Daza C, Bravo P. Caso clínico radiológico para diagnóstico. Rev Chil Pediatr 2002; 73(3):287-290.