 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión científica de la Sociedad Chilena de Medicina Nuclear e Imágenes Moleculares. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y la sociedad. El presidente de la Sociedad Chilena de Medicina Nuclear e Imágenes Moleculares es el Dr. Claudio Solé. La editora científica es la Dra. Teresa Massardo.
El estudio de Tomografía de Emisión de Positrones (PET) se introdujo a fines de los años 70, se hizo conocido en los 80 y en las últimas décadas ha adquirido gran relevancia en los países en desarrollo. En Chile, el primer equipo para realizar PET se inauguró en el Hospital Militar, en 2002, en el marco del Congreso Mundial de Medicina Nuclear que se llevó a cabo en Chile ese año. Actualmente hay otro centro en la Fundación Arturo López Pérez y dos en proyecto, en la Universidad Católica y en una conocida clínica de la capital.
Sasaki, en un congreso de PET efectuado en Tailandia en 2007, resumió el impacto clínico del PET con Fluordeoxiglucosa o F18-FDG en Oncología al señalar que se ha demostrado que este estudio es efectivo en etapificación, reetapificación, evaluación de terapia y evaluación de recurrencias o metástasis; sería “probablemente efectivo” en planificación de tratamiento, evaluación pronóstica y diagnóstico diferencial entre benigno y maligno; y sería posiblemente útil como método de screening. En este estudio, es importante determinar el grado de captación de la glucosa radioactiva en los diferentes tipos de tumores, porque eso determina el rendimiento de la técnica en las diversas patologías. Existe captación moderada/alta en los cánceres pulmonar, de cuello uterino, colorrectal, esofágico, gástrico, de cabeza y cuello, ovárico, mamario, melanoma y en la mayoría de los linfomas; en cambio, la captación es variable en los cánceres de tiroides, testicular, renal, vesical, hepatocelular, sarcomas y en los tumores neuroendocrinos. Por otra parte, existen procesos benignos que consumen más glucosa y son causa de falsos positivos: células inflamatorias, médula ósea hiperplástica y las células tímicas.
Fletcher, en una publicación reciente, señaló las recomendaciones del uso del F18-FDG en oncología en una larga lista, en la que destacan: en cáncer de mama, para estudio de recurrencia; en cáncer colorrectal, para etapificación; en cáncer de esófago, para etapificación; en el de cabeza y cuello, para diagnóstico, etapificación y recurrencia; en linfomas, para etapificación y recurrencia; en nódulos pulmonares, para etapificación; en melanoma, para etapificación; en cáncer tiroideo, para los casos que cursan con tiroglobulina elevada con rastreo con I131 negativo; y también para cánceres primarios de origen desconocido (1).
Es importante conocer los sistemas de reembolso del gasto que originan estos estudios en el mundo. En los Estados Unidos, el sistema MEDICARE reembolsa a sus usuarios los gastos del estudio PET para diagnóstico, etapificación y reetapificación en nueve tipos de tumores: cáncer pulmonar células no pequeñas, cáncer de mama, cáncer de cabeza y cuello, incluido tiroides, cáncer colorrectal, cáncer cervicouterino, cáncer esofágico, melanoma y linfoma de Hodgkin (LH) y no Hodgkin (LNH). En todos estos cánceres se ha demostrado la utilidad y costo-efectividad de la técnica, en comparación con otros procedimientos (2). Asimismo, en un estudio español publicado en 2007 se demostró la utilidad del PET para diagnóstico, etapificación, detección de recurrencia y monitoreo de respuesta en linfomas y tumores de cabeza y cuello (3).
Algunos autores han cuestionado la efectividad clínica. Facey publicó un estudio que sugería que la mayor evidencia de efectividad clínica se encuentra en la detección de nódulo pulmonar solitario (NPS), en el cáncer pulmonar de células no pequeñas, en el linfoma de Hodgkin y en el cáncer colorrectal (4).
El NPS se define como una lesión pulmonar intraparenquimatosa menor de 3 cm, sin atelectasias ni adenopatías; aparece en 1 de 500 radiografías de tórax; en 90% de los casos es un hallazgo incidental; el NPS en mayores de 35 años es maligno en un tercio de los pacientes con lesión; más de 50% de los nódulos pulmonares que se resecan son benignos y sus causas son múltiples, desde inflamatorias e infecciosas hasta malignas.
En el manejo convencional se parte siempre con una radiografía de tórax digital y luego una tomografía computada (TC), aunque también puede ser un hallazgo en ésta. Es importante describir los elementos asociados a malignidad, como: tamaño, bordes (espiculados), localización (lóbulo superior), densidad (sin calcificación) y estabilidad en dos años (doble tamaño en 30-400 días). No obstante, todos estos indicadores, la causa es indeterminada en dos tercios de los NPS. Procedimientos invasivos, como la fibrobroncoscopía y la biopsia, son útiles en nódulos centrales. La biopsia transtorácica tiene una buena sensibilidad (95%) si la muestra obtenida es adecuada, pero es importante la experiencia del operador, ya que puede haber complicaciones como neumotórax, especialmente en pacientes con EPOC. Por último, se puede efectuar videotoracoscopía o cirugía.
En el estudio con PET del NPS se recomienda evaluar la probabilidad de que sea maligno según los parámetros descritos: si es espiculado, si es mayor de 3 cm, si el paciente tiene más de 70 años, si tiene cierta tasa de crecimiento, si hay antecedente de tabaquismo y si está ubicado en el lóbulo superior (5). Así, la probabilidad de que un NPS sea maligno puede ser: baja, en cuyo caso se debe controlar con TC cada tres meses el primer año y cada seis meses después; alta, que se maneja con cirugía; intermedia, que se maneja según los resultados de TC, PET, fibrobroncoscopía y biopsia transtorácica. Finalmente, puede ser un nódulo indeterminado en la TC y en este caso está indicado el PET; si éste es negativo, se deberá hacer seguimiento con TC cada tres meses y si es positivo, se deberá efectuar cirugía/VTC (6).
En un metaanálisis efectuado por Gould en 1.474 NPS se encontró que el PET tenía una sensibilidad de 97% y una especificidad de 78% en NPS mayores a 1 cm, dando una exactitud diagnóstica de 91,2%. Los falsos positivos estaban representados por infecciones y enfermedad granulomatosa (TBC, histoplasmosis) y los falsos negativos, por NPS menores de 1 cm, cáncer bronquioloalveolar, carcinoide y neoplasias mucinosas. Es importante destacar que más de 14% de estos pacientes tenía enfermedad tumoral extratorácica (7). Con respecto a los PET/TC, Kim encontró una sensibilidad de 97% y una especificidad de 85% en 42 NPS de 7 a 30 mm, considerando que el análisis visual era suficiente (8). Existen análisis semicuantitativos que permiten determinar la probabilidad de malignidad de un NPS a través del índice de captación estandarizada, que sobre 2,5 podría orientar a malignidad. En otro estudio, Yi y su grupo analizaron 119 NPS y encontraron que el PET/TC era superior a la evaluación con TC sola, tanto en sensibilidad como en exactitud diagnóstica, por lo que recomiendan que se use como primera línea (9). El PET/TC sería de elección en NPS indeterminados en la TC (10).
El índice de captación estandarizada mayor de 2,5 tiene mayor especificidad para determinar si un NPS es maligno o no: se ha descrito un valor de 82% y además tiene valor pronóstico, ya que un valor sobre 9 se asocia a sobrevida de 68% a dos años, mientras que con menos de la sobrevida a dos años es mayor de 96% (11). También se pueden realizar estudios duales, haciendo control del NPS luego de una hora, que es el protocolo habitual y a dos horas post-inyección; si se produce un aumento de 10% del SUV también sería un indicador de malignidad. Por otra parte, se ha demostrado que el PET más TC tiene mejor relación costo/efectividad que una potencial cirugía en el manejo de los NPS (12).
En la Fig. 1 se muestran imágenes de un paciente de 29 años, fumador, con un NPS en el lóbulo inferior izquierdo de 2,4 cm. Los cortes del PET no muestran captación a nivel del nódulo, pero de todas maneras el paciente se intervino y se determinó que el nódulo correspondía a una lesión benigna.
En otro caso se trataba de una paciente de 56 años con un NPS, ubicado en el lóbulo superior izquierdo (LSI), sospechoso de malignidad en el TAC. Captó intensamente, se intervino y se encontró que la lesión correspondía a un adenocarcinoma, pero además se encontró una lesión supraclavicular derecha y otro nódulo pulmonar derecho que no se veían en la TC (Fig. 2).
En otro paciente, de 56 años, fumador, con un NPS en el lóbulo pulmonar superior derecho, se observa un foco hipermetabólico que se operó, demostrándose un cáncer pulmonar de células no pequeñas (Fig. 3).
En el CPCNP, el PET-FDEG es útil para:
En cuanto a la etapificación del cáncer pulmonar: TC/RM permite determinar T, es decir, el tamaño del tumor; N, recordando que 13% de nódulos menores de 1 cm tienen cáncer; y M, las metástasis a distancia, y que 5% de la población general tiene adenomas no funcionantes suprarrenales por lo cual es importante saber si son o no activos en el PET. En caso de lesiones aisladas hepáticas o cerebrales, la única manera de saberlo es a través de la histología. El cintigrama óseo permite conocer si existen lesiones osteoblástica; en el caso de una lesión única siempre se requerirá una evaluación más detallada, para lo cual está la alternativa del PET óseo con Flúor 18. La mediastinoscopía es útil en la evaluación cervical, para ver los nódulos subcarinales y paratraqueales; si es toracoscopía, permite la evaluación de las regiones aortopulmonar y subaórtica; las complicaciones se presentan en 2,3% de los casos y hay 10% de falsos-negativos. La biopsia transbronquial tiene baja sensibilidad para evaluar el mediastino y también tiene complicaciones, como hemorragias y neumomediastino.
Existen muchas publicaciones sobre etapificación con PET. En un estudio se comparó PET/TC versus PET o TC solos, tanto para evaluar el tumor primario como los ganglios linfáticos y las metástasis y se encontró que el PET/TC era superior (13); asimismo, se ha hablado del valor adicional del PET/TC respecto PET o TC solos (14). La alternativa de la correlación visual o la fusión manual tienen el mismo valor que el PET/TC. En el metaanálisis de Gould se evaluó principalmente el mediastino y se encontró que el PET aislado tiene mucha mayor sensibilidad y especificidad que el TC. En el metaanálisis de Shon, se encontró que el PET puede cambiar la etapa sólo por identificar el mediastino hasta en 16% de los pacientes y, por las lesiones ubicadas a nivel extratorácico, hasta en 94% (15). Los falsos negativos en el mediastino se ven cuando se trata de lesiones muy pequeñas, entre 1 y 7,5 mm y en esos casos es importante hacer la mediastinoscopía, porque va a establecer la diferencia entre las etapas II y III, siendo especialmente importante la diferencia entre las etapas IIIA y IIIB, por la posibilidad de cirugía curativa (5). Sobre la evaluación del mediastino en cáncer pulmonar etapa III con PET, hay trabajos publicados recientemente que demuestran una influencia significativa del resultado de la radio y quimioterapia neoadyuvante y posterior cirugía, ya que el PET permite identificar el grupo de pacientes con criterios para tratamiento curativo (16).
En la Fig. 4 se muestra el caso de un paciente sexo masculino, de 78 años de edad, con una masa pulmonar en el lóbulo medio derecho. La fibrobroncosopía demostró un adenocarcinoma y el PET múltiples lesiones en pulmón derecho, mediastino, a nivel supra e infraclavicular derecho y a nivel de glándula suprarrenal derecha. De acuerdo con lo anterior, este paciente era etapa IV.
Respecto a la reetapificación luego de quimioterapia neoadyuvante, el PET sirve para reetapificar y reevaluar la respuesta precoz al tratamiento, 1 a 3 semanas luego del primer ciclo de quimioterapia, o al completar el tratamiento. En la detección de recurrencias, hay que saber que la TC no puede diferenciar las alteraciones anatómicas post tratamiento, especialmente después de la radioterapia, debido a la presencia de cicatrices, distorsión de la arquitectura bronquialveolar, engrosamiento pleural, derrame o fibrosis del mediastino. Por otra parte, en la radioterapia puede haber alteraciones nodulares o tipo masa que simulan recurrencia y en este caso es importante diferenciar la cicatriz de un tumor viable, lo que se logra con el PET, que tiene una sensibilidad muy alta (98-100%) y una especificidad de 62-92%, debido a la coexistencia de cambios inflamatorios. Existen patrones en la glucosa radioactiva que permiten diferenciar: un patrón difuso en el sitio de la radioterapia es compatible con cambios inflamatorios, mientras que un patrón focal fuera del campo de la radioterapia, con mínimos cambios en la TC, es sospechoso de recurrencia (17). Con respecto al control de tratamiento, la exactitud diagnóstica del PET para evaluar el mediastino post-quimioterapia alcanza a 100%; un PET negativo después del tratamiento o disminución del SUV mayor de 50% se correlaciona con mejor sobrevida (18). Este control de tratamiento se debe hacer entre 1 y 2 semanas desde el inicio de la quimioterapia y si se hace al final de ésta, es mejor predictor. En relación con la radioterapia, cuando el tumor tiene mayor captación previo a ésta va a responder mejor, pero también hay que esperar entre 3 a 6 meses para efectuar el PET, de modo de evitar errores en la interpretación de los cambios inflamatorios.
En la Fig. 5 se muestra el caso de una paciente de 68 años con diagnóstico de cáncer pulmonar derecho no resecado, tratado con sellado pleural con talco y quimioterapia. En la TC había una reducción incompleta de la masa. En el PET la masa no captaba, pero había una actividad difusa pleuropulmonar secundaria al sellado con talco; no había actividad en el tumor primario. La paciente completó el esquema de tratamiento, pero a los 10 meses, en el PET de control apareció un nuevo foco en la mitad del campo pulmonar derecho, relacionado con la lesión primaria antigua: se trataba de una recidiva, por lo que la paciente recibió nuevamente quimioterapia y radioterapia.
En la Fig. 6, las imágenes son de un paciente de 64 años de edad, fumador, con una gran masa en el lóbulo superior izquierdo (LSI) y nódulos a derecha, en los cuales el TC no pudo determinar si correspondían o no a metástasis. La biopsia bajo TC demostró un carcinoma escamoso pobremente diferenciado. Con PET se observa la masa intensa en el pulmón izquierdo y una metástasis a derecha. El paciente completó su tratamiento con quimioterapia (6 ciclos) y presentó una regresión significativa de la masa y desaparición de la lesión a derecha, concordante con respuesta adecuada a tratamiento.
Las imágenes de fusión TC/PET también permiten planificar la radioterapia, siendo importante la asociación de masas con atelectasia, en las que se debe obtener la mayor cobertura posible del tumor con el menor daño al tejido sano. En este caso (Fig. 7) se
trata de una masa posterobasal izquierda que iba a ser sometida a quimioterapia.
El impacto del PET en el CPCNC se evaluó mediante una encuesta aplicada a 274 médicos de la UCLA, según los cuales el PET cambió la etapa en 44% de los pacientes, sea a través de manejo intermodalidad o intramodalidad (19). En otro estudio, el PET implicó un cambio en el manejo en 67% de 105 pacientes, evitando tratamientos innecesarios al permitir un manejo más dirigido (20). Por otra parte, estudios realizados en diferentes países para evaluar la costo-efectividad han demostrado que la estrategia más costo-efectiva es el uso del PET luego de una TC negativa o positiva, lo que permite dirigir la biopsia, la cirugía o la quimioterapia; y que independientemente del uso de la mediastinoscopía, el PET es costo-efectivo en la evaluación del mediastino.
El PET entrega imágenes del cuerpo entero; su sensibilidad depende de la avidez por FDG, el tamaño y la actividad del background que rodea a las lesiones, mientras que la especificidad está dada por la presencia de tejido inflamatorio y la captación fisiológica que ocurre en grasa parda, intestino y sistema urinario. El PET/TC permite obtener una combinación de metabolismo y anatomía, lo que aumenta la sensibilidad y especificidad. Schoder evaluó el nivel del SUV que permite distinguir al linfoma no Hodgkin (LNH) indolente del agresivo en 97 pacientes; encontró SUV promedio de 7 en los indolentes y cercano a 20 en los agresivos, por lo que consideró que con SUV mayor de 10 se puede excluir un LNH indolente, con una especificidad de 81%; si todas las lesiones están con SUV sobre 13 se puede decir que se trata de un linfoma agresivo. Por lo tanto, el PET puede ser útil cuando hay discordancia entre biopsia y comportamiento clínico (21).
En un metaanálisis efectuado por Isasi para evaluar la utilidad del PET en la etapificación de los linfomas, en el que se incluyó a 854 pacientes con 3658 lesiones, provenientes de un total de 20 estudios, el PET hizo un upstaging en 13% y un downstaging, en casi 8% de los casos (22). Asimismo, en un estudio italiano prospectivo multicéntrico se comparó TC con PET o PET/TC; cuando los hallazgos fueron discordantes se revisó el TC o se hicieron imágenes adicionales o biopsia. Hubo un cambio de las etapas en 16% de los casos, con upstaging en 14% y downstaging, en 2%; además, hubo un cambio de estrategia del tratamiento en 6% de los casos (23).
La evaluación de la respuesta a tratamiento con PET en linfomas es especialmente útil cuando existen masas residuales en la TC, lo que ocurre en 70% de los LH y 50% de los LNH. Además, hay muchos pacientes en remisión completa aparente que también presentan recaídas y el tratamiento precoz de la masa residual mejora la sobrevida, por lo tanto, se requiere una herramienta sensible y segura para detectar enfermedad residual o refractaria. En un metaanálisis de 15 estudios, en el que se incluyó a 705 pacientes, 297 con LNH y 408 con LH, se encontró que el PET tuvo una sensibilidad de 72% y una especificidad de 100%, en el subgrupo de pacientes con LNH, en el momento de evaluar la presencia de enfermedad residual después de tratamiento, mientras que en el grupo de LH la sensibilidad fue 84% y la especificidad, 90% (24).
En el año 2007 se publicaron los criterios de respuesta para linfoma maligno que se obtuvieron en un Consenso, en el que se definió como: respuesta completa, la desaparición de todas las evidencias de enfermedad; respuesta parcial, la regresión medible en ausencia de nuevos sitios; enfermedad estable, la situación que no se puede catalogar como respuesta parcial o completa o progresión; y recaída o progresión de enfermedad, la presencia de nuevas lesiones o aumento igual o mayor de 50% de las ya existentes, con clasificación para las masas nodales, hígado, bazo y médula ósea. También se llegó a consenso sobre el momento en que se debe solicitar PET en los linfomas y se estableció las siguientes recomendaciones:
En la Fig. 8, las imágenes son de un paciente de sexo masculino, de 41 años, con diagnóstico de LH. En el PET basal se observa una gran masa mediastínica, con algunos focos sobre la masa y a nivel axilar derecho, inespecíficos. A los cuatro meses post quimioterapia, la respuesta es completa.
El siguiente caso corresponde a un paciente de sexo masculino, de 26 años, con diagnóstico de LH en etapa IIIB. Se puede ver una intensa actividad hipermetabólica en los linfonodos supra e infradiafragmáticos, con compromiso esplénico. En el PET control post quimioterapia se comprueba que hubo adecuada respuesta a tratamiento (Fig. 9).
Las siguientes imágenes son de una niña de 14 años, con diagnóstico de Linfoma de Hodgkin (LH) diagnosticado en noviembre de 2007, tratada con quimioterapia hasta abril de 2008, que tenía una masa residual luego de completar el tratamiento. Se puede ver que el PET no muestra ninguna actividad a nivel del mediastino (Fig. 10) lo que significa que no hay viabilidad tumoral.
El siguiente caso es el de un paciente de 17 años con diagnóstico de LH, que debía hacerse control de tratamiento. En el PET de etapificación se detectó una actividad en la cintura escapular y región axilar que podría corresponder a la presencia de grasa parda, lo que se comprobó administrando 80 mg de propanolol y repitiendo luego la imagen; se observa cómo ésta desapareció completamente, constatándose la adecuada respuesta al tratamiento.
El PET tiene múltiples indicaciones en el CCR, tanto en la etapificación inicial como en la evaluación de recurrencias, reetapificación y evaluación de lesiones hepáticas o pulmonares metastásicas potencialmente resecables. También en los casos en que hay una elevación del antígeno carcinoembrionario o CEA, sin una causa conocida, para diferenciar cáncer de cicatriz en masa presacral después de cirugía o radioterapia y en la evaluación de la respuesta al tratamiento.
El PET tiene alta sensibilidad en la etapificación del CCR; su limitación consiste en que no permite determinar el grado de infiltración de la pared en cáncer rectal, pero se puede usar el ultrasonido endoscópico; sin embargo, el PET sí permite detectar lesiones sincrónicas. En la evaluación de las adenopatías regionales la sensibilidad es baja y la especificidad es alta, porque cuesta determinar el número y localización de estos linfonodos, especialmente en la localización perivesical; habitualmente se puede hablar de N0/N+. El PET tiene la mayor utilidad en las metástasis a distancia, con sensibilidad y especificidad muy altas; en 11 a 23% de los casos existen metástasis extrahepáticas, ya que el hígado es la primera localización y es importante contar con información anatómica y metabólica sobre ellas, cuando son potencialmente resecables (26, 27, 28).
Los falsos positivos se pueden deber a procesos inflamatorios, como diverticulitis, abscesos, adenoma y fístulas, o a enfermedades granulomatosas, mientras que los falsos negativos se producen cuando hay lesiones muy pequeñas, menores de 1 cm, o una lesión necrótica con anillo viable. Importa mucho la histología, ya que la sensibilidad depende de ella: en adenocarcinoma no mucinoso es de 92% y baja a 41-58% cuando hay un componente mucinoso. En un metaanálisis de Rohren que incluyó a 532 pacientes, el PET produjo un cambio de conducta en 26 a 61% de los casos (27).
Cuando se quiere evaluar recurrencia por CEA elevado, se debe considerar que el CEA aumenta en dos tercios de los pacientes con recurrencia y tiene una especificidad de 70 a 84%, con sensibilidad de 80%. El seguimiento con CEA disminuye la mortalidad absoluta en 9 a 13%, sin embargo, hay que considerar que puede estar aumentado en pacientes con enfermedad hepática o de colon, tabaquismo y falla renal, aunque es raro que el aumento sea mayor de 10 ng/ml. Una de las indicaciones, establecida inicialmente por MEDICARE, en Estados Unidos, es la elevación de los marcadores tumorales con imágenes convencionales negativas; en estos casos se demostró que el PET tenía una alta sensibilidad y valores predictivos positivos y negativos que podían alcanzar hasta 100%, con un impacto en el manejo hasta en 60% de los casos.
En el caso de los cánceres rectales con recurrencia en la masa residual, el PET permite evaluar, a diferencia de la TC, la viabilidad tumoral con alta sensibilidad y especificidad. En los pacientes que han sido tratados con radioterapia se debe esperar entre tres y seis meses por la inflamación; y además se debe considerar que puede haber alteraciones anatómicas de la pelvis, por lo que hay que estar atentos a la actividad fisiológica del tracto gastrointestinal y genitourinario. El PET/TC tiene un importante rol, aumentando la sensibilidad y especificidad; el TC otorga la información adicional necesaria sobre las estructuras pélvicas.
Para evaluar la respuesta a quimioterapia en el CCR avanzado, los pacientes respondedores disminuyen la captación de FDG en 33%, en comparación con 1% de los no respondedores. Se recomienda evaluar después de 4 a 5 semanas y, en esos casos, la sensibilidad y especificidad son de 100% y 90%, respectivamente. Si se hace un estudio muy precoz, a la primera o segunda semana, puede existir un “flare reaction” que interfiera en la interpretación, ya que existe un aumento de la captación inicial que luego puede disminuir. Por otra parte, si existe baja captación de FDG previo al tratamiento, esos pacientes van a tener mayor resistencia a la quimioterapia, con la consiguiente menor respuesta.
En cuanto a la evaluación de la respuesta post terapia ablativa de las metástasis hepáticas del CCR, las técnicas locales, como criocirugía o radiofrecuencia provocan la destrucción intrahepática del tumor, lo que se correlaciona con mayor sobrevida. El TC y la RM logran una evaluación limitada, ya que existe una hiperemia post tratamiento o regeneración tisular que aumenta el contraste en la periferia de la lesión; el PET, en estos casos, permite evaluar la actividad tumoral residual, con un valor predictivo positivo de 80% y un valor predictivo negativo de 100%, en menos de tres semanas post tratamiento. Por otra parte, si existe hipermetabolismo en la periferia de los lugares tratados significa que la destrucción fue incompleta; en estos casos, el PET/TC es importante para hacer un re-tratamiento precoz de estos pacientes (29).
En los cánceres rectales localmente avanzados en los que se va a utilizar la radio y quimioterapia neoadyuvante, el PET permite identificar la respuesta precoz, incluso a los 10-15 días para disminuir la etapa, porque disminuye el tamaño y para preservar el esfínter. También permite identificar a los pacientes no respondedores. En estos casos se espera una disminución del SUV en 36% para clasificarlos como respondedores o no respondedores, con una sensibilidad de 100%. Así, no se aplican los tres a seis meses de radioterapia adyuvante, sino que se puede discriminar incluso a dos semanas de radioterapia con una exactitud de 80%.
En la Fig. 12 se trata de una paciente de 50 años con antecedentes de cáncer cervicouterino y melanoma, en la que se encontró una lesión a nivel rectal que correspondía a un adenocarcinoma, según se confirmó histológicamente. La paciente ha sido controlada y ha presentado recidivas locales en los nuevos PET.
Figura 12. Cáncer rectal: diagnóstico de tumor primario. (Centro PET Hosmil).
En la siguiente figura, a un paciente de 76 años con diagnóstico de cáncer de colon operado, con metástasis hepáticas ya conocidas, se le solicitó un PET de etapificación para ver si había otras localizaciones, lo que se descartó (Fig. 13).
Figura 13. Cáncer de colon: etapificación. (Centro PET Hosmil).
Las siguientes imágenes son de un paciente con antecedente de cáncer de colon operado en 1992 y de próstata operado, con CEA en aumento. En el TC de tórax se observó una lesión paramediastínica izquierda sospechosa de neoplasia, con TC de abdomen y pelvis negativo. La FDG confirmó la lesión torácica y nuevas lesiones en pelvis y esqueleto (Fig. 14).
Figura 14. Cáncer de colon: Sospecha de recurrencia por CEA y TC.
A continuación se muestra el caso de una paciente de 50 años, con antecedente de cáncer de recto operado más quimioterapia, que ya había presentado recidivas, las que se operaron y manejaron con quimio y radioterapia y elevaciones del CEA. En el TC se observa una masa ilíaca izquierda que capta intensamente la FDG. La paciente, sin otros focos, fue sometida a radioterapia. Sin embargo, volvió a presentar elevación del CEA. Se observa la imagen del PET y en el control persiste actividad tumoral en la masa ilíaca externa, de menor tamaño e intensidad.
El Ga68-DOTATOC es un nuevo fármaco disponible en nuestro país para los tumores neuroendocrinos. El Ga68 es un isótopo emisor de positrones, igual que el F18, pero la diferencia es que se produce en generador Ge68/Ga68, no en el ciclotrón de la Comisión de Energía Nuclear. La disponibilidad de estos generadores permite el acceso a este nuevo fármaco, que es un análogo de la somatostatina con gran avidez por los receptores de ésta, especialmente el número 2, incluso diez veces mayor que el In111-octreoscan, que es el fármaco que se usa actualmente para la evaluación de estos tumores. El Ga68 tiene una vida media de 68 minutos y el 89% del decaimiento se produce por positrones. Los péptidos marcados con Ga68 tienen un clearence sanguíneo muy rápido y localizan rápidamente el blanco. Las ventajas del Ga68-DOTATOC son: tiene dos a tres veces mayor resolución espacial que la cintigrafía con In111-octreoscan; el protocolo es de tres horas, en comparación con los tres días en el caso del In111; hay menor radiación, tanto para los pacientes como para el equipo médico; permite la cuantificación con el mismo índice de captación estandarizada que el FDG, para evaluar el tratamiento; es más accesible y tiene menor precio.
Las imágenes de la Fig. 16 fueron publicadas por Buchmann en el año 2007 (30). Las de la parte superior corresponden a aquéllas con Ga68-DOTATOC, en la que se observa un compromiso masivo de hígado, abdomen, pelvis e incluso mediastino. También se observan imágenes tomadas con In111-octreoscan, con los cortes coronales de tórax, abdomen y pelvis, en las que se identifican mucho menos lesiones, por la mayor sensibilidad con Ga68.
Figura 16. Comparación entre Ga68-DOTATOC-PET en In111-DTPAOC-SPECT.
Las siguientes imágenes son de un paciente de sexo masculino, de 6 años, con diagnóstico de tumor neuroendocrino del páncreas operado en 2004 y con recurrencia local en agosto 2005, también operada, que tenía elevación de la alfa fetoproteína (AFP) y había sido tratado con quimioterapia hasta marzo 2006. Nov 2007, cirugía: nuevas lesiones abdominopelvianas y aumento de AFP, cintigrama con Tc99m-octreoscan: negativo. En junio 2008 se le hizo un PET-FDG, que mostró actividad hipermetabólica tumoral maligna en hígado y cavidad abdominal. Luego se hizo un Ga68-DOTATOC que resultó negativo, porque en este caso el tumor neuroendocrino ya era muy indiferenciado.
Finalmente, en la Fig. 18 se muestra el caso de un paciente de 45 años, de sexo masculino, con diagnóstico de tumor carcinoide de intestino delgado que consultó para etapificación. Se puede ver la distribución normal del Ga68 porque no hubo lesiones. Se puede observar gran captación del bazo respecto del hígado, eliminación renal y captación variable a nivel del intestino.

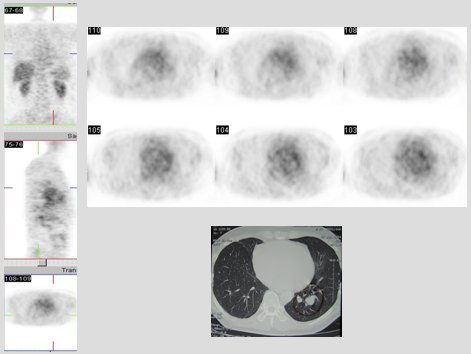 Figura 1. PET en nódulo pulmonar solitario. TAC: NP en LII de 2,4 cm. PET: negativo. Cirugía: benigno (Centro PET Hosmil).
Figura 1. PET en nódulo pulmonar solitario. TAC: NP en LII de 2,4 cm. PET: negativo. Cirugía: benigno (Centro PET Hosmil).

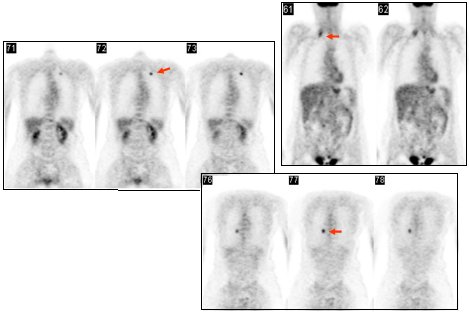 Figura 2. FDG: Foco hipermetabólico en LSI (histología: adenocarcinoma). Focos metastásicos supraclavicular derecho y uno pulmonar derecho, no vistos en TC (Centro PET Hosmil).
Figura 2. FDG: Foco hipermetabólico en LSI (histología: adenocarcinoma). Focos metastásicos supraclavicular derecho y uno pulmonar derecho, no vistos en TC (Centro PET Hosmil).

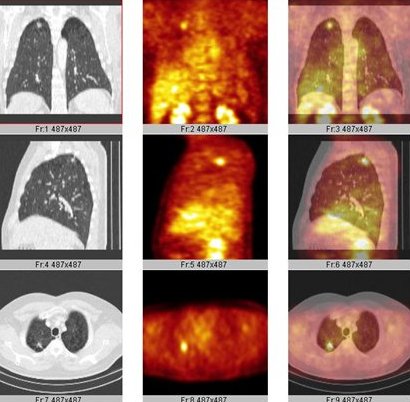 Figura 3. TC: NP LSD 1,5 cm. PET-FDG: foco hipermetabólico en relación a NPS, sin otras localizaciones. Cirugía: CPCNP.
Figura 3. TC: NP LSD 1,5 cm. PET-FDG: foco hipermetabólico en relación a NPS, sin otras localizaciones. Cirugía: CPCNP.

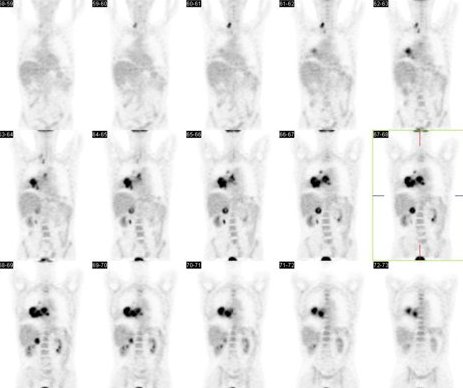 Figura 4.
Figura 4.

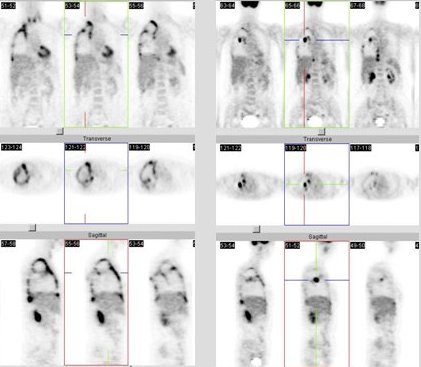 Figura 5.
Figura 5.

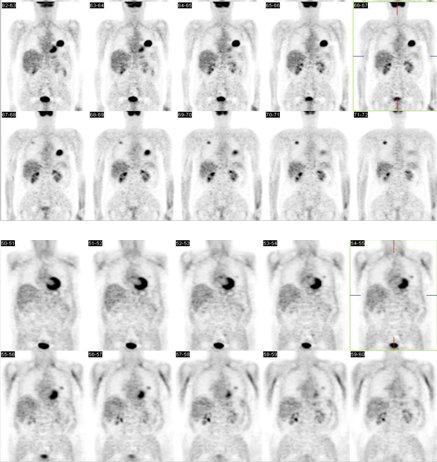 Figura 6.
Figura 6.

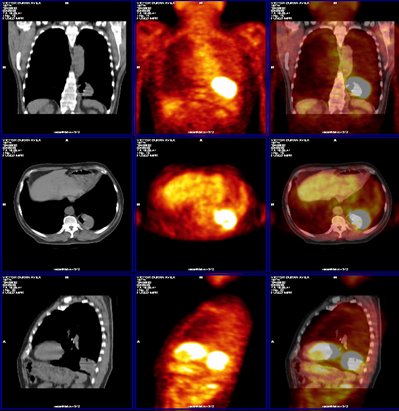 Figura 7. Imágenes de fusión TC/PET en paciente con masa pulmonar posterobasal izquierda (adenocarcinoma), sin lesiones a distancia.
Figura 7. Imágenes de fusión TC/PET en paciente con masa pulmonar posterobasal izquierda (adenocarcinoma), sin lesiones a distancia.

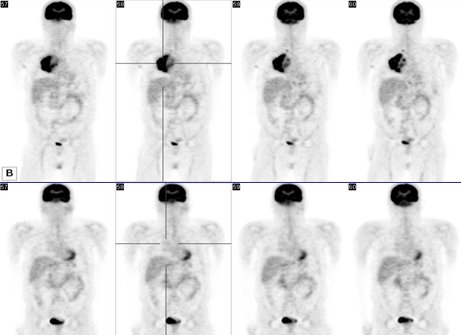 Figura 8.
Figura 8.

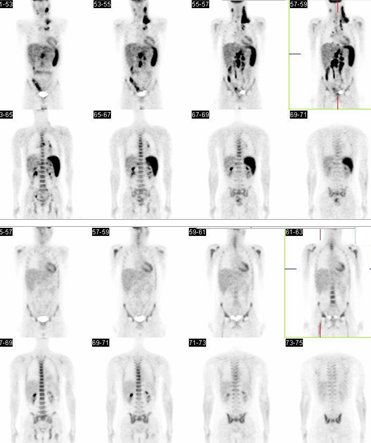 Figura 9.
Figura 9.

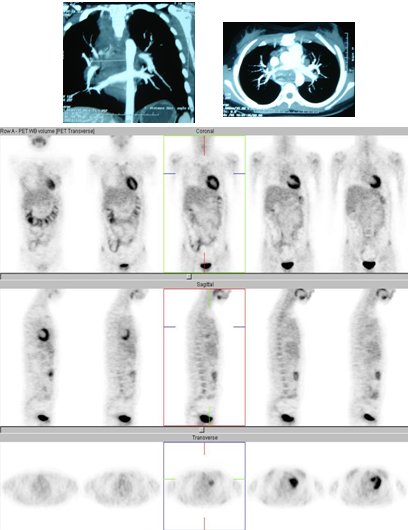 Figura 10.
Figura 10.

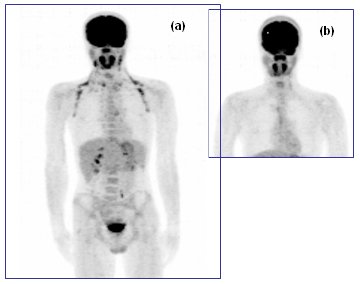 Figura 11. PET-FDG control post quimioterapia: (a) adecuada respuesta a tratamiento. Se complementa post administración Propanolol (b).
Figura 11. PET-FDG control post quimioterapia: (a) adecuada respuesta a tratamiento. Se complementa post administración Propanolol (b).

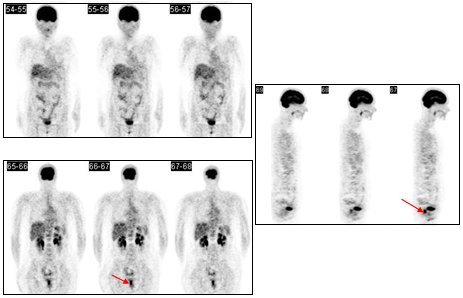 Figura 12. Cáncer rectal: diagnóstico de tumor primario. (Centro PET Hosmil).
Figura 12. Cáncer rectal: diagnóstico de tumor primario. (Centro PET Hosmil).

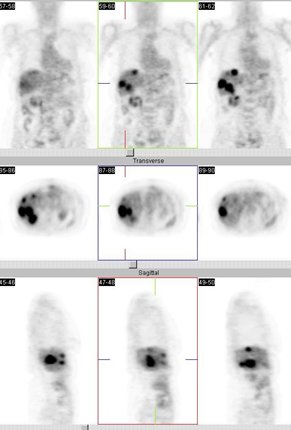 Figura 13. Cáncer de colon: etapificación. (Centro PET Hosmil).
Figura 13. Cáncer de colon: etapificación. (Centro PET Hosmil).

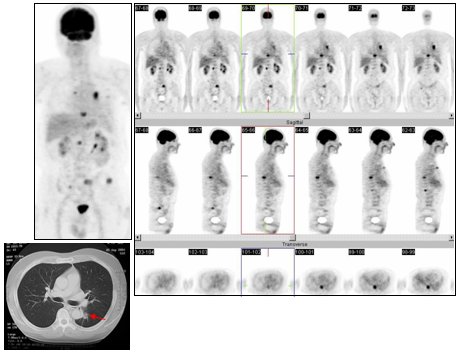 Figura 14. Cáncer de colon: Sospecha de recurrencia por CEA y TC.
Figura 14. Cáncer de colon: Sospecha de recurrencia por CEA y TC.

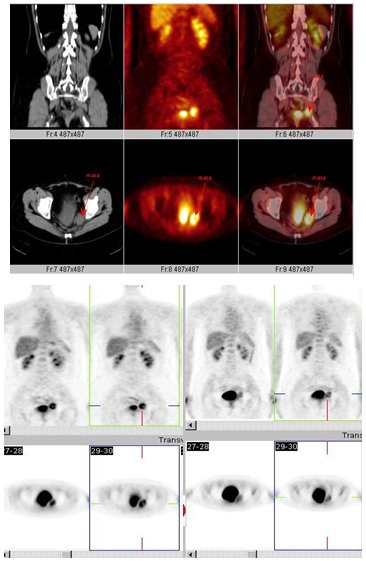 Figura 15.
Figura 15.

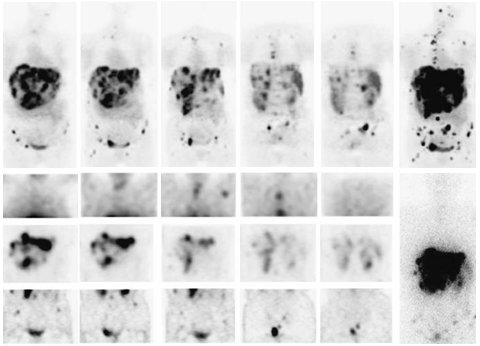 Figura 16. Comparación entre Ga68-DOTATOC-PET en In111-DTPAOC-SPECT.
Figura 16. Comparación entre Ga68-DOTATOC-PET en In111-DTPAOC-SPECT.

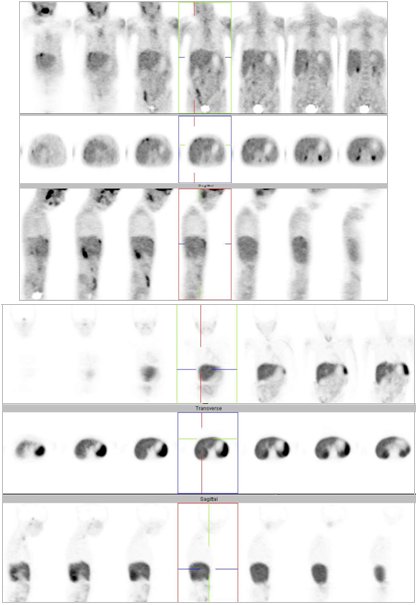 Figura 17.
Figura 17.

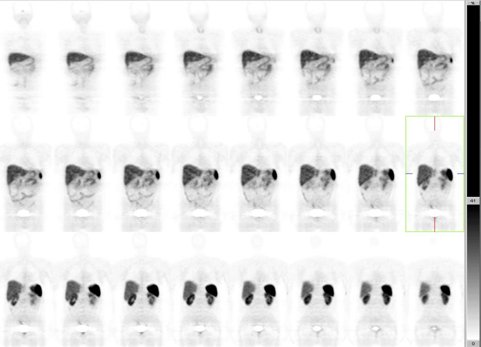 Figura 18. Hombre, 45 años, tumor carcinoide de intestino delgado operado en abril 2008. Etapificación. Ga68-DOTATOC PET: negativo
Figura 18. Hombre, 45 años, tumor carcinoide de intestino delgado operado en abril 2008. Etapificación. Ga68-DOTATOC PET: negativo
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión científica de la Sociedad Chilena de Medicina Nuclear e Imágenes Moleculares. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y la sociedad. El presidente de la Sociedad Chilena de Medicina Nuclear e Imágenes Moleculares es el Dr. Claudio Solé. La editora científica es la Dra. Teresa Massardo.
 Expositora:
M. Josefina Jofré M.[1]
Expositora:
M. Josefina Jofré M.[1]

Citación: Jofré MJ. Positron emission tomography: Updates. Medwave 2008 Oct;8(9):e1717 doi: 10.5867/medwave.2008.09.1717
Fecha de publicación: 1/10/2008

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Fletcher JW, Djulbegovic B, Soares HP, Siegel PA, Lowe VJ, Lyman GH, et al. Recommendations on the use of 18F-FDG PET in oncology. J Nucl Med. 2008 Mar;49(3):480-508. | CrossRef | PubMed |
Fletcher JW, Djulbegovic B, Soares HP, Siegel PA, Lowe VJ, Lyman GH, et al. Recommendations on the use of 18F-FDG PET in oncology. J Nucl Med. 2008 Mar;49(3):480-508. | CrossRef | PubMed | Larson SM. Practice-based evidence of the beneficial impact of positron emission tomography in clinical oncology. J Clin Oncol. 2008 May 1;26(13):2083-4. | CrossRef | PubMed |
Larson SM. Practice-based evidence of the beneficial impact of positron emission tomography in clinical oncology. J Clin Oncol. 2008 May 1;26(13):2083-4. | CrossRef | PubMed | Maldonado A, González-Alenda FJ, Alonso M, Sierra JM. PET-CT in clinical oncology. Clin Transl Oncol. 2007 Aug;9(8):494-505. | CrossRef | PubMed |
Maldonado A, González-Alenda FJ, Alonso M, Sierra JM. PET-CT in clinical oncology. Clin Transl Oncol. 2007 Aug;9(8):494-505. | CrossRef | PubMed | Facey K, Bradbury I, Laking G, Payne E. Overview of the clinical effectiveness of positron emission tomography imaging in selected cancers. Health Technol Assess. 2007 Oct;11(44):iii-iv, xi-267. | PubMed |
Facey K, Bradbury I, Laking G, Payne E. Overview of the clinical effectiveness of positron emission tomography imaging in selected cancers. Health Technol Assess. 2007 Oct;11(44):iii-iv, xi-267. | PubMed | Bunyaviroch T, Coleman RE. PET Evaluation of Lung Cancer. J Nucl Med. 2006 Mar;47(3):451-69. | PubMed |
Bunyaviroch T, Coleman RE. PET Evaluation of Lung Cancer. J Nucl Med. 2006 Mar;47(3):451-69. | PubMed | Ost D, Fein AM, Feinsilver SH. Clinical Practice: The solitary pulmonary nodule. N Engl J Med. 2003 Jun 19;348(25):2535-42. | CrossRef | PubMed |
Ost D, Fein AM, Feinsilver SH. Clinical Practice: The solitary pulmonary nodule. N Engl J Med. 2003 Jun 19;348(25):2535-42. | CrossRef | PubMed | Gould MK, Maclean CC, Kuschner WG, Rydzak CE and Owens DK. Accuracy of positron emission tomography for diagnosis of pulmonary nodules and mass lesions. JAMA. 2001 Feb 21;285(7):914-24. | CrossRef | PubMed |
Gould MK, Maclean CC, Kuschner WG, Rydzak CE and Owens DK. Accuracy of positron emission tomography for diagnosis of pulmonary nodules and mass lesions. JAMA. 2001 Feb 21;285(7):914-24. | CrossRef | PubMed | Kim SK, Allen-Auerbach M, Goldin J, Fueger BJ, Dahlbom M, Brown M, et al Accuracy of PET/CT in characterization of solitary pulmonary lesions. J Nucl Med. 2007 Feb;48(2):214-20. | PubMed |
Kim SK, Allen-Auerbach M, Goldin J, Fueger BJ, Dahlbom M, Brown M, et al Accuracy of PET/CT in characterization of solitary pulmonary lesions. J Nucl Med. 2007 Feb;48(2):214-20. | PubMed | Yi CA, Lee KS, Kim BT, Choi JY, Kwon OJ, Kim H, et al. Tissue characterization of solitary pulmonary nodule. J Nucl Med. 2006 Mar;47(3):443-50. | PubMed |
Yi CA, Lee KS, Kim BT, Choi JY, Kwon OJ, Kim H, et al. Tissue characterization of solitary pulmonary nodule. J Nucl Med. 2006 Mar;47(3):443-50. | PubMed | Jeong YJ, Yi CA, Lee KS. Solitary pulmonary nodules: detection, characterization, and guidance for further diagnostic workup and treatment. AJR Am J Roentgenol. 2007 Jan;188(1):57-68. | CrossRef | PubMed |
Jeong YJ, Yi CA, Lee KS. Solitary pulmonary nodules: detection, characterization, and guidance for further diagnostic workup and treatment. AJR Am J Roentgenol. 2007 Jan;188(1):57-68. | CrossRef | PubMed | Downey RJ, Akhurst T, Gonen M, Vincent A, Bains MS, Larson S, et al. Preoperative F-18 fluorodeoxyglucose-positron emission tomography maximal standardized uptake value predicts survival after lung cancer resection. J Clin Oncol. 2004 Aug 15;22(16):3255-60. | CrossRef | PubMed |
Downey RJ, Akhurst T, Gonen M, Vincent A, Bains MS, Larson S, et al. Preoperative F-18 fluorodeoxyglucose-positron emission tomography maximal standardized uptake value predicts survival after lung cancer resection. J Clin Oncol. 2004 Aug 15;22(16):3255-60. | CrossRef | PubMed | Comber LA, Keith CJ, Griffiths M, Miles KA. Solitary pulmonary nodules: impact of quantitative contrast-enhanced CT on the cost-effectiveness of FDG-PET. Clin Radiol. 2003 Sep;58(9):706-11. | CrossRef | PubMed |
Comber LA, Keith CJ, Griffiths M, Miles KA. Solitary pulmonary nodules: impact of quantitative contrast-enhanced CT on the cost-effectiveness of FDG-PET. Clin Radiol. 2003 Sep;58(9):706-11. | CrossRef | PubMed | Antoch G, Stattaus J, Nemat AT, Marnitz S, Beyer T, Kuehl H, et al. Non–Small Cell Lung Cancer: Dual-Modality PET/CT in Preoperative Staging. Radiology. 2003 Nov;229(2):526-33. Epub 2003 Sep 25. | CrossRef | PubMed |
Antoch G, Stattaus J, Nemat AT, Marnitz S, Beyer T, Kuehl H, et al. Non–Small Cell Lung Cancer: Dual-Modality PET/CT in Preoperative Staging. Radiology. 2003 Nov;229(2):526-33. Epub 2003 Sep 25. | CrossRef | PubMed | Rosenbaum SJ, Lind T, Antoch G, Bockisch A. False-positive FDG PET uptakethe role of PET/CT. Eur Radiol. 2006 May;16(5):1054-65. Epub 2005 Dec 17. | CrossRef | PubMed |
Rosenbaum SJ, Lind T, Antoch G, Bockisch A. False-positive FDG PET uptakethe role of PET/CT. Eur Radiol. 2006 May;16(5):1054-65. Epub 2005 Dec 17. | CrossRef | PubMed | Shon IH, O'Doherty MJ, Maisey MN. Positron emission tomography in lung cancer Semin Nucl Med. 2002 Oct;32(4):240-71. | CrossRef | PubMed |
Shon IH, O'Doherty MJ, Maisey MN. Positron emission tomography in lung cancer Semin Nucl Med. 2002 Oct;32(4):240-71. | CrossRef | PubMed | Eschmann SM, Friedel G, Paulsen F, Reimold M, Hehr T, Budach W, et al. 18F-FDG PET for assessment of therapy response and preoperative re-evaluation after neoadjuvant radio-chemotherapy in stage III non-small cell lung cancer. Eur J Nucl Med Mol Imaging. 2007 Apr;34(4):463-71. Epub 2006 Nov 14. | CrossRef | PubMed |
Eschmann SM, Friedel G, Paulsen F, Reimold M, Hehr T, Budach W, et al. 18F-FDG PET for assessment of therapy response and preoperative re-evaluation after neoadjuvant radio-chemotherapy in stage III non-small cell lung cancer. Eur J Nucl Med Mol Imaging. 2007 Apr;34(4):463-71. Epub 2006 Nov 14. | CrossRef | PubMed | Bruzzi JF, Munden RF. PET/CT imaging of lung cancer. J Thorac Imaging. 2006 May;21(2):123-36. | CrossRef | PubMed |
Bruzzi JF, Munden RF. PET/CT imaging of lung cancer. J Thorac Imaging. 2006 May;21(2):123-36. | CrossRef | PubMed | Vansteenskiste JF, Stroobants SG, De Leyn PR, Dupont PJ, Verbeken EK. Potential use of FDG-PET scan after induction chemotherapy in surgically staged IIIa-N2 non-small-cell lung cancer: a prospective study. The Leuven lung cancer group. Ann Oncol. 1998 Nov;9(11):1193-8. | CrossRef | PubMed |
Vansteenskiste JF, Stroobants SG, De Leyn PR, Dupont PJ, Verbeken EK. Potential use of FDG-PET scan after induction chemotherapy in surgically staged IIIa-N2 non-small-cell lung cancer: a prospective study. The Leuven lung cancer group. Ann Oncol. 1998 Nov;9(11):1193-8. | CrossRef | PubMed | Seltzer MA, Yap CS, Silverman DH, Meta J, Schiepers C, Phelps ME, et al. The impact of PET on the management of lung cancer: the referring physician's perspective. J Nucl Med. 2002 Jun;43(6):752-6. | PubMed |
Seltzer MA, Yap CS, Silverman DH, Meta J, Schiepers C, Phelps ME, et al. The impact of PET on the management of lung cancer: the referring physician's perspective. J Nucl Med. 2002 Jun;43(6):752-6. | PubMed | Kalff V, Hicks R, MacManus M, Binns D, McKenzie A, Ware R et al. Clinical impact of 18F-Fluorodeoxyglucose positron emission tomography in patients with non-small-cell lung cancer: a prospective study. J Clin Oncol. 2001 Jan 1;19(1):111-8. | PubMed |
Kalff V, Hicks R, MacManus M, Binns D, McKenzie A, Ware R et al. Clinical impact of 18F-Fluorodeoxyglucose positron emission tomography in patients with non-small-cell lung cancer: a prospective study. J Clin Oncol. 2001 Jan 1;19(1):111-8. | PubMed | Schöder H, Noy A, Gönen M, Weng L, Green D, Erdi YE, et al: Intensity of 18Flurorodeoxyglucose uptake in PET distinguishes between indolent and aggressive non-Hodgkin's lymphomas. J Clin Oncol. 2005 Jul 20;23(21):4643-51. Epub 2005 Apr 18. | CrossRef | PubMed |
Schöder H, Noy A, Gönen M, Weng L, Green D, Erdi YE, et al: Intensity of 18Flurorodeoxyglucose uptake in PET distinguishes between indolent and aggressive non-Hodgkin's lymphomas. J Clin Oncol. 2005 Jul 20;23(21):4643-51. Epub 2005 Apr 18. | CrossRef | PubMed | Isasi CR, Lu P, Blaufox MD. A metaanalysis of (18) F-2-deoxy-2-fluoro-D-glucose positron emission tomography in the staging and restaging of patients with lymphoma. Cancer. 2005 Sep 1;104(5):1066-74. | CrossRef | PubMed |
Isasi CR, Lu P, Blaufox MD. A metaanalysis of (18) F-2-deoxy-2-fluoro-D-glucose positron emission tomography in the staging and restaging of patients with lymphoma. Cancer. 2005 Sep 1;104(5):1066-74. | CrossRef | PubMed | Rigacci L, Vitolo U, Nassi L, Merli F, Gallamini A, Pregno P, et al. Positron emission tomography in the staging of patients with Hodgkin's lymphoma. A prospective multicentric study by the Intergruppo Italiano Ann Hematol. 2007 Dec;86(12):897-903. Epub 2007 Aug 16. | PubMed |
Rigacci L, Vitolo U, Nassi L, Merli F, Gallamini A, Pregno P, et al. Positron emission tomography in the staging of patients with Hodgkin's lymphoma. A prospective multicentric study by the Intergruppo Italiano Ann Hematol. 2007 Dec;86(12):897-903. Epub 2007 Aug 16. | PubMed | Zijlstra JM, Lindauer-van der Werf G, Hoekstra OS, Hooft L, Riphagen II, et al. PC.18F-fluoro-deoxyglucose positron emission tomography for post-treatment evaluation of malignant lymphoma: a systematic review. Haematologica. 2006 Apr;91(4):522-9. | PubMed |
Zijlstra JM, Lindauer-van der Werf G, Hoekstra OS, Hooft L, Riphagen II, et al. PC.18F-fluoro-deoxyglucose positron emission tomography for post-treatment evaluation of malignant lymphoma: a systematic review. Haematologica. 2006 Apr;91(4):522-9. | PubMed | Juweid ME, Stroobants S, Hoekstra OS, Mottaghy FM, Dietlein M, Guermazi A, et al. Use of positron emission tomography for response assessment of lymphoma: consensus of the Imaging Subcommittee of International Harmonization Project in Lymphoma. J Clin Oncol. 2007 Feb 10;25(5):571-8. Epub 2007 Jan 22. | CrossRef | PubMed |
Juweid ME, Stroobants S, Hoekstra OS, Mottaghy FM, Dietlein M, Guermazi A, et al. Use of positron emission tomography for response assessment of lymphoma: consensus of the Imaging Subcommittee of International Harmonization Project in Lymphoma. J Clin Oncol. 2007 Feb 10;25(5):571-8. Epub 2007 Jan 22. | CrossRef | PubMed | Llamas-Elvira JM, Rodríguez-Fernández A, Gutiérrez-Sáinz J, Gomez-Rio M, Bellon-Guardia M, Ramos-Font C, et al. Fluorine-18 fluorodeoxyglucose PET in the preoperative staging of colorectal cancer Eur J Nucl Med Mol Imaging. 2007 Jun;34(6):859-67. Epub 2006 Dec 29. | CrossRef | PubMed |
Llamas-Elvira JM, Rodríguez-Fernández A, Gutiérrez-Sáinz J, Gomez-Rio M, Bellon-Guardia M, Ramos-Font C, et al. Fluorine-18 fluorodeoxyglucose PET in the preoperative staging of colorectal cancer Eur J Nucl Med Mol Imaging. 2007 Jun;34(6):859-67. Epub 2006 Dec 29. | CrossRef | PubMed | Rohren EM, Turkington TG, Coleman RE. Clinical applications of PET in oncology. Radiology. 2004 May;231(2):305-32. Epub 2004 Mar 24. | CrossRef | PubMed |
Rohren EM, Turkington TG, Coleman RE. Clinical applications of PET in oncology. Radiology. 2004 May;231(2):305-32. Epub 2004 Mar 24. | CrossRef | PubMed | Kantorová I, Lipská L, Bêlohlávek O, Visokai V, Trubaĉ M, Schneiderová M . Routine (18) F-FDG PET preoperative staging of colorectal cancer: comparison with conventional staging and its impact on treatment decision making. J Nucl Med. 2003 Nov;44(11):1784-8. | PubMed |
Kantorová I, Lipská L, Bêlohlávek O, Visokai V, Trubaĉ M, Schneiderová M . Routine (18) F-FDG PET preoperative staging of colorectal cancer: comparison with conventional staging and its impact on treatment decision making. J Nucl Med. 2003 Nov;44(11):1784-8. | PubMed |