 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto corresponde a un trabajo de revisión preparado por sus autores en el desarrollo del Curso y Seminarios de Oncología Básica, realizado por el Centro de Oncología Preventiva y la Escuela de Postgrado de la Facultad de Medicina de la Universidad de Chile entre abril y agosto de 2008. El Director del Curso es el Dr. José Manuel Ojeda.
La leucemia aguda es el cáncer más frecuente en la edad pediátrica: representa 30% de todos los cánceres infantiles en los Estados Unidos y 40% en Chile, y es la primera causa de mortalidad por cáncer. Esta patología puede tener dos fenotipos: linfoblástico (LLA) o mieloblástico (LMA); el primero es el más frecuente, ya que corresponde a alrededor de 80% de todos los casos (1-5).
La translocación cromosómica es uno de los mecanismos esenciales en el desarrollo de un tumor y es muy común en ambos tipos de leucemia. Esta alteración determina la activación de oncogenes mediante la fusión de genes, lo que habitualmente origina productos reguladores de la transcripción. Dentro de los subtipos de leucemia aguda se han descrito asociaciones específicas con alteraciones cromosómicas que se utilizan como factor pronóstico y para estratificar grupos de riesgo, aspecto importante para definir alternativas de tratamiento (3-5).
Uno de los puntos de quiebre cromosómico más frecuentes en las leucemias humanas se ubica en el cromosoma 11 banda q23, donde reside el gen de Linaje Leucémico Mixto (Mixed Lineage Leukemia o MLL, también llamado ALL-1 o HRX), el cual constituye una de las excepciones dentro de las asociaciones específicas; se ha descrito su presencia en más de 60 genes fusionados, por lo que se dice que es un oncogen “promiscuo”. Estas translocaciones se pueden observar en una amplia gama de patologías malignas hematológicas, principalmente en LLA y LMA, así como también en síndromes mielodisplásicos y en el linfoma de Burkitt (4, 5).
Los rearreglos del gen MLL, que determinan distinto pronóstico terapéutico según el fenotipo de leucemia, se detectan en 6% de los casos de LLA y 80% de éstos ocurren en menores de un año de edad (leucemia del lactante). Su presencia constituye un factor de mal pronóstico, que empeora en relación inversa con la edad del paciente. En la LMA son más frecuentes: se ven en14 % de los casos totales y en 65% de los casos en lactantes y confieren un pronóstico de riesgo intermedio (4, 5).
También se ha visto involucrado al gen de MLL en leucemias secundarias a tratamiento, principalmente del tipo LMA en pacientes tratados con inhibidores de la topoisomerasa II como tratamiento de un cáncer primario. Se ha postulado la presencia de mecanismos similares para la leucemia del lactante cuyas madres tuvieron exposición a topoisomerasas II nativas (4).
A continuación se revisará distintos aspectos de la relación entre el gen MLL y la leucemia aguda en pacientes pediátricos.
El gen MLL se ubica en el cromosoma 11q23, justo después del dominio represor; tiene una extensión de 90 kb y se compone de 38 exones; produce un mRNA de 12 kb que codifica una proteína de 3969 aminoácidos, de 430 kDa de peso molecular y compleja estructura. Esta proteína se expresaría ampliamente en el embrión en desarrollo, donde funcionaría como regulador de la transcripción nuclear; en tejidos adultos sus niveles son mínimos (5-7).
La proteína MLL normalmente es clivada en el citoplasma por la taspasa 1 en los aminoácidos 2666 (sitio de clivaje 1 o CS1) y 2718 (sitio de clivaje 2 o CS2), generando dos subunidades: MLL-N (300 kDa) y MLL-C (180 kDa). Su función es acetilar, desacetilar y metilar las histonas de los nucleosomas (8). La proteína madura contiene una región cluster de puntos de quiebre entre los exones 5-11 de 8,3 kb, y en su estructura se ha identificado múltiples dominios proteicos: ganchos AT, un dominio de ADN metiltransferasa (transcriptional repression domain, TRD), un dominio PHD (Plant homology domain), un dominio activador de la transcripción (TA) y un dominio SET o Su (var)3-9, enchancer-of-zeste, trithorax (7) (Figura 1).
Figura 1. Estructura de la proteína MLL.
Las alteraciones en el gen MLL incluyen deleciones, duplicaciones, inversiones y translocaciones recíprocas; en estas últimas se generan proteínas de fusión por la interacción con otros genes, denominados fusion partner genes (FPGs), reemplazando así los dominios de represión transcripcional y de señalización nuclear ubicados en el extremo N-terminal de la proteína MLL, por los extremos C-terminales de los genes de fusión. Los puntos de quiebre que se observan en las leucemias de novo se concentran en la región centromérica, mientras que en las leucemias del lactante y secundarias a tratamiento lo hacen en la región telomérica (5-7). Los genes de fusión más frecuentes son: 9p 21-22 (t 9;11) en MLL-AF9, 4q21 (t 4;11) en MLL-AF4 y 19p13 (t 11;19) en MLL-ENL. MLL-AF4 se ve con mayor frecuencia en LLA, MLL-AF9 es más frecuente en LMA y MLL-ENL es común en ambos tipos de leucemia (8) (Figura 2).
Figura 2. Genes de fusión con MLL.
Se ha postulado que estas proteínas de fusión participan en la leucemogénesis mediante el aumento de la expresión del gen HOX, que codifica para factores transcripcionales, mecanismo que sería crítico para las leucemias relacionadas con el gen MLL. Otro mecanismo descrito para estas proteínas de fusión es el aumento de la expresión de la tirosin kinasa FLT3, como otro paso para la inducción de leucemia del gen MLL (4-6).
En la actualidad se dispone de múltiples técnicas moleculares para evaluar la expresión del perfil genético del gen MLL, entre ellas:
La leucemia linfoblástica en niños ocurre con mayor frecuencia entre los 2 y 5 años. Existen diversos factores de mal pronóstico, como hiperleucocitosis en el momento del diagnóstico, edad de inicio menor de 1 año o mayor de 10 años, portación de citogenética adversa (t 9;22 o cromosoma Philadelphia, hipodiploidía, etc.) y mala respuesta a tratamiento inicial. Esto ha permitido clasificar a los pacientes y programar un tratamiento estratificado, con lo que la sobrevida a 5 años alcanza hasta 90% en los niños mayores, no así en el grupo de lactantes, donde la sobrevida a los 4 años llega sólo a 55%. Estas diferencias tan marcadas no se explican sólo por los tratamientos disponibles, sino por la biología misma de la enfermedad (3-7).
La LLA en lactantes corresponde a una forma más inmadura de diferenciación, como lo demuestra la expresión de antígenos de superficie: CD 10 (-), CD19 (+), HLA DR (+) y además coexpresan antígenos mieloides. En 75% de los casos en lactantes se encuentran alteraciones del gen MLL, que constituyen un factor de peor pronóstico de la enfermedad por sí mismas y se asocian a hiperleucocitosis y a menor edad de presentación, con tasas de sobrevida a 5 años de 35 a 50%. Dentro de los rearreglos MLL, la translocación 4;11 (MLL-AF4) es la más frecuente y la que se asocia a menor tasa de sobrevida en este grupo etario, cercana a 15% a 5 años de seguimiento. Otras alteraciones estructurales del gen 11q23, como su deleción, también se asocian a características clínicas de peor pronóstico (3-5).
Entre los mecanismos planteados para explicar la patogenia de la leucemia aguda en el período de lactante, las translocaciones del gen MLL tienen un papel importante. Diversos estudios en gemelos que han desarrollado leucemia han llevado a plantear que las células neoplásicas de este tipo de leucemia son de origen fetal y sufren transformaciones genéticas secundarias in útero y en la vida postnatal, resultando en alteraciones del 11q23. Esto origina el “fenotipo mutador”, que favorece la rápida acumulación de mutaciones complementarias y deteriora el reconocimiento del quiebre de la doble banda de ADN y los checkpoints del ciclo celular. Este modelo se diferencia de los propuestos para otras neoplasias, en los cuales se necesita al menos dos mutaciones complementarias consecutivas que afecten una, a la diferenciación celular y otra, al control de proliferación y apoptosis celular (4-7).
Estudios in vitro han demostrado que las células leucémicas de LLA en lactantes son más resistentes al tratamiento con corticoides y L-asparraginasa que otras células leucémicas, pero son más sensibles a la citarabina. Entre los mecanismos de resistencia asociados a la portación de translocaciones del gen MLL está la inhibición de la actividad transcripcional del gen p53 mediante la down-regulation de la inducción de los genes p21, mdm2 y Bax en respuesta al daño del ADN (5-7).
La leucemia mieloide aguda corresponde a 15 a 20% de las leucemias agudas de la edad pediátrica y es ligeramente más frecuente en lactantes que en niños mayores. A diferencia de la LLA, la LMA pediátrica tiene un comportamiento similar a la del adulto y en ella la portación de rearreglos del gen 11q23 no empeora el pronóstico (5). Diversos estudios han demostrado tasas de portación de rearreglos de MLL hasta en 35% de los casos de LMA del lactante, con sobrevidas cercanas a 50% a 4 años de seguimiento. En este tipo de leucemia la translocación 9;11 (MLL-AF9) es la más frecuente y se encuentra en cerca de la mitad de los casos. También se ha descrito la fuerte asociación entre las alteraciones de MLL y los fenotipos LMA M4 y M5 (4, 5).
En distintas series de LMA en lactantes el factor edad fue determinante para la sobrevida libre de enfermedad y las tasas de recaídas, dado que este grupo etario presenta menos resistencia a los tratamientos quimioterapéuticos, pero tiene mayor mortalidad asociada a terapia (5).
Los tratamientos quimioterapéuticos con citotóxicos pueden tener como efecto colateral el desarrollo de neoplasias secundarias, tanto precoces, dentro de los tres primeros años de finalizado el tratamiento como tardías, que se presentan siete o más años después de completar el tratamiento (3, 4).
Se ha descrito el desarrollo de leucemia mieloide aguda en pacientes previamente tratados por leucemias o tumores sólidos con inhibidores de la Topoisomerasa II, como epipodofilotoxinas (etopósido, tenopósido), antraciclinas (adriamicina, daunorrubina) y derivados de la dioxipiperazina. En estos pacientes se ha encontrado una incidencia entre 70 a 90% de alteraciones en el 11q23, especialmente amplificaciones y translocaciones, siendo éstas las más frecuentes en los pacientes pediátricos. En los casos de LMA precoz se encuentran translocaciones balanceadas del gen MLL, en cambio en las LMA tardías se detectan translocaciones desbalanceadas, especialmente en pacientes con antecedente de síndromes mielodisplásicos. Las translocaciones (9;11) y (11;19) son las más comunes, principalmente en pacientes con antecedente de uso de epipodofilotoxinas. Este grupo presenta tasas de remisión similares a las LMA de novo, pero la sobrevida final es baja a pesar de quimioterapia o transplante de precursores hematopoyéticos (3, 5). La LLA secundaria a tratamiento es menos frecuente que la LMA y se describe con el uso previo de agentes alquilantes (ciclofosfamida, cisplatino) y radiación. En estos casos la translocación (4;11) es la más frecuente, con resultados de sobrevida a largo plazo limitados (3, 4).
El análisis del gen MLL y sus alteraciones ha permitido el avance del conocimiento de la patogenia de la leucemia aguda en pediatría, patología que por su frecuencia y tasa de mortalidad motiva al mundo científico en la búsqueda y desarrollo de mejores parámetros para caracterizar a los pacientes portadores y optimizar los beneficios y reducir los efectos secundarios de los tratamientos antineoplásicos.

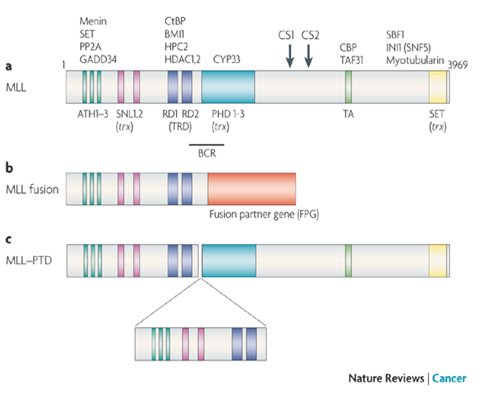 Figura 1. Estructura de la proteína MLL.
Figura 1. Estructura de la proteína MLL.

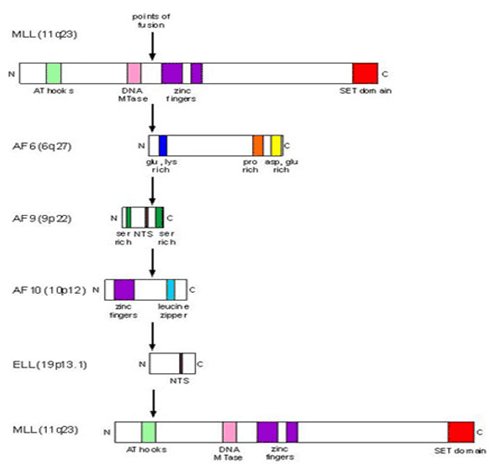 Figura 2. Genes de fusión con MLL.
Figura 2. Genes de fusión con MLL.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto corresponde a un trabajo de revisión preparado por sus autores en el desarrollo del Curso y Seminarios de Oncología Básica, realizado por el Centro de Oncología Preventiva y la Escuela de Postgrado de la Facultad de Medicina de la Universidad de Chile entre abril y agosto de 2008. El Director del Curso es el Dr. José Manuel Ojeda.
 Autores:
Fernando Bracho Milic[1], Ximena Claverie Ramos[1]
Autores:
Fernando Bracho Milic[1], Ximena Claverie Ramos[1]

Citación: Bracho F, Claverie X. MLL gene and leukemia in children. Medwave 2009 Abr;9(4):e3855 doi: 10.5867/medwave.2009.04.3855
Fecha de publicación: 1/4/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Hilden JM, Smith FO, Frestedt JL, McGlennen R, Howells WB, Sorensen PH, et al. MLL gene rearrangement, cytogenetic 11q23 abnormalities, and expression of the NG2 molecule in infant acute myeloid leukemia. Blood. 1997 May 15;89(10):3801-5. | PubMed |
Hilden JM, Smith FO, Frestedt JL, McGlennen R, Howells WB, Sorensen PH, et al. MLL gene rearrangement, cytogenetic 11q23 abnormalities, and expression of the NG2 molecule in infant acute myeloid leukemia. Blood. 1997 May 15;89(10):3801-5. | PubMed | Behm FG, Raimondi SC, Frestedt JL, Liu Q, Crist WM, Downing JR, et al. Rearrangement of the MLL gene confers a poor prognosis in childhood acute lymphoblastic leukemia, regardless of presenting age. Blood. 1996 Apr 1;87(7):2870-7. | PubMed |
Behm FG, Raimondi SC, Frestedt JL, Liu Q, Crist WM, Downing JR, et al. Rearrangement of the MLL gene confers a poor prognosis in childhood acute lymphoblastic leukemia, regardless of presenting age. Blood. 1996 Apr 1;87(7):2870-7. | PubMed | Aplan PD. Chromosomal translocations involving the MLL gene: molecular mechanisms. DNA Repair (Amst). 2006 Sep 8;5(9-10):1265-72. Epub 2006 Jun 21. | CrossRef | PubMed | PMC |
Aplan PD. Chromosomal translocations involving the MLL gene: molecular mechanisms. DNA Repair (Amst). 2006 Sep 8;5(9-10):1265-72. Epub 2006 Jun 21. | CrossRef | PubMed | PMC | Armstrong SA, Golub TR, Korsmeyer SJ. MLL-rearranged leukemias: insights from gene expression profiling. Semin Hematol. 2003 Oct;40(4):268-73. | CrossRef | PubMed |
Armstrong SA, Golub TR, Korsmeyer SJ. MLL-rearranged leukemias: insights from gene expression profiling. Semin Hematol. 2003 Oct;40(4):268-73. | CrossRef | PubMed | Chowdhury T, Brady HJ. Insights from clinical studies into the role of the MLL gene in infant and childhood leukemia. Blood Cells Mol Dis. 2008 Mar-Apr;40(2):192-9. Epub 2007 Oct 1. | CrossRef | PubMed |
Chowdhury T, Brady HJ. Insights from clinical studies into the role of the MLL gene in infant and childhood leukemia. Blood Cells Mol Dis. 2008 Mar-Apr;40(2):192-9. Epub 2007 Oct 1. | CrossRef | PubMed | Wiederschain D, Kawai H, Shilatifard A, Yuan ZM. Multiple mixed lineage leukemia (MLL) fusion proteins suppress p53-mediated response to DNA damage. J Biol Chem. 2005 Jul 1;280(26):24315-21. Epub 2005 Apr 25. | CrossRef | PubMed |
Wiederschain D, Kawai H, Shilatifard A, Yuan ZM. Multiple mixed lineage leukemia (MLL) fusion proteins suppress p53-mediated response to DNA damage. J Biol Chem. 2005 Jul 1;280(26):24315-21. Epub 2005 Apr 25. | CrossRef | PubMed |