Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Diálisis Peritoneal, organizado por los Departamentos de Nefrología de las universidades de Chile y Pontificia Universidad Católica entre los días 18 al 20 de diciembre de 2006. Directora: Dra. Mireya Ortiz Mejías.
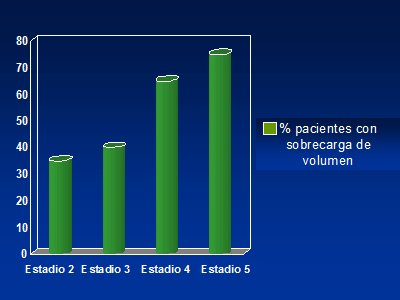
Figura 1. Prevalencia de sobrecarga de volumen de acuerdo con estadio de IRC
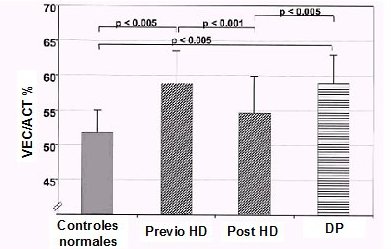
Cuando se compara a los pacientes que están en HD antes del procedimiento dialítico y después de él, se ve que están sobrecargados de volumen antes de comenzar el tratamiento; la situación mejora luego del procedimiento, pero nunca es la misma que se observa en los controles. En otro trabajo(2), en que se comparó a pacientes en HD con pacientes en DP, se encontró que éstos tenían, en promedio, la misma sobrecarga de volumen que los pacientes que iban a comenzar su tratamiento en HD (Fig. 2).
Figura 2. Volumen extracelular en pacientes en HD y DP (VEC: volumen extracelular; ACT: agua corporal total)
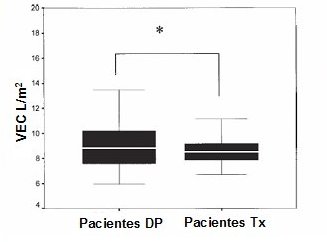
En un tercer trabajo (3) se comparó a los pacientes en DP con los que recibieron trasplante renal. Una vez que se normalizó la función renal con el trasplante, los pacientes en DP tenían más sobrecarga de volumen que los pacientes trasplantados (Fig. 3). Por tanto, la prevalencia de sobrecarga de volumen es muy grande en los pacientes en DP y lo mismo ocurre en los pacientes en HD.
Figura 3. ¿Los pacientes en diálisis tienen sobrecarga de volumen? (Tx = trasplante)
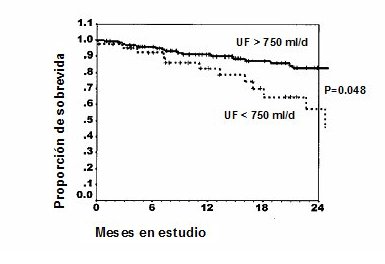
Figura 4. Efecto de la ultrafiltración en la mortalidad (4)
Otro estudio muy importante en esta área es un trabajo prospectivo turco, en que se tomó a 125 pacientes, casi todos en DP ambulatoria continua, y se les siguió durante tres años; los resultados fueron muy similares a los de los estudios multicéntricos europeos: los pacientes en que se logró mayor remoción de sodio presentaron mejor sobrevida, en comparación con aquellos cuya remoción de sodio fue menor (5). La ultrafiltración se correlaciona fuertemente con la remoción de sodio y ésta, a su vez, se correlaciona con el estado volémico del paciente y la presión arterial; por lo tanto, a mayor ultrafiltración, mayor es la remoción de sodio, el estado volémico es más próximo a lo deseado y se tiene mejor control de la presión arterial. Lo anterior se demostró en un estudio realizado en 2003, en que la ultrafiltración tuvo una relación inversa con la presión arterial (6). Entonces, la correlación entre la ultrafiltración, la remoción de sodio, la mantención del estado volémico y la repercusión en la presión arterial son los datos que apoyan la utilidad de aumentar la ultrafiltración para disminuir la mortalidad.
La remoción adecuada de fluidos y sodio también influye en la mortalidad, ya que inciden sobre el estado volémico del paciente. De hecho, para determinar si la ultrafiltración es adecuada se debe considerar, no sólo la tasa de filtración, sino también la situación clínica del paciente; así, se considera que hay una falla en la ultrafiltración, desde el punto de vista clínico, cuando no se logra alcanzar un estado volémico adecuado, ni siquiera con soluciones de alta tonicidad de glucosa. Para lograr esto, la primera medida que se aplica en estos pacientes es la restricción de agua, que siempre se debe combinar con la restricción de sodio en la alimentación, porque sin esto no es posible alcanzar una volemia adecuada.
La falla de la ultrafiltración se puede definir también según la respuesta a la infusión de una solución de DP; la literatura recomienda dos formas de establecer esto: la primera es considerar que la ultrafiltración no es adecuada cuando, en un cambio fijo de cuatro horas, con glucosa al 2,27%, no se logra una ultrafiltración mínima de 100 ml en ese lapso; la segunda, cuando con una solución con mayor tonicidad, es decir, 4,25%, no se consigue una ultrafiltración mínima de 400 ml durante las cuatro horas. Para realizar esta medición, el paciente llega en la mañana, se le drena la solución que tiene en la cavidad abdominal y se le infunde una solución al 2,5 o al 4,5%; se espera que transcurran cuatro horas, luego se drena y se pesa la bolsa.
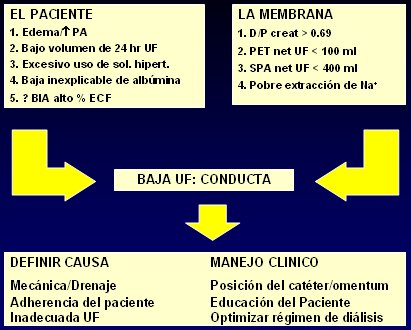
La falla en la ultrafiltración se puede evaluar en el paciente o en la membrana: En relación con el paciente, se debe considerar si está muy edematoso; con cifras tensionales muy altas; si tiene bajo volumen de ultrafiltración; cuando se requiere el uso de soluciones muy hipertónicas y cuando hay una albuminemia muy baja, que no se explica por los aspectos nutricionales del paciente. En relación con la membrana, hay condiciones para hacer una prueba de equilibrio peritoneal cuando la relación entre creatinina dializada y creatinina plasmática (D/P creat) es mayor de 0,69; cuando hay una baja ultrafiltración, cuantificada en la clínica; o bien, cuando hay una baja extracción de sodio. Todas estas situaciones exigen un análisis más criterioso de la capacidad de ultrafiltración en un paciente determinado, cuyo principal objetivo será definir la causa de la falla de la ultrafiltración; para esto, es necesario poner atención en la mecánica y el drenaje, considerando la posición del catéter. Por otra parte, será necesario considerar la adhesión del paciente a la prescripción y se deberá determinar si la falla está en la ultrafiltración misma; esto permitirá tomar las medidas necesarias para resolver el problema (Fig. 5).
Figura 5. Evaluación y manejo de la falla de la ultrafiltración
Los problemas en la membrana no constituyen la única causa de la sobrecarga de volumen, pero son los más comunes: Lo más frecuente es que el peritoneo presente una superficie vascular amplia, es decir, una hipervascularización; puede que el transporte del agua no se haya realizado con eficiencia, situación que se presenta cuando hay un problema con las acuaporinas, que son los canales específicos de agua; también es posible que la absorción del fluido por los vasos linfáticos sea muy rápida; una situación menos frecuente es que el área de superficie peritoneal sea muy reducida. Las dos primeras situaciones son las más frecuentes en la práctica clínica; por lo general se presentan asociadas, de manera tal que, cuando la superficie vascular es grande, también hay dificultades con las acuoporinas.
La DP, especialmente después de tres años de tratamiento, provoca cambios en las características del peritoneo que, desde el punto de vista estructural, se manifiestan como un aumento del transporte de solutos a través de esta membrana, entre ellos, la creatinina, que vuelve por la reabsorción más rápida de la glucosa y el peritoneo se hace menos eficiente para la remoción de fluidos. En un estudio realizado en Brasil se tomó a 100 pacientes a los que se cuantificó el transporte peritoneal, por medio de una prueba de equilibrio peritoneal, al inicio y a los 30 días de la DP. En el momento inicial, sólo 6% de los pacientes tenían las características de transportador alto y la gran mayoría tenía las características de transportador medio; a los 18 meses, el porcentaje de individuos considerados como transportadores altos subió hasta 20%. Lo anterior refleja un aumento de las características de transporte peritoneal, con la consiguiente dificultad para ultrafiltrar pacientes después de dos a tres años de DP.
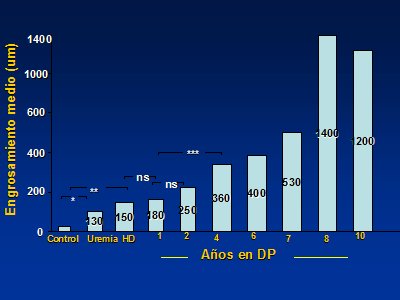
Entonces, lo que sucede es que el transporte peritoneal de solutos aumenta con el tiempo, en paralelo con una caída de la ultrafiltración. Lo anterior acontece cuando la función renal residual también está disminuyendo, de manera que, después de tres a cinco años de DP, que es cuando el paciente más necesita una buena ultrafiltración, es el momento en que es más difícil lograrla. En la Fig. 6 se grafica el espesor del peritoneo con el pasar de los años en DP: se observa que dicho espesor aumenta a medida que transcurre el tiempo. Lo más interesante es que antes de que el paciente empiece la DP, el peritoneo ya está engrosado, de manera tal que algunas afecciones características de la IRC ya están afectando al peritoneo, tanto a nivel morfológico como a nivel funcional; por lo tanto, no sólo la DP es la causante de los cambios histológicos que pueda experimentar la membrana peritoneal.
Figura 6. Historia natural de la histología peritoneal (The Peritoneal Biopsy Registry)
De acuerdo con lo anterior, se ha planteado que la IRC, por medio de sus comorbilidades: sobrecarga de volumen, hipertensión, toxicidad urémica, estrés oxidativo y aumento de la susceptibilidad a infecciones, puede activar una respuesta inflamatoria sistémica que provoca cambios en la membrana peritoneal, aumentando la adherencia y proliferación celular y favoreciendo la disfunción endotelial. Lo anterior caracteriza al paciente con IRC, sin tener ninguna relación con la DP.
En un estudio realizado en 2001, en el que se indujo enfermedad renal en ratones, se observó que la enfermedad renal, sin mediar DP, provocó aumento de factores de neoangiogénesis; en un análisis histoquímico de los vasos se observó que estaban proliferando, pero con una disfunción endotelial importante. Asimismo, se observó una correlación entre la hipertensión crónica de estos ratones y la característica de transporte, lo que demuestra que la uremia puede provocar no sólo alteraciones celulares y moleculares del peritoneo, sino también alteraciones estructurales (7). En otro trabajo, la inducción de diabetes en ratas produjo una hipervascularización, con alteración histológica y funcional de la membrana peritoneal, de la misma manera como ocurre en otros sitios (8).
Luego de que se inicia la DP, las alteraciones que se producen en el organismo se suman a las que se desencadenan localmente en el peritoneo debido a la solución de diálisis, que se caracteriza por alta tonicidad, debido a la glucosa, y pH más ácido, lo que genera una respuesta celular con producción de mediadores de la respuesta inflamatoria, producción de sustancias profibróticas y otras que darán origen a la neovascularización. La combinación de los efectos sistémicos de la uremia con los efectos locales de la solución de DP provoca, a largo plazo, las alteraciones histológicas y funcionales que caracterizan a los pacientes luego de tres a cinco años en DP.
Los pacientes con falla de ultrafiltración o con sobrecarga de volumen pueden tener manifestaciones de edema, hipertensión o edema pulmonar. En tales casos, lo primero que se debe hacer es una prueba de ultrafiltración, en la que se puede usar una solución al 2,5% o al 4,25%, y lo único que va a cambiar es el resultado de la ultrafiltración. Si se usa una solución con alguna de estas concentraciones para un recambio controlado de cuatro horas, los límites para la definición de una falla de ultrafiltración son 400 ml. Si la infusión es de 2.000 ml, un drenaje de 2.400 ml define si hay o no una falla en la ultrafiltración. Si la solución es de 2,5%, el valor de ultrafiltración es más bajo, de 100 ml. Si la ultrafiltración es inferior a 400 ml, el paciente efectivamente tiene una falla en la ultrafiltración. Si la ultrafiltración es superior a 400 ml, el paciente no tiene falla de ultrafiltración y, en consecuencia, no hay problemas con su membrana y habría que buscar otra causa de su sobrecarga de volumen, como adhesión deficiente a la DP o que ésta esté mal prescrita, lo que implica que no hay una adecuada remoción de sodio y de agua. Así también, entre las causas de sobrecarga de volumen podemos encontrar una pérdida de la función renal residual, lo que desencadena una sobrecarga, aun teniendo una buena membrana peritoneal.
Cuando la ultrafiltración con 4,25% es menor de 400 ml, existe la posibilidad de hacer una medición del transporte de soluto, como se hace con la prueba de equilibrio peritoneal, que se puede hacer en todos los pacientes cuando éstos empiezan la DP y se puede repetir cuando se deshacen de la carga de volumen. En esta situación, si el transporte de solutos y el D/P de creatinina están estables, no hay alteración de la membrana peritoneal, porque el transporte de creatinina está estable y puede haber un problema mecánico de los catéteres o vaciamiento de líquido de diálisis hacia el subcutáneo. Si el transporte de soluto, es decir, el D/P de creatinina, está aumentado, el paciente experimenta una peritonitis o bien, presenta las alteraciones de membrana que ya se mencionaron. Así, con la medición de la ultrafiltración después de 4 horas se puede diferenciar a los pacientes que tienen una causa verdadera o aparente de falla en la ultrafiltración, para luego investigar y descubrir la causa del edema, con miras a efectuar el manejo apropiado de la sobrecarga de volumen.
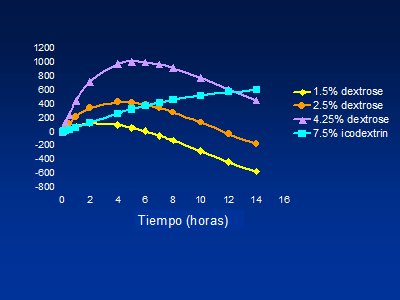
Figura 7. Potencial de ultrafiltración según tipo de solución
Otro método para optimizar la ultrafiltración es alterar las concentraciones o las características de la solución: cuanto mayor sea la concentración de glucosa, más efectiva será la ultrafiltración con una solución determinada. Por ejemplo, luego de 6 horas, la solución al 2,5% puede ultrafiltrar 400 ml y la solución al 4,25% puede ultrafiltrar cerca de 800 ml; en los ciclos más largos, luego de 12 horas, una solución con icodextrina puede mantener la ultrafiltración. De lo anterior se desprende que hay dos modos de optimizar la ultrafiltración: reducir el tiempo del ciclo, para lo cual se puede utilizar una cicladora de ciclos cortos; o aumentar la concentración de glucosa, o utilizar una solución de icodextrina. En la cicladora se puede programar un ciclo de cualquier duración, pero el mínimo debe ser 60 a 70 minutos porque si el ciclo es más rápido, hay tiempo para ultrafiltración, pero no hay tiempo suficiente para la remoción de solutos; así, si se programa 10 ciclos de 30 minutos, la ultrafiltración será muy buena, pero la remoción de solutos será mala y el paciente tendrá problemas en relación con los elevados niveles de urea.
Los métodos para aumentar la remoción de sodio, en un paciente en DP, son: disminuir la concentración de sodio del dializado; aumentar el volumen total del dializado: si en vez de infundir 8 litros se infunden 10 litros, el volumen drenado va a ser mayor, lo mismo que la remoción de sodio; aumentar del número de intercambios; usar soluciones hipertónicas cuando sea necesario: se parte con soluciones al 2,5%, pero, cuando el equilibrio no se logra con esta solución, se pasa al 4,25%; y utilizar agentes osmóticos, como la icodextrina.
Otras medidas a considerar para mantener el estado volémico del paciente son: preservación de la función renal residual; uso de diuréticos, como la furosemida en dosis hasta de 300 mg/día, lo que muchas veces permite prescindir del uso de soluciones hipertónicas, porque el diurético permite compensar el estado volémico del paciente; y restricción de sodio, especialmente en pacientes con función renal residual.
La adhesión al tratamiento es un aspecto que con frecuencia se deja de lado, en el supuesto de que el paciente está siguiendo todas las indicaciones. En un estudio que se realizó en nuestro centro hace unos años, se estimó el número de recambios que no se hicieron durante el mes y se encontró que 40% de los pacientes no hacían un cambio cada dos días, lo que demuestra que se deben instaurar estrategias para lograr una buena adhesión al tratamiento, junto con el equipo de enfermería.







 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Diálisis Peritoneal, organizado por los Departamentos de Nefrología de las universidades de Chile y Pontificia Universidad Católica entre los días 18 al 20 de diciembre de 2006. Directora: Dra. Mireya Ortiz Mejías.
 Expositor:
Roberto Pecoits-Filho[1]
Expositor:
Roberto Pecoits-Filho[1]

Citación: Pecoits-Filho R. Ultrafiltration. Medwave 2007 Nov;7(10):e3606 doi: 10.5867/medwave.2007.10.3606
Fecha de publicación: 1/11/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión