Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Diálisis Peritoneal, organizado por los Departamentos de Nefrología de las universidades de Chile y Pontificia Universidad Católica entre los días 18 al 20 de diciembre de 2006. Directora: Dra. Mireya Ortiz Mejías.
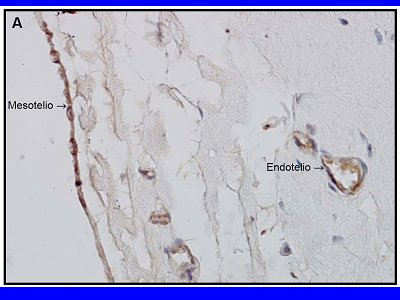
Figura 1. Peritoneo durante instalación de catéter de peritoneodiálisis
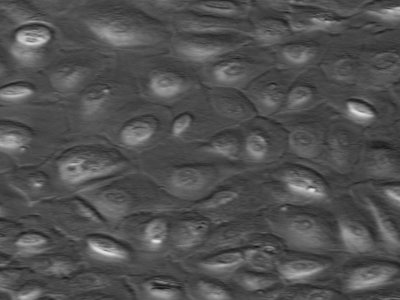
La Fig. 2 es una microfotografía electrónica de mesotelio peritoneal humano, que en cultivo tiene el aspecto de un verdadero mosaico de células.
Figura 2. Células mesoteliales de peritoneo humano
El conocimiento de las células mesoteliales ha ido cambiando en los diez últimos años; inicialmente se las consideraba sólo como un grupo de células por las que transcurrían fluidos y solutos desde un lado hacia otro, pero luego se descubrió que ejercen gran cantidad de funciones: como toda célula constituyente de serosa, pueden producir surfactante; poseen canales de acuaforina I inducibles, en la medida en que se exponen a concentraciones mayores de glucosa; producen citoquinas proinflamatorias y factores de crecimiento (TGF , MGF, VEGF, FGF, PGF), que pueden participar en respuestas inflamatorias y fibróticas a mediano y largo plazo; expresan in vitro todos los componentes del sistema renina-angiotensina, hecho que se descubrió recientemente; finalmente, un aspecto muy importante es que se pueden transformar en fibroblastos, migrar hacia el interior del tejido conectivo subyacente y promover fenómenos de fibrosis.
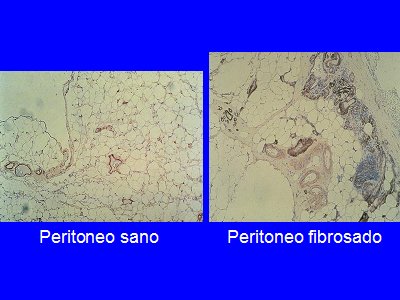
Figura 3. Comparación peritoneo sano y fibrosado
En la hemodiálisis, la distancia entre el flujo sanguíneo y el flujo dializado es relativamente constante y depende principalmente del espesor de la membrana; en cambio, en la membrana peritoneal los capilares se ubican a distintas distancias de la superficie mesotelial y la participación de cada uno de ellos es diferente, según la distancia que los separa del mesotelio. La vascularización peritoneal es más importante que la superficie anatómica: sin ella no podría haber transporte; para que una membrana peritoneal trabaje en forma eficaz son indispensables tanto la superficie como la vascularización, lo que da origen al concepto de superficie peritoneal efectiva, que corresponde a la superficie que está vascularizada y que participa en los intercambios de soluto.
El flujo sanguíneo peritoneal es relativamente bajo, si se compara con los flujos que se utilizan en hemodiálisis: 50 a 100 ml/min, pero permite obtener un clearance de urea de 20 a 30 ml/min, aunque la presión arterial sistólica llegue a ser tan baja como 70 mmHg, lo que sería prácticamente imposible con la hemodiálisis convencional. Hay evidencias de que la inflamación y algunas drogas aumentan el clearance, por aumento de la superficie peritoneal efectiva. Los capilares que más participan en los intercambios con el líquido peritoneal son, probablemente, los que están cerca de la membrana peritoneal, especialmente los de la superficie mesotelial.
Figura 4. Diálisis peritoneal
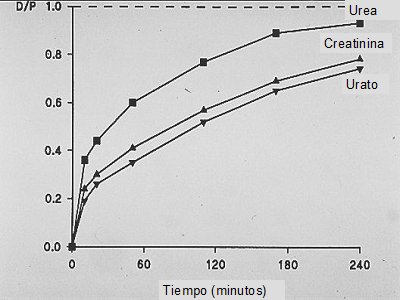
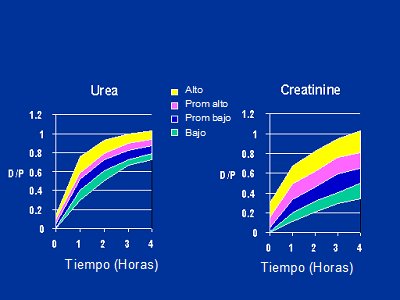
La difusión es mayor en las primeras 2 horas y después disminuye. La herramienta que se utiliza para medir la saturación es la creatinina, a través del test de equilibrio peritoneal o PET. Habitualmente se mide como D/P, que es la saturación del líquido de diálisis con un determinado soluto. Los cuatro carriles característicos de los tests de ultrafiltración (PET) tienen que ver con la elevación de la creatinina a lo largo de la zona del líquido peritoneal y reflejan los carriles clásicos, es decir, los transportadores altos, los transportadores promedio altos, los transportadores promedio bajos y los transportadores bajos. Hay un rango bastante amplio, lo que permite diferenciar los cuatro grupos con cierta seguridad, mientras que en el caso de la urea la distancia que separa los carriles máximos y mínimos es muy pequeña, por lo que es más fácil y seguro utilizar la creatinina (Fig. 5).
Figura 5. Test de equilibrio peritoneal de creatinina y urea (prom.: promedio)
La difusión se puede aumentar manteniendo el mayor gradiente de concentración posible, lo que se logra usando recambios más rápidos; o bien, aumentando la superficie útil mediante volúmenes de infusión mayores. Por ejemplo, si se aumenta el volumen de la solución de 2 litros a 2,5 litros, el clearance se incrementa entre 18% y 23%.
La remoción de solutos en la diálisis peritoneal depende de la saturación de cada litro drenado, es decir, D/P de urea o de creatinina, y de la cantidad de volumen drenado por día o por semana. La D/P x litros drenados da cuenta de los litros efectivos, esto es, los litros que efectivamente contienen el soluto que se está midiendo como clearance. En diálisis peritoneal, el cálculo las adecuaciones se hace de acuerdo con lo que va hacia el exterior; en cambio, en hemodiálisis se calcula como un descenso porcentual del nitrógeno ureico, antes y después de la diálisis. En hemodiálisis se mira desde el lado de la sangre, mientras que en la diálisis peritoneal se mira desde el punto de vista de la sangre y del líquido peritoneal; sin embargo, en diálisis peritoneal se puede importar este concepto y medir los litros de urea que salen por el desagüe en hemodiálisis, para calcular el Kt/V.
Un aspecto que hay que tener claro es que los D/P y los litros drenados se mueven en direcciones opuestas y dependen de las características de cada peritoneo en un momento dado. Lo anterior quiere decir que cuanto mejor sea la saturación de un paciente, en términos de D/P, tanto mejor será la eliminación de solutos, pero, en general será tanto peor, dado que son pacientes transportadores altos que usualmente tienen problemas con la eliminación de volúmenes; de manera tal que, por un lado, se está saturando muy bien, pero, por otro, hay dificultad en la remoción de volúmenes. Cabe recordar que la remoción de solutos en diálisis peritoneal, igual que en hemodiálisis, equivale a la suma de los clearance convectivos y difusivos del soluto considerado. En diálisis peritoneal, el clearance difusivo es mucho más importante que el clearance convectivo, por las condiciones físicas de la membrana.
La ultrafiltración depende de varios factores: gradiente osmótico de glucosa; perfil de desaparición de la glucosa; superficie peritoneal útil; juego de presiones hidrostáticas y oncóticas capilares versus peritoneales, y las características propias de la membrana.
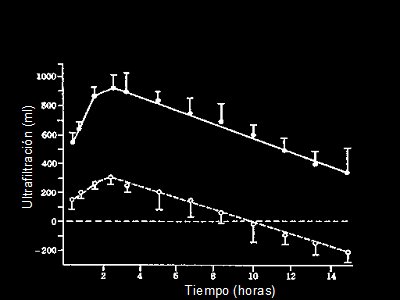
La reabsorción peritoneal de fluidos, fenómeno que no ocurre en la hemodiálisis, es muy típico de la diálisis peritoneal y suele ser bastante alta: se estima entre 60 y 120 ml/hora. No se sabe aún cómo se puede modificar la reabsorción; algunos trabajos han demostrado alguna variación con la administración de lecitina, pero son estudios aislados, con pocos pacientes y no están bien validados. En la práctica no hay manera de cambiar el flujo linfático; en un recambio de 6 horas, esta reabsorción significa una sustracción de ultrafiltrado de 360 a 720 cc, lo que constituye un inconveniente de la reabsorción linfática.
Figura 6. Ultrafiltración neta, usando soluciones de dextrosa al 1,25 y 4,25%
Para aumentar la remoción de volumen de un paciente:
El PET es una prueba que mide y clasifica las capacidades de transporte peritoneal; su principal utilidad es dirigir al paciente a diálisis peritoneal ambulatoria continua (CAPD) o APD. No es una prueba para medición de adecuación, sino que, básicamente, permite decidis cuál técnica conviene más a un paciente, en un momento determinado.
Es importante recordar que no es bueno tener a un paciente saturador o transportador alto en CAPD, porque en esos pacientes la ultrafiltración efectiva es baja, porque ese efecto anula la buena saturación y adecuación y porque no tiene control del volumen. En ese sentido, se parece a la diálisis corta de alta eficiencia, es decir, hay buena depuración y buena saturación, pero mala ultrafiltración.
La remoción de soluto se puede aumentar: maximizando el gradiente de concentración, por medio de intercambios más frecuentes, mayor volumen de recambio (+/-20%) y en APD, dejando recambio diurno; o bien, maximizando la ultrafiltración, mediante recambios más hipertónicos, recambios más frecuentes o mayor volumen de cada recambio, si la tolerancia lo permite.
Las estrategias para el manejo práctico de la ultrafiltración y difusión son: aumento del número de recambios; aumento del volumen de cada recambio; aumento de la osmolaridad de los baños, que funciona preferentemente para la ultrafiltración neta; baños diurnos en APD, en especial en los pacientes que tengan características de transporte bajo, para quienes representa una muy buena alternativa sin afectar la ultrafiltración; uso de la técnica tidal en APD, es decir, no permitir que se drene todo el baño anterior, sino dejar cierto remanente para que no haya tiempos muertos de pérdida de ultrafiltración, debido a que un baño ha salido y el otro no ha terminado de entrar; uso de icodextrina y preservación de la función renal residual.
Las concentraciones y osmolalidades son variables y dependen de la solución que se esté considerando. Hay que recalcar que se trata de una solución principalmente ácida, por el lactato, y que no tiene potasio. Uno de los grandes focos actuales de interés de la industria y de la biotecnología en diálisis peritoneal es ubicar una solución “amistosa” con el peritoneo en el largo plazo, para lo cual se ha planteado utilizar: bicarbonato en lugar de lactato; soluciones con aminoácidos; soluciones con icodextrina en lugar de glucosa; y soluciones libres de productos de degradación de glucosa. La tendencia actual es mejorar la biocompatibilidad de la solución, ya que, en diálisis peritoneal, la incompatibilidad está dada por la solución y no por la membrana, como en el caso de la hemodiálisis.






 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Diálisis Peritoneal, organizado por los Departamentos de Nefrología de las universidades de Chile y Pontificia Universidad Católica entre los días 18 al 20 de diciembre de 2006. Directora: Dra. Mireya Ortiz Mejías.
 Expositor:
Antonio Saffie[1]
Expositor:
Antonio Saffie[1]

Citación: Saffie A. Anatomy and physiology of the peritoneal membrane. Medwave 2007 Oct;7(9):e3604 doi: 10.5867/medwave.2007.09.3604
Fecha de publicación: 1/10/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión