Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
En el diagnóstico de la infección fúngica invasiva (IFI), es importante tener claros algunos conceptos:
En la población mundial, los pacientes que reciben tratamiento profiláctico tendrían más probabilidades de tener IFI posible; con tratamientos más específicos, tienen IFI probable; las IFI demostradas son las menos frecuentes, ya que es complicado demostrar la etiología fúngica en los cuadros de este tipo.
Chile tiene varias necesidades en este aspecto: entre ellas, sensibilizar a los profesionales del área (y también a las autoridades); trabajar en la formación del futuro profesional; actualizar a los profesionales clínicos y de laboratorio, como se está haciendo con este curso; aumentar recursos y gestión profesional; formular un programa nacional de vigilancia y redes de apoyo en diagnóstico micológico; y confeccionar guías de consenso nacional para el tratamiento, manejo y diagnóstico de las micosis invasivas.
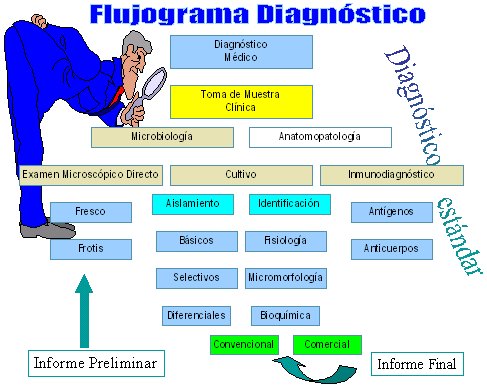
En la Figura 1 se ve el flujograma de diagnóstico estándar de un laboratorio de micología, según el cual, primero se realiza el diagnóstico médico y luego se toma la muestra clínica; si hay una biopsia debe ir a anatomía patológica y a microbiología, además de las otras muestras que van a microbiología, donde se realiza un examen microscópico directo de la muestra, el que puede ser un examen al fresco o un frotis; este examen es muy importante, ya que permite determinar en forma precoz la presencia de hongos y tipo de hongos en el material clínico: levadura, pseudohifas, hongo filamentoso, hongo septado o no septado.
Figura 1. Flujograma diagnóstico en laboratorio de micología.
Posteriormente se realiza el cultivo para el aislamiento e identificación del hongo. El aislamiento se puede realizar con medios básicos, selectivos o diferenciales, ya que hay una gama de medios de cultivo, no sólo el agar Sabouraud con glucosa. En cuanto a la identificación, en la mayoría de los hongos filamentosos se hace por su micromorfología; en el caso de los hongos levaduriformes, a lo anterior se agrega estudios con pruebas fisiológicas y bioquímicas. Entre estas últimas se pueden utilizar métodos convencionales, que son más difíciles de efectuar, o métodos comerciales, que han ayudado bastante en el diagnóstico de las levaduras.
El inmunodiagnóstico se efectúa mediante detección de antígenos y, en algunos casos, por detección de anticuerpos; una vez que se ha identificado el agente, lo que puede demorar 24 horas, una semana o más tiempo, se envía el informe definitivo, con el nombre de la especie del agente etiológico. También se podría agregar la susceptibilidad.
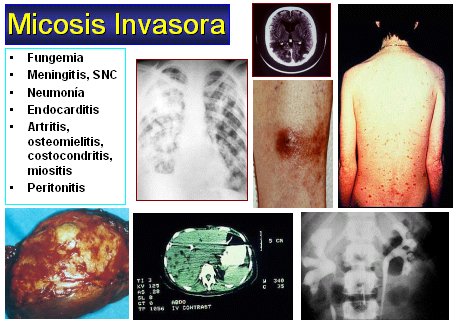
Hay una gran gama de micosis invasivas (Figura 2). Las más frecuentes son las siguientes:
Figura 2. Micosis invasivas.
Esta es la etapa primordial en el diagnóstico de la micosis, ya que la sensibilidad del examen de laboratorio está en directa relación con este proceso.
El procedimiento de toma de muestra varía según el tipo de micosis y el lugar afectado; en el caso de la orina, en la mayoría de los pacientes que presentan una infección fúngica urinaria la etiología es la Candida y la muestra de orina se toma por punción del catéter.
En el caso de la muestra de sangre, ésta se toma desde una vía periférica o el catéter, y debe efectuarse antes de que el paciente llegue al peak febril. Se debe asegurar una cantidad suficiente de material clínico para realizar los exámenes de laboratorio. La muestra debe estar acompañada de la solicitud de examen con el diagnóstico médico presuntivo; es importante que el médico no escriba sólo estudio de hongos, sino que consigne que desea un examen microscópico directo más un cultivo e incluya en la orden los datos mórbidos del paciente, la enfermedad de base y, si es posible, los principales factores predisponentes, ya que el personal del laboratorio puede utilizar esta información para hacer una correlación entre lo que se observa en el material clínico y lo que se aísla en las placas de cultivo, para aplicar el criterio diagnóstico.
En las fungemias, las muestras de sangre se pueden hacer con hemocultivo convencional, en que se coloca la muestra de sangre en una botella con un medio enriquecido, luego se lleva a la estufa y todos los días, en la mañana o en la tarde, se observa si aparece turbidez para hongos; pero este procedimiento tiene una sensibilidad de sólo 30%, en el mejor de los casos. Por esto, la industria investigó y desarrolló métodos más sensibles, conocidos como métodos comerciales, cuya sensibilidad sube de 60%, la que depende más de la población que del método.
En infección aguda, se recomienda tomar dos hemocultivos consecutivos; no es necesario esperar 20 minutos para la toma de la segunda muestra, en caso de una infección fúngica invasiva aguda.
En fiebre de origen desconocido, se recomienda tomar tres hemocultivos, dos de ellos consecutivos, por venipunturas diferentes, y el tercero, por lo menos una hora después.
En pacientes en tratamiento con antibacterianos, sobre todo si son de amplio espectro, se recomienda utilizar los hemocultivos automatizados, principalmente los que utilizan frascos con resina, que puede captar todas las proteínas de fase aguda de la respuesta inflamatoria y todas las sustancias o los fármacos que de alguna manera pueden inhibir el desarrollo de los microorganismos.
En probable infección del torrente sanguíneo asociada con catéter, se debe tomar una muestra de sangre del catéter y dos muestras por venipunturas periféricas diferentes, para ver la correlación.
El hemocultivo cuantitativo pareado se recomienda en infecciones asociadas con dispositivos implantables de larga duración, o cuando el estado del paciente no permite la extracción de este catéter; lo anterior se ve principalmente en pacientes hemato-oncológicos que necesitan un catéter venoso central subclavio. Muchas veces los oncohematólogos tratan de mantener el catéter el mayor tiempo posible y confirmar que no está colonizado, debido a su costo y a todo lo que significa extraerlo y colocar un nuevo catéter. La siembra cuantitativa de sangre obtenida a través del catéter central y de sangre periférica permite hacer un recuento microbiano comparativo entre ambas muestras; la relación 4:1 del hemocultivo central, respecto del periférico, permite afirmar que la fuente de contaminación es el catéter. Es un valor microbiológico muy útil para el clínico que debe tomar la decisión de retirar ese catéter.
En líquido cefalorraquídeo (LCR) , por ejemplo, en caso de neurocriptococosis, se utiliza un tubo con tapa rosca; el volumen debe ser de 2 ml y la muestra no se debe refrigerar. Los exámenes que se solicitan son examen microscópico directo (que se realiza con tinta china) y gram; detección cualitativa y cuantitativa del antígeno capsular; y cultivo e identificación del agente.
En abscesos, la muestra se obtiene por punción con jeringa.
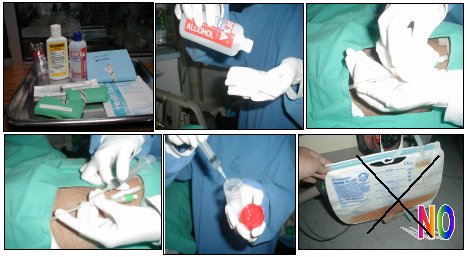
Las muestras de orina generalmente requieren un procedimiento adecuado, es decir, se punciona el catéter y no se toma de la bolsa (Figura 3).
Figura 3. Toma correcta de la muestra de orina en micosis invasivas.
La mayoría de las infecciones fúngicas del tracto urinario, en este caso las candidurias, son asintomáticas; la mayor parte de los laboratorios consideran significativo el valor mayor de 100.000 unidades formadoras de colonias (UFC), pero en ciertas publicaciones se propone que un valor igual o superior a 20.000 UFC sería suficiente para que el clínico indique un tratamiento específico contra Candida en orina. Se ha observado que los pacientes con urocultivos de valores inferiores a 20.000 UFC suelen negativizarlos en los días siguientes; por eso, si el clínico no desea comenzar un tratamiento, debe solicitar cultivos 72 horas después de esa muestra de orina y evaluar si el recuento aumenta o se mantiene.
Los hongos que causan infecciones en nuestro medio son cosmopolitas, o sea, están presentes en todo el mundo y presentan escaso poder patógeno.
Es uno de los procedimientos más simples, útiles y baratos para el diagnóstico de las micosis. La sensibilidad de este examen depende de la experiencia del observador y tiene la ventaja de la rapidez. Se utiliza mucho en micosis superficiales y mucocutáneas, no así en micosis invasivas, debido a los problemas que surgen para obtener una muestra representativa de una infección fúngica invasiva; por lo general, los procedimientos invasivos están contraindicados en los pacientes graves.
Cuando se puede hacer el examen microscópico directo (EMD), está la alternativa de una preparación al fresco; ésta se puede hacer en todo tipo de muestra y permite la observación directa en líquidos, o bien se puede agregar clarificadores, con o sin colorantes, para otras muestras.
Las preparaciones en frotis se utilizan con material líquido solamente y se pueden teñir con Giemsa o con Gram, en el caso de los hongos.
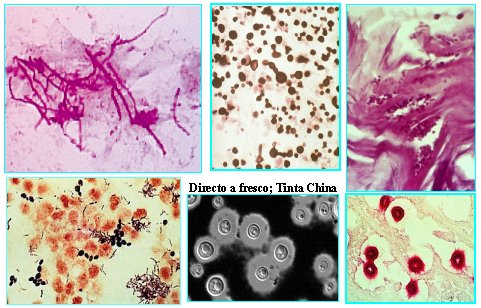
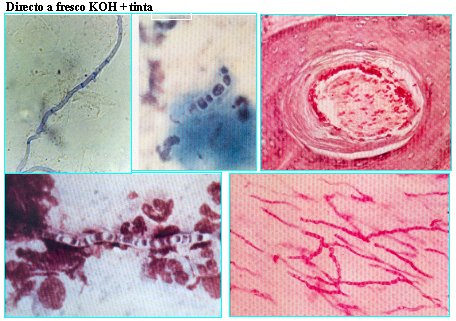
En la Figura 4 se observa un frotis de micosis superficial de una muestra de candidiasis orofaríngea y otra de flujo vaginal. A la derecha se ve un corte histológico en el cual se ven levaduras; en el centro, abajo, un examen directo de una levadura con cápsula, con una preparación de tinta china, que corresponde a Cryptococcus; es un corte histológico realizado con una tinción especial para Cryptococcus, llamada Mucicarmin Mayer.
Figura 4. EMD con levaduras.
En la Figura 5 se observa un hongo filamentoso, hialino, septado, en muestra de material purulento; se ven elementos celulares polimorfonucleares. Se puede ver la hifa.
Figura 5. EMD con hongos filamentosos.
En criptococosis, lo más conocido es el látex para Cryptococcus, que consiste en una cápsula con anticuerpos contra el antígeno del polisacárido capsular, que se llama glucoronoxilomanano. Para esta técnica, la muestra de LCR es la más sensible; luego vienen sangre y orina, en ese orden. Hay varios sistemas comerciales en el mercado (Crypto-lA, IIMI latex-Crypto, Pastorex, etc.) y el tiempo varía en cada uno de ellos entre 30 minutos y 2 horas. El rendimiento es muy bueno, con sensibilidad sobre 95% y especificidad entre 93% y 100%. La ventaja de esta técnica es que permite un diagnóstico muy rápido, sensible y específico.
En aspergilosis, los métodos de detección de anticuerpos circulantes son útiles en aspergiloma y aspergilosis alérgica, pero no sirven tanto para aspergilosis invasiva, por su baja sensibilidad en una infección de este tipo. Por ejemplo, la técnica de ELISA para detección de anticuerpos circulantes detecta sólo 33% de los casos de aspergilosis invasiva. En cambio, la antigenemia para aspergilosis invasiva detecta el galactomanano, exoantígeno liberado por el Aspergillus cuando causa infección dentro del hospedero. Se puede utilizar con muestras de suero, orina, LCR, incluso de líquido pericárdico, cuyos títulos ya están definidos. También se puede utilizar el lavado broncoalveolar, pero el punto de corte aún no está definido para este tipo de muestra.
Entre los métodos comerciales disponibles está el látex, cuyo primer exponente fue Pastorex Aspergillus (de Sanofi D. Pasteur), que detecta desde 15 ng de antígeno/ml; en consecuencia, es un método poco sensible y fue reemplazado por el ELISA Platelia Aspergillus, de Bio-Rad, cuyo límite de detección es de 0,5 a 1 ng del antígeno/ml y es, por tanto, mucho más sensible que el método anterior. Se recomienda efectuar muestras prospectivas, por lo menos 2 muestras de suero por semana, para evaluar si los títulos van en aumento.
En tres estudios diferentes, en los que se reunieron 125 casos probados y de probables IFI debido a Aspergillus, en el total de pacientes este método demostró sensibilidad de 90% a 93%, especificidad de 94% a 98%, altos valores predictivos positivos (87% a 93%) y altos valores predictivos negativos (95% a 98%). Por lo tanto, aunque no se pueda utilizar como única herramienta de diagnóstico, este examen es una buena herramienta de apoyo dentro del conjunto de exámenes disponibles para el estudio de la aspergilosis invasiva.
El examen es rápido, aunque la sensibilidad es variable según el tipo de técnica que se utilice, (látex, ELISA, anticuerpo) y además depende del tipo de infección por Aspergillus (aspergiloma, aspergilosis alérgica o aspergilosis invasiva). Según la situación global del paciente hay que tener cautela con los resultados; por eso es importante que el médico escriba los antecedentes del paciente en la solicitud del examen. Es muy específico.
En candidiasis, lamentablemente, el espectro es distinto. Se ha utilizado el antígeno de pared (1-3) Beta-D-glucano, pero este antígeno se encuentra también en Aspergillus y Pneumocystis, y no es específico de Candida. Hay varios sistemas comerciales, de los cuales los principales son Fungitec, Waco-WB y Glucatell. Tienen alta sensibilidad y especificidad, con 90% y 100%, respectivamente, pero el valor predictivo positivo es muy bajo (54%); el valor predictivo negativo es alto y la eficacia global, según algunos estudios, llega a 85%. Puede haber falsos positivos en pacientes en hemodiálisis que utilizan sistemas con membranas de celulosa y en pacientes en tratamiento con albúmina, inmunoglobulinas, sulfamidas y anticancerígenos.
Otros antígenos utilizados para identificar las candidiasis invasivas son manano y mananoproteínas. Hay un látex para antígenos de Candida, como el Cand-Tec, cuya sensibilidad oscila entre 25% y 100%, por lo cual no es muy seguro, y Pastorex Candida, cuya sensibilidad también es baja, de 53%, pero es muy específico (94%). En su línea de investigación para el diagnóstico de candidiasis invasivas, Quindos desarrolló la detección de anticuerpos antimicelio de Candida, la cual se puede realizar en dos horas, con gran sensibilidad y especificidad; se sigue trabajando para lanzarlo al mercado.
Entre las técnicas de inmunodiagnóstico está la detección de metabolitos como D-arabinitol, D-manosa y enolasa, que se puede hacer mediante varios métodos, pero cuya sensibilidad es muy baja (40%). La utilidad de estos métodos para Candida es limitada, pero son una alternativa disponible en el mercado, rápidos y muy específicos, a pesar de su baja sensibilidad.
Entre los hemocultivos comerciales están los automatizados y los manuales.
Entre los hemocultivos automatizados está el BACTEC 9240 (Becton Dickinson), que tiene varios viales. El que mejor funciona para hongos es el Bactec NR660 6A, que es el último que se ha desarrollado y tiene muy buena actividad; es mucho mejor que el anterior para hongos, el MYCO/F lytic, y es más sensible para aislamiento que el Bactec NR. Se incuba a 35 °C hasta por 7 días y se agita durante los dos primeros días. Las levaduras se detectan por tinción de Gram diaria y cuando el equipo informa que hay un vial positivo, se detecta la presencia de CO2 mediante fluorescencia.
Otro hemocultivo automatizado es el BacT/Alert (bioMérieux), que tiene varios viales; el que se utiliza para hongos es el FAN aerobic, cuya sensibilidad para determinar la presencia de hongos es mejor; también mediante la detección de CO2, pero con una reacción colorimétrica. En comparación con el inmunodiagnóstico, es más lento (24 a 32 horas), pero en relación con el método convencional es mucho más rápido y puede ahorrar hasta cinco días. Por ejemplo, un hemocultivo convencional podría salir positivo al séptimo día; este examen, en cambio, puede salir positivo a las 24 ó 48 horas. La sensibilidad y la especificidad también son mejores, en comparación con el hemocultivo convencional, a partir de 60%.
Respecto a los hemocultivos comerciales manuales, el más conocido y que lleva más tiempo en el mercado es el Lisis centrifugación (Isolator ISO 1,5), para el cual se toma una muestra de sangre y se la coloca en un tubo, en contacto con una solución de lisis que destruye todas las células sanguíneas, pero al hongo no le pasa nada, gracias a su pared protectora. Luego el tubo se centrifuga, los microorganismos quedan abajo, se elimina el sobrenadante, el sedimento se agita y algunas gotitas de este sedimento se siembran en agar chocolate, a 35 °C por 3 días, para todas las bacterias; otras se siembran en agar Sabouraud glucosado y, según el protocolo, también en un agar selectivo para hongos. Luego éstos se incuban a 30 °C, hasta 14 días para histoplasmosis, pero, como en Chile no existe esta entidad, la incubación puede durar hasta 7 días.
Otro hemocultivo manual es el Hemobac Trifásico (Probac), producto relativamente nuevo que consiste en un caldo enriquecido, en el fondo; agar chocolate y agar Sabouraud, en una paleta. Es trifásico, porque consta de tres medios de cultivo (el caldo enriquecido, agar chocolate por un lado de la paleta y agar Sabouraud por el otro lado). Se coloca la muestra de sangre dentro del caldo, que contiene también la paleta con ambos medios de cultivo, y se siembran por inversión del sistema, por lo menos dos veces al día, en la mañana y en la tarde. La muestra de sangre, que está en el caldo enriquecido, baña estos medios de cultivo y durante la noche permite el crecimiento de colonias, también por detección de CO2. Se incuba a 35 °C, hasta por 7 días.
Ambos métodos son relativamente rápidos, mucho más rápidos que el hemocultivo convencional; tardan entre 2 y 3 días. La sensibilidad también parte de 60% y son muy específicos, principalmente en levaduras, porque la Lisis Centrifugación tiene mucha contaminación con bacterias, pero para levaduras es muy buena.
En una serie de tres estudios comparativos entre Isolator y Bactec, efectuados en un total de 102 pacientes con candidemia comprobada mediante aislamiento en hemocultivo, se detectó como sigue: por ambos métodos, 64 pacientes; sólo por Isolator, 19 pacientes; y sólo por Bactec, 19 pacientes, esto es, 83 pacientes en total, equivalente a 81% con ambos métodos. En otras palabras, del total de pacientes (102), el hemocultivo dio positivo, tanto Isolator como Bactec, en 64 muestras. De los demás pacientes, sólo dio positivo Isolator en 19 y sólo dio positivo Bactec en 19; sumando los dos, la sensibilidad del diagnóstico fue 81% (83 pacientes entre 102, por Isolator y el mismo valor por Bactec).
En otro estudio, de menor cuantía, se comparó BacT/Alert con Hemobac Trifásico (HT). En la serie había gran cantidad de agentes, pero sólo tres pacientes tenían candidemia por C. albicans y los tres fueron detectados por ambos métodos. La detección con CO2 se hizo a las 47 y 40 horas respectivamente, pero como en el BacT/Alert es necesario traspasar la levadura al agar Sabouraud, con este sistema se tarda más horas en obtener colonias (67 horas); en cambio, con HT, como la paleta ya está dentro del sistema, las colonias aparecen a las 40 horas.
Comparando el hemocultivo automatizado (HA) con la Lisis Centrifugación (LC), resulta lo siguiente:
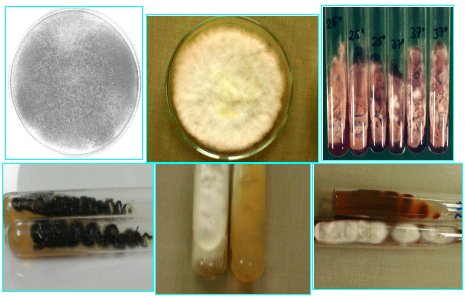
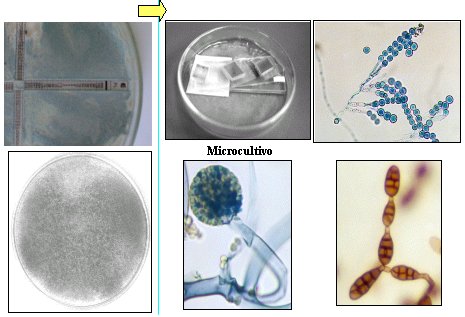
En la Figura 6 se observa colonias de hongos filamentosos, los que se identifican principalmente por micromorfología. En el microcultivo se ve la estructura (Figura 7).
Figura 6. Cultivo de hongos filamentosos.
Figura 7. Identificación de hongos filamentosos.
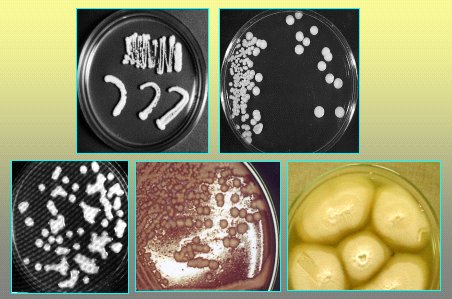
En la Figura 8 se ve cultivos de levaduras que originan distintos tipos de colonias. En la Figura 9 se muestra el medio agar cromogénico; en este caso, es una fotografía del cromoagar, donde algunas especies presentan colores particulares, característica muy importante cuando se quiere determinar si más de una especie causa el cuadro clínico o coloniza a un paciente. El tiempo en relación al agar Sabouraud es el mismo, pero es mucho más fácil de trabajar.
Figura 8. Cultivo de levaduras.
Figura 9. Cultivos en agar cromogénico.
La micromorfología se realiza en todos lo hongos para identificar la especie y se compone de microcultivo, células reproductoras, de propagación y resistencia, y estructuras ornamentales.
Las pruebas fisiológicas y bioquímicas se utilizan, fundamentalmente, para las levaduras. Las primeras son tubo germinal, crecimiento de cicloheximida y termotolerancia. Las bioquímicas son la asimilación de azúcares, las fuentes de nitrógeno, la fermentación de carbohidratos y la ureasa.
Ejemplos:
Según el aspecto de la colonia se sospecha un género determinado de levaduras y, a partir de eso, se aplican ciertos exámenes de laboratorio; no a todas las levaduras se les realiza tubo germinal, microcultivo, etc. Depende de lo que se aísle.
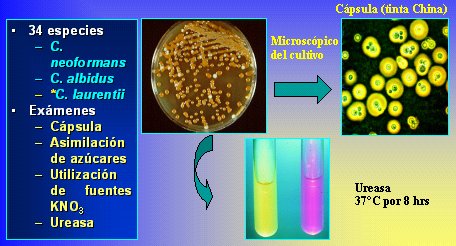
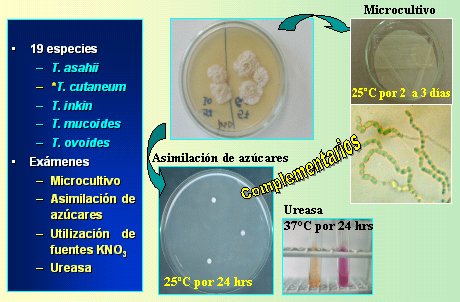
En la Figura 10 se muestra el flujograma para C. albicans con imágenes obtenidas en Internet; en la Figura 11 el flujograma corresponde a Cryptococcus, que es una levadura cremosa, con cápsula y urea positiva, y en la Figura 12 se observa Trichosporon, una levadura rugosa, para la cual se realiza microcultivo y bioquímica.
Figura 10. Flujograma para Candida.
Figura 11. Flujograma para Cryptococcus.
Figura 12. Flujograma para Trichosporon.
Varios sistemas bioquímicos comerciales, como Auxacolor, Fungichrom 1 y galerías API, tardan el mismo tiempo que el convencional, pero son más sensibles y específicos, y mucho más fáciles de ver en el laboratorio. Algunas incubaciones son a 30° C, pero algunas galerías se pueden incubar a 35° C ó 37° C, y hay que tener mucho cuidado con eso, porque las pruebas se pueden alterar.
Los nuevos sistemas enzimáticos son buenos, porque se ha conseguido adaptar algunos sistemas automatizados de detección enzimática, cuyo período de incubación es de 4 horas, lo que evita hacerlo de un día para otro, como ocurre con los sistemas bioquímicos. Han aparecido sistemas de galería y, por lo tanto, no se necesitan sistemas automatizados: están MicroScan, RapID Yeast Plus System y otros. En suma, son más rápidos que la bioquímica, pero tan sensibles y específicos como ella.
La identificación de especie por látex es muy cara y está disponible sólo para las especies C. albicans, C. krusei y C. dubliniensis. Se debe obtener la colonia, luego se hace un látex y en 5 minutos informa si es alguna de las tres especies nombradas.
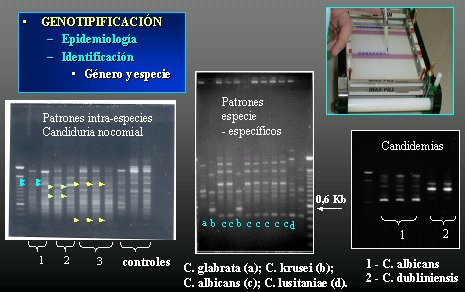
La biología molecular se ha utilizado principalmente en genotipificación, en epidemiología, para detectar si hay brotes, y, en estudios epidemiológicos, para la identificación de género y especie. En la Figura 13 se muestra la identificación, por genotipificación, de C. albicans, de C. dubliniensis y la elaboración de mapas de genotipificación. En este ejemplo, todas las letras (c) son C. albicans, las letras (b) son C. krusei y las (a) son C. Glabrata; pero el mapa no es específico y puede alterarse por cambios en la corriente o en alguna concentración, o sea, la dificultad está en que no es específico.
Figura 13. Biología molecular.
Hemos trabajado arduamente en desarrollar el diagnóstico por PCR de las especies de levadura del género Candida. Realizamos un estudio informático que permitió identificar regiones variables particulares de cada especie y diseñar los partidores que están en distintas posiciones dentro del ADN ribosomal y que, en teoría, permitirían obtener fragmentos de distintos pares de base para cada una de las especies.
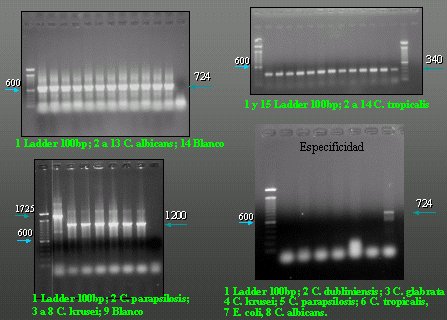
En la Figura 14, C. albicans tiene 724 pares de bases por PCR y Candida tropicalis tiene 340 pares de bases. La primera es Candida parapsilosis, con 1.725 pares de bases en su banda y hay una sola banda de C. krusei, con 1.200 pares de bases. Esto es especificidad. En cada una de las líneas hay una levadura de una especie distinta, todas ellas atacadas con el juego de partidores para C. albicans, que sólo dio positivo en C. albicans. Estos resultados son muy prometedores y fueron presentados en el Congreso Chileno de Insectología de 2004 y en el Congreso de Tecnología Médica.
Figura 14. Diagnóstico molecular - PCR.
Medwave, Año V No. 7 Agosto 2005. Derechos Reservados.
















 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
 Expositor:
Víctor Silva[1]
Expositor:
Víctor Silva[1]

Citación: Silva V. Present and future in the diagnosis of invasive fungal infections. Medwave 2005 Ago;5(7):e3557 doi: 10.5867/medwave.2005.07.3557
Fecha de publicación: 1/8/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión