Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
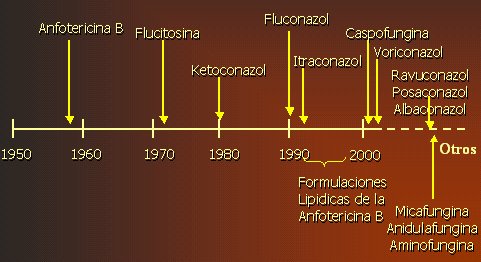
La anfotericina, que apareció a finales de la década de 1950, aún es el gold standard en la mayoría de las micosis invasivas; pero, debido a su toxicidad, han surgido varios nuevos antimicóticos. El fluconazol apareció en 1990; la caspofungina y el voriconazol, después de 2000. En la Figura 1 se pueden ver ubicados estos medicamentos en una línea de tiempo, al final de la cual figuran ravuconazol, posaconazol, albaconazol, micafungina, anidulafungina y aminofungina, las que todavía no están disponibles y que trataremos a continuación.
Figura 1. Historia de los antifúngicos.
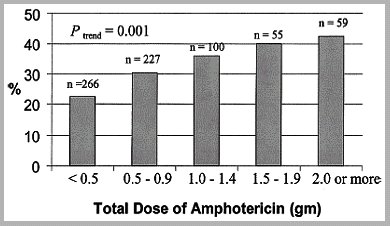
El inconveniente fundamental de la anfotericina es la nefrotoxicidad y por eso se ha trabajado en nuevos antimicóticos, los que cada vez se indican más, porque las infecciones micóticas son una patología que va en aumento. Numerosos trabajos demuestran la nefrotoxicidad de la anfotericina; es clásico el estudio de Bates en el que se observó que en alrededor de 80% de los pacientes tratados con este medicamento aumentaban los valores de creatinina y que en 30% de ellos se presentaba insuficiencia renal aguda, la que dependía de la dosis acumulativa (Figura 2).
Figura 2. Nefrotoxicidad por anfotericina (Bates DW, Clin Infect Dis 2001; 32:686-93).
Además, la mortalidad, ajustada por edad y gravedad del cuadro, de los pacientes que recibieron anfotericina B y desarrollaron insuficiencia renal aguda era de 54% versus 16% en los pacientes que no la desarrollaron. Por lo tanto, la insuficiencia renal tiene una connotación muy importante para el pronóstico de los pacientes.
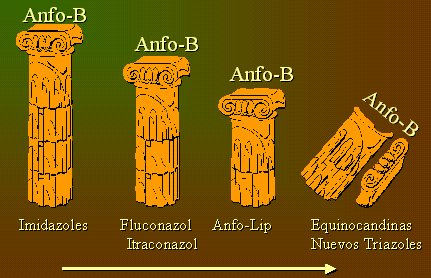
La Figura 3 grafica la importancia de la anfotericina, en comparación con otros antifúngicos, con el paso del tiempo. En un principio aparece la anfotericina, representada como una columna fuerte, junto con los imidazoles; con la aparición de fluconazol e itraconazol comienza a disminuir de tamaño, proceso que continúa con los lipídicos; por último, con las equinocandinas y los nuevos triazoles se desmorona la columna de la anfotericina. De hecho, un infectólogo estadounidense ha planteado que se debe reevaluar la anfotericina B como gold standard, porque las nuevas alternativas han abierto una nueva dimensión, con resultados similares (y en algunos casos mejores) y con menos reacciones adversas.
Figura 3. Importancia de la anfotericina en comparación con otros antifúngicos (dibujo de Teresita Díaz).
En al actualidad hay múltiples alternativas terapéuticas para distintas infecciones. Por ejemplo, para la candidiasis invasora hay ocho posibilidades de tratamiento, a las que se puede agregar itraconazol endovenoso. Ellas son:
En la aspergilosis invasora se puede utilizar:
Con respecto a otros hongos, para la criptococosis sirven fluconazol, anfotericina B desoxicolato o lipídica, con o sin fluocitosina, y voriconazol. En cambio, no hay nada nuevo para la mucormicosis, sólo la anfotericina B desoxicolato o formulaciones lipídicas; lo mismo para la fusariosis, con resultados bastante malos, aunque en este caso los tendría algo mejores el voriconazol. La fusariosis es un problema importante en la actualidad.
Las futuras drogas se pueden calificar de lejanas, que son las que aún están en fases muy preliminares y no han pasado de la fase de estudio en animales; y de próximas, que son aquellas con las que se están efectuando estudios clínicos.
Dentro de las drogas lejanas, que están siendo motivo de intensas investigaciones, pero todavía en una fase muy preliminar, se encuentran:
Las drogas futuras próximas están en estudios fase 2 ó 3 y son:
Es un triazol de nueva generación, que se caracteriza por una vida media larga, de 24 horas. En la actualidad se dispone sólo de la formulación oral, pero el laboratorio Schering-Plough está trabajando con intensidad en la preparación endovenosa, porque es una molécula tan interesante, que es fundamental disponer de una formulación endovenosa. Las dosis que recomiendan los estudios son 400 mg vía oral, 2 veces al día, o bien 800 mg 1 vez al día, que es la que más se está utilizando y que es posible gracias a su vida media prolongada. Hasta el momento su seguridad es buena y, en cuanto a la posibilidad de interacción con fármacos, ésta no se debe a que sea un sustrato para citocromo P450, sino a que es un inhibidor de la CYP3A4.
Se han realizado muchos estudios en animales con posaconazol, cuyos resultados demuestran que es igual o mejor que otros azoles, en diferentes modelos experimentales. Ha demostrado muy buena actividad contra Candida, Aspergillus, Cryptococcus, Histoplasma, Coccidioides y hongos dematiáceos, que van a ir adquiriendo cada vez mayor importancia en los pacientes trasplantados. Además, tiene muy buena actividad contra los hongos del orden Mucorales, es decir, la mucormicosis; es la primera droga con esta característica.
En la evaluación de los antimicóticos nuevos en seres humanos, todos deben pasar por ciertas etapas: primero se observa su efecto sobre candidiasis orofaríngea y esofágica y, si pasan esa etapa, se pueden realizar otras pruebas en humanos. Esta prueba permite objetivar los resultados en cuanto al éxito clínico y micológico, además de las reacciones adversas.
En algunos trabajos presentados en el ICAAC de 2003 y 2004 acerca de la utilidad de posaconazol en seres humanos, se observó lo siguiente:
También se ha utilizado en otros hongos, como terapia de salvataje cuando han fracasado otros antimicóticos, como en el caso de S. apiospermum, que causa una infección compleja y sobre el cual se obtuvo resultados bastante satisfactorios, con 43% de éxito (3/7 pacientes) en casos que normalmente tienen una mortalidad cercana a 100%. En una serie de 10 casos de infecciones graves del sistema nervioso central por Cryptococcus, Histoplasma, Scedosporium, Aspergillus, Coccidioide y hongos dematiáceos), se obtuvo 50% de éxito (5/10), y en la primera publicación acerca de su uso en mucormicosis, como salvataje, se describe 71% de éxito (17/24) con posaconazol. En cromoblastomicosis, que es más frecuente en países tropicales, también se obtuvo una muy buena respuesta, con 70% de éxito (9/13).
Herbrecht describió la primera experiencia en fusariosis, infección que se caracteriza por una mortalidad cercana a 100% cuando no mejora la neutropenia, con 50% de éxito al final del tratamiento (13/26): hubo 5 pacientes con respuesta completa; 8 con respuesta parcial; en 2 no cambió la evolución; y en 10 casos fracasó. Es importante que 4 casos de éxito tenían enfermedad diseminada, cuya recuperación es muy rara, y que 16 de los pacientes tratados eran refractarios a los tratamientos convencionales y su respuesta fue de 43%. La terapia fue primaria en 6 pacientes, con 67% de respuesta Este es un trabajo muy interesante, ya que se trata de una patología de muy mal pronóstico con los tratamientos convencionales (Herbrecht et al Clin Microbiol Dis 2004, 10-58).
El estudio de este fármaco comenzó con Bristol Myers Squibb y está disponible una prodroga endovenosa (E1224) y oral. Lo más interesante de esta droga es que su vida media es muy larga (120 a140 horas), por lo cual podría cumplir un papel importante en la profilaxis de trasplantados. Tiene 98% de unión a proteínas y hasta hoy ha demostrado que es bastante segura. Estudios en animales han demostrado buenos resultados sobre A. fumigatus, A. flavus y A. terreus, con concentraciones aceptables, y, en cuanto a interacción con drogas, no es metabolizado por citocromo P450, pero inhibe CYP2C9, CYP2C19 y CYP3A4.
En cuanto a los estudios clínicos, en un primer trabajo, efectuado en candidiasis orofaríngea en pacientes VIH positivos, hubo curación micológica de 62% en 57 pacientes refractarios. Además, hay un trabajo publicado acerca del uso de ravuconazol en candidiasis esofágica (ravuconazol 400 mg/día versus fluconazol 200 mg día) en un estudio aleatorio de 76 pacientes, con resultados de curación comparables (86% con ravuconazol, 78% con fluconazol). También se ha utilizado con éxito en protocolos de onicomicosis y en estos momentos hay estudios en curso para evaluar su utilidad en la profilaxis de pacientes trasplantados.
De los triazoles de nueva generación, es el más nuevo en investigación. Se están probando dosis de 80 a 320 mg; su vida media es de 30 a 70 horas; ha demostrado bastante seguridad hasta el momento. Su eliminación por orina es escasa y alcanza 15% de la concentración sérica en el líquido cefalorraquídeo, lo que podría tener alguna importancia en el tratamiento de las micosis del SNC. La actividad in vitro es muy buena, comparado con otros antimicóticos, y el espectro bastante amplio: sirve contra Candidas, Cryptococcus, A. fumigatus, Dermatofitos, Scedosporium prolificans y Scedosporium apiospermum.
Ya hay estudios con albaconazol en seres humanos, sobre todo para adecuar las dosis. In vivo, el fármaco ha demostrado actividad contra candidiasis, aspergilosis y scedosporiosis, patógeno que se describe cada vez más en pacientes inmunosuprimidos y también ha demostrado eficacia en tripanosomiasis. En un modelo animal de meningitis criptococócica en conejo se comprobó eficacia similar a la de fluconazol, en cuanto a sobrevida y recuentos cuantitativos en todas las dosis probadas. Su eficacia es buena y; de hecho, ya se han comenzado estudios de Cryptococcus en seres humanos.
Es una de las equinocandinas más avanzadas. Hay una gran base de estudios en animales (más de 50) y se caracteriza por su absorción oral muy baja (menos de 3%), por lo que se debe administrar por vía parenteral. Su vida media es de 24 horas y su concentración en orina es muy baja; lo mismo ocurre con la caspofungina, por lo que no son buenas alternativas en la infección urinaria. No cruza la barrera hematoencefálica y es muy segura, igual que las demás equinocandinas; no requiere ajuste en insuficiencia renal ni hepática, salvo en cuadros muy avanzados.
Recientemente se terminó un estudio de fase 3 en candidiasis/candidemia, con anidulafungina versus fluconazol. Es un trabajo grande, muy importante, comparable al de caspofungina con anfotericina B, pero está en revisión para su presentación en un congreso durante 2005, seguramente en el ICAAC. En 2004 se publicaron los resultados de un estudio comparativo de anidulafungina (100/50 mg) versus fluconazol (200/100 mg) en candidiasis esofágica, necesario para poder continuar hacia las etapas siguientes. El fármaco superó este paso con éxito; las reacciones adversas fueron similares en ambos grupos y los resultados fueron muy buenos y comparables en ambos grupos (Krauss et al Clin Infect Dis 2004; 38:770-5).
En otro estudio, no comparativo, dirigido a determinar la dosis más apropiada contra candidiasis invasora y candidemia, se obtuvo 84% de éxito con dosis menores de 100/50 mg; 90% de éxito con dosis de 150/75 mg; y 89% de éxito con dosis de 200/100 mg. La primera dosis es la dosis de ataque y luego se sigue con una dosis de mantención. Lo mismo se hace con caspofungina: una dosis de ataque de 70 mg y se sigue con 50 mg. En la prueba de curación, a las dos semanas de terminado el tratamiento se obtuvo resultados comparables con 200/100 versus 150/75 (Krause et al Antimicrob Agents Chemother 2004; 48:2021-4). En el mismo estudio, los porcentajes de éxito en candidemia, definido como erradicación conocida, según el tipo de cepa, fueron: 82% C. albicans; 95% C. glabrata, 86% C. parapsilosis, un resultado excelente.
El desarrollo de esta equinocandina va tan avanzado como el de la anidulafungina. Hay formulación endovenosa de 75 mg por dosis, la vida media es prolongada (14 horas) y la excreción urinaria es mayor que la de las demás equinocandinas (alrededor de 7%). Podría tener utilidad en infecciones urinarias, en el futuro. Se ha probado con dosis hasta de 200 mg/día, muy bien toleradas y seguras. Como con las demás equinocandinas, no hay resistencia cruzada con cepas resistentes a los azoles. Todavía no hay trabajos comparativos entre micafungina, anidulafungina o caspofungina; todas serían similares. Recién se está iniciando un estudio comparativo de micafungina con caspofungina en candidemia y candidiasis invasora.
En cuanto a estudios de eficacia clínica de la micafungina en candidiasis esofágica, uno se presentó en 1999 y otro en 2002, en el ICAAC. En el primero se probó con dosis de 12,5, 25 y 50 mg/día, con 81%, 90% y 100% de éxito, respectivamente. En las nuevas infecciones (88 pacientes) hubo 93% de éxito y en las infecciones refractarias (9 pacientes) 78% de éxito (ICAAC 1999 abs.1421 e ICAAC 2002 abs. M-882).
En un estudio comparativo de respuesta según dosis de micafungina versus fluconazol, en candidiasis esofágica, realizado en 245 pacientes, se demostró que las dosis de 100 mg y 150 mg de micafungina son parecidas y los resultados muy similares a los de fluconazol. No hubo diferencias significativas (de Wet et al Clin Infect Dis 2004; 39:842-8).
Por otra parte, en un estudio clínico no comparativo de candidemia y candidiasis invasora en pacientes con cáncer, que fue presentado en 2001, se observó 92% de éxito. En otro trabajo, también de 2001 y de candidemia, se obtuvo 100% de éxito; en candidiasis diseminada, 62%. Los grupos son muy diferentes, no son comparables y por eso hay muchas diferencias en los resultados. En algunos la casuística es grande, en otros es muy pequeña, pero han permitido reunir información sobre micafungina, la que ha demostrado ser muy eficaz, comparable con las otras drogas y mucho más segura que la anfotericina B en el tratamiento de las candidiasis.
En cuanto a Aspergillus, los resultados también han sido interesantes. Se ha descrito 57% de éxito en Aspergillus fumigatus, 75% en A. flavus, 88% en A. Niger y 14% en A. terreus, que es el más resistente del grupo. De hecho, los resultados fueron relativamente malos y con anfotericina son pésimos. En el mismo estudio de micafungina en aspergilosis los resultados fueron relativamente buenos, con alrededor de 60% de éxito en enfermedad pulmonar invasora, enfermedad pulmonar crónica necrotizante y aspergiloma pulmonar, todas ellas enfermedades de alta letalidad.
En uno de los estudios más recientes se observó el efecto de micafungina en terapia de combinación en aspergilosis refractaria, en pacientes con trasplante de médula ósea. Fue un estudio multicéntrico, abierto, no comparativo, en el que se administró una dosis de 75 mg/día, que podría modificarse en el futuro, según los resultados que se obtengan: 26% de estos pacientes eran neutropénicos, 59% tenían micosis invasiva demostrada, 41%, probable. En los estudios con antimicóticos, en especial los empíricos, es importante asegurarse de que los pacientes han tenido una micosis; por eso hay que tener mucho cuidado con la interpretación. Hay un trabajo con voriconazol, otro con caspofungina y otro con anfotericina liposomal y anfotericina desoxicolato, en los que se comparó el efecto en pacientes neutropénicos febriles, pero en la gran mayoría de ellos no se demostró ninguna micosis. Lo que realmente sirve son los resultados de los antimicóticos contra infecciones fúngicas comprobadas.
En otro estudio, 53% de los pacientes tenían enfermedad de injerto contra huésped, cuadro muy grave que se asocia con alta mortalidad. Los autores asociaron micafungina con anfotericina B en 71 pacientes y micafungina con anfotericina B y azoles, en 13 pacientes, partiendo de la base de que eran terapias de salvataje, ya que la mortalidad habitual de estos pacientes es cercana a 100%. Las terapias lograron respuesta completa o parcial en 38,8%, según los investigadores, muy bueno para este tipo de pacientes. Un panel de expertos externo determinó que sólo 28,4% de los pacientes habían respondido.
Es el anitimicótico más nuevo, pero ya está en estudio en seres humanos. Es un derivado sintético de una sustancia natural, la cispentacina, que es un beta aminoácido que actúa en la isoleucil-tRNA sintetasa; no tiene resistencia cruzada con otros antimicóticos; es de uso oral y su vida media es de 7 horas. Hasta el momento ha demostrado un buen perfil de seguridad, no interactúa con P450 y su eliminación es renal. De aquí se ha derivado una serie de otras moléculas que están en estudio. Su actividad primaria es contra Candida, en especial C. glabrata y C. krusei; tiene cierta actividad contra C. albicans y ninguna sobre C. parapsilosis ni C. tropicalis; o sea, su actividad es relativamente restringida. In vivo su actividad es comparable con la de fluconazol, incluso mejor con cepas resistentes de C. albicans en conejos y actividad antifúngica frente a infecciones por C. glabrata y C. krusei en seres humanos.
En el primer estudio presentado en el ICAAC de pacientes con candidiasis orofaríngea VIH positivos, se administró icofungipen 150 mg 2 veces al día, con 67% de éxito; e icofungipen 150 mg 3 veces al día, con 79% de éxito. Con fluconazol 100 mg, que era el gold standard, hubo 100% de respuesta, todos eran sensibles a fluconazol. Se puede cuestionar el sentido de realizar estas comparaciones, si son 100% sensibles a fluconazol, pero es sólo la primera etapa. Ahora se está utilizando en cepas resistentes a fluconazol y, como la resistencia no es cruzada, si los resultados son buenos podría ser una alternativa interesante en un grupo de pacientes muy complejos, como son los VIH positivos refractarios, que desarrollan candidiasis recurrentes y se vuelven resistentes a anfotericina y a azoles. Con esto habría una alternativa oral. Además, es interesante como modelo de fármacos que actúan a ese nivel, porque puede aparecer otro de espectro más amplio que se podría utilizar en el futuro.
Es un anticuerpo recombinante humano contra la heat shock protein 90 (HSP90) fúngica, molécula que está presente en bacterias y hongos, y en todas partes, y que acompaña una serie de episodios de estrés celular. En un estudio en el que se asoció anfotericina B con mycograb se demostró un efecto aditivo in vitro e in vivo. En la mayoría de los casos tiene efectos positivos con polienos, es decir, con anfotericina B, pero no con candinas ni azoles (Matthews et al AAC 2003, 47:2208-16; Matthews et al Vaccine 2004; 22: 865-71).
En un estudio grande, ciego, aleatorio, en 139 pacientes con candidiasis invasiva, se evaluó la respuesta clínica, a los diez días, de anfotericina B lipídica sola, versus anfotericina B lipídica con mycograb por cinco días (1 mg/kg). Con anfotericina b lipídica sola se observó 48% de mejoría; con la combinación la cifra subió a 84%. Este resultado es curioso, porque es demasiado espectacular; ya se presentó en el ICAAC, pero todavía no se ha publicado en ninguna parte ni el trabajo ha sido presentado en congreso; es sólo información preliminar.
Los datos han causado extrañeza. La mortalidad atribuible a anfotericina B lipídica fue 18%; la de la combinación, 4%; y el tiempo de clearance de cultivo, o sea, la negativización de la Candida, fue de 23 días con anfotericina B lipídica y de 3 días con la combinación. Un aspecto interesante es que se está utilizando estos anticuerpos recombinantes en tratamientos contra el estafilococo. Son inhibidores específicos de la heat shock protein de este microorganismo y del enterococo causante del síndrome hemolítico urémico. Un laboratorio se dedica sólo a anticuerpos recombinantes.
En conclusión, hay gran actividad en torno a los antimicóticos y se está haciendo muchos estudios con caspofungina en pediatría. En los próximos años va a aparecer gran cantidad de información y, por otro lado, hay consenso en que se debe empezar a utilizar asociaciones en el tratamiento de Aspergillus y otras micosis muy graves. Si bien la base científica de esta conducta no es muy fuerte por ahora, cada vez aparecen más estudios en su apoyo.



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
 Expositor:
Luis Thompson[1]
Expositor:
Luis Thompson[1]

Citación: Thompson L. New antifungal therapies. Medwave 2005 Jun;5(6):e3555 doi: 10.5867/medwave.2005.06.3555
Fecha de publicación: 1/7/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión