Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
En la última década se han desarrollado varios métodos para realizar pruebas de sensibilidad in vitro a los antifúngicos, los que han demostrado ser reproducibles y fiables inter e intra laboratorio, además de tener cierta capacidad para detectar la resistencia in vitro.
La mayoría de los expertos piensa que las pruebas de sensibilidad a los antifúngicos tienen utilidad práctica, pero otros opinan que no ayudan al manejo de los pacientes con micosis invasora; este escepticismo se debe a dos razones, una de las cuales es microbiológica y se refiere al problema de la estandarización, porque estas pruebas de sensibilidad en los hongos son mucho más recientes que las de antibióticos y, hasta el momento, con alrededor de 10 años en uso, todavía presentan limitaciones técnicas.
La otra razón es clínica y consiste en que las alternativas terapéuticas para enfrentar las infecciones fúngicas invasoras son escasas, por lo tanto, las pruebas de sensibilidad no tendrían mucho sentido en la práctica clínica. Para algunos autores, la correlación entre los resultados de los estudios de sensibilidad a los antifúngicos y la evolución de los enfermos, es decir, la correlación in vitro e in vivo, se puede calificar como discreta, porque hay infecciones debidas a cepas sensibles, in vitro, a un antifúngico determinado, que no responden al tratamiento con ese fármaco; y, al revés, hay micosis producidas por cepas resistentes in vitro, que responden favorablemente al ser tratadas con el antifúngico.
Un método de sensibilidad debe reunir las siguientes características:
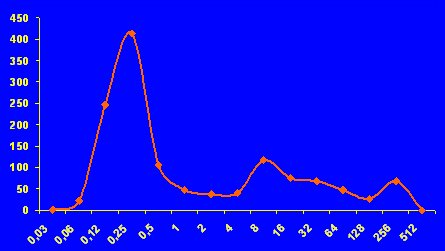
Figura 1. Distribución de las CIMs de FCZ en C. albicans.
Hasta la década de 1980 había menos opciones terapéuticas que en 2000. Las micosis eran menos frecuentes y se clasificaban en primarias, endémicas, cutáneas y subcutáneas. Recién estaban apareciendo las micosis oportunistas, por lo que todavía había poco interés por realizar estas pruebas. Los pocos métodos desarrollados tenían escasa reproducibilidad.
En 1992, el National Committee for Clinical Laboratory Standards (NCCLS) realizó los primeros ejercicios de estandarización basados en las bacterias, para ver lo que sucedía con los hongos. En 1997 apareció el primer documento de la NCCLS, en el cual se publicaron las técnicas de susceptibilidad in vitro para las levaduras y en 1998 se propuso un método para los hongos filamentosos. Entre 1998 y 2001 se publicaron documentos de varias sociedades microbiológicas, europeas y americanas.
En 2002 se publicaron los documentos del NCCLS: M27-A2 para las levaduras y M38-A para hongos filamentosos, documentos que la mayoría de los trabajos tienen como referencia y que definen lo que es una técnica reproducible para el estudio de susceptibilidad de los antifúngicos. En 2003 se sacó un estándar europeo llamado EUCAST, basado también en una norma europea para los antibióticos. En la mayoría de los trabajos aparecen tanto el NCCLS como el EUCAST.
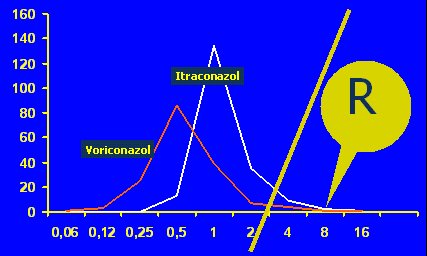
Es importante aclarar para cuáles antifúngicos está estandarizado un método. Se distingue entre poblaciones de Candida albicans frente a fluconazol y anfotericina B, y la CIM de las cepas sensibles oscila entre 0,5 y 1. Estos estándares se refieren a fluorocitosina, imidazoles, triazoles y los nuevos azoles, pero hay un problema con anfotericina B. En Aspergillus y hongos filamentosos se acepta, aunque no hay puntos de corte, que la CIM sobre 2 microgramos significa resistencia a los azoles voriconazol o itraconazol (véase Figura 2).
Figura 2. Distribución de las CIMs de Aspergillus spp para azoles en RPMI 2%.
La detección de resistencia a la anfotericina B constituye un problema del NCCLS que aún no se ha resuelto, pero se piensa que el E test, el mismo que se conoce para bacterias, podría ser la solución y detectar las poblaciones sensibles y resistentes. El E test no está validado por el NCCLS, porque lo distribuyen los suecos, pero se espera que en el futuro lo acepte.
Para los hongos filamentosos, sobre todo en lo que más se ha trabajado: Scedosporium prolificans, Scopulariopsis spp., Fusarium spp., Alternaria spp., Paecilomyces lilacinus y Aspergillus, también están determinados los valores de corte con CIM de 2 a 4 mg/l, que permiten distinguir entre poblaciones sensibles y resistentes.
En cuanto a la detección de resistencia, para determinar la CIM del NCCLS está el M27-A para levaduras, como macro y microdilución; el M38-P; y ahora aprobado para hongos filamentosos, que es de microdilución. El EUCAST Documento E.Dis 7.1 realiza una propuesta para levaduras fermentadoras, similar a la del NCCLS.
En cuanto a métodos de difusiones de agar, están el E test, M-44 P con discos de fluconazol para levaduras, que acaban de recibir la aprobación del NCCLS, y las tabletas de antifúngicos, que son europeas y se llaman Neo Sensitab-Rosco.
En 1997, el NCCLS determinó la CIM con un método de microdilución en caldo. El primero que se validó ese año fue el macrométodo, que consiste en alrededor de 10 tubos con concentraciones del antifúngico, en los cuales se coloca el inóculo y se determina la CIM, observando el tubo en el cual no hubo desarrollo o hubo un crecimiento menor, comparado con un control de crecimiento. El medio que se utiliza es el RPMI 1640, que debe estar a un pH definido (7), para lo cual se utiliza un buffer, porque en caso contrario cambian los resultados, cambian las CIM y los resultados no son fiables. El inóculo también está estandarizado; la incubación se realiza a 35º C durante 48 y 72 horas y la lectura es visual.
En el micrométodo se emplea microplacas con 96 pocillos, en los cuales va el antifúngico, el control de esterilidad, los inóculos, los controles de la cepa ATCC y el control de crecimiento. La determinación de la CIM también es por la turbidez y donde no se produzca desarrollo o éste sea menor, comparado con el tubo control, eso corresponde a la CIM.
Hay puntos de corte con fluconazol, itraconazol y 5 fluorocitosina. Hasta 1997 había valores de corte con las cepas sensibles y resistentes; con fluconazol, 64 o más es resistente; con itraconazol, sobre 1 (la 5 fluorocitosina ya no se usa). A partir de 1997, con los estudios de Rex, apareció un valor nuevo, que es la sensibilidad dosis dependiente; los valores de corte fluctúan entre 16 y 32 microgramos con fluconazol, y entre 0,25 y 0,5 con itraconazol. Con anfotericina B y ketoconazol no hay valores de corte hasta el momento.
La dificultad está en que no se puede diferenciar entre poblaciones cuando se hace estudios de la susceptibilidad a anfotericina. Las CIM del 99% de las cepas se incluyen en un intervalo de 4 diluciones dobles (0,12 y 1 microgramo por litro), por lo cual no puede establecerse valores de corte fiables para diferenciar ambas poblaciones. La propia variabilidad intrínseca de las pruebas de sensibilidad hacen necesario un intervalo de distribución más amplio, Por ejemplo, con fluconazol las CIM varían entre 0,12 y 0,5 en las cepas de Candida, lo que corresponde a la población sensible in vitro, y entre 16 y 64 microgramos por litro, lo que corresponde a la población resistente in vitro. Con el nuevo valor de corte, en que la sensibilidad es dosis dependiente, oscila entre 16 y 32 microgramos, de modo que el valor de corte estaría determinado como sensible dosis dependiente.
La principal limitación es que algunas levaduras crecen con lentitud, como Cryptococcus y Trichosporon, que no se desarrollan bien en el medio de cultivo que recomienda el NCCLS; por lo tanto, las CIM no van a corresponder a la realidad, no van a ser fiables y no serán útiles en el tratamiento de los pacientes.
La otra limitación es que esta técnica de referencia no se puede utilizar en muchos laboratorios asistenciales, porque su metodología es compleja: en algunos casos se ocupa gran cantidad de tubos, se consume mucho tiempo y no se puede hacer de rutina. En consecuencia, no ofrecen información rápida, lo que termina por dificultar el manejo del paciente. Hay propuestas para introducir modificaciones que permitan disminuir estos problemas, con los métodos denominados NCCLS-like (similares al NCCLS).
El EUCAST tiene modificaciones, pues se propone agregar glucosa para que la levadura crezca más rápidamente y disminuya a 24 horas el tiempo de lectura; se aumentó el inóculo y la determinación de la CIM se hace por espectrofotómetro (la anterior era visual). Se piensa que este método sería ideal en los países latinos, porque la lectura es más objetiva, por lo que se está procurando promover el EUCAST y no el NCCLS.
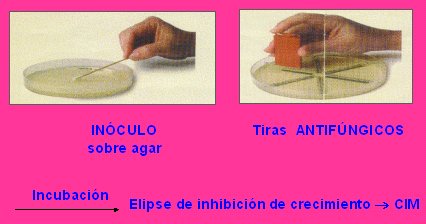
El E test mostró alta reproducibilidad inter laboratorios e intra laboratorio con C. krusei y C. parapsilosis que, cuando recién se inició, fue mayor de 98%. Es un método de difusión en agar y es cuantitativo: una vez establecido el inóculo y las tiras de antifúngicos que se utilizan, la CIM se determina por la elipse de inhibición del crecimiento (véase Figura 3).
Figura 3. Método de difusión (E test).
Las tabletas también corresponden a un método de difusión, utiliza el medio de cultivo Shadomy; el inóculo es de 10 elevado a 5, el tiempo de lectura es a las 24 horas y la determinación es visual, porque se debe medir los diámetros de los halos de inhibición. Estos valores los da el fabricante y se puede clasificar los hongos en sensibles, resistentes y sensibles dosis dependientes, según el diámetro del halo de inhibición.
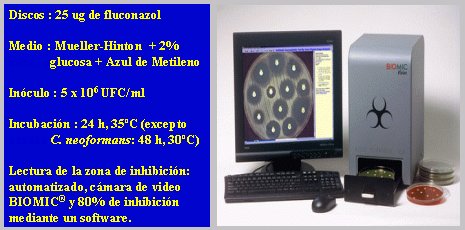
Las tabletas Neosensitab son europeas, pero en los Estados Unidos se realizó un estudio en 20.900 levaduras de 40 hospitales y 26 países, para promover el uso de discos con 25 ug de fluconazol en el medio Mueller-Hinton, igual que el de las bacterias, al cual se le adicionó glucosa al 2% y azul de metileno para una mejor lectura. El inóculo es de 5 por 10 elevado a 6 UFC/ml y la lectura se hace a las 24 horas. La lectura de la zona de inhibición se puede automatizar, lo que significa tener una cámara de video BIOMIC; se consideró 80% de inhibición mediante un software. Cuando se hizo este estudio, se instaló este sistema en todos los laboratorios participantes (Figura 4).
Figura 4. Discos de fluconazol. Estudio Multicéntrico Internacional:
20.900 levaduras , 40 Hospitales, 26 países (J. Meis y col. DMID 2000, 36:215-223).
En el documento M44 NCCLS de 2002 está todo estandarizado para que, si se sigue las instrucciones de ese documento, los resultados sean comparables con los de otros estudios que utilicen la técnica de difusión en agar. Los valores de corte indican que sensible es igual a 19 mm o más y resistente, igual a 12 mm o menos.
Se dice que son una alternativa práctica y de bajo costo, aunque para Chile el costo de todo sistema comercial es alto. Lo importante es que, en la mayoría de los casos, estos sistemas están comparados con las técnicas del NCCLS, por lo que sus resultados son fiables, pero hay que contar con esa referencia, en caso contrario es preferible no usarlos. En la mayoría de las publicaciones de las técnicas comerciales se recomienda el Sensititre Yeast One, el Fungitest y el ASTY.
Respecto a los hongos miceliales, en 2002 se aprobó el documento M 38-A (NCCLS) con algunas limitaciones: en el medio de cultivo RPMI no crecen todos los hongos filamentosos; si no crecen bien no se obtendrá una buena CIM y los resultados no son fiables. Por ahora se puede aplicar a un número limitado de especies como Aspergillus, Fusarium y Pseudoallescheria, pero hay un problema en las especies que producen escasos conidios, porque con esta técnica es necesario contarlos. Además, existen pocos datos sobre la correlación in vitro e in vivo. En un trabajo se determinó cuántas veces una CIM de 2 mg/L es 1mg/L a la semana siguiente, usando la técnica del NCCLS M 38P y RPMI, con 2% de glucosa en dos diluciones: Aspergillus flavus y Aspergillus terreus. Se realizó repeticiones en cuatro días diferentes. Los resultados que se fueron obteniendo en algunas cepas también fueron diferentes, por tanto, demostró que existe una variabilidad.
La aplicación de estas técnicas tiene como finalidad predecir la respuesta a un tratamiento antifúngico y determinar si un agente que es resistente in vitro, puede ocasionar un fracaso terapéutico. Para eso es preciso dominar los conceptos de resistencia microbiológica y resistencia clínica. Si hay resistencia microbiológica, la CIM a un antifúngico es mayor de la que habitualmente se observa entre los miembros de su especie. La resistencia clínica es el crecimiento o falta de inhibición de un microrganismo en un foco de infección a pesar que en dicho foco existan concentraciones terapéuticas del antifúngico El principal problema es que con las técnicas in vitro se detecta la resistencia microbiológica, pero es necesario conocer también la resistencia clínica.
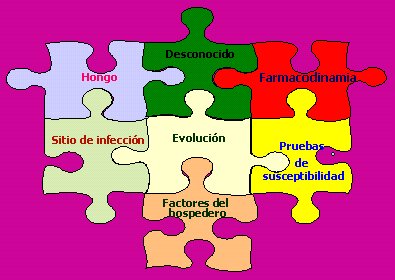
En la práctica clínica se requiere que haya una correlación in vitro – in vivo para predecir la resistencia clínica mediante la detección de la resistencia microbiológica in vitro. En esto, además de las pruebas de susceptibilidad, influyen otros factores: el hongo, el sitio de infección, el hospedero, farmacodinamia, la evolución de la infección y ciertos elementos desconocidos (Figura 5).
Figura 5. La evolución de una infección depende de muchos factores.
La correlación también se ha determinado en modelos animales, mediante el estudio de fracasos y éxitos terapéuticos, en los cuales se ha podido medir la farmacodinamia, la farmacocinética, la detección de moléculas o la biomasa. La finalidad de los estudios de correlación es obtener los valores de corte que ya se mencionaron. Dichos estudios de correlación se llevan a cabo, generalmente, en estudios clínicos multicéntricos o en modelos animales; si bien se ha visto que en muchos casos no reproducen lo que sucede en el ser humano, a veces ofrecen algún resultado que puede ser útil en la clínica. Realizar estudios clínicos también es difícil, porque reunir pacientes con una característica de infección fúngica invasora puede tardar meses o años; las manifestaciones clínicas son diversas, es difícil obtener las muestras y a veces no se consigue reunir el grupo. También están los factores del hospedero y otros ya citados.
La finalidad de realizar estos estudios de sensibilidad es detectar la resistencia y elegir la mejor alternativa de tratamiento para así reducir la probabilidad del fracaso terapéutico. Otro aspecto que se debe considerar es la aparición de especies patógenas con resistencia intrínseca y de cepas con resistencia secundaria. Por ejemplo, C. krusei, igual que Aspergillus terreus, tiene resistencia intrínseca a fluconazol y, por otro lado, C. glabrata puede adquirir resistencia secundaria. En la mayoría de las cepas de Candida albicans, la CIM de fluconazol está entre 0,12 y 0,5 microgramos/L, de modo que una cepa con CIM de fluconazol de 64 microgramos/L se puede considerar resistente in vitro. Si se recibe ese informe, no se va a utilizar fluconazol para tratar esa especie; se deberá buscar una alternativa.
Los primeros puntos de corte con fluconazol, itraconazol y 5-fluorocitosina se obtuvieron a partir de estudios en candidiasis orofaríngea; los demás, de algunas infecciones profundas, pero se vio que no había una correlación tan evidente.
En un modelo animal con candidiasis invasora se observó una disminución de la respuesta a fluconazol con una CIM mayor de 8 mg/L. En itraconazol, los fracasos terapéuticos se relacionaban con CIMs 0,25-0,5 mg/L; es importante considerar el cálculo de las relaciones entre parámetros farmacocinéticos y la CIM. Los cocientes entre la concentración plasmática o el área bajo la curva (AUC) y la CIM pueden ser predictores de la respuesta a los antifúngicos. Ej. Cociente AUC/CIM mayores de 25 son índices de respuesta superior a 90%, en cambio si es menor de 6,5 se reduce la probabilidad de respuesta a 57%. Basados en estas cifras deberían emplearse dosis más altas (800 mgs cada 12 horas) para tratar una cepa que presente una CIM de fluconazol de 32 mg/L.
Los estudios de correlación con anfotericina B están en una fase de desarrollo menos avanzada, no se han propuesto puntos de corte. El método actual de sensibilidad no detecta la resistencia es decir, no separa las poblaciones sensibles y resistentes, no se ha demostrado resistencia clínica en algunas cepas de levaduras y en modelo animal no se ha descrito buena correlación.
En hongos filamentosos, en modelos animales se ha observado resistencia in vivo en algunos casos con una CIM mayor de 2 sin embargo, otros autores encuentran una buena correlación entre una CIM mayor para Aspergillus y la evolución clínica de la aspergilosis invasora.
En relación a los azoles y hongos, existen valores de corte para fluconazol e itraconazol, basados en datos clínicos, principalmente en candidiasis orofaríngea. Además se ha definido valores para las cepas sensibles dosis dependiente, pero no se han propuesto valores de corte para hongos filamentosos. Los modelos animales demuestran correlación y en enfermos con SIDA con candidiasis orofaríngea. Fluconazol en infecciones profundas: 100 enfermos se incluyeron en puntos de corte del NCCLS. 32 enfermos tratados con 400 mg, 79% de los casos con especies sensibles respondieron (C. albicans) y 0% con especies resistentes (sólo 2 casos). En 34 candidemias tratadas con 100-200 mg, 48 % de las sensibles no respondieron y 100% de las resistentes.
Itraconazol en modelos animales demuestran relación, no existen datos en candidiasis profundas. La correlación en hongos filamentosos está en fase de estandarización y aún no hay valores de corte. Se observado fracasos terapéuticos con itraconazol en infecciones por Aspergillus con CIM mayor de 8 mg.
La resistencia microbiológica definida con puntos de corte (NCCLS y otros), para 5-fluorocitosina, fluconazol e itraconazol se conoce, pero sólo para levaduras; para los hongos filamentosos se supone que con anfotericina la CIM sobre 2 significa resistencia, pero esos valores de corte no están bien establecidos. La correlación es variable; hay dificultad para detectar la resistencia a anfotericina B y se está comenzando a trabajar con los hongos miceliales.
Resumen para levaduras:
Resumen para hongos filamentosos:
Para los hongos filamentosos, todo está en proceso de estandarización. El documento del NCCLS M38A y las alternativas equivalentes no identifican la resistencia a la anfotericina B para el género Aspergillus. Es razonable suponer que las especies o los aislamientos con CIM sobre 2 con anfotericina son resistentes, pero NCCLS M38A y las alternativas equivalentes sí pueden identificar la resistencia a los azoles. Por tanto, la utilidad clínica sería tener datos para el tratamiento inicial de las micosis invasoras y cambiar el tratamiento al identificar la especie, o bien para el tratamiento específico, según los casos. Se debe realizar estudios de sensibilidad en enfermos con SIDA, en otros casos de inmunodepresión y en las micosis invasoras.
Las indicaciones actuales para hacer las pruebas de sensibilidad son las siguientes:
Un aspecto importante es que muchas veces los estudios de sensibilidad pasan a ser un antecedente más; en un paciente debilitado, que tiene una enfermedad crónica, con inmunodepresión, este antecedente muchas veces no se considera.
Para realizar estos estudios se usa los métodos NCCLS, los like, el EUCAST, los métodos comerciales, pero sólo en especies estandarizadas, no en cualquier levadura que se aísle en el laboratorio. Lo ideal es realizar los estudios en un centro asistencial que los haga de rutina, o bien, en un centro de referencia que realice también estas pruebas de sensibilidad. Sin embargo, lo más importante es que el lugar donde se haga se ciña a los controles de calidad y, entre otros elementos, tenga un buen control de los lotes de medios de cultivo y de antifúngicos que se van a utilizar en la realización de esa técnica.
Igual que con las bacterias, una vez obtenidos los resultados se puede utilizar la denominada regla 90/60, que quiere decir que 90% de los hongos sensibles y 60% de los hongos resistentes responden al tratamiento.
Para terminar, un comentario muy inteligente citado por múltiples autores, sin que se sepa a ciencia cierta quién fue el primero: “Un test de sensibilidad predice sólo cómo tratar un tubo infectado”.





 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
 Expositora:
María Cristina Díaz[1]
Expositora:
María Cristina Díaz[1]

Citación: Díaz MC. Clinical utility of determining in vitro antifungal susceptibility. Medwave 2005 Sept;5(8):e3554 doi: 10.5867/medwave.2005.08.3554
Fecha de publicación: 1/9/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión