Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
El tema de las micosis sistémicas en el paciente pediátrico es muy amplio ya que los pacientes en riesgo son variados. Así, los pacientes pediátricos en riesgo son los siguientes:
El bajo peso al nacer es un factor determinante de micosis. Los recién nacidos de término tienen 10% de colonización oral, cutánea y rectal; los que pesan menos de 1500 g están colonizados en 15% y los que pesan menos de 1000 g, entre 30% y 50%. Esos porcentajes dependen mucho del tipo de parto, porque, por lo general, la Candida se adquiere debido al parto por vía vaginal; la especie depende de que la madre haya o no usado tratamientos con imidazólicos contra candidiasis vaginal o si utilizó antibióticos durante el embarazo, etc.
La piel es la gran barrera de defensa de los adultos, pero en los prematuros es muy delgada: un feto de 26 semanas de gestación tiene sólo 3 capas de células en su estrato córneo, versus 16 capas en el recién nacido de término. Esta situación lo torna muy lábil, casi como un paciente quemado, para adquirir infecciones invasivas por hongos. Además, son frecuentes las rupturas en la piel, causadas por catéteres, por ejemplo, que brindan una puerta de entrada.
Las deficiencias funcionales en los macrófagos y anticuerpos favorecen las micosis. A pesar de que los recién nacidos y los niños pequeños, de 2 a 4 meses, son los que tienen mayor número de linfocitos y de macrófagos circulantes en la sangre, esos macrófagos no son funcionales y los anticuerpos no han tenido tiempo de desarrollarse; son niños sin experiencia desde el punto de vista inmune, de los antígenos externos. Por lo anterior, estos pacientes tienen su capacidad fagocítica disminuida.
La exposición a antibióticos y otros medicamentos de uso frecuente en estos niños, constituyen factores de riesgo. Por ejemplo, la aminofilina disminuye la actividad fagocítica de los neutrófilos; los antagonistas H2 promueven la colonización por algunos tipos de Candida, como la C. parapsilosis. Todas esas interacciones constituyen factores de riesgo de infecciones de este tipo y es necesario tratarlos dentro de esa perspectiva.
La enfermedad granulomatosa crónica es poco frecuente, su incidencia es alrededor de 1/250.000 recién nacidos vivos, pero de todas maneras es importante conocerla, porque una de las principales causas de muerte de estos pacientes son las infecciones por hongos. Esta enfermedad tiene dos etiologías genéticas, una ligada al cromosoma X y la otra autosómica recesiva. El problema reside en que existe un defecto de los fagocitos que les impide reducir oxígeno y generar radicales de oxígeno para producir muerte intracelular, por lo tanto, estos pacientes son muy susceptibles a infecciones por microorganismos catalasa positivos, de modo que con frecuencia padecen infecciones estafilocócicas a repetición. Sin embargo, eliminan eficazmente los microorganismos catalasa negativos. El Aspergillus y la Candida son microorganismos catalasa positivos, pero estos pacientes desarrollan fundamentalmente aspergilosis.
Las inmunodeficiencias celulares o combinadas, pueden ser defectos de la producción de fagocitos y de la inmunidad humoral, como las SCID (Severe Combined Immuno Deficiencies) o defectos en áreas de generación de linfocitos, como el síndrome de Di George.
Entre los factores que predisponen a infecciones por hongos en las inmunodeficiencias secundarias están: daño de la barrera mucocutánea por quimioterapia o radioterapia; deficiencia funcional de los neutrófilos; deficiencia funcional de los linfocitos T; administración de esteroides; alteración del equilibrio microbiano normal por uso de antibióticos y quimioterápicos; uso de catéteres; y otros factores. Lo dicho afecta a los pacientes con cáncer y a los trasplantados, que son los que determinan la mayor incidencia de micosis.
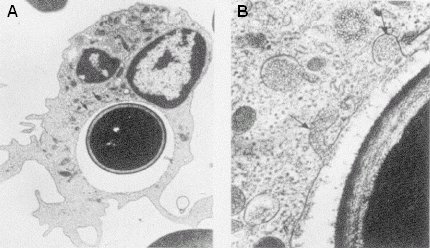
La fagocitosis es el principal mecanismo de defensa; si el paciente carece de ella, cualquiera sea la terapia antifúngica que se administre, no va a funcionar. La recuperación de los fagocitos es esencial para la recuperación del paciente. La Figura 1 ilustra la fagocitosis de una célula de Candida: la célula ya está totalmente englobada y el fagocito empieza a producir lizosimas y una serie de enzimas que destruyen la pared del hongo.
Figura 1. El fagocito ingiere una célula de Candida. A: la célula está totalmente englobada; B: el fagocito empieza a producir enzimas que destruyen la pared del hongo.
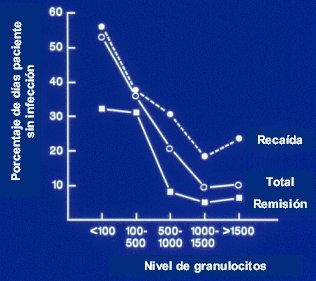
Un gráfico clásico es el de Bodey et al (Figura 2), en que se demostró por primera vez que el nivel de granulocitos es el principal determinante de riesgo de infección fúngica. En proporción inversa; por ejemplo, pacientes con más de 1.000 ó 1.500 granulocitos tienen poco riesgo; con recuentos bajo 1.000, el riesgo comienza a aumentar; y bajo 500, el aumento es notable (Ann Intern Med 1966;64(2):328-40).
Figura 2. Granulocitos versus infección.
Recuérdese que no sólo importa el número de granulocitos circulantes sino también la duración de la granulocitopenia. En una experiencia del mismo centro se demostró que el tiempo de duración de la granulocitopenia determina el número de pacientes con aspergilosis pulmonar invasiva, lo que ocurre no sólo con Aspergillus, sino también con otras micosis.
La respuesta del paciente a la terapia depende mucho de la patología de base. Por ejemplo, en pacientes con trasplantes alogeneicos, que son los que sufren el mayor grado de inmunodepresión, porque es necesario eliminar por completo la médula para realizar el trasplante, la respuesta es muy mala. En cambio, en el trasplante autólogo, es decir, en pacientes que reciben su propia médula tratada, la respuesta es un poco mejor. En pacientes sin trasplante, con leucemias o linfomas, con inmunodeficiencia importante, pero que no llegan a la ablación de la médula, la respuesta también es mejor, lo mismo que en el trasplante de órganos sólidos. En suma, la respuesta al tratamiento depende mucho del tipo y grado de inmunodepresión del paciente.
En un trabajo publicado en 1999 se describió la probabilidad de sobrevida en niños con cáncer y aspergilosis, y se analizó la experiencia de 12 años de aplicación de protocolos oncológicos en el Hospital St Jude, en Memphis, Estados Unidos. En los casos de aspergilosis, la sobrevida fue de alrededor de 20% (Abassi, Clin Infect Dis 1999; 29:1210). Hoy los resultados son mejores, gracias a los nuevos avances terapéuticos y al enfoque multidisciplinario, pero todavía el pronóstico es ominoso, especialmente en ciertas formas de aspergilosis, como la aspergilosis cerebral.
La respuesta no sólo depende de la inmunodepresión. En una serie de pacientes trasplantados, en quienes se administró Solumedrol en distintas dosis, para el tratamiento de una enfermedad de injerto versus huésped, se observó que los pacientes cuya sobrevida fue más larga fueron los que necesitaron menor cantidad de medicamentos inmunosupresores; los que necesitaron mayor cantidad sobrevivieron menos. En suma, durante la evolución de estas enfermedades, numerosos factores determinan el curso clínico, el resultado final de las micosis.
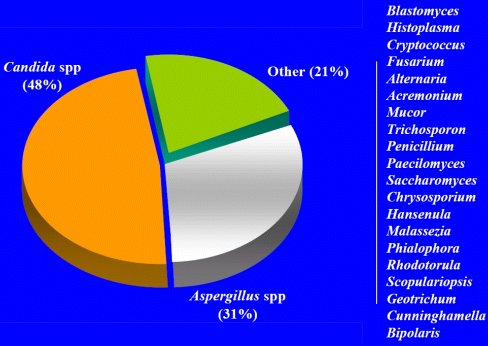
En múltiples revisiones de la epidemiología de los hongos en pacientes con cáncer y trasplante (Figura 3), se comprueba que, en la mayoría de los casos, las infecciones son por Candida y un tercio de ellas son por Aspergillus. En recién nacidos, también la mayoría de las infecciones son por Candida y la minoría por Aspergillus. En cambio, en pacientes con inmunodeficiencia secundaria como, por ejemplo, la enfermedad granulomatosa crónica, se observa una gran cantidad de Aspergillus y pocos casos de Candida.
Figura 3. Patógenos fúngicos en pacientes con cáncer y receptores de trasplantes de stem cell (datos de Walsh, Bodey, Meunier, Vásquez, Pannuti, Anaissie y Morrison).
La epidemiología, por lo tanto, depende de la patología de base del paciente y también varía entre los distintos centros y zonas geográficas. En un estudio muy interesante, realizado por Wilkenstein en 368 pacientes con enfermedad granulomatosa crónica, de Estados Unidos, a quienes se hizo seguimiento entre 1993 y 1995, se observó que, en estos pacientes, la causa de muerte más frecuente era Aspergillus, tanto en la forma ligada al sexo como en la forma autosómica recesiva; en cambio, las infecciones por bacterias y Candida tuvieron un porcentaje menor (Wilkenstein, Medicine 2000; 79:155). En estos pacientes, los resultados de los tratamientos antifúngicos dependen del tipo de micosis, ya sea con anfotericina B, voriconazol o fluconazol. El interferón gamma puede mejorar a estos pacientes, porque estimula la producción de defensas en los ganglios linfáticos, de las que estos pacientes carecen.
En una serie muy numerosa, compuesta por 5.447 recién nacidos de bajo peso de nacimiento con sepsis de aparición precoz, es decir, durante la primera semana, y 6.200 recién nacidos con bajo peso de nacimiento con sepsis de aparición tardía, es decir, después de los 10 días y hasta los dos meses, se observó que los hongos eran muy importantes en las sepsis precoces, pero aún más en las tardías. El patógeno fundamental fue C. albicans y hubo algunos casos por C. parapsilosis, fundamentalmente en la septicemia de aparición tardía: 1,5% de todos los niños de esta edad presentaron septicemia bacteriana o fúngica precoz (Kaufman. Clin Microbiol Rev 2004; 17:638).
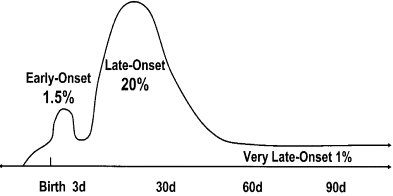
Es importante esta división en precoz y tardía (Figura 4), porque la génesis es distinta: la sepsis de aparición precoz se adquiere en el canal materno y depende de factores difícilmente controlables; en cambio, los factores que predisponen a la sepsis de comienzo tardío se pueden manejar, como el lavado de manos, el manejo de los sistemas de aire acondicionado y su limpieza, la limpieza de las incubadoras, un buen equipo, lo que depende del personal que trabaja en la unidad neonatal y de contar con una proporción del personal adecuada al número de pacientes, de modo de evitar sobrecargas.
Figura 4. Incidencia porcentual y tiempo de presentación de septicemia bacteriana y fúngica en recién nacidos con bajo peso de nacimiento. Mecanismos distintos.
En un trabajo de Stoll, publicado en 2002, se analizó la incidencia y la mortalidad porcentuales de las micosis sistémicas en recién nacidos con bajo peso de nacimiento, en dos períodos, y se observó que la mortalidad aumentó durante el segundo período: entre 1991 y 1993 la incidencia fue de 9% y entre 1998 y 2000 fue poco más de 10%. Este resultado se explica porque cada año sobrevive un mayor número de prematuros, cada vez de menos peso, en las unidades de cuidados intensivos; este hecho determina un aumento de la mortalidad por la gran cantidad de factores de riesgo y la marcada labilidad de estos niños. Por tanto, en la medida en que se recuperen pacientes más lábiles, los cuidados van a tener que ser más intensos (Stoll, Pediatrics 2002; 110:285).
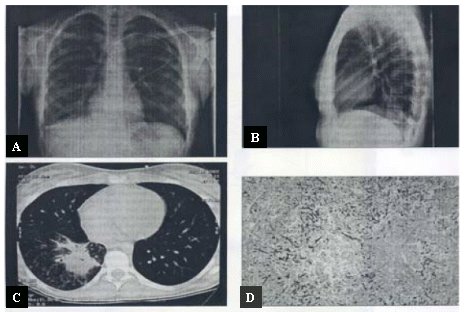
Es básico tener acceso a un diagnóstico adecuado. Se conoce en detalle todo lo referente al diagnóstico micológico, los métodos actuales de cultivo, etc.; pero también es muy importante el aporte de las imágenes, especialmente la tomografía axial computarizada (TAC) que, por el hecho de ser más sensible puede permitir detectar lesiones más precozmente. Por ejemplo, cuando en esta radiografía (Figura 5) no se ve prácticamente nada (A y B), en la TAC se observa claramente una lesión en la base (C). Este examen es, pues, esencial para detectar a tiempo las micosis de este tipo. En el recuadro D de la misma figura se ve la histología de las lesiones radiológicas en el mismo paciente.
Figura 5. Micosis: Importancia de la TAC en el diagnóstico.
La actitud debe ser muy vigilante y el examen físico, muy cuidadoso, para detectar máculas diminutas que podrían no significar nada en otro tipo de paciente; hacer un examen de fondo de ojo seriado en el recién nacido, porque en 10% a 20% de las candidiasis sistémicas se observa lesiones de ese tipo, detectables al oftalmoscopio. Una biopsia es un procedimiento muy simple y la muestra obtenida se envía al laboratorio de microbiología para cultivo, al laboratorio de patología para tinciones especiales, fijación e histología; y, eventualmente, al laboratorio de biología molecular para pruebas de otro tipo.
Lo anterior exige un trabajo coordinado que contemple la interacción entre distintos laboratorios; el clínico debe saber adónde hay que enviar la muestra, para que además de fijar la muestra en formalina para tinciones tradicionales pueda hacerse un cultivo, una tinción de inmunofluorescencia en tejido fresco, u otras tinciones como por ejemplo una tinción de blanco de calcoflúor.
Los factores que inciden en el éxito de la terapia antifúngica son múltiples: diagnóstico precoz, inmunidad del huésped, fármacos antifúngicos, posibilidad de reducir la carga infectante, drenar focos de infección y retirar cuerpos extraños. Es necesario confiar en los fármacos antifúngicos, pero es preciso contar con fármacos mejores. En la medida en que existan fármacos más potentes, el resultado de una terapia antifúngica va a depender principalmente del medicamento; en cambio, los medicamentos disponibles en este momento no son tan eficaces como los antibióticos contra las bacterias.
El primer antifúngico apareció en 1950; en 1958 apareció la anfotericina B, después la griseofulvina y luego la 5 fluorcitosina, en la década de 1970. Así como han aumentado las inmunodeficiencias secundarias por cáncer y por trasplantes, ha ido aumentando el interés por elaborar nuevos antifúngicos. En la década de 1980 hubo un aumento al final, con la aprobación de fluconazol, y en 2000 aumentó enormemente la cantidad de antifúngicos, pero de ellos sólo caspofungina y voriconazol están aprobados en la actualidad.
En el recién nacido, la anfotericina B se ha utilizado ampliamente. A esa edad, este fármaco se metaboliza con mucho menos efectos tóxicos que en el paciente adulto. En los recién nacidos prematuros y de bajo peso de nacimiento, a diferencia de los adultos, la anfotericina B traspasa la barrera hematoencefálica y permite obtener buenos niveles en el líquido cefalorraquídeo; luego, una meningitis por Candida en un recién nacido tiene mejor pronóstico que en un paciente leucémico. La toxicidad renal de la anfotericina B se puede controlar con la administración constante de un volumen mínimo de sodio de 4 mEq/kg/día, aunque esta sobrecarga salina, que se administra en pacientes con cáncer y otras patologías, no se ha comprobado en el recién nacido, por temor a una eventual insuficiencia cardiaca. Esta situación se analizó últimamente en la revista Pediatrics. En casos de meningitis se agrega la 5 fluorcitosina, fármaco que no es útil si se administra solo; hay que asociarlo siempre con anfotericina B.
En cuanto al fluconazol, algunos trabajos han demostrado mejor sobrevida en el recién nacido de muy bajo peso cuando se administra este fármaco como profilaxis; no hay experiencia con voriconazol y caspofungina. En las inmunodeficiencias primarias y secundarias hay mucho más material publicado; es más, en algunos estudios publicados en 2004 se demostró que hay una pequeña población de niños en la cual el voriconazol, solo o asociado con caspofungina, o la caspofungina, son mejores alternativas que la anfotericina B sola.
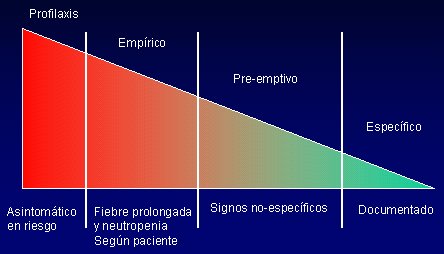
En pediatría, el ideal es administrar el tratamiento según categorías de riesgo (Figura 6), de menor a mayor certeza; se trata de acercarse lo más posible a un diagnóstico específico, a sabiendas de que no siempre se puede esperar hasta conseguir este objetivo para tratar al paciente; por ejemplo, en el caso de un enfermo oncológico, no se puede aplazar el tratamiento hasta aislar el hongo. En algunos casos habrá que administrar una profilaxis; en otros, habrá que dar tratamiento empírico, basado en factores de riesgo como fiebre prolongada, neutropenia u otros, como en el caso del recién nacido, pero todo depende del paciente. El ideal es llegar al tratamiento preventivo, que se instaura cuando hay signos que no son absolutamente específicos, pero sí muy sugerentes de una infección por hongos. En el empírico, la fiebre prolongada puede ser por hongos o por otra etiología. Si se administra profilaxis a todos los pacientes, se va a seleccionar cepas resistentes, va a cambiar la flora fúngica del hospital y van a ocurrir infecciones muy graves.
Figura 6. Tratamiento antifúngico por categorías de riesgo.
El tratamiento empírico, en el recién nacido, se considera en los casos en que es muy probable que el paciente tenga una infección por hongos:
Los catéteres traen riesgos a los recién nacidos. La Candida invade al recién nacido no sólo por la piel; en el enfermo oncológico se pueden desarrollar grandes poblaciones de Candida dentro del tubo digestivo, desde el cual puede pasar a través de la célula e invadir distintos parénquimas. Se puede encontrar este hongo en sondas de alimentación o catéteres, a los cuales se adhieren mediante el glicocálix, de tal forma que es imposible sacarlo; si no se retira el catéter, los hongos van a continuar su siembra en el torrente sanguíneo. Al parecer, la caspofungina tendría mayor efecto sobre el glicocálix, en comparación con los fármacos que usamos ahora.
La resistencia depende de factores del hospedero, del hongo y del fármaco.
Un ejemplo es el caso de un adulto de 21 años, portador de SIDA, que presentó candidiasis orofaríngea, por lo que su médico tratante le indicó fluconazol, pero el paciente terminó resistente a todo tipo de azoles, y por este motivo se hospitalizaba de vez en cuando, para ser tratado con anfotericina B. Para mejorar la calidad de vida del paciente, el médico decidió no volver a hospitalizarlo y le indicó tomar una tableta de nistatina al día. El paciente se fue a su casa con esta indicación. Nosotros eliminamos de su dieta el azúcar que utilizan los hongos y le indicamos otro tipo de azúcar que los hongos no utilizan; a los siete días se evidenció una mejoría significativa del cuadro. El enfermo siguió ese régimen durante mucho tiempo, asociado con una tableta de nistatina al día, y se logró controlar su candidiasis. Está claro que se trata de un problema multifactorial que se debe enfrentar desde distintos ángulos.
En cuanto a los factores del hongo, en una revisión de infecciones por Candida que ocurrieron durante 18 años en enfermos oncológicos del Hospital St. Jude en Memphis, se encontró a 12 pacientes con meningitis por Candida; el agente causal de todas ellas, salvo una, fue C. tropicalis. Todos los pacientes murieron por la meningitis, o sea, el diagnóstico de meningitis por Candida es muy grave en pacientes de este tipo. Tal vez un caso quirúrgico, en que la vía de entrada de la Candida sea la herida quirúrgica, y en que actúen otros factores como la inmunidad del paciente, se pueda recuperar, pero en los pacientes oncológicos es mucho más improbable (Clin Infect Dis 2000; 31:451-7).
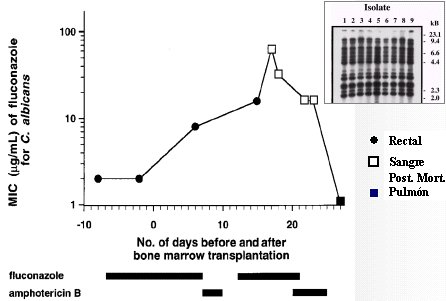
La variabilidad genética del hongo es otro factor; en este paciente, la CIM fue variable en los distintos aislamientos de Candida. En el caso de un paciente adulto con trasplante de médula ósea, del cual post mortem se tomó cultivos rectales, de sangre y de pulmón; en todos los aislamientos se encontró la misma especie. A estos aislamientos se les hizo estudio genético, el que demostró variaciones que determinaron un cambio en la resistencia al fluconazol (Marr et al. Clin Infect Dis 1997;25:908) (Figura 7).
Figura 7. Resistencia a fluconazol intratratamiento.
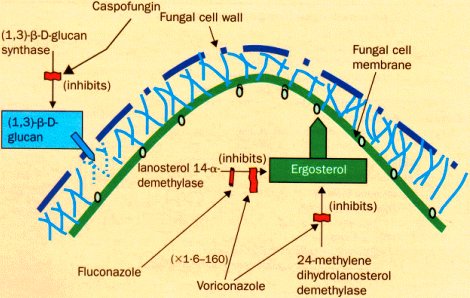
Los nuevos fármacos traen nuevas esperanzas. La caspofungina actúa en la pared celular y el voriconazol inhibe la síntesis del ergosterol de la membrana; algunas infecciones resistentes a fluconazol son sensibles a voriconazol, porque el primero actúa sólo en una enzima de la síntesis de ergosterol y el voriconazol actúa en dos sitios distintos. A raíz de estos distintos mecanismos de acción se originó la hipótesis de que la asociación de caspofungina y voriconazol, o de anfotericina B y voriconazol son sinérgicas (Lancet Infect Dis 2002;2:550-63) (Figura 8).
Figura 8. Mecanismo de acción de fluconazol, voriconazol y caspofungina.
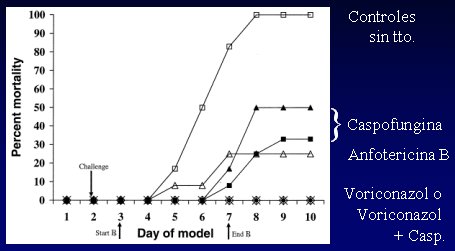
Hay muchos modelos animales, pero destaca por su gravedad la mortalidad de la aspergilosis, en cuyes tratados con distintos antifúngicos y combinaciones. Los resultados del tratamiento de cuyes con una inyección de conidias de Aspergillus son los siguientes (Figura 9): 100% de los controles sin tratamiento murieron; los que recibieron caspofungina sola, en dos dosis distintas, murieron; en los que recibieron sólo anfotericina, la mortalidad fue un poco menor; pero los que recibieron voriconazol, o voriconazol más caspofungina, sobrevivieron (Kirkpatrick et al. AAC 2002;46:2564). Esto plantea que la combinación de voriconazol con caspofungina es realmente eficaz en el tratamiento de las micosis. En 2004 se publicó un estudio en pacientes trasplantados que confirmó este resultado.
Figura 9. Mortalidad por aspergilosis en cuyes tratados con distintos antifúngicos y combinaciones.
En un estudio publicado en 2002 se describe a 69 pacientes pediátricos tratados con voriconazol; por desgracia, no hay ningún estudio comparativo de voriconazol versus anfotericina B, etc. En este estudio, los pacientes recibieron voriconazol como salvataje; eran niños de 8 años de edad, en promedio, con una mediana de 7 y rango entre 9 meses y 15 años. En la mayoría de los casos participaron porque eran refractarios o intolerantes a la terapia antifúngica tradicional; 93% de estos niños recibieron voriconazol como última opción. Del total de pacientes, 58 fueron totalmente evaluables; 72% tuvieron Aspergillus, 14% Scedosporium y 7% Candida, es decir, era una población de niños graves. La mayoría de ellos tenían trasplante de médula ósea, enfermedad granulomatosa crónica y diálisis. El fármaco se indicó como tratamiento primario en la minoría de los casos y, por falla de tratamiento, en la gran mayoría; en estos últimos, la respuesta al tratamiento, completa o parcial, fue de 45%; todos ellos hubieran muerto con la terapia convencional, pero 45% de ellos sobrevivieron con esta droga nueva. En la aspergilosis del sistema nervioso central, que es una enfermedad 100% mortal, entre 6 pacientes, 3 tuvieron al menos una respuesta parcial; ésta se combinó con cirugía y sobrevivieron (Walsh, Pediatr Infect Dis 2002; 21:240).
El gran temor que surge de la administración de voriconazol en recién nacidos son los efectos oculares, porque a esta edad la retina se está desarrollando y el fármaco contiene un compuesto que actúa en la síntesis de esteroles. Algunos de estos niños experimentaron efectos oculares menores, como dolor leve y prurito; de los que recibieron 6 mg/kg, 2 pacientes sufrieron efectos visuales adversos, lo mismo que 6 de los que recibieron 4 mg/kg cada 12 horas. En general, los problemas visuales aparecieron con la primera dosis de voriconazol, pero después cedieron. En recién nacidos, por desgracia, es necesario esperar y se debe conocer bien la droga antes de administrarla.
Es muy importante no extrapolar los resultados de los estudios clínicos de adultos a los niños, ya que éstos eliminan más rápidamente el voriconazol y, por lo tanto, es probable que necesiten dosis mayores para mantener niveles plasmáticos eficaces. Si se extrapolan las dosis pediátricas a las que están comprobadas como eficaces en el adulto, para alcanzar el área bajo la curva requerida sería necesario administrar una dosis de 10 a 11 mg/k/día, lo que es mucho. Por tanto, no se debe indicar un antibiótico que no está bien estudiado en niños. La calidad de estas nuevas drogas merece estudios adecuados y esperamos que ellos se realicen cuanto antes, para determinar la dosis adecuada en las distintas poblaciones. Los recién nacidos, probablemente, tendrán requerimientos muy distintos a los del niño mayor y quizá se parezcan más a los del adulto.
La anfotericina B deoxicolato sigue siendo el fármaco de elección para el tratamiento empírico de las micosis pediátricas. Los niños la toleran mejor que los adultos y la administración sostenida de sodio disminuye su toxicidad.
El voriconazol y la caspofungina aparecen como mejores alternativas y podrían ejercer un gran impacto en el tratamiento de las micosis en los próximos años, pero faltan más estudios para recomendarlos como fármacos de primera línea en pediatría, sobre todo en recién nacidos, con las consideraciones farmacocinéticas adecuadas.
Hay que evaluar la terapia combinada in vitro, in vivo, en modelos experimentales y en estudios clínicos controlados, antes de su uso generalizado en pacientes. De hecho, hay resultados conflictivos entre las evaluaciones in vitro y los resultados de modelos animales; sólo después de superar con éxito estos últimos está permitido pasar a la etapa de estudios en pacientes, y eso varía según el fármaco.









 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
 Expositor:
Sergio Vargas[1]
Expositor:
Sergio Vargas[1]

Citación: Vargas S. Systemic fungal infections in pediatric patients. Medwave 2005 Oct;5(9):e3553 doi: 10.5867/medwave.2005.09.3553
Fecha de publicación: 1/10/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión