Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
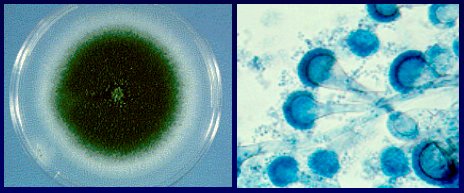
Aspergillus sp, cuya morfología se aprecia en la Figura 1, es el hongo filamentoso más importante en pacientes trasplantados; entre ellos, A. fumigatus es el más importante, aunque la incidencia de Aspergillus no fumigatus y de otros hongos, como Fusarium, ha ido aumentando. El cambio de especies que se está viendo en infecciones por Candida también está ocurriendo con los hongos filamentosos.
Figura 1. Aspergillus spp.
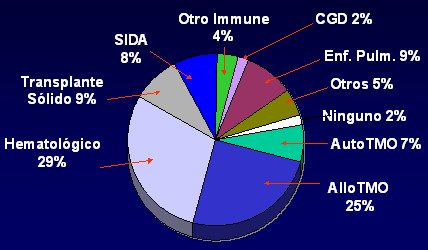
La incidencia de aspergilosis invasiva en los distintos trasplantes sólidos es de 9%; en el trasplante de médula ósea es 7% y en el trasplante alogénico, 25%. En consecuencia, además de los neutropénicos, que es un grupo muy importante, a los trasplantados de médula ósea o de órganos sólidos corresponden 40% a 50% de los casos de aspergilosis (véase Figura 2). En la medida en que se creen programas de trasplante en los países en desarrollo, esta situación va a aumentar (Patterson, et al, Medicine 2000;79:250–60.
Figura 2. Aspergilosis invasiva (n = 595).
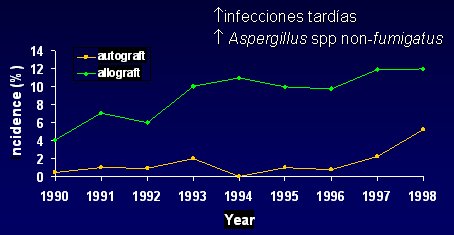
Han aparecido infecciones por Aspergillus no fumigatus y un grupo nuevo, constituido por infecciones tardías en los trasplantados de médula ósea. En la Figura 3, correspondiente a un estudio de Marr, se observa la ocurrencia de aspergilosis en el tiempo después de un trasplante de médula ósea y se puede ver que después del día 180 ocurre un repunte de las infecciones por Aspergillus. Por tanto, estas infecciones no se observan sólo durante la neutropenia sino también en períodos alejados.
Figura 3. Infecciones fúngicas en TMO. Aumento de la aspergilosis. Marr KA et al., Clin Inf Dis, 2002, 34:909.
No todos los receptores de órganos sólidos presentan el mismo riesgo de aspergilosis invasiva. La incidencia es de 1% a 8% en hígado, 3% a 14% en pulmón, 1% a 10% en corazón y muy baja en riñón. Lo importante es que en el hígado el tiempo de inicio es muy precoz, con un promedio de 17 días después del trasplante, y que la infección tiende a diseminarse y a comprometer el sistema nervioso central, con una mortalidad muy elevada (87 %), como es habitual en la aspergilosis.
Los factores de riesgo de aspergilosis invasiva dependen del tipo de trasplante. En el trasplante hepático, presentan aspergilosis invasiva los retrasplantados y los pacientes que se trasplantan y caen en diálisis; en el trasplante de corazón, la reoperación, la diálisis y la infección por citomegalovirus son factores que aumentan varias veces el riesgo. En el caso del pulmón, por motivos no aclarados, cuando se trasplanta un solo pulmón aumenta el riesgo de la aspergilosis invasiva; los factores de riesgo son infección concomitante con citomegalovirus, rechazo, aumento de la inmunosupresión, bronquiolitis obliterante (una patología del trasplantado de pulmón) y la colonización previa con Aspergillus.
Sin embargo, desde un punto de vista más general, la aspergilosis invasora tiene dos factores de riesgo significativos, que son válidos para todas las situaciones: la exposición o colonización y la inmunosupresión. La combinación de estos dos factores es lo que finalmente condiciona el desarrollo de una aspergilosis invasiva.
La exposición o colonización se relaciona con las condiciones y la calidad del aire al interior de los hospitales y la presencia de plantas, fruta fresca, etc. El aspecto de las construcciones es muy relevante, ya que se presenta en la mayoría de los hospitales. La inmunosupresión se debe a la neutropenia prolongada; los esteroides; GVHD, como factor de riesgo muy significativo; la edad avanzada; y el trasplante hepático y de pulmón. Sin embargo, se ha descrito nuevos factores de riesgo, específicos de los trasplantados, como el uso de fluconazol.
En un estudio realizado en trasplantados de médula ósea se comprobó que la incidencia de infecciones por hongos filamentosos aumentó de 18%, antes de la instauración de profilaxis con fluconazol, a 29%, después de ella. La profilaxis con fluconazol fue un factor predictor independiente de infección por hongos filamentosos (Van Burik, Medicine 77:246, 1998).
En trasplante hepático también se ha documentado el aumento de las aspergilosis secundario a la profilaxis sistemática con fluconazol; Fortun describió un aumento de la aspergilosis a 8% en 101 pacientes, frecuencia alta en trasplante hepático, al utilizar esta profilaxis (Fortun Europ J Clin Microbiol Inf Dis 16:314, 1997). Por tanto, el fluconazol puede disminuir las infecciones por Candida, pero favorece el desarrollo de hongos filamentosos, aspecto que hay que tener en cuenta.
El otro factor de riesgo, muy importante en el trasplante de médula ósea, es la GVHD intestinal, que está demostrada como factor de riesgo significativo de aspergilosis invasora; no así la GVHD de hígado y de piel. Por otro lado, la GVHD de alto grado también se ha demostrado como factor de riesgo significativo (Walsh, et al. ICAAC 2002. Abstract M1233).
En este momento, en el Hospital de la Universidad Católica, hay un paciente trasplantado de médula ósea que evolucionó muy bien, se fue de alta a las tres semanas, pero alcanzó a estar dos semanas en su casa y presentó un cuadro respiratorio, precedido de diarrea y vómitos. Actualmente lleva un mes hospitalizado; los vómitos y las molestias altas cesaron, pero sigue con diarrea; en la endoscopía alta y la colonoscopía sólo se encontró inflamación de todo el tubo digestivo. Se ha ido subiendo la inmunosupresión de manera progresiva, lo que aumenta el riesgo. Se monitorizó para citomegalovirus dos veces por semana y finalmente la antigenemia se hizo positiva, de tal manera que su estado es muy grave. El paso siguiente sería la aspergilosis pulmonar, razón por la cual se está monitorizando de cerca. Cuando la GVHD intestinal es tan intensa, tiene un pronóstico bastante reservado.
Otro factor de riesgo nuevo de aspergilosis invasiva es el infliximab, que neutraliza la actividad de TNF alfa y es un potente inmunosupresor; en algunos pacientes que han necesitado infliximab se ha “incendiado” la aspergilosis invasiva. En un estudio realizado en 270 pacientes con trasplante alogénico de médula ósea, hubo 52 GVHD de grado III-IV y 16 infecciones invasoras por hongos. En 11 pacientes se utilizó infliximab para tratar este cuadro: 2 de ellos murieron por complicaciones de GVHD y 6 de los 9 restantes (67%), presentaron aspergilosis invasora; es decir, casi dos tercios de los pacientes con infliximab, en el contexto clínico de GVHD grave, presentaron aspergilosis invasora. En pacientes con GVHD, las infecciones fúngicas filamentosas invasoras aumentaron notablemente con infliximab: 6/11 versus 4/41 sin infliximab, con un riesgo relativo de 5,59 (Marty, et al., ICAAC 2002. Abstract M1234).
Un ejemplo de lo anterior es el caso de un joven de 18 años con GVHD intestinal, hepática y cutánea; por sus condiciones se aumentó de manera rápida la inmunosupresión, hasta llegar a infliximab un día viernes; el martes siguiente murió por una aspergilosis invasora. El día viernes empezaron a aparecer nódulos, el fin de semana se fue a la UTI y falleció a los cinco días, con compromiso del sistema nervioso central. En suma, el infliximab es muy potente como factor de riesgo de aspergilosis invasora.
Otro caso es el de una paciente que se trasplantó de hígado y estuvo varios días en la UCI, por diversas complicaciones; finalmente salió de la UCI y pasó a intermedio, pero volvió en estado muy grave con una aspergilosis que se incendió rápidamente. No teníamos antecedentes de pacientes neutropénicos con aspergilosis, con compromiso del SNC, diseminada o cutánea; este caso fue excepcional. También falleció. Su caso impresionó por la precocidad y agresividad con que se presentó, a pesar de que estaba dentro de lo descrito, en cuanto a que, en el trasplante hepático, la aspergilosis ocurre precozmente, dentro del primer mes, y en 30% a 60% de los casos se presenta como una infección diseminada con compromiso del sistema nervioso central, con 90% de mortalidad.
El panorama ha cambiado de manera importante, en el último tiempo, en los centros que realizan gran cantidad de trasplantes. Datos recogidos durante los períodos de 1993 a 1995 y de 1999 a 2002 demuestran que la infección diseminada en trasplante hepático bajó de 62% a 30%, el compromiso del SNC prácticamente desapareció y la presentación dejó de ser tan precoz, ya que en 23% de los casos se presentó después de 90 días postrasplante. Además, 55% de los enfermos sobrevivieron, es decir que la mortalidad bajó de 90% a 60%.
Cuando se analizó las características de estas cohortes, comparando la inicial y la final, se comprobó que los pacientes actuales están menos graves, tienen menos deficiencia renal y menos deficiencia hepática que los de la primera cohorte. Además, ha cambiado de manera significativa la terapia inmunosupresora; se está usando mucho más tacrolimus, donde antes se usaba más ciclosporina. Es probable que lo anterior haya influido en el cambio anotado, junto con un tratamiento más precoz, porque la precocidad y la acuciosidad diagnósticas han mejorado. En el último tiempo se ha empezado a utilizar nuevas terapias, pero probablemente no alcanzaron a influir en estos datos.
El tacrolimus baja la inmunidad, pero tiene otras características. Los inhibidores de la calcineurina son antibióticos aislados desde hongos; la ciclosporina A es un péptido cíclico y el tacrolimus es un macrólido, ambos, como muchos antibióticos, aislados de hongos, ayudan a frenar una infección. Los inhibidores de la calcineurina tienen actividad natural contra Aspergillus, como se ha comprobado en varios trabajos de laboratorio. Además, se ha probado que existe sinergismo entre tacrolimus y caspofungina; en cambio, entre ciclosporina y caspofungina ocurre inhibición; por tanto, el tacrolimus no competiría con el antifúngico sino, por el contrario, sus actividades se potencian.
La actividad de caspofungina contra Aspergillus aumenta con ciclosporina, tacrolimus y otros medicamentos más nuevos, como la rapamicina; la combinación de tacrolimus y caspofungina sería más potente, de manera que aparece todo un campo nuevo de acción y de investigación en el área de los inmunomoduladores y su asociación con antifúngicos.
Para prevenir las infecciones por hongos filamentosos en los pacientes de este tipo, es clave el manejo de la inmunosupresión, ya que el riesgo aumenta cuando ésta sube. Además, se debe hacer un manejo adecuado de las construcciones y de los sistemas de aire. En cuanto al aislamiento protector, ya no aparece en las normas del CDC; se ha cambiado por el concepto de ambiente protegido, que se refiere a las condiciones del aire en la pieza. Lo dicho se encuentra en las últimas guías del CDC para trasplante de médula ósea, que están en revisión, pero que serán publicadas pronto.
Está demostrado que el traslado con mascarilla fuera de la pieza, en especial en hospitales con construcciones, disminuye el riesgo de aspergilosis; todo paciente que sale de su pieza debe utilizar este elemento, porque el mecanismo de adquisición del Aspergillus es por vía respiratoria, por contaminación del aire (Raad I., ICHE, 2002, 23:41). En los trasplantes de pulmón, puede venir en el injerto o de una colonización de la vía aérea, pero es menos frecuente. El flujo laminar permite hasta 400 cambios de aire por hora y el filtro HEPA elimina 99,97% de las partículas menores de 0,3 micrones de diámetro (Bodey G., Appl Micribiol, 1971,22:828). Los resultados en prevención de la infección bacteriana son controvertidos, pero no afectan la mortalidad; en cambio, está demostrado su valor en la disminución de la aspergilosis invasora (Barnes RA., J. Hosp Infect. 1989,14:8).
En otro estudio se midió el aire, fuera del hospital y dentro de él, en un lapso en que había sectores en construcción y en otro lapso en que no los había y se observó que la contaminación por Aspergillus disminuía paulatinamente al ir avanzando desde el exterior hacia el hospital, la sala, las unidades oncológicas y las piezas, con el filtro HEPA; además, se observó un aumento durante los períodos de construcción (Weber SF, ICHE, 1990,11:235).
La guía antigua del CDC (MMWR: Guidelines for preventing opportunistic infections among cell transplant recipients. CDC, Oct 2000), establece las siguientes recomendaciones para lograr un ambiente protegido:
Lo dicho no es lo mismo que el aislamiento protector, que corresponde a la vestimenta con mascarilla, botas y gorro para entrar a ver a estos enfermos.
La mortalidad y la gravedad aumentan en la medida en que se pasa del estado de colonización al aspergiloma, la traqueobronquitis y las infecciones invasivas. Todos estos cuadros se ven en los pacientes con trasplante de pulmón. El diagnóstico es muy difícil; la sospecha clínica es generalmente la que manda, tanto en infecciones por Candida como en infecciones por Aspergillus, aunque el apoyo de imágenes, sobre todo en hongos filamentosos, es muy importante. No existe un test diagnóstico para Candida; la serología es poco útil, el rendimiento de los cultivos es pobre y la colonización es de difícil interpretación. Para Aspergillus, últimamente, han sido útiles la serología y las imágenes.
El galactomanano es conocido en Aspergillus y se ha estado aceptando en pacientes neutropénicos y trasplantados de médula ósea. La sensibilidad oscila entre 67% y 100%, y la especificidad también es relativamente buena. Se recomienda hacerlo seriado, dos o tres veces por semana, con ciertos puntos de corte más o menos establecidos. El test positivo puede preceder la aspergilosis invasiva hasta en una o dos semanas, de tal manera que sería un buen aporte para el diagnóstico más precoz en estos pacientes. En los otros trasplantes la sensibilidad cae a 50%; la especificidad sigue siendo buena en trasplante hepático, pero en trasplante de pulmón la sensibilidad es de 30%. Los rendimientos obtenidos en neutropenia y trasplante de médula ósea no son válidos para estos otros tipos de trasplante. Aún falta información, pero no se ve tan prometedor como en médula ósea. La mortalidad depende del trasplante; en general va de 90%, en médula ósea, para la aspergilosis invasora, a 60% a 90% en otros trasplantes. En nuestra casuística es muy alta, porque los casos son pocos, pero muy graves.
En cuanto a tratamiento, los nuevos antifúngicos han cambiado el pronóstico de los enfermos, en los últimos años, pero han aumentado los costos, lo que ha repercutido, a su vez, en los seguros de salud. En nuestro medio, las aspergilosis invasoras en pacientes con trasplante de médula ósea, que son los más inmunosuprimidos, se tratan con lo que haya disponible y se consideran infecciones de pésimo pronóstico. En general, todos estos pacientes ya han fracasado con anfotericina.
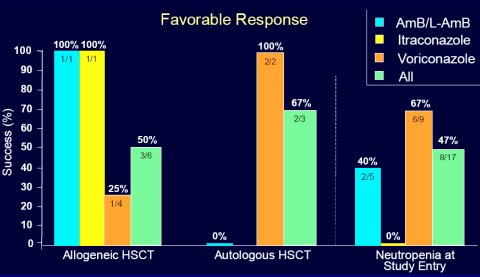
Maertens publicó en ICAAC, en 2004, datos que reflejan muy bien nuestra situación. El autor analizó el impacto de asociar caspofungina con anfotericina B liposomal, caspofungina con itraconazol y caspofungina con voriconazol. En nuestro hospital, el pronóstico, en el grupo de pacientes con neutropenia, ha mejorado por sobre 50%; Maertens obtuvo los mismos resultados, e incluso mejores. En trasplante de médula ósea, la sobrevida fue de 50% en alogénico y 70% en trasplante autólogo, con aspergilosis invasora (véase Figura 4). Esto refleja la tendencia del pronóstico; no significa que se deba utilizar terapias combinadas en todos los pacientes, pero sí en aquellos cuya situación es muy crítica, lo cual se refleja en este estudio (Maertens, Glasmacher, Herbrecht; ICAAC 2004, Abstract 3718).
Figura 4. Estudio multicéntrico, no comparativo, de caspofungina combinada con otros antifúngicos en adultos con aspergilosis invasiva refractaria o intolerancia a regímenes estándar. J Maertens, A Glasmacher, R Herbrecht, et al. ICAAC 2004, Abstract 3718).




 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada del Curso de Actualización en Micología Médica, Infecciones Fúngicas Invasoras y Nosocomiales, organizado por el Instituto de Ciencias Biomédicas (ICBM) de la Universidad de Chile entre los días 29 de noviembre al 1 de diciembre de 2004.
Director del Curso: Dr. Víctor Silva, MSc.,PhD.
Coordinadora del Curso: Dra. Lily Contreras.
Edición científica: Dr. Víctor Silva.
 Expositor:
Jaime Labarca[1]
Expositor:
Jaime Labarca[1]

Citación: Labarca J. Epidemiology, prevention and management of fungal infections in transplant patients (part II). Medwave 2005 Jun;5(5):e3552 doi: 10.5867/medwave.2005.05.3552
Fecha de publicación: 1/6/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión