Resumen
Este texto corresponde a un trabajo de revisión preparado por sus autores en el desarrollo del Curso y Seminarios de Oncología Básica, realizado por el Centro de Oncología Preventiva y la Escuela de Postgrado de la Facultad de Medicina de la Universidad de Chile entre abril y agosto de 2006. El Director del Curso es el Dr. José Manuel Ojeda.
Introducción
La investigación del cáncer ha ido evolucionando a lo largo de los años; en esta evolución los objetivos de estudio han sido múltiples y han ido adaptando e integrando los nuevos conocimientos y metodologías adquiridos por la ciencia. En 1971, Judah Folkmann inició el estudio de la angiogénesis del cáncer, postulando algunos de los principios que aun hoy señalan las vías de estudio y aplicaciones terapéuticas de la angiogénesis. Folkmann demostró que el crecimiento del tumor es dependiente de la angiogénesis y que si un tumor no es capaz de desarrollarla, no crecerá más allá de 2 a 3 mm. Es así que en los últimos 10 a 15 años se han enfocado tecnologías y recursos sobre el objetivo de conocer la biología de la angiogénesis y su implicancia como factor pronóstico o alternativa terapéutica para el cáncer.
La angiogénesis como proceso biológico
La angiogénesis se define como la formación de vasos sanguíneos a partir de una red preexistente, para diferenciarla de la vasculogénesis, que es la formación de vasos sanguíneos
de novo. En el embrión, los vasos sanguíneos proveen a los órganos en crecimiento con el oxígeno necesario para desarrollarse. Aparte de la función de nutritiva, los vasos sanguíneos también proveen de factores tróficos para promover la morfogénesis de los órganos.
Los vasos sanguíneos provienen de precursores endoteliales que comparten origen con precursores hematopoyéticos; estos progenitores se ensamblan en un laberinto vascular primitivo de pequeños capilares (vasculogénesis). Ya en esta etapa, las células de esta red primitiva van adquiriendo características de células arteriales o venosas, indicando la especificidad de las células endoteliales y la regulación genética de estas características.
Luego de que el plexo vascular primitivo está formado, se generan más células endoteliales para formar nuevos capilares, por brotes o por división de estos vasos sanguíneos. Es posible diferenciar dos tipos de angiogénesis:
angiogénesis por brotes y no-brotes (
sprouting y unsprouting). La por brotes también se llama
por yemación y la que no involucra nuevos brotes de vasos también se llama
por intususcepción. Se distingue una serie de etapas en la conformación de nuevos vasos: primero se inicia con una disrupción de la membrana basal; luego hay una migración de las células endoteliales a través de la matriz, junto a proliferación de ésta; posteriormente estas células se agrupan y canalizan; se restablece la membrana basal y las adhesiones endoteliales; por último, se restablece el flujo. Por otra parte, en la angiogénesis por no-brotes o intususcepción la formación de vasos a partir de otros preexistentes es por medio de la separación de vasos por pilares transcapilares o postes de matriz extracelular; fue por primera vez descrita en pulmón de embriones.
In vivo, la angiogénesis que no es por brotes ocurre por proliferación de células endoteliales dentro de un vaso, produciendo un abertura central que va a dividir a los capilares por medio de pilares transcapilares o por fusión y división de capilares. El tipo de angiogénesis va a depender del órgano o tejido especifico; en cerebro se produce principalmente por brotes y en pulmón por no-brotes, sin embargo en ocasiones es posible ver ambos tipos a la vez.
La regulación de la angiogénesis se realiza mediante un complejo balance entre factores angiogénicos y antiangiogénicos, y se habla de
complejo balance porque la familia de proteínas y receptores y células implicadas en la angiogénesis son varias. En el adulto, las células endoteliales se encuentran en estado de reposo (G0) y tienen una vida promedio de 1200 días; sin embargo, la capacidad de angiogénesis se mantiene en forma fisiológica, ya sea, por ejemplo, para la reparación de heridas o la renovación del endometrio, manteniendo la secuencia descrita previamente, salvo por el hecho de que previo a iniciar la angiogénesis hay una serie de etapas previas, en las cuales se disgregan la adhesiones y uniones de la células endoteliales, hay inducción de actividades proteolíticas para la degradación de la membrana basal y la matriz extracelular y se produce la neutralización de las vías de inhibición de la angiogénesis.
A continuación se revisarán las vías mayores de señalización en la angiogénesis tumoral.
Receptores VEGF/VEGF
La angiogénesis es fundamental en los procesos fisiológicos del adulto, requiriendo una acción coordinada de una variedad de factores de crecimiento y moléculas de adhesión celular en las células endoteliales y para-endoteliales. Es así que el VEGF-A y su receptor es la vía de señalización más estudiada y comprendida, actualmente, en el desarrollo de la angiogénesis. La pérdida de un alelo de VEFG-A induce letalidad embrionaria y varios estudios han demostrado el rol de VEFG-A en la angiogénesis tumoral. VEFG-A es capaz de unirse a dos receptores asociados a tiroxina-kinasa (KTR), el VEFGR-1 (Flt-1) y VEFGR-2(KDR, flk-1), de los cuales el VEFGR-2 es el que está más implicado como mediador mitogénico y angiogénico, aumentando la permeabilidad vascular.
La importancia de VEFGR-1 es más complicada, ya que bajo ciertas condiciones su función es de un receptor regulador que termina secuestrando VEFG, evitando que éste se una a VEFGR-2; sin embargo, hay creciente evidencia de su rol en la hematopoyesis y como reclutador de monocitos y otras células provenientes de la médula ósea, que llegan a la vasculatura del tumor y promueven la angiogénesis. Además, el VEFGR-1 está involucrado en la inducción de metaloproteinasa de matriz (MMPs) y en la liberación de factores de crecimiento desde células endoteliales en forma paracrina. En estos procesos se ha identificado al VEGF-B y al factor de crecimiento ligado a placenta (PlGF), que estarían interactuando con VEFGR-1. Aún más, el VEFGR-1 puede, en ciertas ocasiones, ser utilizado por las células tumorales para mediar vías implicadas en señales quimiotácticas, lo cual expande el rol de este receptor.
La expresión de VEFG-A es estimulada por hipoxia, por la transcripción del factor inducido por hipoxia HIF, el cual es regulado por el gen supresor de tumores von Hippel–Lindau (VHL). En condiciones normooxigenadas, la proteína del gen VHL se encarga de ubiquitinizar HIF, permitiendo su degradación. Estudios de hibridización
in situ han demostrado un aumento en la expresión del mRNA de VEFG-A en muchos tumores. La expresión de VEFG-A es particularmente alta en células de carcinomas renales, consistentemente con la noción de que el gen VHL está inactivado por mutaciones en 50% de estos tumores, lo que a su vez explica la alta respuesta de estos tumores a bloqueadores de VEFG-A. Sin embargo, la sobreexpresión de VEFG-A también incluye mutaciones en una serie de otros oncogenes, como ras, erbB-2/Her2, EGFR activado y bcr-abl.
Factor de crecimiento derivado de plaquetas (PDGF) y angiopoyetinas
Otras moléculas implicadas en la señalización para el desarrollo y diferenciación de vasos son el PDGF-B/PDGFR-beta y las angiopoyetinas (Ang), que son ligandos del receptor Tie2. El PDGF-B es necesario para el reclutamiento de pericitos y la maduración de la microvasculatura. La inhibición de la vía de PDGFR-beta ha resultado en un árbol microvascular en tumores, árbol que es altamente dependiente de VEFG para mantener su sobrevida; el retiro del VEGF-A lleva a apoptosis endotelial y regresión vascular y en este contexto, los vasos que se han formado recientemente, asociados o no a tumor, son altamente sensibles al bloqueo de VEGF, mientras que los vasos ya maduros, cubiertos por una membrana basal y pericitos, son resistentes a inhibidores de VEGF y factores antiangiogénicos. En este hecho subyace la especificidad del tratamiento antiangiogénico, por la irrigación del tumor, que normalmente se mantiene en forma bastante precaria, sin llegar a madurar completamente.
Por otra parte, recientes estudios han enfatizado la importancia de las señales de PDGF-A (y potencialmente de PDGF-C) y PDGFR-alfa en el reclutamiento de productos angiogénicos desde el estroma, que son inducidos por VEGF-A y otros factores angiogénicos. Se requiere de la angiopoyetina Ang-1 para la remodelación y maduración inicial de vasculatura inmadura. A diferencia de los embriones de ratón sin VEGF-A, la pérdida de Ang-1 o su receptor Tie2 los hace capaces de desarrollar una vasculatura primaria normal, pero ésta falla luego en lograr un modelamiento y maduración adecuados. Está aceptado generalmente que Ang-1 es el principal agonista de Tie2 y que Ang-2 actúa como antagonista o agonista parcial de Tie2, pero informes recientes han demostrado un efecto proangiogénico de Ang2, ya que el uso de inhibidores de Ang2 en tumores ha llevado a una disminución en el crecimiento tumoral, junto con una reducción de la proliferación endotelial.
Factores antiangiogénicos
La angiogénesis es un proceso altamente regulado, mediante un complejo balance entre factores pro y antiangiogénicos. Se ha identificado una serie de reguladores antiangiogénicos, sin embargo, aun no se sabe cómo actúan o su rol en la regulación fisiológica de la angiogénesis. La trombospondina es una larga glicoproteína multifuncional, secretada por la mayoría de de las células epiteliales en la matriz extracelular, que inhibe la angiogénesis asociada al crecimiento tumoral y metástasis. Ésta es clivada en una serie de dominios con actividad antiangiogénica, que se conocen como angiostatina. Muchos fragmentos de proteínas, en general asociadas a la matriz extracelular, se han descrito como inhibidores endógenos de la angiogénesis; es el caso de endostatina, tumstatina, vasostatina y de los más recientes inhibidores como vasohibina, que deriva del endotelio. Se han postulado muchas hipótesis acerca del mecanismo de acción de estas proteínas, incluyendo la unión específica a integrinas, en el caso de endostatina y tumstatina. Un hecho interesante de destacar es que los factores angiogénicos tienen una vida media muy corta, a diferencia de los factores antiangiogénicos endógenos, lo que hace que se acumulen inhibidores en sitios distantes del tumor primario y que la resección de éste remueva la fuente de estos inhibidores, permitiendo el crecimiento de metástasis.
Angiogénesis en cáncer: switch angiogénico
Para iniciar la neovascularización, el tumor debe hacer un
switch hacia un fenotipo angiogénico, lo que se puede deber a cambios genéticos en las células tumorales en respuesta a estrés local, incluyendo la hipoxia. Estudios en modelos transgénicos que reproducen las distintas etapas histológicas del tumor sugieren que la adquisición del fenotipo angiogénico ocurre tempranamente en la progresión del tumor. Las evidencias disponibles en muestras de tejido humano apoyan este modelo. Los oncogenes y genes supresores de tumor más comunes asociados a la transformación de células neoplásicas tienen también un rol en la activación del
switch angiogénico. Más aún, en los mutantes de p53 se ha reportado un aumento en las concentraciones de VEFG, mientras en los p53 salvajes hay una disminución en la producción de VEFG, a la vez que hay un aumento en las concentraciones de trombospondina-1.
Las células del tumor inducen angiogénesis en un proceso similar al de angiogénesis normal. La angiogénesis del tumor también es mediada por las moléculas generadas por las células del tumor y las células circundantes, tales como pericitos y monocitos. El VEGF, Ang2, y FGF están implicados en la angiogénesis del tumor, pero en concentraciones más altas que en la angiogénesis de tejido normal. También actúan otros factores que normalmente no están implicados en la angiogénesis normal, como por ejemplo la interleuquina-8 (IL-8), que es más bien un factor de inflamación. La sobreexpresión de IL-8 en el tumor estimula la producción del metaloproteinasa de matriz 2 (MMP-2), que degrada la membrana basal, remodela la matriz extracelular y facilita la angiogénesis del tumor. La presencia en el torrente sanguíneo de precursores de la célula endotelial CD34+ y de monocitos en áreas de angiogénesis en heridas y tumores, sugiere la hipótesis de que estos precursores hematopoyéticos circulantes podrían contribuir en parte a la regulación de la angiogénesis (Figura 1).
Figura 1. Algunas de las vías de la angiogénesis y posibles objetivos terapéuticos. Imagen adaptada del review de Lancet Oncology del Dr. Stephen B Fox
Angiogénesis específica del tumor: aunque las células del tumor inducen la formación de los vasos sanguíneos en un proceso que se asemeja al angiogénesis normal, la ultraestructura de los vasos del tumor es anormal, la neovasculatura está dilatada y sinuosa y en general carece de pericitos funcionales; por otra parte, las paredes de los vasos del tumor son finas y se pueden componer de células endoteliales y células del tumor. Estos vasos son también extremadamente permeables, debido en parte a la presencia de fenestraciones y a la carencia de una membrana basal. Se ha demostrado que las células endoteliales de los vasos del tumor tienen un aumento en los niveles de marcadores específicos de la angiogénesis. Estos marcadores se pueden utilizar para distinguir las células endoteliales de los vasos del tumor de las células de vasos normales. Se han aplicado muchas tecnologías para identificar marcadores específicos de células endoteliales del tumor o para identificar ligandos que se unen específicamente a las células endoteliales del tumor.
Angiogénesis en clínica
La angiogénesis tiene valor pronóstico: La metodología apropiada es vital para validar una variable como pronóstica en el cáncer; debe incluir un buen diseño, estudios multicéntricos con centralización de la revisión, programas de control de calidad y estandarización de todos los pasos de la técnica, así como un número apropiado de casos, longitud del seguimiento y evaluación estadística. Para la angiogénesis del tumor, la mayoría de los estudios sobre el pronóstico se han basado en la medida de la vascularización intratumoral, identificada mediante el conteo de vasos identificados por marcadores pan-endoteliales o relacionados con angiogénesis, mediante técnicas de immunohistoquímica. Para limitar la subjetividad durante la evaluación se han desarrollado dos técnicas alternativas para determinar la vascularización: el método visual de Chalkley y sistemas automatizados multiparamétricos de análisis de la proyección de imagen, los cuales evalúan el área vascular, el número de microvasos y el perímetro e intensidad de la tinción. El factor de crecimiento angiogénico más extensamente estudiado es el VEGF, que ha sido medido por un immunoensayo colorimétrico, immunohistoquímica o protección de RNAasa.
Como punto aparte se puede describir la investigación en cáncer de mama, que ha sido la más extensa: la mayor cantidad de publicaciones se refiere a marcadores de angiogénesis y pronóstico del cáncer de mama. En su mayoría los estudios fueron retrospectivos y usaron los métodos de Weidner o de Chalkley para determinar y a evaluar el conteo de vasos sanguíneos; también hay estudios de la supervivencia libre de recaída, incluyendo análisis multivariados. Para la supervivencia libre de recaída, en 31 de 41 estudios y para la supervivencia total, en 23 de 30 estudios que evaluaron el valor pronóstico de la vascularización, se encontró una asociación estadísticamente significativa entre el conteo de vasos y el pronóstico. En análisis de multivariables, en 23 de 29 y en 20 de 23 estudios se encontró que la vascularización intratumoral es un indicador pronóstico significativo e independiente de supervivencia libre de recaída. Cabe destacar que en los estudios con análisis multivariado se utilizó anticuerpos anti CD31 o anti CD34 y la mayoría dio resultados positivos en supervivencia libre de recaída (13/14) y todos en supervivencia total (12/12) dieron mejores resultados que la marcación con (factor VIII) fVIII-RA, por lo tanto, CD31 emerge como un marcador panendotelial para propósitos pronósticos (Tabla I).
Tabla I. Utilidad de CD31 como marcador panendotelial para propósitos pronósticos.
El valor pronóstico de la angiogénesis se demostró por primera vez en los estudios de dos grupos, en 1992. Desde entonces se ha demostrado que el grado de vascularización del tumor primario se correlaciona directamente con la presencia de micrometástasis en médula ósea y con la invasión de nodos linfáticos, lo que afecta el pronóstico.
Angiogénesis como objetivo terapéutico
La inhibición de la angiogénesis siempre se planteó como una estrategia prometedora para el tratamiento del cáncer y otras patologías. Los mayores progresos en la terapia del cáncer en los últimos años se han logrado mediante estudios multicéntricos destinados a comprobar la eficacia de los tratamientos; es así como en 2004 la FDA aprobó el uso de dos fármacos antiangiogénicos, el bevacizumab, un anticuerpo monoclonal para el tratamiento del cáncer del colon, y el pegoptinib, un inhibidor del VEFG-A para el tratamiento de la degeneración macular asociada a la edad.
Hoy es posible desarrollar múltiples estrategias para la terapia antiangiogénica, como son las terapias génicas, la coagulación intravascular para desteñir endotelio, terapias locales como la terapia fotodinámica y fármacos o anticuerpos con actividad antiangiogénica. En general, los agentes antiangiogénicos inhiben la proliferación o invasión de vasos sanguíneos y puede demorar días o semanas en producir algún efecto. Los tumores se pueden achicar proporcionalmente a la regresión de los vasos, lo cual no se debe a aumento de la apoptosis o a disminución de la densidad vascular; sin embargo, hay drogas que son capaces de alterar el citoesqueleto de las células endoteliales o causar muerte aguda de las células, como por ejemplo, la infusión arterial de TNF-alfa, que provoca una caída rápida del flujo sanguíneo y necrosis en grandes áreas de tumor, efecto que se observa en horas. Modelos preclínicos demuestran que estas terapias antiangiogénicas tienen mejor efecto en tumores pequeños, a la vez que logran un sinergismo con las terapias actuales.
Uno de los primeros agentes antiangiogénicos usados en la práctica clínica fue el interferón-alfa, para los hemangiomas gigantes infantiles, con muy buenos efectos. Una amplia gama de caminos se han abierto para ensayos fase I y II, predominantemente para las señales de VEGF y la de las metaloproteinasas. A diferencia de los ensayos fase I de la quimioterapia, los agentes antiangiogénicos inusualmente presentan una regresión de los tumores. Las preguntas claves son, por lo tanto, si se ha inhibido la angiogénesis y si hay un efecto biológico en los ensayos de la fase I suficiente como para determinar las dosis óptimas para las fases subsiguientes, II y III.
Aunque las drogas antiangiogénicas no tienen la misma toxicidad que la quimioterapia, ellas tienen efectos tóxicos que limitan su dosis, como por ejemplo desórdenes del tejido conectivo con el uso de metaloproteinasas y efectos en el sistema nervioso central con TNP-470. Otros efectos adversos mencionados, aunque no necesariamente relacionados, son: trombosis venosa, trombosis arterial y hemorragia de tumores. Los inhibidores de metaloproteinasas causan síndrome de hombro congelado y contracción de Dupuytren, que son reversibles pero pueden requerir el retiro temporal de la terapia.
Trials
Inicialmente las drogas deben pasar por un ensayo de fase I para determinar las dosis activas y toxicas; sin embargo, como se explicó anteriormente, pueden surgir dificultades para, por ejemplo, monitorizar la respuesta a tratamiento. Un ejemplo es el EGFR, que cuando está activado en tumores estimula el crecimiento y liberación de factores angiogénicos. Para comprobar inhibición y acción de un inhibidor de bajo peso molecular (Iressa, ZD-1839) fue necesario tomar biopsias de piel de pacientes, para confirmar un nivel de dosis que podía por lo menos inhibir un blanco
in vivo, no obstante fuera tejido fino normal.
El desarrollo de las drogas antiangiogénicas actuales ha planteado una serie de nuevos desafíos, pero su efecto antitumoral sólo se ha demostrado en conjunto con las terapias convencionales. La estrategia actual es utilizar una dosis levemente menor que la máxima tolerada para los ensayos fase II y III. Sin embargo, algunos agentes antiangiogénicos tienen un efecto más rápido o tumoricida, como los anticuerpos anti-VEGF y el IM862 y éstos han procedido de líneas convencionales. Algunas drogas también se han utilizado como terapias de mantención luego de que se ha obtenido la máxima respuesta con quimioterapia, como por ejemplo, el inhibidor BB94 de metaloproteinasa, que demostró una ventaja significativa en la supervivencia de pacientes con cáncer avanzado de estómago.
El efecto de fármacos antiangiogénicos endógenos aun está en estudio; los ensayos con angioestatina y endostatina son bastante prometedores. Recientemente se ha lanzado la terapia génica para mantener una liberación sostenida de endostatina; esto ha sido eficaz en los modelos animales y puede ser una estrategia para el uso clínico. Las células inflamatorias contribuyen a la angiogénesis del tumor y una de las vías principales es la de la ciclooxigenasa; debido a su alta tolerabilidad y la posibilidad del tratamiento crónico, los inhibidores de esta vía están siendo estudiados clínicamente.
Conclusiones
La angiogénesis se mantiene como la promesa del futuro para el tratamiento del cáncer, si bien actualmente se está investigando su rol en otras enfermedades donde se requiere una revascularización. Aún no se comprenden totalmente los mecanismos implicados en la angiogénesis, los impactos que tienen tanto los factores angiogénicos y antiangiogénicos circulantes en el torrente sanguíneo y los mecanismos celulares y tisulares que tienen los fármacos antiangiogénicos. Otra vía de estudio es la búsqueda, dentro de la farmacopea actual, de fármacos que posean actividad antiangiogénica, como la lovastatina, cuyos usuarios regulares presentan menor incidencia de cáncer. Estudios recientes apuntan a una actividad antiangiogénica de la lovastatina como uno de los mecanismos involucrados en este efecto.
Referencias
- Peter Carmeliet, Angiogenesis in life, disease and medicine, NATURE:Vol 438,15, Dec 2005, 932-936
- Stephen B Fox, Giampietro Gasparini, and Adrian L Harris, Angiogenesis: pathological, prognostic, and growth-factor pathways and their link to trial design and anticancer drugs, THE LANCET Oncology Vol 2 May 2001, 278-289.
- Yanzheng Liu and Albert Deisseroth, Tumor vascular targeting therapy with viral vectors, BLOOD, 15 APRIL 2006, VOLUME 107, NUMBER 8, 3027-3033.
- Leigh Coultas1, Kallayanee Chawengsaksophak1 & Janet Rossant, Endothelial cells and VEGF in vascular development, NATURE, Vol 438, 15 Dec 2005, 937-945.
- David S. Goodsell, The Molecular Perspective: VEGF and Angiogenesis, Stem Cells 2003;21;118-119.
- Janusz Rak,2 Joanne L. Yu, Robert S. Kerbel, and Brenda L. Coomber, What Do Oncogenic Mutations Have To Do with Angiogenesis/Vascular Dependence of Tumors?, CANCER RESEARCH 62, April 1, 2002, 1931–1934.
- Pia Nyberg, Liang Xie, and Raghu Kalluri, Endogenous Inhibitors of Angiogenesis, Cancer Res 2005; 65: (10). May 15, 2005, 3967-3979.
- Michael Papetti And Ira M. Herman, Mechanisms of normal and tumor-derived angiogenesis, Am J Physiol Cell Physiol 282: C947–C970, 2002.
- Tanja Veikkola, Marika Karkkainen, Lena Claesson-Welsh, and Kari Alitalo, Regulation of Angiogenesis via Vascular Endothelial Growth Factor Receptors1, CANCER RESEARCH 60, January 15, 2000, 203–212.
- Werner Rissau, Mechanism of Angiogenesis, Nature vol 386, 17 Abril 1997, 367-371.
- Napoleone Ferrara1 & Robert S. Kerbel, Angiogenesis as a therapeutic target, NATURE, Vol 438 , 15 December 2005, 967-971.

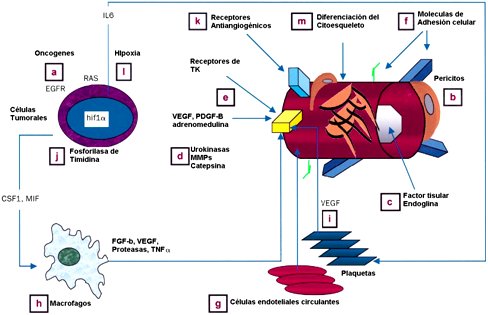 Figura 1. Algunas de las vías de la angiogénesis y posibles objetivos terapéuticos. Imagen adaptada del review de Lancet Oncology del Dr. Stephen B Fox
Figura 1. Algunas de las vías de la angiogénesis y posibles objetivos terapéuticos. Imagen adaptada del review de Lancet Oncology del Dr. Stephen B Fox

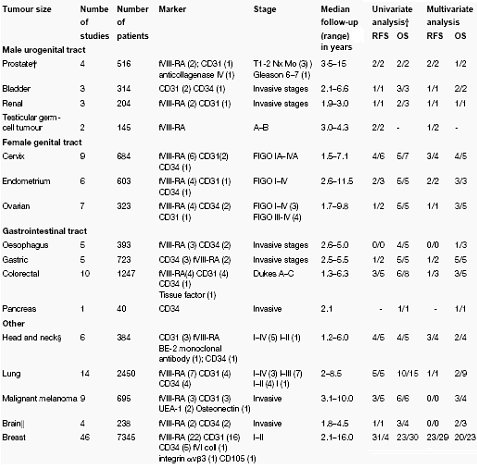 Tabla I. Utilidad de CD31 como marcador panendotelial para propósitos pronósticos.
Tabla I. Utilidad de CD31 como marcador panendotelial para propósitos pronósticos.

Esta
obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Figura 1. Algunas de las vías de la angiogénesis y posibles objetivos terapéuticos. Imagen adaptada del review de Lancet Oncology del Dr. Stephen B Fox
Figura 1. Algunas de las vías de la angiogénesis y posibles objetivos terapéuticos. Imagen adaptada del review de Lancet Oncology del Dr. Stephen B Fox

 Tabla I. Utilidad de CD31 como marcador panendotelial para propósitos pronósticos.
Tabla I. Utilidad de CD31 como marcador panendotelial para propósitos pronósticos.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Expositor:
René Letelier[1]
Expositor:
René Letelier[1]

