Este texto completo es la transcripción editada y revisada de una conferencia dictada en el curso Avances en Asma e Inmunología de Pulmón, organizado por el Instituto Nacional del Tórax durante los días 21 al 23 de julio de 2005.
Directores del Curso: Dr. Edgardo Carrasco, Dr. Ricardo Sepúlveda.
Introducción
En las últimas tres décadas se ha producido un aumento de las enfermedades alérgicas en los países desarrollados, especialmente en los de origen anglosajón, con mayor prevalencia en las áreas urbanas, comparadas con las rurales del mismo país. Para explicar este incremento se han estudiado los factores ambientales de los países industrializados, como el aumento de los alergenos intradomiciliarios, cambios en la dieta y contaminación del aire, sin resultados concluyentes. En cambio, diversos estudios epidemiológicos y experimentales han encontrado en forma consistente una relación inversa entre las infecciones que ocurren durante la niñez y el desarrollo de atopia en la vida adulta, lo que ha dado origen a la denominada “Hipótesis de la Higiene”, que postula que la falta de estimulación del sistema inmune por productos microbianos en los primeros años de vida facilita el desarrollo de alergia y enfermedades relacionadas, como asma y rinitis alérgica (1).
La inmunidad innata o inespecífica es la primera línea de defensa frente a las infecciones; está presente antes de que el individuo se contacte con microbios, se activa rápidamente frente a éstos y ayuda al desarrollo de la respuesta inmune adaptativa. La inmunidad innata es, desde un punto de vista filogenético, el mecanismo de defensa más antiguo y está presente en todos los organismos multicelulares, incluyendo plantas e insectos, a diferencia de la inmunidad adaptativa, que aparece en los vertebrados, siendo, por lo tanto, más evolucionada y permite una respuesta óptima para cada tipo de microorganismo, permitiendo su eliminación y dejando células de memoria que protegen de subsecuentes infecciones (2).
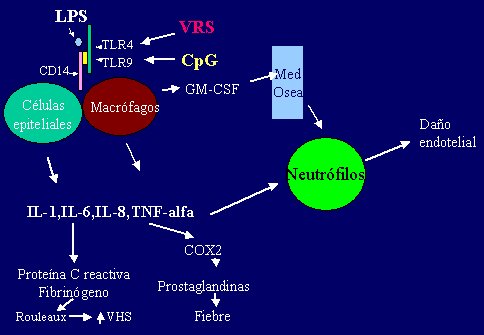
Existe una relación entre la inmunidad innata y la inmunidad adquirida. En la respuesta inmune adquirida, el linfocito T CD4 juega un rol central, pero su participación depende del reconocimiento del antígeno presentado por las células presentadoras de antígeno, (CPA) entre ellas, las células dendríticas y los macrófagos. Las rutas más comunes y frecuentes de entrada de gérmenes son: piel, vía aérea y gastrointestinal; en el epitelio de estos sistemas están presentes las células dendríticas que captan el antígeno y lo llevan hacia el ganglio linfático regional o al tejido linfoide asociado a mucosas, presente en la mucosa bronquial y gastrointestinal, donde se produce el encuentro con el linfocito T. Las células dendríticas inmaduras están capacitadas para captar el antígeno mediante los receptores de membrana que unen microbios, como los Toll-like receptors. Al captar antígenos, la célula dendrítica inmadura comienza a madurar, aumentando la expresión de antígenos de histocompatibilidad clase II (MHC II) que, unidos al antígeno extraño, permiten la presentación a un linfocito T CD4+ (helper). La célula presentadora de antígeno (célula dendrítica o célula monocito-macrófago) comienza a producir citoquinas, entre ellas la IL-12, que induce el desarrollo de linfocitos T CD4+ tipo Th-1 productores de interferón - gamma. Esta respuesta inmunitaria mediada por células se activa especialmente por fracciones proteicas o lipoproteicas de gérmenes que son endocitados por CPA (3) (Figura 1).
Figura 1. Receptores Toll like.
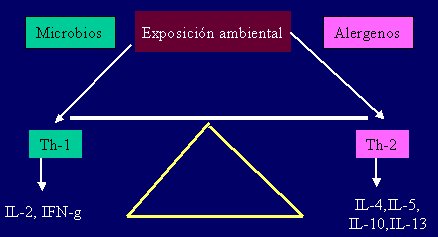
El ambiente in útero en que se desarrolla el feto se caracteriza por una muy baja producción de IFN-gamma debido a la escasez de células T tipo Th-1 y por lo tanto, una polarización hacia una mayor presencia de células T tipo Th-2. Desde el momento de nacer, la estimulación microbiana induce la “desviación inmune” hacia la respuesta tipo Th-1 (3), lo que evita el desarrollo de alergias (respuesta tipo Th-2), porque se mantiene el balance Th-1/Th-2. La falta de estímulos Th-1 favorece el reconocimiento de los alergenos ambientales por los linfocitos T, en un ambiente con citoquinas tipo Th-2 (IL-4), lo que favorece la respuesta de IgE frente al alergeno (4) (Figura 2).
Figura 2. Hipótesis de la Higiene: la ausencia de infecciones en la infancia se asocia a atopia.
Se ha postulado que la desviación inmune ocurre en los primeros años de vida y que la reactividad inmunológica del adulto se establece antes de los 5 años; según la teoría de la higiene, en los países industrializados, la reducción de la contaminación microbiana ambiental favorecería esta respuesta. El mecanismo de desarrollo de atopia basado en el paradigma Th-1/Th-2 proviene de estudios realizados en ratones, con subpoblaciones muy bien definidas. En los seres humanos, este concepto se sustenta en el hallazgo en biopsias de células T tipo Th-2 en las vías aéreas de asmáticos alérgicos (5) y de células de memoria tipo Th-2 alergeno-específicas, en sangre periférica (6). Sin embargo, el mecanismo de desarrollo de la atopia es bastante más complejo, ya que intervienen no sólo las citoquinas producidas por los linfocitos tipo Th-2, sino también la IL-10 (7) y las células T reguladoras (CD4+/CD25+) (8), que pueden modular esta respuesta.
Más complejo aún es el desarrollo de asma, ya que la sensibilización frente a un alergeno no necesariamente se asocia a la presencia de síntomas y no todos los individuos atópicos desarrollan hiperreactividad bronquial; además del factor ambiental, la sensibilización alérgica, la hiperreactividad bronquial y la inflamación de la vía aérea dependen de múltiples factores genéticos, por lo tanto, tratar de explicar el aumento de la atopia y de las enfermedades atópicas sólo por la teoría de la higiene es simplificar en extremo una patología bastante más compleja.
Los estudios epidemiológicos no han podido demostrar en forma fehaciente que las infecciones tempranas en la vida protegen del desarrollo de atopia, como se ha hecho en animales de experimentación, en los que se ha podido modificar la respuesta inmune, previniendo el desarrollo de alergia. También se ha logrado desviar la respuesta alérgica mediante productos microbianos, lo que ha abierto un campo de investigación con miras a desarrollar una inmunoterapia efectiva, que sea capaz de prevenir o modificar el desarrollo de alergia.
Las infecciones por Micobacterias, especialmente M. Tuberculosis y M.bovis, producen una fuerte respuesta tipo Th-1, con producción de IL-12, IFN-gamma, IL-18 e IL-23, las cuales producen supresión de la respuesta tipo Th-2. En un estudio realizado en 867 escolares japoneses (9) con vacunación BCG al nacer, se encontró que la mayor respuesta al PPD se correlacionaba con menor frecuencia de asma, rinoconjuntivitis y eczema; sin embargo, estos resultados no son probablemente atribuibles sólo a la vacunación BCG, ya que estos niños procedían de una población con alta tasa de tuberculosis (100/100000) y, por lo tanto, con exposición natural a M. Tuberculosis, en adición al BCG.
En un estudio epidemiológico más reciente (10), que incluyó 235.477 niños de 13 a 14 años, estudiados previamente en el estudio internacional de asma y alergia en niños, ISAAC, realizado en Europa, USA, Canadá, Australia y Nueva Zelandia, se encontró una relación inversa entre el número de casos notificados de tuberculosis y la prevalencia de sibilancias y asma en los últimos 12 meses. Un aumento de la notificación de casos de tuberculosis de 25/100.000 se asoció a una disminución de 4,7% de asma alguna vez. Estos resultados parecen apoyar la hipótesis de que la exposición natural de una comunidad a M. Tuberculosis tendría un rol en la disminución de la atopia, a diferencia de los hallazgos descritos para la relación BCG versus atopia, aunque, a diferencia del estudio efectuado en niños japoneses, otros trabajos no han demostrado que la vacunación BCG antes del año de edad (11-12) o más tardía (13), se correlacione con disminución de la atopia, definida por cuestionario, test cutáneo y niveles de IgE.
La endotoxina corresponde a fragmentos de lipopolisacáridos (LPS) de la pared bacteriana de los gérmenes gramnegativos, que se encuentra en cantidades variables en los ambientes ocupacionales y domésticos, como granjas, graneros y textiles; también está presente en el polvo de habitación, especialmente en casas con animales domésticos y alfombras. Por años se relacionó la inhalación de altas dosis de endotoxina con asma ocupacional (trabajadores de algodón, agricultura, viveros, etc.); dosis altas de endotoxina puede producir una respuesta inmediata y prolongada de broncocontricción en cualquier individuo y agrava la inflamación de la vía aérea en asmáticos; incluso, se ha relacionado el nivel de endotoxina con la aparición de sibilancias en el primer año de vida (14-15).
En contraste con el efecto pro-inflamatorio de la endotoxina, los estudios epidemiológicos han demostrado que la exposición microbiana puede proteger del desarrollo de atopia. Este efecto se ha descrito en niños de países desarrollados que viven en aéreas rurales, quienes presentan menor prevalencia de alergia y asma (16); además, en las casas de niños alérgicos se encontró menor cantidad de polvo de habitación y esos niveles se correlacionaron con menor nivel de IFN-gamma producido por linfocitos T de sangre periférica (17), sugiriendo que la exposición natural a endotoxina en los primeros años puede inducir una respuesta tipo Th-1. En áreas rurales hay numerosas fuentes de endotoxina, como los animales y la ingesta de leche no pasteurizada, que pueden modular la respuesta inmune en los primeros años de vida. La presencia de animales domésticos también se han relacionado con mayor nivel de endotoxinas y se ha postulado que esto puede tener un efecto preventivo en el desarrollo de alergias (18); sin embargo, en los niños sensibilizados a alergenos de gatos o perros los síntomas se agravan con mínima exposición a estos alergenos, quizás porque en los individuos sensibilizados, la inhalación de endotoxina asociada a un alergeno produzca mayor respuesta inflamatoria que la inhalación del alergeno solo (19).
La exposición a endotoxinas, por lo tanto, puede tener un efecto pro-inflamatorio o tener un efecto preventivo en el desarrollo de alergias y esto dependerá de: la edad de exposición, con mayor efecto preventivo en niños menores de un año, que no están sensibilizados a alergenos ambientales; de la dosis de exposición; y de factores genéticos.
Los factores genéticos que influyen en la respuesta inmune innata han sido estudiados, también con resultados inconsistentes, pero es probable que la desrregulación inmune observada en el asma se deba a factores genéticos. Se ha demostrado que variaciones genéticas de los receptores de la respuesta inmune innata frente a componentes bacterianos, modifican la respuesta inmune específica; así, la presencia del polimorfismo “TT” en la región promotora del CD14, molécula receptora del LPS presente en monocitos-macrófagos y células dendríticas, se ha asociado a una menor sensibilización alergénica y niveles más bajos de IgE (20). Un estudio reciente, efectuado en niños asmáticos atópicos suecos, encontró una mayor prevalencia del TLR4, sugiriendo una inhabilidad para responder a la endotoxina y, por lo tanto, mayor riesgo de desarrollar respuesta tipo Th-2 (21). En un estudio realizado en niños alemanes nacidos y criados en granjas, la menor prevalencia de atopia y enfermedades atópicas se correlacionó con polimorfismo del TLR2 (22) y se ha descrito asociación entre presencia de perros en la casa y polimorfismos del CD14, con desarrollo de atopia. Asimismo, se ha observado una menor prevalencia de dermatitis atópica en niños con genotipo TT de la región promotora del CD14.
En cuanto a infecciones virales, estudios epidemiológicos han demostrado que los hijos menores de las familias y los que asisten a sala cuna (23) presentan menos atopia, lo que se ha atribuido a que estos lactantes están expuestos a mayor cantidad de infecciones virales leves. En un seguimiento de 499 recién nacidos con factores de riesgo de atopia y 815 sin riesgo, presentaron asma a los 7 años de edad aquellos niños que durante los primeros años de vida habían desarrollado obstrucción bronquial en relación con infecciones respiratorias agudas bajas; en cambio, el diagnóstico de asma fue 50% menor en aquellos lactantes que presentaron dos o más infecciones respiratorias altas sin compromiso bronquial (24). Esto estaría en concordancia con los estudios inmunológicos que demuestran que las infecciones virales inducen una fuerte respuesta de IFN-gamma. La infección severa por virus respiratorio sincicial (VRS), en cambio, se ha asociado a desarrollo de episodios de obstrucción bronquial o asma bronquial hasta la edad de 13 a 14 años (25-26). No se sabe si el virus tiene un mecanismo causal de la obstrucción bronquial, o sólo pone en evidencia la susceptibilidad para desarrollarla; sin embargo, desde el punto de vista inmunológico hay evidencia de que el VRS no induce una respuesta de IFN-gamma (27-30).
El progreso en el conocimiento de la respuesta inmune a gérmenes, de los receptores y mecanismos de señales de los receptores tipo Toll (TLRs), que han demostrado una participación en numerosas enfermedades, sugiere que su manipulación tiene un enorme potencial terapéutico (31). El estudio de la respuesta innata del sistema inmune y su relación con la inmunidad adquirida ha permitido el desarrollo de líneas de investigación (32) que, probablemente, permitirán realizar la prevención primaria o secundaria de las alergias en el futuro.


 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el curso Avances en Asma e Inmunología de Pulmón, organizado por el Instituto Nacional del Tórax durante los días 21 al 23 de julio de 2005.
Directores del Curso: Dr. Edgardo Carrasco, Dr. Ricardo Sepúlveda.
 : Expositor: Dra. Patricia Díaz Amor.
: Expositor: Dra. Patricia Díaz Amor. 

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión