 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Desafíos en Nutrición y Alimentación, organizado por la Sociedad Chilena de Pediatría entre los días 26, 27 y 28 de abril de 2006.
Directores: Dr. Francisco Moraga y Dr. Eduardo Atalah.
En el área de alergia a alimentos la información es limitada; aunque ha habido avances en los últimos años, la comprensión actual de la alergia alimentaria dista mucho de la realidad y no se ha logrado desarrollar una explicación inmunológica unitaria de este cuadro. A continuación se analizará el papel que desempeñan las células epiteliales especializadas, cuya función es presentar antígenos alimentarios y bacterianos al sistema inmune.
El sistema inmune se compone de una gran cantidad de elementos y es una de las áreas mas extensas del organismo; por desgracia, el enfoque inicial que se dio al estudio del sistema inmune fue tratar de dilucidar la inmunidad adaptativa y sólo en los últimos años se ha investigado la inmunidad innata, especialmente la inmunidad de mucosas, por lo que el conocimiento actual es escaso. Dentro del sistema inmune de la mucosa intestinal están: los toll-like receptors (TLR); las células dendríticas, capaces de percibir patrones moleculares de bacterias y microorganismos y presentarlos al resto del sistema inmune; la IgA secretora, que cumple un papel importante; el tejido linfoide asociado con el intestino (GALT); e IgG e IgA específicas, que permiten estudiar el papel del sistema inmune con parámetros séricos, en alguna etapa.
Las proteínas sufren degradación y destrucción de epítopes conformacionales inmunogénicos, pero la mayoría de las proteínas alimentarias no despiertan una respuesta inmune; si así fuera habría una reacción inmune permanente y un gasto energético incompatible con la vida. 2% de las proteínas ingeridas y algunas bacterias son capaces de llegar a la circulación portal, pero el organismo logra establecer mecanismos de tolerancia, aunque algunos individuos genéticamente predispuestos no pueden desarrollar estos mecanismos y se enferman.
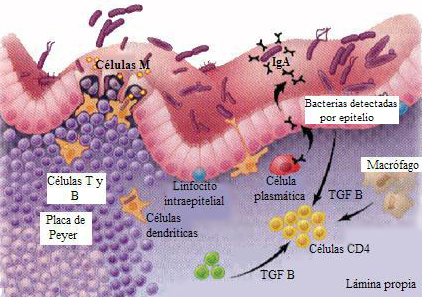
En el esquema del intestino que se muestra en la Figura 1, las células M captan antígenos en el lumen intestinal y los transportan para que se inicie la respuesta inmune. A este nivel cumplen un papel muy importante los TLR, puesto que establecen un enlace entre la inmunidad innata y la inmunidad adaptativa. Una vez establecida esa respuesta se realiza una presentación muy abundante a linfocitos B y T en esa zona, para desencadenar una respuesta inmune adaptativa. Además se activan mecanismos de tipo regulador, que hacen que la respuesta inmune ejerza su función dentro de límites que no sean dañinos para el propio organismo.
Figura 1. Esquema de respuesta inmune a nivel intestinal
El conocimiento actual indica que la alteración de estos mecanismos reguladores sería importante en la génesis de las alergias alimentarias y que entre las moléculas involucradas están algunas que actúan como intermediarios, como la interleuquina (IL) 10 y el TGF (factor transformante de crecimiento) beta, e IL reguladoras, que inhiben el desarrollo de una respuesta mayor. El equilibrio entre estas respuestas permite que se produzca tolerancia o hiporreactividad frente a antígenos de alimentos y de bacterias comensales, al tiempo que se desarrolla una respuesta inmune contra bacterias patógenas. El organismo debe ser capaz de discriminar entre una y otra. Los mecanismos íntimos todavía se conocen en forma parcial, pero se sabe que dosis altas de antígenos inducen anergia o deleción de los linfocitos y, en cambio, dosis bajas de antígenos inducen respuesta mediada por células T reguladoras. Si hay respuesta inmune, hay regulación: ése es el principio.
La alergia a alimentos es una reacción de hipersensibilidad mediada por mecanismos inmunológicos. Esta definición la estableció un grupo de expertos y se debe considerar que en ella aparece el término mecanismos inmunológicos, es decir, no dice que la alergia es mediada por IgE ni que se trata de una reacción de hipersensibilidad inmediata, por lo tanto, la alergia alimentaria puede ser mediada por IgE o por inmunidad celular. La anafilaxia por alergia a alimentos es una reacción mediada por IgE, sistémica y generalizada, que amenaza de la vida y que habitualmente cursa con compromiso y colapso circulatorio.
La alergia alimentaria es una alteración de la homeostasis entre antígenos del intestino e inmunidad del huésped, lo que origina un grupo heterogéneo de enfermedades secundarias a la acción de la IgE o de la inmunidad celular, que son los mecanismos inmunes más conocidos. Frente a un paciente es aconsejable tratar de pensar en los mecanismos inmunes, porque eso ayuda a ordenar ideas y a establecer criterios clínicos y, muchas veces, terapéuticos. Estas enfermedades se pueden presentar en formas clínicas aisladas o asociadas con otras manifestaciones de alergia; el caso más clásico es la dermatitis atópica, que en al menos 30 a 40% de los casos se asocia a alergia alimentaria.
La alergia alimentaria se presenta en 6% de los niños y en 3 a 4 % de los adultos. Esta disminución de la prevalencia se debería a que con el tiempo se establecen mecanismos de tolerancia, a medida que se desarrolla el sistema inmune. Por otro lado, ha aumentado la frecuencia de alergia a algunos alimentos, como el maní y el huevo. En el desarrollo de esta alergia influyen factores genéticos y ambientales; por ejemplo, en el caso del asma se ha establecido que dependería en 50% de factores genéticos y en 50%, de factores ambientales, pero no hay datos sobre la alergia por alimentos.
En la alergia a alimentos mediada por IgE no se ha podido definir factores propios, específicos, sino que habría factores genéticos comunes para las alergias mediadas por esta inmunoglobulina. Existen numerosos genes involucrados, con grados variables de penetrancia y hay interacciones entre genes y entre genes y ambiente; además, existen mutaciones de diferentes genes que dan como resultado los mismos fenotipos.
En la literatura se lee que el riesgo de alergia es mayor cuando hay menor cantidad de interferón gamma en los mononucleares y menor contenido de IL-13 en sangre de cordón, factor que está genéticamente determinado. Hay estudios en curso para determinar los polimorfismos de genes candidatos a alergias por IgE; estos mismos estudios se han estado realizando en asma y en otras enfermedades del área. Además puede haber alteraciones en las citoquinas que median alergias, en las citoquinas reguladoras y en algunas citoquinas de Th1 (T helper 1), por mayor o menor expresión de ellas.
Otros factores genéticos que participan son los receptores de células B, de células T, de citoquinas, de IgE, de CD14 y el receptor mayor de endotoxinas, TLR 4. También participan factores de trascripción nuclear, como el factor nuclear kappa B (NF-kappa B), relacionado con la respuesta de los TLR; los FOXP3 (forkhead box P3), relacionado con las células reguladoras naturales y los Tbet, con las respuestas Th1 y Th2. Además, se han definido algunos alelos HLA específicos, por ejemplo el alelo para el síndrome látex-fruta. A pesar de lo que se ha expuesto, todavía falta mucha información.
Un elemento muy pertinente para los pediatras es la edad en la que se introducen los alimentos. Por ejemplo, la administración de fórmulas en el período neonatal no es una práctica recomendable, desde el punto de vista de las alergias alimentarias. También los factores ambientales son muy interesantes, de hecho hay diferencias regionales: por ejemplo, en los Estados Unidos es muy frecuente la alergia al maní, mientras que en Chile parece ser mucho menos común. Respecto a la microflora intestinal y la teoría de la higiene, en el parto natural antiguo el recién nacido adquiría flora intestinal de las deposiciones de la madre y se colonizaba con una microflora que le permitía un desarrollo inmune armónico, mientras que en la actualidad el recién nacido se expone a alergenos alimentarios nuevos clonados, que serán motivo de preocupación.
El siguiente caso clínico es muy ilustrativo. Se trata de un varón de 3 meses de edad, con antecedentes familiares de rinitis alérgica y asma bronquial, cuya madre tuvo que volver a trabajar una vez que terminó su período postnatal, por lo que dejó preparada una fórmula de leche. Ante la primera ingesta el niño hizo una reacción anafiláctica, por lo que estuvo hospitalizado un día y medio en la Unidad de Cuidados Intensivos de la Universidad Católica; cuando egresó tuvo buena tolerancia a leche de soya y toleró la leche a los 3 años y medio de edad. En este caso está claro que la genética y el ambiente cumplen un papel importante, ya que se trata de un paciente con una historia familiar de alergia al que se le agregó un factor ambiental muy relevante. La literatura más reciente informa que han aumentado otras alergias alimentarias y que la alergia a la leche ha disminuido, probablemente porque disminuyó la costumbre de dar mamaderas en las maternidades y en las unidades de recién nacidos.
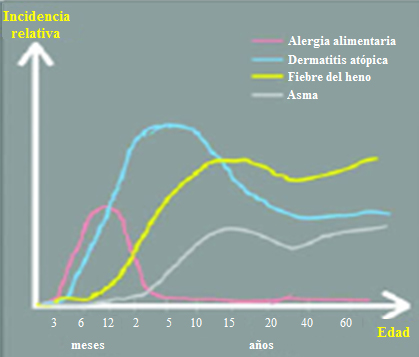
Los pacientes atópicos suelen pasar de una enfermedad alérgica a otra en el curso de su vida (Fig. 2): presentan alergia alimentaria y dermatitis atópica en forma precoz y luego desarrollan síntomas de rinitis alérgica y asma bronquial. Los pediatras deben estar en conocimiento y atentos, para detectar los factores ambientales que se pueden modificar para que no se presenten estas situaciones.
Figura 2. Incidencia relativa de enfermedades alérgicas según edad
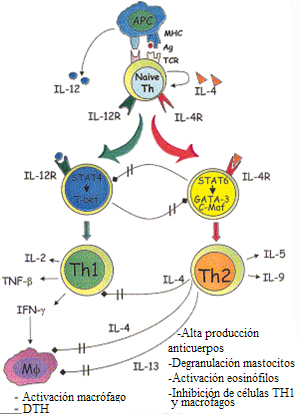
Respecto a la hipótesis de la higiene, decir que algunas personas son Th1 y otras, Th2 es una simplificación exagerada; es una buena hipótesis, una herramienta de trabajo adecuada, pero no representa la realidad. La dificultad se presenta cuando la respuesta Th2 fetal-neonatal no evoluciona hacia un balance adecuado entre Th1 y Th2; este desequilibrio se produciría por una disminución de la estimulación de los TLR por los microorganismos, lo que conllevaría una desviación de la respuesta hacia Th2, frente a alergenos del ambiente. En este punto, es importante el balance de los factores de transcripción Th1 específico (Tbet) y Th2 específico (GATA-3 ); el aspecto más importante es que habría una activación reducida de las células T reguladoras. Una menor exposición a antígenos del ambiente determinaría no sólo una menor estimulación hacia Th1, sino también una activación reducida de las células T reguladoras. En los niños con alergia a alimentos habría una disminución de las bacterias de la microflora, como Lactobacilli y bifidobacterias, pero habría una adquisición temprana de Clostridium, que induciría una respuesta Th1 inadecuada, con aumento del gasto energético y desarrollo de enfermedad. Según la hipótesis de la higiene, habría una derivación hacia la línea Th2 o hacia a la línea Th1, según el medio ambiente en el cual se encuentra la célula Th naive, original o nativa. Esta célula va a dar una respuesta en el sentido Th2, si hay un ambiente con IL-4 y algunos factores de transcripción específicos; en cambio, se producirá una respuesta Th1 si en el medio hay IL-12 y otros factores de transcripción.
Figura 3. Hipótesis de la higiene
En este contexto, cabe preguntarse dónde desempeña su papel el ambiente y dónde, la genética. Esta pregunta está, por ahora, sin respuesta; probablemente esto ocurra en la etapa de interleuquina 4 y 12 y en la expresión de factores de transcripción y por esto se está estudiando genéticamente los polimorfismos de los factores de transcripción. La lactancia materna en las primeras etapas evita reacciones de tipo inflamatorio, por lo cual es una gran protectora del gasto energético.
En la actualidad existen varias enfermedades causadas por la alergia a los alimentos; entre ellas:
En cuanto a los alergenos relacionados con las alergias a los alimentos, la mayoría corresponden a los llamados alergenos clase 1, que son proteínas de 10 a 70 kilodaltons, estables al ácido, al calor y a las proteasas, cuya sensibilización ocurre habitualmente por vía digestiva. También hay sensibilización por vía respiratoria, como el polen de abedul, pero estos son alergenos clase 2, bastante más inestables. En general, el repertorio de proteínas que inducen alergia alimentaria es más bien reducido; las proteínas que causan alergia alimentaria comparten homología en algunas regiones, pero la reactividad cruzada clínica es menos frecuente que la descrita para estas homologías. La mayoría de los pacientes pueden tener alergia a un alimento único, pero algunos se pueden sensibilizar posteriormente a un segundo alergeno alimentario.
Entre las células reguladoras intestinales, las CD4 son muy importantes; las células Th3 son suprimidas por el factor transformante de crecimiento beta secretado; las células Tr1 son suprimidas principalmente por la IL-10; las células CD4 CD25 son más importantes en el desarrollo de autoinmunidad que de alergia a alimentos; además hay células CD8 y células natural killer (NK). La ruptura de la tolerancia oral se ha asociado con la célula reguladora intestinal Treg, que tiene formas naturales y formas inducidas por la IL-10, que suprimen los linfocitos CD4; la flora intestinal normal estimula las células Treg inducidas, por lo que la pérdida de esta flora favorece la alergia a alimentos y en algunos estudios se ha visto que los probióticos estimularían las Treg inducidas (1). Hay datos controvertidos respecto a la IL-10, porque, como ha sucedido con otros factores, en una situación estimula y en otra situación suprime. Se pueden citar dos ejemplos de estudios experimentales sobre las células reguladoras intestinales: en uno de ellos se encontró que los niños con alergia a proteína de leche de vaca tienen menor cantidad de linfocitos duodenales en la lámina propia y epitelio y, además, expresan el factor transformante de crecimiento beta (2); y en el otro estudio hubo una disminución de la expresión de este mismo factor y de la IL-10 en linfocitos de mucosa duodenal, en niños con enteropatía inducida por leche (3). En consecuencia, las células intestinales reguladoras tendrían un papel en esta respuesta.
Como no se conocen todos los factores relacionados con estas patologías, los métodos de diagnóstico todavía son imperfectos, por lo tanto es importante conocer los exámenes que pueden ser útiles y analizar sus resultados con juicio crítico, sin olvidar que siempre debe haber una correlación entre la historia y los exámenes de laboratorio y que éstos no sirven por sí solos en esta área de la medicina.
La hipersensibilidad inmediata se evalúa mediante los tests cutáneos y la IgE específica, mientras que la hipersensibilidad retardada, que se asocia a la inmunidad de tipo celular, se determina mediante las pruebas de parche (patch test), que se utilizaron originalmente en algunas enfermedades dermatológicas, pero ahora se están empleando en el área de la alergia alimentaria. Estos exámenes no están estandarizados, ni en su aplicación ni en su interpretación y los datos disponibles en la literatura son bastante controvertidos, de modo que se sus resultados se deben tomar con cautela, sin sacar grandes conclusiones a partir de un examen alterado. En las enfermedades mediadas por inmunidad celular, la biopsia de intestino o piel podría ser un elemento valioso de ayuda diagnóstica.
Los tests cutáneos serían útiles, pero en niños pequeños y hay que tener cautela con las interpretaciones; el valor predictivo negativo de las pruebas cutáneas de hipersensibilidad inmediata es bastante bueno (mayor de 95%), excepto en los menores de 2 años, porque podrían desarrollar mayor respuesta con el correr del tiempo. Si el test es positivo sólo significa sensibilización IgE, es decir, un test cutáneo positivo no significa que el paciente esté enfermo, sino que tiene una sensibilización mediada por IgE; la interpretación de este resultado dependerá de la clínica; de hecho, la correlación con los síntomas clínicos no va más allá de 50%. En un estudio reciente de Hill se encontraron valores altos para leche, maní (8 mm) y huevo (7 mm) en niños mayores de 2 años, con valores un poco más bajos en niños menores de esa edad (6,5 mm para leche y maní y 4 mm para huevo); los resultados se correlacionaron con el diagnóstico pertinente de alergia alimentaria (4). Los extractos comerciales deben ser estandarizados, incluso en el caso de frutas y verduras, pero algunos grupos trabajan con el llamado prick by prick, que es el examen directo, porque no disponen de extractos comerciales estandarizados.
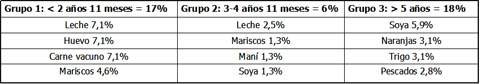
En un trabajo del grupo de Martínez, que se publicó en 2005, en un grupo seleccionado de niños de distintos grupos etarios se evaluó la hipersensibilidad inmediata mediada por prick test. El grupo 1 estaba compuesto por menores de 2 años 11 meses; el grupo 2, por niños de 3 años a 4 años 11 meses; y el grupo 3, por mayores de 5 años. Los niños del grupo 1 los niños presentaban sensibilización a leche, huevo y carne de vacuno en el mismo porcentaje (7,1%); a mariscos fue un poco menor (4,6%). El grupo 2 tuvo los resultados más bajos en todos los tests cutáneos y el grupo 3 dio resultados intermedios (Tabla I). La presencia de otros alergenos alimentarios no significa que sean alérgicos a todos ellos; sólo son tests cutáneos que reflejan los alergenos a los que está sensibilizada nuestra población. Hay pocos estudios en población chilena en este aspecto.
Tabla I. Frecuencia de tests cutáneos positivos a alimentos según grupo etario (Martínez J et al. Pruebas cutáneas de hipersensibilidad inmediata en una población pediátrica seleccionada. Rev Méd Chile 2005; 133: 195-201)
En cuanto a la IgE específica, las nuevas tecnologías de cuantificación automatizada y cuantitativa han permitido desarrollar una tercera generación de exámenes, como UniCap e Immulite 2000, que son más exactos, requieren pequeñas cantidades de suero y se basan en alergenos crudos, nativos, purificados y recombinantes. Sin embargo, se ha visto que 10% a 25% de los pacientes con IgE negativa tienen manifestaciones clínicas y sólo las concentraciones mayores se asocian a cuadros clínicos, con un valor predictivo positivo mayor de 95 %; con los valores menores es necesario mostrar mucha cautela. Los valores vigentes de UniCap en mayores de 5 años, pero que pueden cambiar, son: huevo, 7 kIU; leche, 15 kIU; maní, 14 kIU; pescado, 10 kIU; y en menores de 2 años: leche, 5 kIU; y huevo, 2 kIU.
La IgE específica sirve para predecir tolerancia. Cuando un niño tiene alergia a la proteína de leche de vaca se puede retirar o introducir la leche en forma empírica, pero la disminución de la IgE especifíca para leche y huevo ha sido útil en el pronóstico de tolerancia. Si diminuye en menores de 4 años, hay mayor probabilidad de tolerancia (6), más aun si la disminución es rápida: cuanto más rápida sea la disminución de la IgE específica, mayor es la probabilidad de desarrollar tolerancia. Lamentablemente, todavía no ha sido posible dar valores concretos a esta disminución. En el futuro se va a trabajar más con los epítopes de unión de las IgE al alergeno.
En mi grupo de trabajo se han definido tres puntos relevantes para los especialistas del área de la nutrición, inmunología y gastroenterología:
Las conductas que se toman son muy diversas y es importante que los grupos atingentes lleguen a algún tipo de consenso para ayudar a la comunidad pediátrica en esta toma de decisiones, que de por sí es difícil y crea más de alguna dificultad. Por ejemplo, ¿cuándo recomendar una fórmula de aminoácidos? En general, nuestra conducta no es recomendarla de entrada.




 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Desafíos en Nutrición y Alimentación, organizado por la Sociedad Chilena de Pediatría entre los días 26, 27 y 28 de abril de 2006.
Directores: Dr. Francisco Moraga y Dr. Eduardo Atalah.
 Expositor:
Eduardo Talesnik G.[1]
Expositor:
Eduardo Talesnik G.[1]

Citación: Talesnik E. Food allergy: a view from immunology. Medwave 2006 Sep;6(9):e3530 doi: 10.5867/medwave.2006.09.3530
Fecha de publicación: 1/10/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Kalliomäki M, Salminen S, Poussa T, Arvilommi H, Isolauri E. Probiotics and prevention of atopic disease: 4-year follow-up of a randomised placebo-controlled trial. Lancet. 2003 May 31;361(9372):1869-71. | CrossRef | PubMed |
Kalliomäki M, Salminen S, Poussa T, Arvilommi H, Isolauri E. Probiotics and prevention of atopic disease: 4-year follow-up of a randomised placebo-controlled trial. Lancet. 2003 May 31;361(9372):1869-71. | CrossRef | PubMed | Pérez-Machado MA, Ashwood P, Thomson MA et al. Reduced transforming growth factor-beta1-producing T cells in the duodenal mucosa of children with food allergy. Eur J Immunol. 2003 Aug;33(8):2307-15. | CrossRef | PubMed |
Pérez-Machado MA, Ashwood P, Thomson MA et al. Reduced transforming growth factor-beta1-producing T cells in the duodenal mucosa of children with food allergy. Eur J Immunol. 2003 Aug;33(8):2307-15. | CrossRef | PubMed | Beyer K, Castro R, Birnbaum A, Benkov K, Pittman N, Sampson HA. Human milk-specific mucosal lymphocytes of the gastrointestinal tract display a TH2 cytokine profile. J Allergy Clin Immunol. 2002 Apr;109(4):707-13. | CrossRef | PubMed |
Beyer K, Castro R, Birnbaum A, Benkov K, Pittman N, Sampson HA. Human milk-specific mucosal lymphocytes of the gastrointestinal tract display a TH2 cytokine profile. J Allergy Clin Immunol. 2002 Apr;109(4):707-13. | CrossRef | PubMed | Hill DJ, Heine RG, Hosking CS. The diagnostic value of skin prick testing in children with food allergy. Pediatr Allergy Immunol. 2004 Oct;15(5):435-41. | CrossRef | PubMed |
Hill DJ, Heine RG, Hosking CS. The diagnostic value of skin prick testing in children with food allergy. Pediatr Allergy Immunol. 2004 Oct;15(5):435-41. | CrossRef | PubMed | Martínez J, Méndez C, Talesnik E, Campos E, Viviani P, Sánchez I. Pruebas cutáneas de hipersensibilidad inmediata en una población pediátrica seleccionada. Rev Med Chil. 2005 Feb;133(2):195-201. Epub 2005 Apr 7. | PubMed |
Martínez J, Méndez C, Talesnik E, Campos E, Viviani P, Sánchez I. Pruebas cutáneas de hipersensibilidad inmediata en una población pediátrica seleccionada. Rev Med Chil. 2005 Feb;133(2):195-201. Epub 2005 Apr 7. | PubMed |