 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Desafíos en Nutrición y Alimentación, organizado por la Sociedad Chilena de Pediatría entre los días 26, 27 y 28 de abril de 2006.
Directores: Dr. Francisco Moraga y Dr. Eduardo Atalah.
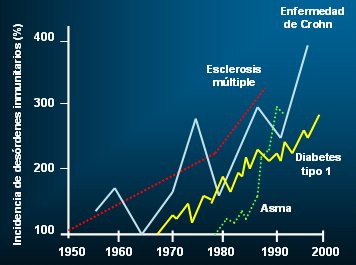
En los últimos 30 años ha habido a nivel mundial un aumento considerable de la prevalencia de las enfermedades alérgicas en los países desarrollados, e incluso en los no tan desarrollados, fenómeno que también ha afectado a Chile. Como en 30 años no se alcanza a producir un cambio genético de tal magnitud que explique este fenómeno, este aumento indica que hay otros factores involucrados. La prevalencia de enfermedades prototipo de causa inmunológica, como el asma bronquial, la esclerosis múltiple, la enfermedad de Crohn y la diabetes mellitus tipo 1 ha aumentado de manera notable (Fig. 1).
Figura 1. Incidencia de alteraciones inmunológicas prototípicas (1950-2000)
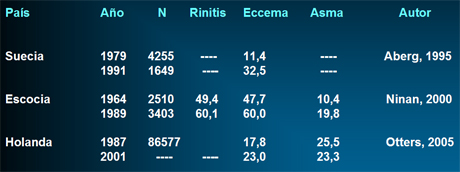
En tres estudios realizados en países desarrollados: Suecia, Escocia y Holanda, con la participación de una cantidad considerable de individuos, se obtuvieron los siguientes resultados: en Suecia, la incidencia del eccema prácticamente se triplicó en el curso de 22 años; en Escocia y Holanda el eccema atópico aumentó alrededor de 50% y lo mismo ocurrió con enfermedades como el asma. Sólo en un estudio, en población de Holanda, se detectó una disminución de las patologías asociadas con el asma y de las hospitalizaciones secundarias, probablemente porque el manejo ambulatorio de este cuadro ha mejorado de manera considerable (Tabla I).
Tabla I. Aumento de fenómenos alérgicos en países desarrollados
Hay algún grado de controversia respecto de la nomenclatura y definición de las reacciones adversas a los alimentos, pero en general se acepta que:
Un aspecto muy importante en el estudio de la alergia a los alimentos es el tratar de determinar sus causas. Se sabe que en la génesis del eccema y del asma de origen ambiental participan factores genéticos porque: en el eccema hay una concordancia de 85% en las manifestaciones entre los gemelos monocigóticos y sólo de 21 % entre los dizigóticos; para en el asma estos porcentajes son 75% y 16%, respectivamente. Hay evidencia de que para estos cuadros existen factores predisponentes codificados en más de un cromosoma, es decir, se trata de enfermedades de origen poligénico; además, los individuos que desarrollan fenómenos de tipo alérgico por lo general tienen antecedentes familiares de atopia y otras formas de sensibilización; más aún, algunos grupos étnicos son muy susceptibles a desarrollar alergias de tipo alimentario, como es el caso de la población afroamericana.
Otro grupo de factores involucrados en la patogenia de los fenómenos alérgicos corresponden al ambiente materno-perinatal y a factores que afectan al lactante menor. Por ejemplo, las madres más jóvenes tienden a tener hijos con mayor susceptibilidad a la sensibilización a alergenos alimentarios; los niños que tienen alto peso de nacimiento también son más susceptibles; la explicación de esta observación reside en que se postula que los recién nacidos de muy bajo peso tienen su sistema inmunológico inmaduro y que esta inmadurez los protege de las sensibilizaciones precoces; la administración temprana de algunas proteínas exógenas, como sucede con la llamada mamadera oculta que reciben a veces los recién nacidos en la sala de recién nacidos y, por último, factores dependientes del nivel del saneamiento ambiental, de las infecciones que afectan al lactante durante los primeros meses de vida y de algunos métodos empleados para su prevención (vacunas), que estimulan el sistema inmune.
Diversas investigaciones confirman que el desarrollo de los fenómenos atópicos está relacionado con factores ambientales:
Existen diversos mecanismos localizados a nivel de las mucosas del tracto respiratorio y del tubo digestivo que protegen de la penetración de antígenos. En la mucosa intestinal, los mecanismos actúan como barreras superpuestas, de manera que aunque en forma aislada ninguno de ellos es 100% eficaz, el conjunto representa una defensa flexible y de alta eficiencia. Algunos de estos mecanismos defensivos son de naturaleza no inmunológica y operan en el lumen del tubo digestivo; ejemplos de dichos mecanismos son la acidez gástrica, la actividad de los enzimas proteolíticos gástricos y pancreáticos, la acción detergente de las sales biliares y el peristaltismo intestinal sumado al flujo de jugo intestinal.
Otros mecanismos, también de naturaleza no inmunológica, se encuentran ubicados directamente en la superficie de la mucosa y son la principal defensa contra los antígenos: entre estos mecanismos están: la integridad de las uniones intercelulares y la normalidad funcional de las células epiteliales intestinales; cuando estos factores fallan se vuelve posible la penetración de antígenos al interior del organismo, donde ocurre su interacción con el aparato inmune y se produce la sensibilización. Uno de los ejemplos más citados en este sentido, pero menos probados, es el de la diarrea por rotavirus.
Otros mecanismos de defensa frente a antígenos provenientes del ambiente (incluyendo los alimentos) son la producción y descarga de mucus; los receptores falsos en las membranas de los enterocitos, la capacidad del epitelio intestinal de digerir a nivel intracelular (digestión lisosomal) péptidos y proteínas y, por último en esta lista incompleta, la microbiota residente del intestino grueso, que estimula el aparato inmune local, degrada alergenos, produce metabolitos para los colonocitos y posee receptores falsos en la superficie de los microorganismos.
También existen mecanismos de defensa de naturaleza inmune, de los cuales uno de los mejor caracterizados es la secreción de inmunoglobulinas de tipo IgA, y el funcionamiento de mecanismos combinados, de naturaleza inmune y no inmune, tales como la secreción de mucus desencadenada por la presencia de complejos antígeno-anticuerpo en las vecindades del epitelio intestinal, que además estimula el peristaltismo y el arrastre de los antígenos. De los complejos antígeno-anticuerpo que traspasan la mucosa intestinal la mayor parte sufre un proceso de fagocitosis e inactivación e hidrólisis en las células de Küpfer del hígado así como en otros elementos del sistema retículo endotelial.
Como se manifestó anteriormente, los individuos con antecedentes familiares de atopia tienen altas probabilidades de desarrollar este tipo de cuadros. Si ambos padres son atópicos, la probabilidad de que sus hijos también desarrollen fenómenos de atopia es muy alta, pero si ambos presentan la misma sintomatología, la probabilidad es mayor; esta probabilidad disminuye si un sólo un progenitor es atópico, y más aún si no hay antecedentes de atopia en la familia. Por lo tanto, los individuos pueden nacer con un patrimonio genético que los hace susceptible a estos cuadros; pero hay que tener en cuenta que el individuo sólo va a presentar esta patología si el ambiente es favorable a su desarrollo (Tabla II).
Tabla II. Base familiar de la alergia a proteínas de la leche de vaca (Tomado de: Bousquet J. J Allergy Clin Immunol 1986; 78: 1019-1022)
Existen enfermedades, de prevalencia variable, en las que se altera la permeabilidad del epitelio intestino y, por lo tanto, su calidad de barrera frente al ambiente externo (2). Entre ellas están ciertas patologías intestinales, como las alergias gastrointestinales, que hacen que aquel individuo aquejado por alergia a una proteína sea susceptible a desarrollar otra manifestación de alergia intestinal frente a una proteína distinta; por este motivo hay individuos que son alérgicos a múltiples proteínas de la dieta. Otras patologías predisponentes son las gastroenteritis agudas, las infecciones intestinales y las enfermedades inflamatorias crónicas, que hacen que el epitelio intestinal sufra daños más o menos intensos o que partes del tejido conectivo de la mucosa queden al descubierto porque el epitelio se ha desprendido. La enfermedad celíaca y las cirugías intraabdominales en las que se manipula el tubo digestivo, y especialmente el intestino delgado, tabién se asocian con una mayor tendencia a la aparición de fenómenos alérgicos.
Existen enfermedades sistémicas que aumentan la permeabilidad a macromoléculas presentes en el lumen del intestino delgado, como las radiaciones ionizantes, las quemaduras extensas, el shock séptico, el shock hipovolémico y la desnutrición: se trata de cuadros en los que está afectada la calidad de la barrera intestinal, que ha sido demostrada mediante pruebas de laboratorio (prueba de la lctulosa-manitol). Por otra parte, los antiinflamatorios no esteroidales también modifican profundamente la permeabilidad de la mucosa (Sanderson IR, Walker WA. Uptake and transport of macromolecules by the intestine. En: AL de Weck, HA Sampson. Intestinal inmmunology and food allergy. Nueva York. Raven Press 1995; 19-36).
Entre los cuadros clínicos asociados probablemente con alteraciones resultantes de la inmadurez de la barrera mucosa intestinal, se describen, en recién nacidos y en la niñez temprana (respuesta clínica inmediata) la enterocolitis necrotizante, la alergia gastrointestinal, síndrome de la muerte súbita infantil, dermatitis, diarrea toxigénica y malabsorción; y en etapas tardías de la niñez y edad adulta las enfermedades inflamatorias del tubo digestivo, la hepatitis crónicamente activa, algunas formas de nefritis y las enfermedades mediadas por complejos autoinmunes (Walker WA. Transmucosal passage of antigens. En: Food Allergy. E. Schmidt, ed. Nueva York. Raven Press. 1988: 15-34).
La lactancia materna tiene un efecto preventivo beneficioso, debido a que provee una cantidad importante de inmunoglobulina A secretora, galactopolisacáridos, marcadores falsos y anticuerpos específicos. Se ha sugerido que la incidencia de atopia sería mayor en niños con alto riesgo de desarrollar este cuadro en base a sus antecedentes familiares, y que reciben lactancia materna durante menos de 4 meses, en comparación con aquellos amamantados por más tiempo. Los niños que tienen bajo riesgo de desarrollar atopia, amamantados por más o por menos de 4 meses, tienen baja incidencia, en comparación con aquellos con alto riesgo evaluado a través de sus antecedentes familiares.
En los cien últimos años, en los países occidentales se ha masificado el uso de agua potable, a la vez que ha disminuido la contaminación bacteriana y parasitaria del ambiente, lo que ha significado una disminución importante de enfermedades como la diarrea y el cólera, mientras que el uso masivo de antibióticos ha disminuido la incidencia de algunas otras patologías infecciosas. Al mismo tiempo, y sobre todo a partir del final de la década de 1940, el mundo ha sido testigo de un aumento sostenido de las patologías alérgicas. Teniendo en cuenta lo antedicho, una de las hipótesis más atractivas para explicar el aumento de los fenómenos alérgicos plantea que cuando los individuos viven en ambientes “limpios”, que no suponen un estímulo constante de su sistema inmune, el funcionamiento de éste se modifica y se vuelve más susceptible a “cometer errores” en la interpretación de estímulos de tipo inmune, los que, en vez de resultar en fenómenos de inmunidad activa o de tolerancia, se traducen por manifestaciones alérgicas. Este enunciado es el de la hipótesis de la higiene, que fue elaborada por Strachan en 1989 (3) y que se aplica también a la realidad chilena, en la que se ha podido observar un aumento de la incidencia del asma y de manifestaciones de atopia, entre ellas del eccema, en el transcurso de los últimos decenios.
La primera explicación formulada para sustentar esta hipótesis se basó en el paradigma de las respuestas T helper del sistema inmune, que tiene capacidad para montar dos tipos de reacciones: T helper 1 (Th1) y T helper 2 (Th2). Las reacciones tipo Th2 son reacciones de tipo humoral, en el curso de las cuales el estímulo antigénico se traduce en la producción de inmunoglobulinas y los cuadros alérgicos están exacerbadas en; en las reacciones de tipo Th1, los linfocitos estimulan una reacción inflamatoria en base a células. El feto in útero no tiene capacidad para desarrollar reacciones de tipo inflamatorio y todo su sistema inmune está inhibido, aunque esto no quiera decir que está inactivo: el motivo para esto es que el feto vive en el seno de un individuo totalmente distinto a él desde el punto de vista inmunológico; de modo que el feto debe vivir en un estado de anergia total o de poca capacidad de reaccionar a través de mecanismo de tipo inmune. En circunstancias normales los recién nacidos son levemente anérgicos, sin capacidad de reaccionar, pero tienen tendencia a secretar mayor cantidad de las citoquinas que regulan las respuestas humorales, las que pueden resultar en reacciones alérgicas. En épocas anteriores, en el curso del primer año de vida, las enfermedades respiratorias altas e infecciones intestinales repetidas, además del paso continuo de microorganismos a lo largo del tubo digestivo que producía el cuadro conocido como enteropatía ambiental crónica, el sistema de inmunidad humoral, que podía llegar a producir alergias era parcialmente inhibido por el predominio del sistema de reacción defensiva basado en la proliferación de linfocitos Th1, que permite una reacción inflamatoria adecuada; es decir, el patrón inicial de respuesta de tipo Th2 se desplazaba hacia un patrón Th1 al madurar éste bajo el estímulo de infecciones repetidas, sintomáticas y asintomáticas.
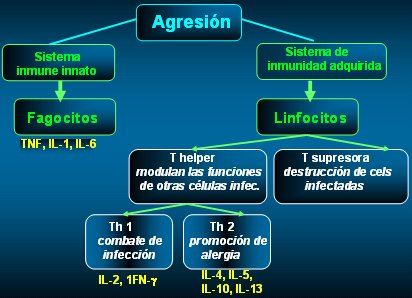
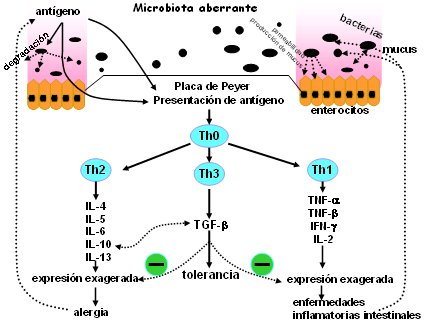
En la Figura 2 se resumen los mecanismos inmunitarios que llevan al desarrollo de ambos tipos de respuesta (Th1 y Th2). Sin embargo, entre la llegada del antígeno y la operación del sistema inmune adaptativo, que elabora respuestas específicas humorales y/o celulares, o frente a una agresión, reacciona primeramente otro conjunto de mecanismos que constituyen el sistema innato, que se caracteriza por ser rápido e inespecífico y que tiene como efectores a los neutrófilos, monocitos circulantes, macrófagos y factores del complemento. Si el sistema innato no es capaz de neutralizar al antígeno (o al microorganismo invasor) entra en juego el sistema adaptativo, de inmunidad adquirida, mucho más lento, específico, mediado por los linfocitos, que producen reacciones de inmunidad a través de la proliferación de células ayudantes (helper). Éstas células helper modulan la función de otras células a través de la producción de mensajeros humorales y son capaces de activan los mecanismos Th1, de combate celular de la infección, o de tipo Th2, de promoción de la inmunidad humoral, que puede resultar en la aparición de fenómenos de alergia. A cada uno de estos dos tipos de mecanismos corresponden mensajeros específicos: IL-2 y TNF-g para las respuestas de tipo Th1 y las interleuquinas (IL)-4, IL-5, IL-10 e IL-13, en el caso de las respuestas de tipo Th2.
Figura 2. Mecanismos de la respuesta inmunitaria
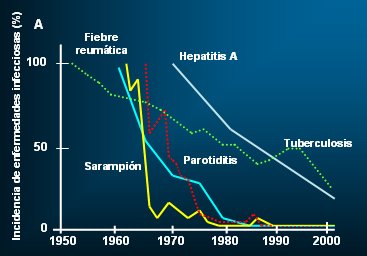
La Figura 3 es un gráfico realizado con datos provenientes de países europeos, en el que se ve cómo han disminuido las enfermedades infecciosas entre los años 1950 y 2000, lo que refleja el grado en que se ha perdido el estímulo para nuestro sistema inmune.
Figura 3. Incidencia de enfermedades infecciosas prototípicas: 1950-2000
Se postula actualmente que hasta el momento de nacer, el sistema inmune del ser humano ha tendido a desarrollarse hacia respuestas de tipo TH 2; y que al entrar en contacto con los antígenos del ambiente, puede existir una ventana crítica en la cual el organismo se sensibiliza a algunas macromoléculas. En algunos individuos esta sensibilización lleva hacia la atopia y las patologías alérgicas, pero en la mayoría la evolución lleva al predomino de un tipo de respuesta diferente: la tolerancia. En este sistema el antígeno, que incluso puede ser alergeno potencial, induce una reacción inicial pero a continuación se produce la supresión de la capacidad de reaccionar y el individuo vive sin síntomas, si ni siquiera saber que ha tenido contacto con un potencial alergeno, y sigue en esta ausencia de reacción a esta molécula a veces por el resto de la vida. Por otro lado, una cierta proporción de los individuos desarrollan las manifestaciones manifestaciones clínicas que denominamos de atópicas, pero que con el tiempo también son capaces de evolucionar hacia el desarrollo de la tolerancia (Fig. 4). Esto quiere decir que existe una evolución que permite que un mismo antígeno produzca respuestas de inmunidad humoral, de tipo celular, de alergia o de tolerancia dependiendo de la naturaleza de la molécula que representa el estímulo al sistema inmune, del estado funcional de dicho sistema, de su maduración y, por supuesto, del patrimonio genético del individuo.
Figura 4. Desarrollo de las respuestas inmunes en lactantes sanos y atópicos
Se ha podido determinar que algunos microorganismos son capaces de estimular respuestas de tipo Th1 o de modificarlas . Los agentes relevantes para la aparición de los fenómenos tipo Th1 son:
El sistema inmune del tubo digestivo es el mayor del organismo, ya que es la superficie del intestino delgado es más extensa del organismo: un adulto tiene aproximadamente 1,7 m2 de piel, 80 m2 de superficie de su aparato respiratorio, 20 m2 de su sistema génitourinario y 400 m2 de su intestino delgado, de manera que toda molécula foránea que entra en contacto con la superficie del epitelio intestinal está en relación con la interfase más grande entre el medio ambiente (representado por el lumen del tubo digestivo), su superficie más extensa y el aparato inmune más grande del organismo. La correcta estimulación del sistema inmune del tubo digestivo contribuye a mantener patrones adecuados de respuesta y a través de esto, a prevenir los fenómenos de tipo alérgico. El sustituto actual de esa estimulación adecuada probablemente está representado por los probióticos y esto explicaría sus efectos sobre la calidad de las respuestas inmunes de quienes los consumen con una frecuencia adecuada.
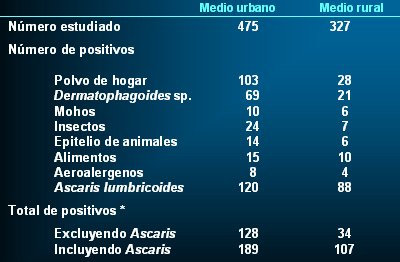
En un estudio de Neil Lynch realizado en Venezuela hace prácticamente 22 años (4), se demostró que los individuos provenientes del medio rural que tienen contacto frecuente con la piel de animales y sus células descamadas, con diversos aeroalergenos, con parásitos, y que sufren picaduras de insectos, que entran en contacto con numerosas especies de vegetales y sus pólenes, tienen menor reactividad alérgica que quienes viven en el medio urbano, pese a tener, paradojalmente, recuentos absolutos más altos de eosinófilos circulantes y de IgE total (Tabla III). Esta diferencia en la reactividad es especialmente notable frente a dermatofagoides y el polvo del hogar, porque en un departamento cerrado, con aire acondicionado, se respira un ambiente en el que se recirculan alergenos que favorecen las respuestas de tipo alérgico (Th2).
Tabla III. Reactividad cutánea en adultos venezolanos de áreas urbanas y rurales. *Número de individuos con al menos una prueba cutánea positiva (tomado de: Lynch NR et al. Incidence of atopic disease in a tropical environment: partial independence from intestinal helminthiasis. J Allergy Clin Immunol 1984; 73(2): 229-233)
El problema es que si sólo existiera un sistema de respuesta tipo Th1 o Th2 el organismo viviría en un estado de inflamación perpetua, porque habría reacciones inmunes frente a todo lo que es exógeno al organismo, lo cual no ocurre en la mayoría de las personas. Entonces, el esquema que es muy clásico y que sigue siéndolo, explica algunos tipos de respuestas pero no todas. Para lograr una mejor explicación de la forma en que opera el sistema inmune se ha desarrollado una hipótesis unificadora, que considera que en los individuos sanos no funcionan en forma constante ni Th1 ni Th2, sino que habría otro tipo de respuesta (Th3), cuyo resultado es la tolerancia. Si el organismo estuviera montando respuestas de tipo inflamatorio en forma constante, el requerimiento de energía sería imposible de sostener: es un hecho de observación habitual las infecciones crónicas, de larga duración, aunque sean de intensidad relativamente baja, terminan por causar repercusiones nutricionales intensas; por eso se postula que los sistemas innato y adaptativo funcionan conectados entre sí, y que el organismo normalmente tiende a las reacciones de tolerancia.
Cuando los antígenos o microorganismos entran por el tubo digestivo, normalmente se estimularía el sistema Th3 (o Th0, como también se los llama) y no el sistema Th 1 ni Th 2; el sistema Th3 estaría modulado por una combinación de citoquinas que lleva a la tolerancia y hace que normalmente el sistema inmune genere una reacción inmune, pero que a continuación ésta sea suprimida, en un proceso que puede incluir la deleción del clon de linfocitos y que como resultado, un nuevo encuentro con el antígeno no genere una reacción. El problema se presenta cuando, en presencia de enfermedades intestinales, el sistema inmune deriva hacia reacciones de tipo Th2 o, en el caso de las enfermedades infecciosas, a respuestas de tipo Th1 (Fig. 5).
Figura 5. La microbiota intestinal: el potencial de inmunomodulación
Esto quiere decir que el tubo digestivo debe ser capaz de diferenciar cuando hay presentes moléculas inocuas o bacterias, pero además, entre estas últimas debe distinguir entre aquellas que son beneficiosas y aquellas con potencial patógeno (Fig. 6). Este proceso es muy complejo porque en el tubo digestivo hay una microbiota residente muy abundante, cuya magnitud es tal que en un gramo de deposiciones hay un número de microorganismos que supera al de seres humanos que habitan la Tierra, que representa un órgano que pesa un kilo y medio y en el que el número total de microorganismos que la componen supera por un factor de aproximadamente 100 el número de células eucariotas que conforman el organismo humano.
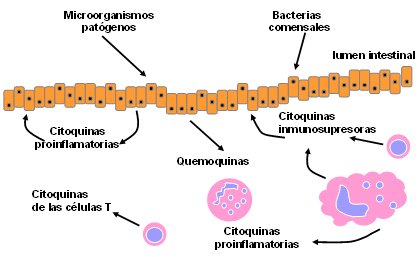
El mecanismo que permite al organismo reconocer a las bacterias que circulan a lo largo del tubo digestivo o que residen en él como inofensivas o potencialmente patológicas reside en las células epiteliales intestinales. Existen en ellas secuencias de polisacáridos que se han llamado toll-like receptors (TLR) y otra llamada CD14 que reconocen patrones moleculares presentes en la membrana de las bacterias y que son típicos para cada especie de bacteria y eso le señala al organismo, en primer lugar, que van transitando microorganismos por el lumen intestinal; en segundo lugar, señala que debe mostrar una respuesta adecuada y, en tercer lugar, orienta a que esta respuesta ojalá sea de tipo Th1 y no Th2.
Figura 6. Interacción de las bacterias con el epitelio intestinal y las respuestas del huésped
Los TLR y los CD14 reconocen los patrones moleculares asociados con patógenos, los patrones CpG no metilados del ADN y los lipopolisacáridos. El reconocimiento por los enterocitos de factores bacterianos se hace de acuerdo con el siguiente patrón:
En resumen, las bacterias cambian la composición de la membrana celular de los enterocitos y actúan sobre sensores celulares y del aparato inmune, para entregar una información que permite el establecimiento de mecanismos de defensa que bloquean la translocación de microorganismos desde la mucosa intestinal hacia el resto del organismo; por lo tanto, una microbiota residente normal en cuanto a su número y composición, junto con los organismos que transitan periódicamente a lo largo del tubo digestivo, son fundamentales para modulación de la homeostasis del sistema inmune y la salud del individuo y juega un papel fundamental en la disminución de las posibilidades de que se produzcan reacciones de tipo alérgico.











 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Desafíos en Nutrición y Alimentación, organizado por la Sociedad Chilena de Pediatría entre los días 26, 27 y 28 de abril de 2006.
Directores: Dr. Francisco Moraga y Dr. Eduardo Atalah.
 Expositor:
Oscar Brunser[1]
Expositor:
Oscar Brunser[1]

Citación: Brunser O. Food allergy: definitions and clarifications. Medwave 2006 Sep;6(9):e3529 doi: 10.5867/medwave.2006.09.3529
Fecha de publicación: 1/10/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Food tolerance and food aversion. A joint report of the Royal College of Physicians and the British Nutrition Foundation. J R Coll Physicians Lond. 1984 Apr;18(2):83-123. | PubMed |
Food tolerance and food aversion. A joint report of the Royal College of Physicians and the British Nutrition Foundation. J R Coll Physicians Lond. 1984 Apr;18(2):83-123. | PubMed | Sanderson IR, Walker WA. Uptake and transport of macromolecules by the intestine. En: Intestinal inmmunology and food allergy. Nueva York: Raven Press, 1995; 19-36.
Sanderson IR, Walker WA. Uptake and transport of macromolecules by the intestine. En: Intestinal inmmunology and food allergy. Nueva York: Raven Press, 1995; 19-36.