Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la Universidad de Chile durante los días 3 de abril y 7 de agosto de 2002.
Editor Científico: Dr. José Manuel Ojeda.
Plegamiento y Degradación de Proteínas Intracelulares
Las proteínas se pliegan en su conformación final gracias a unas proteínas llamadas chaperonas intracelulares. La HSP (heat shock protein) es un ejemplo, que además de asegurar un plegamiento apropiado, juega un papel en el replegamiento de proteínas desnaturadas, como las que participan en transducción de señales y regulación del ciclo celular.
La ubiquitina proteosoma es importante para la degradación de proteínas intracelulares. La poliubiquitinación apunta a proteínas para destrucción por el proteosoma. Este proceso regula el nivel de muchas proteínas reguladoras del ciclo celular de corta vida. La activación del factor nuclear KB (NF KB), clave en la transcripción y factor antiapoptótico, es controlado por la degradación por proteosomas de la proteína inhibidora IKB. Las moléculas de adhesión celular (CAM) involucradas en metástasis y angiogénesis, tales como: E-selectina, ICAM-1 y VCAM-1 son reguladas por el NF KB. Por lo tanto la down regulación de los eventos dependientes de NF KB resultan en la mejoría de las propiedades apoptóticas de los agentes citotóxicos y limitación de las metástasis tumorales. La inhibición del sistema ubiquitina proteosoma puede detener la progresión del cáncer in vivo e in vitro (31) mediante mecanismos que afectan el crecimiento de metástasis y la angiogénesis.
17 allyloaminogeldanamicin (17-AAG). El análogo de benzoquinona ansamicina 17-AAG se une fuertemente a un bolsillo ATP/adenosina difosfato en HSP 90. Esto detiene la transición de HSP 90 de complejo inmaduro a maduro que le permite la adquisición de proteínas chaperonas de conformación estable o funcional. Estas proteínas chaperonas incluyen factores de transcripción (por ej. receptores de retinoides y hormonales) y protein kinasas (por ej. Raf 1, erbb2 y cdk4) que regulan el crecimiento y proliferación celular. Como resultado, la estabilidad de estas proteínas se reduce, promoviéndose la degradación por proteasas. Estudios preclínicos demuestran sinergismos esquema dependientes con agentes como paclitaxel y doxorrubicina. Estudios fase I muestran hepatotoxicidad reversible que limita la dosis.
Sistema ubiquitina proteosoma
PS-341: es un ácido dipeptidil boronico modificado derivado de leucina y fenilalanina que inhibe selectivamente el proteosoma mediante la unión reversible a los sitios activos de enzimas. Inhibe el crecimiento y es citotóxico para muchos tipos de células tumorales humanas en rango nanomolar. La inhibición del proteosoma 20 S ha sido demostrado ex vivo en muestras de pacientes. Toxicidades incluyen neuropatía sensitiva dolorosa, diarrea y fatiga (32). En un estudio reciente fase I se demostró respuesta parcial en NSCLC.
Kinasa dependiente de ciclina (cdk)
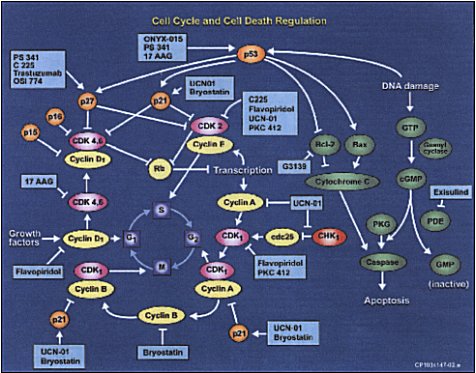
Cdk junto con ciclinas complementarias son puntos regulatorios del ciclo celular (Figura 2)
La expresión aberrante de estas proteínas, particularmente de ciclinas involucradas en fase G1 del ciclo celular (ciclinas D y E), han sido asociadas con una variedad de cánceres humanos, incluido el cáncer de pulmón. La inhibición de la actividad de cdk bloquea la liberación del factor de transcripción E2F, causando falla en la activación de genes de transcripción requeridos para entrar a la fase S. Esto lleva a la detención del ciclo celular en células neoplásicas y también mejora la apoptosis inducida por quimioterapia.
Flavopiridol (HMR 1275, L86-8275): es una flavona sintética 3-hidroxi-1 metipiperidinil que muestra una actividad antiproliferativa y antitumoral potente mediante la inhibición selectiva de la cdk1 (también conocida como cdc2), cdk2, cdk4 y cdk7 (33) produciendo detención del ciclo celular en los límites G1/S y G2/M como también produciendo downregulación de la ciclina D1. Estudios preclínicos demuestran que el flavopiridol produce muerte celular programada, promueve diferenciación, inhibe procesos angiogénicos y modula eventos de la transcripción sin importar el status de bcl-2 o p53.
Reciente evidencia sugiere que el flavopiridol puede unirse directamente e inhibir el DNA.
En un estudio fase I de administración de flavopiridol en infusión continua por 72 horas cada 3 semanas la diarrea limitó la dosis (34). Al administrar antidiarreicos surgieron otras toxicidades como astenia, eventos vasculares trombóticos, elevación leve reversible de pruebas hepáticas y un síndrome proinflamatorio con elevación de reactantes de fase aguda.
En un estudio fase II, en pacientes no tratados previamente con NSCLC metastásico, no hubo respuesta clínica, pero se observó una estabilización de la enfermedad (35). El sinergismo dependiente de la secuencia en la combinación con agentes citotóxicos ha sido demostrado. En cáncer de pulmón se ha observado sinergismo en la combinación de paclitaxel con cisplatino. Esto es atribuido a efectos diferenciales esperados en la cinética del ciclo celular, si bien la especificidad de la secuencia observada en la inducción de apoptosis de estas combinaciones queda por ser probada.
Figura 2. Cascada reguladora de apoptosis.
Exisulind. GMPc es un 2º mensajero acoplado a una proteína G que activa objetivos GMPc dependientes, uno es la proteína kinasa G, que a su vez activa la cascada reguladora de apoptosis (Figura 2) MEKK1-SEK1-JNK1. La actividad del GMPc es regulada por una familia de enzimas hidrolíticas llamadas fosfodiesterasas (PDE). Exulind, una sulfona derivada del inhibidor de la COX (ciclooxigenasa) sulindac. Exisulind no inhibe a la COX constitutiva ni a la inducible. En líneas celulares de cáncer de colon Exisulind induce apoptosis mediante inhibición de PDE GMPc o PDE2 o PDE 5, causando un aumento del GMPc y la kinasa G (36).
La propiedad de inducir apoptosis de exisulind es diferente a la producida por la quimioterapia convencional. El p53 o bcl-2 parecen ser innecesarios para su acción en líneas celulares tumorales, mientras que la inducción de apoptosis de las otras drogas quimioterápicas son dependientes de p53 o bcl-2. Por lo tanto, las células tumorales que contengan mutaciones de p53 o sobreexpresen bcl-2 que son resistentes a la quimioterapia convencional, pueden responder a exisulind produciendo muerte celular programada. Se ha visto sinergia citotóxica cuando exisulind se combina con otros agentes quimioterápicos (taxanos, cisplatinos y gemcitabina) (37). Un reciente estudio fase I de docetaxel administrado semanalmente más exisulind diario resultó con buena tolerancia y estabilización de enfermedad. Un estudio fase III, doble ciego, aleatorio de docetaxel con o sin exisulind se está realizando en pacientes con NSCLC avanzado que no han respondido a régimen basado en platino.
Cox 2
Lípidos bioactivos como prostaglandinas generadas de la vía de la ciclooxigenasa, modulan respuestas involucradas en el crecimiento tumoral, angiogénesis e invasión. Los dos genes que codifican para las dos isoformas de la COX, COX 1 y COX 2 son homólogos en más de 60%. En varios tumores malignos, incluyendo cáncer de pulmón, se encuentran elevaciones en la concentración de COX 2 (38). En adenocarcinomas invasivos se ha visto una elevación de 70 %. En SCLC es negligible y en los carcinomas escamosos muestran baja expresión. Existe evidencia que indica que COX 2 juega un importante papel en el cáncer. Esta enzima no está normalmente presente en muchos tejidos, sin embargo es inducible por una variedad de citokinas y mitógenos. La expresión de COX 2 se observa en vasos neoformados en modelos de tumores injertados, mientras que en condiciones normales la vasculatura sólo expresa COX 1. La presencia de COX 2 en la neovasculatura de muchos tumores humanos y en metástasis, como también la dependencia de la neovascularización inducida por FGF-2 (factor de crecimiento de fibroblastos) en la expresión de COX 2, sugiere un rol predominante en la regulación tumoral y angiogénesis.
Sin embargo, COX 2 no es obligatoria para mantener el fenotipo maligno. En apoyo a esta conclusión, el tratamiento de líneas celulares injertadas derivadas de un tumor pulmonar murino con inhibidores de la COX 2, produjeron sólo una pequeña represión del tumor, sin embargo existe una sobreexpresión temprana de COX 2 en lesiones; esto, sumado al hecho de que en animales tratados con inhibidores de COX 2 previo a exposición carcinogénica, indica que podría ser usado como quimioprevención.
P53
La proteína p53 es una fosfoproteína nuclear supresora de tumores. Activa dos vías en respuesta al daño del DNA: la vía de detención de crecimiento para la reparación del DNA o la vía apoptótica. Una vez que los genes p53 son borrados o mutados, las células se vuelven susceptibles a daño del DNA y crecimiento celular no regulado. Esto se asocia con mal pronóstico en pacientes con NSCLC (39). La presencia de la mutación de p53 puede identificar a pacientes resistentes a la quimioterapia o radioterapia (40).
La terapia génica dirigida a p53 ha sido explorada en modelos pre-clínicos. Transferencia génica de tipos de p53 mediada por virus puede inducir apoptosis y restaurar la sensibilidad a drogas o radioterapia en células de NSCLC por inyección intratumoral (41). La administración sistémica no es recomendada por la inmunogenicidad de los agentes, además de la reacción cruzada de algunos anticuerpos. Al igual que otras terapias génicas, existen problemas en la transferencia eficiente y la replicación deficiente del vector.
Además, los adenovirus pueden unirse e inactivar p53 nativo en células normales, debiendo establecerse temas de seguridad. Estudios iniciales usando transferencia génica de p53 vía inyección intratumoral no revelan toxicidad significativa. Se observó actividad antitumoral en 3 de 9 pacientes con NSCLC (42). Los tres pacientes tenían enfermedad endobronquial y recibieron inyecciones intratumorales por vía broncoscópica. La baja eficiencia de transducción asociada al vector retroviral fue el factor limitante mayor.
También, dos estudios fase I no aleatorios escalados, con y sin cisplatino, en pacientes que habían fallado a la quimioterapia y radioterapia reforzaron la observación previa de actividad antitumoral en el grupo de pacientes con enfermedad endobronquial obstructiva (41). De manera similar, un estudio fase II de combinación de radioterapia en pacientes con NSCLC localizado, reveló una mejoría de la anatomía patológica en un 62% entre 8 pacientes evaluados en comparación con controles históricos recibiendo radioterapia o quimioterapia sola. Cinco (39%) de 13 pacientes lograron respuesta completa, mientras que otros (15%) presentaron respuestas parciales. Sin embargo, en un estudio fase II multicéntrico terminado, de combinación de quimioterapia y transferencia de p53 nativo intratumoral, que comparó respuestas aisladas de lesiones tumorales tratadas con una lesión comparable que no estaba recibiendo terapia génica dentro de cada paciente, no hubo beneficio adicional en pacientes con NSCLC avanzado recibiendo quimioterapia de primera línea efectiva (43). Estas observaciones sugieren que el beneficio de esta terapia génica estaría confinado a pacientes recibiendo radioterapia concomitante o a pacientes refractarios a quimioterapia con enfermedad endobronquial.
ONYX-015: es un adenovirus con replicación selectiva que apunta a células tumorales con un gen p53 no funcionante. Esto tiene la ventaja que la proteína adenoviral, E1B 55K, inactiva la proteína p53 nativa para permitir replicación viral. El adenovirus mutante ONYX-015 contiene una deleción del gen E1B que hace su replicación defectuosa en células normales. Sin embargo, puede replicarse en células tumorales que carecen de p53 funcional, con la consecuente lisis de la célula. ONYX-015 es sinérgico con paclitaxel y cisplatino en líneas celulares de cáncer de pulmón, un efecto que es dependiente de p53 mutante (44). La eficacia puede estar limitada por el clearence inmunológico mediado por el huésped antes que el virus llegue a su objetivo. Sistemas de entrega tópica o intratumoral pueden ser de gran beneficio en esta situación, se encuentran en progreso.
Bcl-2: debido a que las terapias génicas destinadas a producir un aumento de función en la expresión de proteínas proapoptóticas, los esfuerzos se han enfocado primariamente en la down regulación de antagonistas de la apoptosis como bcl-2 y bcl-XL usando oligonucleótido antisense (AS ODN). Varios miembros de la familia bcl-2 de productos proto-oncogénicos han sido implicado como proteínas antiapoptóticas y han mostrado ser reguladores clave en la vía de la muerte celular. La expresión de bcl-2 se ha correlacionado con mal pronóstico en un número de cánceres. Su presencia confiere quimio y radiorresistencia in vitro (45).
G3139: la inducción de apoptosis de las células tumorales se ha logrado experimentalmente usando seggmentos cortos de DNA de una hebra complementaria a la región codificadora de mRNA de bcl-2. La administración de AS ODN en estudios pre-clínicos demuestra down regulación eficaz de la proteína bcl-2 e inducción de apoptosis. Se cree que el tratamiento asociado con AS ODN bcl-2 especifico, podría evitar la quimioresistencia y aumentar la citotoxicidad. Esto ha sido demostrado in vitro e in vivo en varios modelos tumorales humanos, incluyendo SCLC.
G3139 (Genasense): es un oligonucleótido fosfortiato que apunta a los primeros seis codones del marco de lectura del mRNA del bcl-2. La toxicidad observada en estudios de fase I en pacientes con linfoma no Hodgkin fue similar a la de otros AS ODN reportados, reforzando la observación del efecto de clase del esqueleto de fosforotioato. Una toxicidad potencial secuencia específica es la linfopenia reversible. Resultados iniciales de un estudio fase II en SCLC quimiorefractario demostró 17% de estabilización de enfermedad, si bien las respuestas objetivas están por verse (46).

 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la Universidad de Chile durante los días 3 de abril y 7 de agosto de 2002.
Editor Científico: Dr. José Manuel Ojeda.
 Expositora:
Elsa Cabrera Acosta[1]
Expositora:
Elsa Cabrera Acosta[1]

Citación: Cabrera E. New therapies in lung cancer III. Medwave 2002 Dic;2(11):e3502 doi: 10.5867/medwave.2002.11.3503
Fecha de publicación: 1/12/2002

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión