Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 2 de abril y 7 de octubre de 2003. Director: Dr. José Manuel Ojeda.
Los anticuerpos o inmunoglobulinas juegan un rol importante como componentes del sistema inmune, que circulan en la sangre y el sistema linfático y se unen a antígenos extraños expresados en células tumorales, infectadas por virus o transplantadas, desencadenando una reacción de destrucción celular mediada por otras células del sistema inmune (linfocitos citotóxicos, natural killer, macrófagos) y por complemento.
Gracias a las características mencionadas, los anticuerpos monoclonales han ejercido un gran impacto en el campo de la investigación y la terapéutica. En las últimas dos décadas, el desarrollo y la disponibilidad de estos anticuerpos ha permitido el desarrollo de nuevos marcadores, tanto para aplicaciones in vitro como para monitorizar respuestas a tratamientos, efectuar detección histoquímica de células malignas, identificar subgrupos de pacientes con pronóstico favorable o desfavorable y distinguir algunos tumores de origen desconocido.
Su utilidad terapéutica ha sido más gradual, pero ya se está comenzando a apreciar un impacto en la práctica clínica. El tratamiento con anticuerpos monoclonales ha producido regresión objetiva de tumores como linfomas, melanomas, cáncer de mama y ciertas leucemias; así, desde 1997, rituximab ha sido aprobado para su uso en Linfoma indolente no Hodgkin, y trastuzumab (Herceptinâ) se utiliza para potenciar la terapia contra el cáncer de mama y, aparentemente, este tipo de terapia tendrá un impacto en la oncología clínica.
Sin embargo, existen aún una serie de obstáculos para la aplicación de la terapia monoclonal, incluyendo la entrega de anticuerpos a la célula tumoral, la especificidad de antígeno, la modulación antigénica, la heterogenicidad de la expresión antigénica, la potenciación de los mecanismos efectores y la disminución de la respuesta inmune frente a inmunoglobulinas extrañas.
Para mejorar el efecto de la seroterapia monoclonal, los anticuerpos han sido asociados a drogas citotóxicas, radioisótopos e inmunotoxinas, de modo que, cuando el anticuerpo se une a la célula que contiene el antígeno, entrega su carga tóxica directamente al tumor.
Otra utilidad de estos anticuerpos es que pueden ser utilizados para seleccionar células stem normales de la médula ósea o sangre, para transplantes en pacientes con cáncer. Se han desarrollado numerosos estudios preclínicos, como también fase I y II, con distintos tipos de inmunoconjugados.
Para utilizar anticuerpos monoclonales, deben tomarse en cuenta varias consideraciones. En primer lugar, es necesario tener claro que el antígeno sobre el cual se va a actuar está presente en el tumor y que no se presenta, o tiene menor expresión, en los tejidos normales.
También es importante considerar la inmunogenicidad de los anticuerpos, ya que estos frecuentemente corresponden a anticuerpos no humanos, capaces de montar una respuesta inmune por sí mismos. La vida media es otro factor, ya que es importante saber por cuánto tiempo se mantendrán sus efectos. También existen problemas logísticos, como el costo y la disponibilidad, en el caso de los anticuerpos monoclonales anti-idiotipo (1, 2).
Kohler, en 1977, mostró que es posible efectuar la hibridización entre células malignas plasmáticas mantenidas en cultivos, con células linfoides inmunes. Estas células híbridas crecen en cultivo y producen anticuerpos con una especificidad única, gracias a la selección de un clon.
Células esplénicas de un animal que ha sido inmunizado con un antígeno extraño son colocadas en un cultivo, en conjunto con células de mieloma y en presencia de polietilenglicol, para estimular la fusión celular. La célula del mieloma es una mutante que no secreta inmunoglobulinas y ha sido seleccionada por tener un déficit de enzima que evita su crecimiento en un medio que contiene hipoxantina, aminopterina y timidina (medio HAT).
Las células esplénicas normales no crecen en este medio, ni las células de mieloma tampoco; sólo los híbridos pueden hacerlo, gracias a que la enzima perdida es provista por la fusión de las células. Luego de la selección, las células híbridas son clonadas, y los anticuerpos secretados por cada clon de células híbridas (conocido como hibridoma), pueden ser testeados para determinar su especificidad.
Existen anticuerpos para distintos tipos histológicos tumorales; muchos de éstos tienen una reactividad cruzada con células normales de algunos tipos. La mayoría de estos anticuerpos son hechos en líneas celulares de ratón, y esto es un problema, ya que pueden ser reconocidos como antígenos extraños por el sistema inmune humano.
Estos son los llamados anticuerpos monoclonales murinos, que fueron el primer tipo de anticuerpo monoclonal utilizado en la práctica clínica. Son activadores débiles del sistema inmune y se utilizan sólo contra tumores linfoides de células B y T; suelen mostrar sólo actividad antitumoral transitoria. Los anticuerpos diseñados contra tumores sólidos demostraron ser muy inactivos cuando se estudiaron en ensayos clínicos. Un problema en la utilización de anticuerpos monoclonales murinos ha sido el desarrollo de anticuerpos humanos anti-ratón (HAMA).
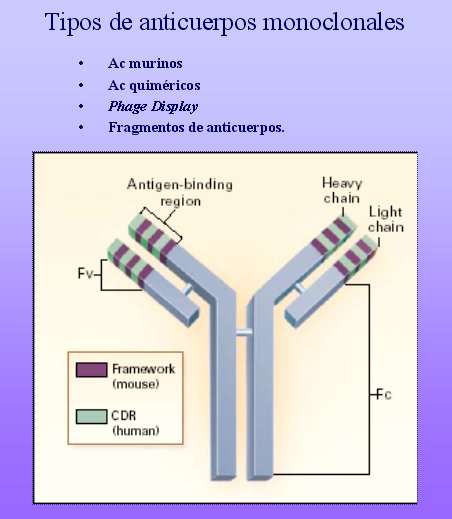
Con el tiempo, algunas estrategias utilizadas en tecnología molecular genética han permitido el desarrollo de anticuerpos monoclonales humanos, las que se resumen en la figura 1. En primera instancia se generaron anticuerpos quiméricos, los cuales tienen una región constante, de origen humano, y una región variable, de origen murino. Esto se logra por clonación molecular de genes de inmunoglobulinas de cadenas livianas y pesadas que se relacionan con componentes de la región variable de éstas, asociadas a regiones constantes de las cadenas pesadas y livianas. Alternativamente, utilizando el proceso de recombinación homóloga, las regiones constantes de cadenas livianas y pesadas humanas pueden ser introducidas dentro de células de hibridomas para reemplazar la región constante murina.
Otro enfrentamiento, que utiliza el denominado fragmento CDR, involucra clonar sólo regiones variables de las cadenas livianas y pesadas murinas que se unen al antígeno (CDR 1, 2 y 3) y reemplazar las correspondientes regiones humanas.
Una tercera alternativa para la producción de anticuerpos monoclonales humanos involucra el “phage display” , basado en la recombinación randomizada independiente que ocurre entre genes de cadenas pesadas y livianas clonadas.
Más recientemente se están utilizando ratones que tienen grandes regiones de genes de inmunoglobulina humana no reorganizados, generados por tecnología transgénica, en los cuales los genes de las cadenas de inmunoglobulinas de ratones han sido eliminados, para luego realizar inmunización y generación de hibridomas subsecuentes, produciendo hibridomas con genes que secretan inmunoglobulinas específicas. Éstos tienen la ventaja de presentar menor inmunogenicidad que los anticuerpos murinos, además de una vida media más larga y mayor actividad inmunológica, pero tienen el problema de que es más difícil producirlos en cantidades farmacológicas.
También se dispone de fragmentos de anticuerpos, que son pequeñas proteínas que se unen a antígenos o fragmentos de anticuerpos, tales como F(ab’)2 o proteínas de cadena única que unen antígenos. Pueden tener vidas medias más cortas, mayor acceso al tumor y ventajas como transportadores (2, 3).
Figura 1.
En cuanto a los mecanismos de acción, los anticuerpos monoclonales pueden ejercer su efecto de distintas maneras. Pueden producir efectos directos, como la apoptosis de la célula tumoral, ya que al unirse a receptores celulares pueden desencadenar una serie de señales intracelulares que llevan a ésta; además, pueden bloquear receptores de factores de crecimiento, deteniendo la proliferación celular tumoral.
Dentro de los efectos indirectos están reclutar células que tienen capacidad citotóxica, como monocitos, macrófagos y natural killer que presentan receptores para Fc; así, estas células se unen al anticuerpo monoclonal y son activadas, llevando a la lisis tumoral; este mecanismo se denomina citoxicidad celular mediada por anticuerpos (ADCC). Por otro lado, los anticuerpos también se unen al complemento, conduciendo a un efecto directo de muerte celular conocida como citotoxicidad dependiente de anticuerpos (3).

 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 2 de abril y 7 de octubre de 2003. Director: Dr. José Manuel Ojeda.
 Expositor:
Luis Villanueva O.[1]
Expositor:
Luis Villanueva O.[1]

Citación: Villanueva L. Overview of monoclonal serum therapy in cancer. Medwave 2004 Sep;4(8):e3494 doi: 10.5867/medwave.2004.08.3494
Fecha de publicación: 1/9/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión