 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 2 de abril y 7 de octubre de 2003. Director: Dr. José Manuel Ojeda.
Cada año se diagnostica cáncer de ovario a 20.000 mujeres en los Estados Unidos, siendo la mayoría de los casos esporádicos y 10%, hereditarios (1,2). Existe el síndrome de cáncer de mama-ovario y el síndrome de cáncer colorrectal hereditario no polipósico (HNPCC), de los cuales forma parte el cáncer de ovario.
El primero es el más frecuente, y según estudios poblacionales se caracteriza por el alto riesgo de presentación temprana de cáncer de mama y ovario en parientes cercanos (56% en cáncer de mama y 16% en cáncer de ovario), encontrándose con mayor frecuencia mutaciones de los genes BRCA1 y BRCA2.
El segundo se asocia a un amplio espectro de localizaciones de cáncer, siendo el principal el colorrectal, pero pueden aparecer neoplasias en endometrio, estómago, intestino delgado, sistema hepatobiliar y ovario, los que se relacionan con mutaciones de genes diferentes a los BRCA (3,4,5).
El carcinoma de ovario es la neoplasia ginecológica de peor pronóstico, debido a que en la mayoría de los casos (70%) se detecta en forma tardía, lo que se explica fundamentalmente por tres factores: en primer lugar, su ubicación profunda dentro de los órganos de la pelvis, lo que dificulta su examen clínico, otorgándole mayor valor utilidad como herramienta de screening a los exámenes de laboratorio y a la imagenología. En segundo lugar, los síntomas que produce el cáncer de ovario son vagos y tardíos, y por último, aún se desconoce en forma detallada la progresión histológica de la neoplasia, lo que nos permitiría detectar tempranamente lesiones predisponentes, patologías preneoplásicas o estadios iniciales de la enfermedad (6).
Por lo expuesto, se requiere alcanzar una mayor comprensión de la etiopatogenia del cáncer ovárico, y, paralelamente, desarrollar nuevas y más eficientes técnicas de prevención, detección y tratamiento de esta neoplasia, campo en el que el estudio genético está cumpliendo un papel destacado.
Tanto los casos esporádicos como familiares requieren de la acumulación de mutaciones genéticas, causadas por un proceso multifactorial, donde influyen la edad y la exposición a carcinógenos (por ejemplo, ambientales), sobre una predisposición genética (6).
Los estudios epidemiológicos han dado claves sobre ciertos factores asociados a la carcinogénesis del cáncer de ovario, pero los mecanismos exactos aún no están claros. La hipótesis más probable es que la ovulación se asocia al desarrollo de mutaciones genéticas en el epitelio ovárico (7). Varias líneas de investigación apuntan a esta observación, haciéndose más consistente al identificarse al embarazo y a los anticonceptivos orales como factores protectores (8); ahora bien, el mecanismo por el cual la ovulación puede dañar al DNA somático aún no está claro (9).
Se piensa que la transformación maligna de un epitelio normal es causada por alteraciones en la regulación de la proliferación, apoptosis, envejecimiento y reparación del DNA. La patogénesis molecular de éstos cánceres es heterogénea, lo que se refleja en la variedad de características clínicas, así como en la histología, diferenciación, potencial de invasión y metástasis (6).
La mayoría de los cánceres de ovario hereditarios se deben a mutaciones de los genes BRCA1 y BRCA2, genes supresores de tumores que normalmente están activos en nuestro organismo, requiriendo de la alteración de sus dos alelos para expresarse, ya sea por una mutación puntual o por una deleción. La alteración de uno de los alelos determina un patrón de herencia autosómica dominante (6,10).
El gen BRCA1, identificado en el año 1994, está ubicado en el cromosoma 17q12-21; tiene 24 exones que codifican una proteína de 1.863 aminoácidos, cuya función celular aún no es entendida por completo, pero podría tener un rol en la reparación del DNA (18,19,20,32). No se ha encontrado diferencia histológica entre los cánceres ováricos de tipos esporádico y familiar que tienen una forma mutada del gen.
La mayoría de los casos se presentan en una etapa avanzada, y corresponden histológicamente a carcinomas serosos moderada a mal diferenciados (11-13). En algunos estudios, la sobrevida ha sido mejor en personas que presentan la mutación del gen en comparación a casos esporádicos comparados por edad, etapa y otros factores pronósticos (14,15). Otros estudios, por el contrario, no han mostrado un pronóstico más favorable al estar presente dicha mutación (16). Ninguno de ellos permite una conclusión definitiva (6).
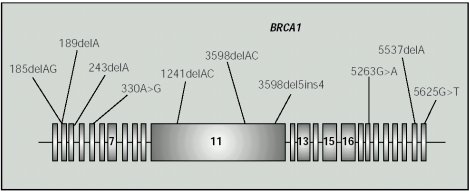
El gen mutado implica un riesgo de presentar cáncer de ovario de 20-60% a los 40 años (17,19). Se han identificado más de 250 mutaciones diferentes en BRCA1 en familias de alto riesgo (18)(Figura 1).
Figura 1. Estructura del gen BRCA 1 y localización de las mutaciones detectadas.
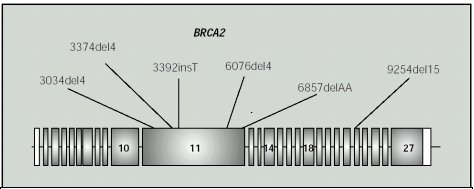
El gen BRCA2 fue identificado en 1995; está ubicado en el cromosoma 13q12-13 y tiene 27 exones que codifican una proteína de 3.418 aminoácidos(18-19). También podría tener un rol en la reparación del DNA. Al principio se creía que su mutación era poco frecuente en el cáncer de ovario familiar, en relación a los BRCA1, pero hoy en día se identificado en hasta un 30-35% de los casos (6,18,19,20,32) (Figura 2).
Figura 2. Estructura del gen BRCA 2 y localización de las mutaciones detectadas.
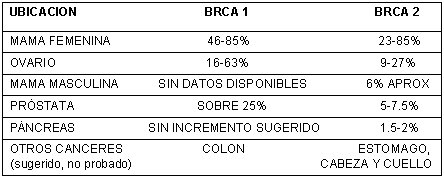
También se han asociado alteraciones de ambos genes a otras ubicaciones de cáncer, como se aprecia en la tabla I (20).
Tabla 1. Rango de riego de cáncer estimado (a los 70 años) en relación a mutaciones de genes BRCA 1.
Se realizó un estudio sobre la prevalencia de las mutaciones de los genes BRCA en una población de judíos Ashkenazi, en un total de 1.004 pacientes, de los cuales 896 casos presentaban cáncer epitelial de ovario, con un 26,1% de mutaciones de BRCA 1 y 2, encabezada por un 17,3% de BRCA1 tipo 185delAG, 2,2% BRCA1 tipo 5382insC y 6,6% BRCA2 tipo 6174delT.
Casi 30% de las mutaciones BRCA se observaron en cáncer epitelial invasivo del ovario y 4,3% en carcinomas ováricos de bajo potencial maligno (“borderline”). En los no epiteliales, sólo 5% tenía mutaciones, pero sólo del tipo BRCA2-6174delT, mientras que en 27,9% de las neoplasias peritoneales primarias se encontraron los mismos tres tipos de mutaciones que se observaron en los cánceres epiteliales. Además, la mayoría de las mutaciones BRCA1 y 2 se encontraron bajo los 60 años de edad, predominando los primeros, sin diferencia estadísticamente significativa entre ambos genes en cuanto a estadío, grado y morfología, pero con una notoria ausencia de sus mutaciones en el tipo mucinoso (21).
Con el descubrimiento del rol de estos genes en el cáncer de ovario hereditario, se infiere que sería aconsejable un manejo profiláctico más agresivo sólo en un grupo determinado de pacientes con antecedentes familiares de riesgo, y no incluir a todos los pacientes de familias de alto riesgo.
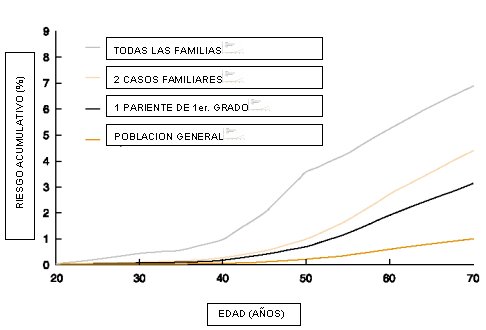
Aunque todavía no se sabe el grado de penetrancia de estas mutaciones, sabemos que aumentan el riesgo de cáncer de ovario en relación a la población general, y hay trabajos que demuestran que las mutaciones de los genes BRCA1 y BRCA2 son elevadas en pacientes con cáncer de ovario familiar y/o cáncer de mama de aparición en edades tempranas, y que el riesgo acumulativo de desarrollar un cáncer de ovario es proporcional al número de familiares afectadas (31) (Figura 3).
Figura 3. Riesgo de cáncer de ovario hereditario según familiares afectados.
Afortunadamente, la incidencia de este cáncer comienza a aumentar desde los 40 años, cuando la mayoría de las mujeres ya ha tenido hijos (6).
No se ha demostrado la eficacia de un screening para cáncer de ovario en mujeres que tengan estas mutaciones, ni con CA125 ni con ecotomografía transvaginal, pero se recomienda hacerlos desde los 30 a 35 años, cada 6 a 12 meses. Sí se ha visto una disminución de la mortalidad por este cáncer con la ooferectomía profiláctica, incluso mínimamente invasiva, a base de la técnica laparoscópica, en mujeres que ya han completado su paridad, pudiendo reemplazar el tratamiento quirúrgico por el uso de anticonceptivos orales en aquellas mujeres que deseen tener más hijos previo a este procedimiento (6,20).
Existe evidencia de que la mutación de genes BRCA podría aumentar el riesgo de cáncer de las trompas de Falopio, por lo que éstas también deberían extirparse (22).
El principal beneficio de conocer la existencia de mutaciones BRCA1 y 2, es la información individual y familiar en el riesgo de cáncer de ovario, que puede implicar decisiones sobre la prevención y vigilancia del cáncer (23,24,25), lo que puede implicar complejas limitaciones y riesgos.
Por un lado, podríamos observar un resultado negativo, pero como no es una prueba completamente sensible, esto no es necesariamente definitivo, ya que pueden presentarse mutaciones indetectables o una mutación en otro gen que predisponga al cáncer de ovario, pudiendo atraer alteraciones psicológicas, como el sentirse excluido de la familia o de las decisiones tomadas bajo el supuesto de tener la mutación, como el no tener más hijos o frustración al presuponer que se tiene la alteración y que el examen no la evidencia (26,27,28).
Por otra parte, un resultado positivo conlleva tres opciones clínicas: vigilancia, anticoncepción oral y/o ooferectomía profiláctica, asociándose esta última a conflictos personales en relación a la femeneidad, sexualidad, fertilidad y el envejecimiento (28,29).
Si luego del consejo genético se decide realizar la prueba, se recomienda partir con un familiar a quien se le haya diagnosticado cáncer de ovario o mama (26), por tres razones: primero, si se trata de una mutación familiar es más probable encontrarla en un miembro afectado que en uno que no lo esté; segundo, una mutación encontrada en una persona con cáncer toma mayor importancia en relación a una persona sana, y tercero, una mutación relacionada con un cáncer permite que en el futuro se realicen las pruebas genéticas a los familiares, orientándose específicamente a dicha mutación (28).
Los criterios para elegir a quién realizar las pruebas genéticas son (18):
Criterios de mujeres de alto riesgo (18):
Criterios de mujeres de bajo riesgo (18):
Sin embargo, esto tiene implicancias éticas y psicológicas. Por ejemplo, el hecho de saberse portador de estas mutaciones podría hacer sentir a la persona enferma, o sentirse forzado a realizar algún tratamiento profiláctico por su expresión clínica (28).
Un número limitado de estudios han revisado la participación de la pareja en la decisión de realizar estas pruebas genéticas y en las resoluciones posteriores, demostrándose la importancia del apoyo conyugal, especialmente ante la necesidad de tomar medidas profilácticas drásticas (30).
Se ha establecido que los antecedentes familiares de cáncer de ovario aumentan el riesgo de desarrollar esta enfermedad, más aún según el número y/o relación familiar. Sin embargo, la mayoría de las mujeres que desarrollan este cáncer no tienen una historia familiar.
Varias mutaciones de genes se han identificado como causales de esta predisposición en gran parte de los cánceres familiares, entre ellos los genes BRCA1 y BRCA2. Basadas en esto, se están realizando intervenciones profilácticas para disminuir el riesgo en pacientes portadoras de estas mutaciones o que tienen antecedentes familiares de peso, pero en las que no se han demostrado alteraciones genéticas. De todas formas, la evidencia en cuanto a la eficacia de éstas todavía es insuficiente.
No se deben olvidar las implicaciones psicológicas que producen estas pruebas y sus resultados en los pacientes involucrados, tanto en el ámbito personal como familiar.
Ésta es un área en desarrollo, que cada vez cobra más importancia, especialmente en patologías hereditarias, orientando a una mejor vigilancia y tratamiento, en beneficio del paciente y su descendencia.




 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 2 de abril y 7 de octubre de 2003. Director: Dr. José Manuel Ojeda.
 Expositora:
Claudia Osorio[1]
Expositora:
Claudia Osorio[1]

Citación: Osorio C. Ovarian cancer and mutations of the BRCA1 and BRCA2 genes. Medwave 2004 Jun;4(5):e3493 doi: 10.5867/medwave.2004.05.3493
Fecha de publicación: 1/6/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Boring CC, Squires TS, Tong T. Cancer statistics, 1993. CA Cancer J Clin. 1993 Jan-Feb;43(1):7-26. | CrossRef | PubMed |
Boring CC, Squires TS, Tong T. Cancer statistics, 1993. CA Cancer J Clin. 1993 Jan-Feb;43(1):7-26. | CrossRef | PubMed | Claus EB, Schildkraut JM, Thompson WD, Risch NJ. The genetic attributable risk of breast and ovarian cancer. Cancer. 1996 Jun 1;77(11):2318-24. | CrossRef | PubMed |
Claus EB, Schildkraut JM, Thompson WD, Risch NJ. The genetic attributable risk of breast and ovarian cancer. Cancer. 1996 Jun 1;77(11):2318-24. | CrossRef | PubMed | Struewing JP, Hartge P, Wacholder S, Baker SM, Berlin M, McAdams M, et al. The risk of cancer associated with specific mutations of BRCA1 and BRCA2 among Ashkenazi Jews N Engl J Med. 1997 May 15;336(20):1401-8.
| CrossRef | PubMed |
Struewing JP, Hartge P, Wacholder S, Baker SM, Berlin M, McAdams M, et al. The risk of cancer associated with specific mutations of BRCA1 and BRCA2 among Ashkenazi Jews N Engl J Med. 1997 May 15;336(20):1401-8.
| CrossRef | PubMed | Steichen-Gersdorf E, Gallion HH, Ford D, Girodet C, Easton DF, DiCioccio RA, et al. Familial site-specific ovarian cancer is linked to BRCA1 on 17q12-21. Am J Hum Genet. 1994 Nov;55(5):870-5.
| PubMed | PMC |
Steichen-Gersdorf E, Gallion HH, Ford D, Girodet C, Easton DF, DiCioccio RA, et al. Familial site-specific ovarian cancer is linked to BRCA1 on 17q12-21. Am J Hum Genet. 1994 Nov;55(5):870-5.
| PubMed | PMC | Lynch HT, Lemon SJ, Karr B, Franklin B, Lynch JF, Watson P, et al. Etiology, natural history, management, and molecular genetics of hereditary nonpolyposis colorectal cancer: genetics counseling implications. Cancer Epidemiol Biomarkers Prev. 1997 Dec;6(12):987-91. | PubMed |
Lynch HT, Lemon SJ, Karr B, Franklin B, Lynch JF, Watson P, et al. Etiology, natural history, management, and molecular genetics of hereditary nonpolyposis colorectal cancer: genetics counseling implications. Cancer Epidemiol Biomarkers Prev. 1997 Dec;6(12):987-91. | PubMed | Wenham RM, Lancaster JM, Berchuck A. Molecular aspects of ovarian cancer. Best Pract Res Clin Obstet Gynaecol. 2002 Aug;16(4):483-97. | CrossRef | PubMed |
Wenham RM, Lancaster JM, Berchuck A. Molecular aspects of ovarian cancer. Best Pract Res Clin Obstet Gynaecol. 2002 Aug;16(4):483-97. | CrossRef | PubMed | Cramer DW, Hutchinson GB, Welch WR. Determinants of ovarian cancer risk. II. Inferences regarding pathogenesis. J Natl Cancer Inst. 1983 Oct;71(4):717-21. | PubMed |
Cramer DW, Hutchinson GB, Welch WR. Determinants of ovarian cancer risk. II. Inferences regarding pathogenesis. J Natl Cancer Inst. 1983 Oct;71(4):717-21. | PubMed | Whittemore AS, Harris R, Intyre J. Characteristics relating to ovarian cancer risk . Collaborative analysis of twelve case – control studies. II. Invasive epithelial ovarian cancer in white women. Am J Epidemiol. 1992 Nov 15;136(10):1184-203. | PubMed |
Whittemore AS, Harris R, Intyre J. Characteristics relating to ovarian cancer risk . Collaborative analysis of twelve case – control studies. II. Invasive epithelial ovarian cancer in white women. Am J Epidemiol. 1992 Nov 15;136(10):1184-203. | PubMed | Schildkraut JM, Bastos E, Berchuk A. Relationship between lifetime ovulatory cycles and overexpression of mutant p53 in epithelial ovarian cancer. J Natl Cancer Inst. 1997 Jul 2;89(13):932-8. | CrossRef | PubMed |
Schildkraut JM, Bastos E, Berchuk A. Relationship between lifetime ovulatory cycles and overexpression of mutant p53 in epithelial ovarian cancer. J Natl Cancer Inst. 1997 Jul 2;89(13):932-8. | CrossRef | PubMed | Scully R. Role of BRCA gene disfunction in breast and ovarian cancer predisposition. Breast Cancer Res. 2000;2(5):324-30 | CrossRef | PubMed |
Scully R. Role of BRCA gene disfunction in breast and ovarian cancer predisposition. Breast Cancer Res. 2000;2(5):324-30 | CrossRef | PubMed | Berchuck A, Heron KA, Carney ME, Lancaster JM, Fraser EG, Vinson VL, et al. Frequency of germline and somatic BRCA1 mutations in ovarian cancer. Clin Cancer Res. 1998 Oct;4(10):2433-7. | PubMed |
Berchuck A, Heron KA, Carney ME, Lancaster JM, Fraser EG, Vinson VL, et al. Frequency of germline and somatic BRCA1 mutations in ovarian cancer. Clin Cancer Res. 1998 Oct;4(10):2433-7. | PubMed | Takahashi H, Behbakht K, McGovern PE, Chiu HC, Couch FJ, et al. Mutation analysis of the BRCA1 gene in ovarian cancers. Cancer Res. 1995 Jul 15;55(14):2998-3002. | PubMed |
Takahashi H, Behbakht K, McGovern PE, Chiu HC, Couch FJ, et al. Mutation analysis of the BRCA1 gene in ovarian cancers. Cancer Res. 1995 Jul 15;55(14):2998-3002. | PubMed | Stratton JF, Gayther SA, Russell P, Dearden J, Gore M, Blake P, et al. Contribution of BRCA1 mutations to ovarian cancer. N Engl J Med. 1997 Apr 17;336(16):1125-30. | CrossRef | PubMed |
Stratton JF, Gayther SA, Russell P, Dearden J, Gore M, Blake P, et al. Contribution of BRCA1 mutations to ovarian cancer. N Engl J Med. 1997 Apr 17;336(16):1125-30. | CrossRef | PubMed | Rubin SC, Benjamin I, Behbakht K, Takahashi H, Morgan MA, LiVolsi VA, et al. Clinical and pathological features of ovarian cancer in women with germ-line mutations of BRCA1. N Engl J Med. 1996 Nov 7;335(19):1413-6. | CrossRef | PubMed |
Rubin SC, Benjamin I, Behbakht K, Takahashi H, Morgan MA, LiVolsi VA, et al. Clinical and pathological features of ovarian cancer in women with germ-line mutations of BRCA1. N Engl J Med. 1996 Nov 7;335(19):1413-6. | CrossRef | PubMed | Modan B. BRCA1 mutations and survival in women with ovarian cancer. N Engl J Med. 1997 Apr 24;336(17):1255; author reply 1256-7. | PubMed |
Modan B. BRCA1 mutations and survival in women with ovarian cancer. N Engl J Med. 1997 Apr 24;336(17):1255; author reply 1256-7. | PubMed | Johannsson OT, Ranstam J Borg A, Olsson H. Survival of BRCA1 breast and ovarian cancer patients: a population-based study from southern Sweden. J Clin Oncol. 1998 Feb;16(2):397-404. | PubMed |
Johannsson OT, Ranstam J Borg A, Olsson H. Survival of BRCA1 breast and ovarian cancer patients: a population-based study from southern Sweden. J Clin Oncol. 1998 Feb;16(2):397-404. | PubMed | Whittemore AS, Gong G, Itnyre J. Prevalence and contribution of BRCA1 mutations in breast cancer and ovarian cancer: results from three U.S. population-based case-control studies of ovarian cancer. Am J Hum Genet. 1997 Mar;60(3):496-504. | PubMed | PMC |
Whittemore AS, Gong G, Itnyre J. Prevalence and contribution of BRCA1 mutations in breast cancer and ovarian cancer: results from three U.S. population-based case-control studies of ovarian cancer. Am J Hum Genet. 1997 Mar;60(3):496-504. | PubMed | PMC | Pharoah PD, Ponder BA. The genetics of ovarian cancer. Beast Practice & Research Clinical Best Pract Res Clin Obstet Gynaecol. 2002 Aug;16(4):449-68. | CrossRef | PubMed |
Pharoah PD, Ponder BA. The genetics of ovarian cancer. Beast Practice & Research Clinical Best Pract Res Clin Obstet Gynaecol. 2002 Aug;16(4):449-68. | CrossRef | PubMed | Grzybowska E, Siemiñska M, Zientek H, Kalinowska E, Michalska J, Utracka-Hutka B, et al. Germinale mutations in the BRCA1 gene predisposing to breast and ovarian cancers in Upper Silesia population. Acta Biochim Pol. 2002;49(2):351-6. | PubMed |
Grzybowska E, Siemiñska M, Zientek H, Kalinowska E, Michalska J, Utracka-Hutka B, et al. Germinale mutations in the BRCA1 gene predisposing to breast and ovarian cancers in Upper Silesia population. Acta Biochim Pol. 2002;49(2):351-6. | PubMed | Robson ME. Clinical considerations in the management of individuals at risk for hereditary breast and ovarian cancer. Cancer Control. 2002 Nov-Dec;9(6):457-65. | PubMed |
Robson ME. Clinical considerations in the management of individuals at risk for hereditary breast and ovarian cancer. Cancer Control. 2002 Nov-Dec;9(6):457-65. | PubMed | Hirsh-Yechezkel G, Chetrit A, Lubin F, Friedman E, Peretz T, Gershoni R, et al. Population attributes affecting the prevalence of BRCA mutation carriers in epithelial ovarian cancer cases in Israel. Gynecol Oncol. 2003 Jun;89(3):494-8. | CrossRef | PubMed |
Hirsh-Yechezkel G, Chetrit A, Lubin F, Friedman E, Peretz T, Gershoni R, et al. Population attributes affecting the prevalence of BRCA mutation carriers in epithelial ovarian cancer cases in Israel. Gynecol Oncol. 2003 Jun;89(3):494-8. | CrossRef | PubMed | Aziz S, Kuperstein G, Rosen B, Cole D, Nedelcu R, McLaughlin J, et al. A genetic epidemiological study of carcinoma of the fallopian tube. Gynecol Oncol. 2001 Mar;80(3):341-5. | CrossRef | PubMed |
Aziz S, Kuperstein G, Rosen B, Cole D, Nedelcu R, McLaughlin J, et al. A genetic epidemiological study of carcinoma of the fallopian tube. Gynecol Oncol. 2001 Mar;80(3):341-5. | CrossRef | PubMed | Hoskins KF, Stopfer JE, Calzone KA, Merajver SD, Rebbeck TR, Garber JE, et al. Assesment and counseling for women with a family history of breast cancer: a guide for clinicians. JAMA. 1995 Feb 15;273(7):577-85. | CrossRef | PubMed |
Hoskins KF, Stopfer JE, Calzone KA, Merajver SD, Rebbeck TR, Garber JE, et al. Assesment and counseling for women with a family history of breast cancer: a guide for clinicians. JAMA. 1995 Feb 15;273(7):577-85. | CrossRef | PubMed | Burke W, Daly M, Garber J, Botkin J, Kahn MJ, Lynch P, et al. Recommendations for follow-up care of individuals with an inherited predisposition to cancer. II. BRCA 1 and BRCA 2. JAMA. 1997 Mar 26;277(12):997-1003. | CrossRef | PubMed |
Burke W, Daly M, Garber J, Botkin J, Kahn MJ, Lynch P, et al. Recommendations for follow-up care of individuals with an inherited predisposition to cancer. II. BRCA 1 and BRCA 2. JAMA. 1997 Mar 26;277(12):997-1003. | CrossRef | PubMed | Armstrong K, Calzone K, Stopfer J, Fitzgerald G, Coyne J, Weber B. Factors associated with decisios about clinical BRCA 1 / 2 testing. Cancer Epidemiol Biomarkers Prev. 2000 Nov;9(11):1251-4. | PubMed |
Armstrong K, Calzone K, Stopfer J, Fitzgerald G, Coyne J, Weber B. Factors associated with decisios about clinical BRCA 1 / 2 testing. Cancer Epidemiol Biomarkers Prev. 2000 Nov;9(11):1251-4. | PubMed | Bars Culver J, Hull J, Levy-Lahad E. BRCA 1 and BRCA 2 hereditary breast / ovarian cancer. Genetest. [on line] | Link |
Bars Culver J, Hull J, Levy-Lahad E. BRCA 1 and BRCA 2 hereditary breast / ovarian cancer. Genetest. [on line] | Link | Davison C, Macintyre S, Smith GD. The potential social impact of predictive genetic testing for susceptibility to common chronic diseases: a review and proposed research agenda. Sociol Health Illn. 1994 Jun;16(3):340-71. | CrossRef | PubMed |
Davison C, Macintyre S, Smith GD. The potential social impact of predictive genetic testing for susceptibility to common chronic diseases: a review and proposed research agenda. Sociol Health Illn. 1994 Jun;16(3):340-71. | CrossRef | PubMed | Ponder M, Green JM. BRCA1 testing: some issues in moving fron research to service. Psycho-Oncology 1996 ; 5(3):223-32. | CrossRef |
Ponder M, Green JM. BRCA1 testing: some issues in moving fron research to service. Psycho-Oncology 1996 ; 5(3):223-32. | CrossRef | Balmer C. BRCA 1 and BRCA 2 genetic testing for ovarian cancer: is it all good news? Eur J Oncol Nurs. 2002 Sep;6(3):162-8. | CrossRef | PubMed |
Balmer C. BRCA 1 and BRCA 2 genetic testing for ovarian cancer: is it all good news? Eur J Oncol Nurs. 2002 Sep;6(3):162-8. | CrossRef | PubMed | Bluman LG, Rimer BK, Regan Sterba K, Lancaster J, Clark S, Borstelmann N, et al. Attitudes, knowledge, risk perceptions and decision-making among woman with breast and/or ovarian cancer considering testing for BRCA1 and BRCA2 and their spouses. Psychooncology. 2003 Jul-Aug;12(5):410-27. | CrossRef | PubMed |
Bluman LG, Rimer BK, Regan Sterba K, Lancaster J, Clark S, Borstelmann N, et al. Attitudes, knowledge, risk perceptions and decision-making among woman with breast and/or ovarian cancer considering testing for BRCA1 and BRCA2 and their spouses. Psychooncology. 2003 Jul-Aug;12(5):410-27. | CrossRef | PubMed | Reedy M, Gallion H, Fowler JM, Kryscio R, Smith SA. Contribution of BRCA1 and BRCA 2 to Familial Ovarian Cancer: A Gynecologic Oncology Group Study. Gynecol Oncol. 2002 May;85(2):255-9. | PubMed |
Reedy M, Gallion H, Fowler JM, Kryscio R, Smith SA. Contribution of BRCA1 and BRCA 2 to Familial Ovarian Cancer: A Gynecologic Oncology Group Study. Gynecol Oncol. 2002 May;85(2):255-9. | PubMed | Pericay C, Díez O, Campos B, Balmaña J, Domènech M, Lerma E, et al. Características clinicopatológicas y evolución clínica de pacientes con cáncer de mama y mutaciones en los genes BRCA 1 o BRCA 2. Med Clin (Barc). 2001 Jul 7;117(5):161-6. | PubMed |
Pericay C, Díez O, Campos B, Balmaña J, Domènech M, Lerma E, et al. Características clinicopatológicas y evolución clínica de pacientes con cáncer de mama y mutaciones en los genes BRCA 1 o BRCA 2. Med Clin (Barc). 2001 Jul 7;117(5):161-6. | PubMed |