Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 2 de abril y 7 de octubre de 2003. Director: Dr. José Manuel Ojeda.
El surgimiento de una nueva célula ocurre cuando otra célula se divide o cuando dos de ellas se fusionan, como en el caso del espermatozoide con el ovocito. Cualquiera de los dos fenómenos, inicia un programa de replicación celular que está codificado en el DNA y es ejecutado por proteínas. Este programa suele incluir un período de crecimiento celular, durante el cual se elaboran proteínas y se replica el DNA, seguido por la división celular, cuyo resultado es la aparición de dos células hijas.
Que una célula crezca y se divida es una decisión muy bien regulada por el organismo, la que asegura que un individuo adulto reemplace las células desgastadas o produzca más células en respuesta a una nueva necesidad. Ejemplos de esto último lo constituyen la división de las células hepáticas en respuesta a la remoción de parte del hígado, que finaliza cuando este órgano alcanza su tamaño normal; o bien, la proliferación de los eritrocitos en respuesta a la escasez de oxígeno existente en las grandes alturas. Sin embargo, fallas en el control de esta regulación llevan a determinadas células a multiplicarse sin que el organismo las necesite, dando origen a los tumores.
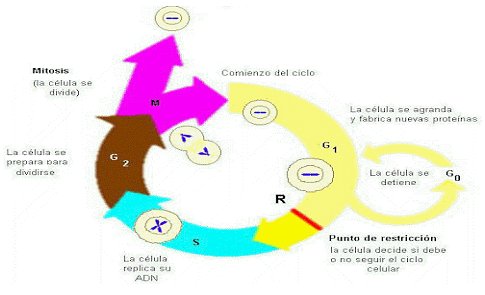
La mayoría de las células eucariontes vive de acuerdo a un reloj interno, o sea, progresan a través de una secuencia de fases denominadas en conjunto Ciclo Celular, que comienza cuando una célula hija, producto de la división de su progenitora (citocinesis), debe acumular energía (ATP) e incrementar su tamaño durante el intervalo denominado G1 de la interfase, que es el período más largo del ciclo celular.
Una vez adquirido el tamaño y ATP necesarios, comienza la fase S, en la que se sintetiza o duplica el DNA, que posteriormente se distribuirá equitativamente a las dos células que se originarán del proceso. Dado que la síntesis consume gran cantidad de energía, la célula debe entrar nuevamente en un proceso de crecimiento y adquisición de más energía denominado G2 para finalmente dividirse en la fase M (Mitosis).
El avance a lo largo del ciclo es controlado por puestos de chequeo estratégicos que comprueban el estado de la célula, revisando, por ejemplo, la cantidad y calidad del DNA intracelular o la presencia de sustancias nutritivas extracelulares.
Cuando se cumplen determinadas condiciones, la célula progresa hacia el próximo puesto de control; de no ser así, la célula detiene su progresión y trata de restablecer las condiciones óptimas para avanzar en el ciclo. Si este intento fracasa, la célula puede tomar decisiones tan drásticas como el suicidio para evitar la generación de células anormales.
La regulación del ciclo celular ocurre de diferentes formas en los distintos tipos celulares. Sólo unas pocas células de eucariontes pueden proliferar y dividirse tan rápido como las bacterias (30 minutos). La mayor parte de las células animales y vegetales demora entre 10 y 20 horas en duplicarse. Muchas células de animales adultos, como la mayor parte de las células nerviosas y las células del músculo estriado, nunca se dividen; otras, como las células hepáticas, conservan su capacidad de división, aunque en condiciones normales no la utilizan. Estas células han salido temporalmente del ciclo celular, después de la mitosis, y han entrado en un estado de latencia o quiescencia denominado G0, inserto en el intervalo G1, como se puede ver en la figura 1.
Figura 1. Fases del ciclo celular.
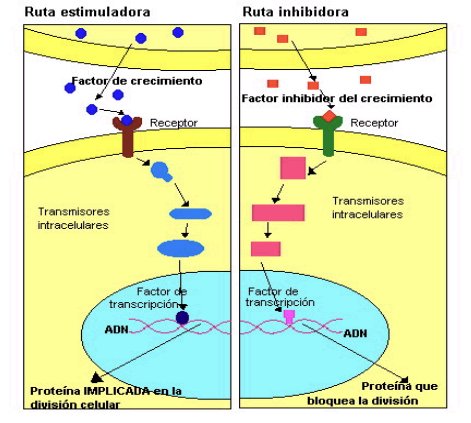
Factores ambientales, tales como cambios en la temperatura o el pH, carencia de nutrientes, etc., llevan a una disminución en la división celular. Las células normales se reproducen en respuesta a una cascada de señales enviadas por factores de crecimiento externos, deteniendo su división en respuesta a factores inhibidores, que también actúan por medio de cascadas de señales (Figura 2).
Figura 2. Cascadas de señales que regulan la división celular.
Las células tienen una determinada capacidad intrínseca para proliferar. En el organismo, una célula individual generalmente se divide hasta que llega a un grado de diferenciación en que ha adquirido las características óptimas para desarrollar una función determinada.
El proceso de diferenciación es el ejemplo más complejo de la dinámica celular, que se caracteriza por cambios morfológicos en la célula; así, las diferentes estructuras de una neurona y de una célula muscular, son un reflejo de sus respectivas funciones en la comunicación a larga distancia y en la contracción.
Esta diferenciación celular crea la diversidad de tipos celulares que surgen durante el desarrollo de un organismo a partir de un ovocito fertilizado, en un proceso de multiplicación y diferenciación de gran magnitud que hace que un mamífero, por ejemplo, que comienza como una sola célula, se convierta en un organismo con centenares de tipos celulares diversos, como el tejido muscular, nervioso o la piel. Ello denota de manera impresionante, la importancia del DNA en el control del comportamiento celular: el desarrollo es un conjunto de miles de cambios orquestados por el DNA, que se producen prácticamente sin fallas.
Las células tienen una capacidad finita para proliferar; en las células humanas, esta capacidad alcanza, en promedio, a alrededor de 50 divisiones. Durante la fase final, las células entran en un proceso de degeneración llamado crisis, que conduce a la senescencia o envejecimiento y, posteriormente, a la muerte celular, como un proceso programado denominado apoptosis.
Por otra parte, la muerte celular programada desempeña una importante función de control de la población, al establecer un equilibrio entre la proliferación y la muerte de las células. Además, elimina células innecesarias; un ejemplo es la formación de los dedos de manos y pies durante la embriogénesis, que son esculpidos por la muerte de las células que se encuentran en los espacios interpuestos entre ellos.
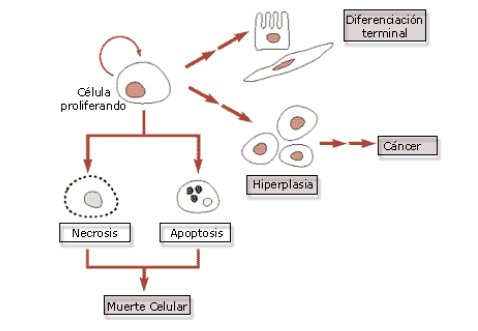
La apoptosis sigue un programa de acontecimientos por medio del cual desaparece todo vestigio de una célula. En la presente revisión focalizaremos nuestra atención en el proceso de Apoptosis, determinando los mecanismos que la gatillan (con especial interés en el Envejecimiento Celular), las vías por las cuales se desencadena y sus diferencias con la necrosis. Además, analizaremos cómo una célula puede llegar a la Inmortalización, una propiedad notable de las células cancerosas, con énfasis en la acción de la Telomerasa y la proteína P53 (Figura 3).
Figura 3. Muerte celular, diferenciación e inmortalización.
El envejecimiento se caracteriza por una declinación gradual en la reserva funcional orgánica, lo que disminuye la habilidad para mantener la homeostasis bajo condiciones
de estrés. Durante el envejecimiento, la degeneración progresiva de las células y la pérdida de la capacidad regenerativa van en aumento, llevando finalmente a la muerte.
Es difícil responder a qué edad una persona debiera ser llamada “mayor”. Por razones prácticas, se ha adoptado el criterio de la edad de 65 años; sin embargo, es necesario señalar que la edad calendario es un indicador imperfecto del envejecimiento, puesto que desde el punto de vista clínico, dos personas con la misma edad calendario son más diferentes cuando son mayores que en cualquier otra etapa de la vida, porque su condición física está relacionada no sólo con su envejecimiento, sino además, con su estatus sicológico y social y, fundamentalmente, con la presencia de enfermedades crónicas.
Se piensa que en muchos sistemas orgánicos, la disminución de la función comienza alrededor de los 30 a 40 años, incrementándose en un 1% anual, y aunque el envejecimiento en sí no constituye una enfermedad, éste puede facilitar el camino para que ellas se originen. Por ejemplo, la disminución del rendimiento cardíaco observada en personas mayores puede progresar a una falla cardíaca en presencia de factores precipitantes, como la hipertensión.
La introducción de técnicas como el cultivo celular y la biología molecular han provisto nuevas herramientas para el análisis del envejecimiento, a un nivel molecular. De esta manera, se ha demostrado que los fibroblastos humanos normales poseen una capacidad limitada para proliferar in vitro, pudiendo duplicarse un número finito de veces. Así, después de una fase de crecimiento exponencial, ellos alcanzan un punto (conocido como el límite Hayflick), después del cual detienen su división.
Los fibroblastos normales se duplican 70 a 80 veces, para luego entrar en un período prolongado de quiescencia denominado Estadio 1 de mortalidad (M1), en el que no se replican, pero mantienen su viabilidad y actividad metabólica basal por un largo tiempo. Estas células senescentes requieren mitógenos para permanecer en un estado viable, pero no son capaces de proliferar en presencia de estímulos de crecimiento. Posteriormente estas células pasan a un segundo estadío, denominado crisis (M2), que las lleva luego a la muerte.
Otro hallazgo fundamental de Hayflick fue la observación de que el potencial replicativo de las células en cultivo se relaciona con el número de células duplicándose, más que con la edad cronológica del cultivo; así, células criopreservadas por largos períodos, una vez reconstituídas, se dividieron el mismo número de veces que aquellas que no habían sido congeladas. Estudios posteriores correlacionan la disminución del potencial proliferativo celular in vitro, con el proceso de envejecimiento in vivo (4).
El envejecimiento está asociado con dos procesos que culminan con la muerte de la célula; éstos son, la degeneración celular progresiva y la disminución de la capacidad regenerativa.
La degeneración y la regeneración de células son procesos que ocurren en todas las etapas de la vida y que bajo condiciones normales permanecen bien balanceados, proporcionando un reemplazo activo de las células dañadas y una efectiva preservación de la integridad funcional de tejidos y órganos. Sin embargo, en la vejez, este balance se inclina hacia la degeneración, cuyos mecanismos parecen estar relacionados con la producción de especies oxígeno reactivas (ROS) y la glicosilación no enzimática de proteínas, ambos procesos ligados a factores ambientales.
La pérdida de la capacidad proliferativa y regenerativa, en tanto, estaría relacionada con factores endógenos que tienen que ver con un acortamiento del telómero de los cromosomas, genéticamente determinado, y con la apoptosis.
El proceso degenerativo ocurre primariamente en respuesta a estrés oxidativo. Los radicales libres o ROS son moléculas que poseen un electrón no pareado en su órbita más externa, lo que las hace ser extremadamente reactivas, puesto que ellas buscan estabilizar su configuración uniéndose a otras moléculas que le permitan recuperar los electrones perdidos.
En condiciones normales, existe en la célula una pequeña producción de ROS dada por la fosforilación oxidativa y la betaoxidación de los ácidos grasos; sin embargo, la generación de ROS aumenta significativamente con la exposición a irradiaciones, a algunos agentes químicos y frente a infecciones. En estas condiciones, los radicales libres pueden ocasionar daño estructural y funcional a las moléculas con las que interactúan, siendo los ácidos nucleicos, los fosfolípidos y las proteínas macromoléculas extremadamente susceptibles a daño mediado por ROS.
Las alteraciones ultraestructurales causadas por ROS son reconocidas y eliminadas por los mecanismos de reparación celular, sin embargo, el daño acumulativo puede exceder el potencial de reparación, originando envejecimiento y muerte celular.
Por otra parte, estudios realizados en animales de laboratorio han demostrado un aumento significativo de su vida media al exponerlos a dietas con restricción calórica, lo que puede ser atribuido a una menor producción de metabolitos y baja generación de ROS. Se ha sugerido, además, que la longevidad dependería en forma importante de un eficiente sistema antioxidante, que aminoraría los efectos del estrés oxidativo; sin embargo, este sistema es limitado, y la proporción en que las enzimas antioxidantes son resintetizadas declina con la edad.
La otra vía implicada en la degeneración celular relacionada con la edad, es la acumulación de productos finales de la glicolisación avanzada (AGE), que se forman por la reacción no enzimática entre grupos aldehídos de azúcares reductores y grupos aminos de proteínas.
La generación de AGE induce patologías en las que están involucradas importantes proteínas como hemoglobina, fibrinógeno o lipoproteínas, que conducen a estenosis de vasos sanguíneos o a daños de las membranas celulares, o bien, alteran proteínas de la matriz extracelular, como el colágeno, produciendo fallas en la interacción célula-matriz. Los AGE, además, pueden unirse a receptores específicos de células inmunes, gatillando la liberación de mediadores inflamatorios, con generación de ROS, lo que incrementa el daño producido por AGE.
En lo que respecta a la disminución de la capacidad regenerativa que ocurre durante el envejecimiento, esto se relaciona claramente con dos procesos ligados con el control del ciclo celular: la regulación de la proliferación y la inducción de la muerte celular programada.
Los tejidos maduros mantienen una homeostasis proliferativa, que optimiza el número de células en ellos. La muerte de una célula inicia el ciclo mitótico en otra célula que forma parte de ese tejido, y esa división celular produce dos células hijas, cuyo destino puede ser diferente; por una parte, la célula puede ser dirigida hacia una función tejido específica, reemplazando la pérdida, y alternativamente, la otra puede ser destinada a la preservación del potencial proliferativo para futuras divisiones, si fuera necesario, manteniéndose en calidad de “stem cell”.
Como se dijo anteriormente, el ciclo celular es altamente controlado, en sus diferentes etapas, por proteínas reguladoras específicas. Estudios recientes han revelado que la expresión de muchos genes involucrados en la progresión del ciclo está significativamente alterada en las poblaciones senescentes, comparadas con las poblaciones celulares jóvenes. Estos cambios se ejemplifican por el producto del gen Retinoblastoma (Rb), una proteína con actividad supresora de tumor, regulador negativo del ciclo, que actúa en G1 reclutando (inhibiendo) a E2F, que es un factor de transcripción que regula los genes necesarios para la síntesis de DNA. La inactivación de Rb (por fosforilación), permite que el ciclo celular se complete.
Está demostrado que en células senescentes la proteína Rb permanece constantemente desfosforilada, contribuyendo a la detención del ciclo celular. La fosforilación de Rb depende de kinasas dependientes de ciclina (CDK4 y CDK6). Estas kinasas, a su vez, están bajo el control inhibitorio de la proteína p21, la cual inactiva el complejo ciclina-CDK e induce un tipo de senescencia por frenación de la proliferación.
Interesantemente, la proteína p21 es regulada por la conocida proteína p53, que es la encargada de resguardar la integridad del genoma y es capaz de promover la detención del ciclo y la apoptosis celular en respuesta a daño del DNA. Fibroblastos animales deficientes de p53, proliferan vigorosamente y no sufren senescencia.
Algunos estudios recientes han vinculado la activación de genes silentes con los fenómenos de envejecimiento y longevidad. Así, se ha encontrado en levaduras al gen sir-2.1 que controla la vida media de estas especies, favoreciendo su longevidad. Este gen también ha sido encontrado en el gusano C. Elegans, realizando idéntica función, y se han encontrado muchos genes, tanto en levaduras, nematodes, Drosophila e incluso en ratones, que cuando son mutados, incrementan la longevidad.
Es muy interesante que, en muchos casos, las proteínas codificadas por aquellos genes tienen equivalentes en animales superiores; sorprendentemente, la vida media adulta del C. Elegans puede triplicarse como resultado de la actividad reducida de una vía de señales semejante a la que responde al factor de crecimiento de insulina o insulina símil (IGF-I) en mamíferos.
Sin embargo, no necesariamente el envejecimiento involucra los mismos procesos en todas las especies; es posible que especies distintas tengan mecanismos esenciales diferentes. El gerontologista George Martin ha distinguido entre mecanismos privados de envejecimiento, únicos para una especie o grupo animal, y aquellos públicos, como el daño oxidativo del DNA, que se supone común a todas las especies.
La participación de agentes oxidantes en la senescencia celular, se ha relacionado con la sobreexpresión del gen Ras. Trabajos realizados en fibroblastos humanos han demostrado que Ras activado incrementa los niveles de oxidantes, produciendo detención de la proliferación, situación que puede ser revertida reduciendo el oxígeno ambiental, o bien incorporando al cultivo antioxidantes permeables a la célula, que por lo demás, incrementan la vida media de los fibroblastos.
Entre las vías principales de señalización y/o mediadores en respuesta a la injuria oxidativa, se cuentan la vía de la kinasa, regulada por señales extracelulares (ERK), la kinasa amino terminal c-Jun (JNK), la cascada de kinasas activada por mitógenos (MAPK), la vía del fosfoinositol 3 kinasa (PI 3 K), el sistema de señalización del factor nuclear (NF)-kB, la activación de p53 y la respuesta a shock térmico.



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 2 de abril y 7 de octubre de 2003. Director: Dr. José Manuel Ojeda.
 Expositor:
Jorge Vergara Bórquez[1]
Expositor:
Jorge Vergara Bórquez[1]

Citación: Vergara J. Cell fate: death or immortalization (Part I). Medwave 2004 Ago;4(7):e3490 doi: 10.5867/medwave.2004.07.3490
Fecha de publicación: 1/8/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión