Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Internacional de Diabetes del Niño y del Adolescente, organizado por la Asociación Latinoamericana de Diabetes entre los días 19 al 21 de abril de 2006. Directora: Dra. Gloria López.
Cuando se plantea cuáles son los problemas de crecimiento en los niños con diabetes mellitus tipo 1 (DM1), lo primero que se debe recordar es el síndrome de Mauriac, expresión máxima del compromiso pondoestatural en pacientes con DM1 (Fig. 1), que se observaba con frecuencia antes de la incorporación de la insulina, debido a la deficiencia insulínica y a la gran restricción calórica a la que se veían sometidos estos pacientes.
Figura 1. Niño con síndrome de Mauriac.
En los últimos 50 años, niños de todos los países portadores de esta enfermedad crecen y se desarrollan sanos y eutróficos, lo que lleva a preguntar ¿Qué elementos han determinado un cambio sustancial en el desarrollo pondoestatural? ¿Cuáles de ellos se deben a la DM propiamente tal y cuáles derivan del mejor manejo y control de la DM? Y, por último ¿Qué se debe esperar hoy del crecimiento en nuestros pacientes con DM?
Si bien el síndrome de Mauriac es un cuadro cada vez menos frecuente, en las últimas décadas han aparecido comunicaciones aisladas de casos de síndrome de Mauriac (1, 2, 3, 4) y en algunas de estas publicaciones se ha tratado de dilucidar las causas de este síndrome. El crecimiento normal aún es una de las metas del tratamiento en niños con DM1; sin embargo, en la actualidad, a pesar de los nuevos esquemas de tratamiento insulínico y la variada disponibilidad de insulinas y análogos, todavía algunos trabajos publicados revelan alteraciones en los patrones de crecimiento y en el funcionamiento del eje hormonal de crecimiento (GH). Al revisar este tema, más de 2500 publicaciones, en los quince a veinte últimos años, mencionan el crecimiento; pero los resultados de estas publicaciones son diversos, probablemente debido a que la metodología y las poblaciones son distintas y, lo que es más importante, que los factores que influyen en este cuadro son múltiples, con muestras a menudo insuficientes para demostrar la significación de determinado factor o causa.
Este eje es tal vez uno de los puntos que reúne mayor consenso. Aunque no todas las publicaciones obtienen los mismos resultados, en su mayoría concuerdan en que hay un estado de resistencia a GH, debido principalmente a la disminución de la insulina (insulinopenia), que provoca una regulación hacia abajo (down regulation), con disminución de receptores de GH y de la señal postreceptor a nivel hepático. Lo anterior determina una disminución de IGF-1 (Insulin-like Growth Factor-1) y aumento de IGFBP-1 (Insulin-like Growth Factor Binding Protein-1) e IGFBP-4, ambas proteínas transportadoras que tienen mayor afinidad por IGF-1 que IGFBP-3, por lo tanto, pasan a ser competencia e inhibidores de IGF-1. También se ha descrito que hay un aumento de la actividad proteolítica contra IGFBP-3. En suma, disminuye IGF-1, disminuye IGFBP-3 y aumentan las proteínas transportadoras con mayor afinidad por IGF-1.
Evidentemente, existe una disfunción del eje GH- IGF-1 con resistencia a la GH.
La mayoría de los estudios demuestra que esta disfunción se revertiría con tratamiento insulínico, pero en forma parcial, porque se requiere no sólo una adecuada secreción de insulina para el funcionamiento normal del eje GH-IGF-1, sino también una concentración adecuada de insulina en la circulación portal. La mayoría de los tratamientos se administran vía subcutánea; por lo tanto, no es la misma vía por la cual el hígado recibe la hormona en condiciones fisiológicas. La insulina también modula la expresión del gen del receptor de GH hepático (5) y del gen de IGFBP-1 (6). En pacientes con microalbuminuria persistente se ha descrito aumento del fragmento IGFBP-3 18 kD N-terminal urinario, lo que indica aumento de actividad proteolítica contra IGFBP-3 (7).
Soriano-Guillen et al (8) estudiaron varios factores de crecimiento en 22 pacientes con debut de DM1. Midieron estos factores los días 0, 2, al mes y a los 4 meses de tratamiento con insulina y observaron que había una disminución significativa en los niveles de IGF-1 en el día 0 y en el día 2 de haber iniciado la insulinoterapia, pero se recuperaron con el tratamiento insulínico a más largo plazo. Este aumento en los niveles al mes y a los cuatro meses de iniciado el tratamiento fue significativo, en comparación con las mediciones anteriores (Fig. 2).
La medición del factor se hizo los días 0 (DM1), 2 (DM2), al mes (DM3) y a los 4 meses (DM 4) de efectuado el tratamiento con insulina (Fuente: Pediatr Res 2004; 55(5): 830-835).
Con respecto a IGFBP-3, se vio una tendencia a la disminución de sus valores, pero no fue significativa en ninguno de los tiempos medidos (Fig. 3).
Figura 3. Representación esquemática de los niveles promedio (± DE) de IGFBP-3 (Pediatr Res 2004).
En el estudio publicado por Bideci et al (9) se estudió a 27 pacientes con DM1 en etapa estable (post luna de miel) y se les comparó con 25 controles. Se comprobó que los valores tanto de IGF-1 como de IGFBP-3 estaban significativamente disminuidos, situación que se mantuvo al dividir los pacientes en prepuberales y puberales.
Este elemento facilita el almacenamiento de GH, participa en la secreción de GH y también influye en la conformación tridimensional y en el acoplamiento de GH a su receptor. En pacientes con deficiencia de zinc se ha descrito una respuesta normal al test de secreción de GH, con peaks no muy altos, pero que alcanzan a caer dentro del rango normal, pero hay disminución de la GHBP (Growth Hormone Binding Protein) hepática y la actividad y los niveles de IGF-1 están disminuidos. Respecto a los niveles plasmáticos de zinc en DM1, los estudios han descrito valores normales, aumentados y disminuidos; por lo tanto, el zinc no siempre sería la causa del retardo de crecimiento en estos niños, aunque en el estudio de Bideci et al, realizado en Turquía (10) en 28 pacientes con DM1 en etapa estable que se compararon con 15 controles, se encontró que en el grupo total había diferencias significativas, pero que al dividirlos en prepuberales y puberales dicha diferencia se mantenía sólo en el grupo de los puberales. Por lo tanto, en relación con el zinc, igual que en muchas otras patologías, se debe considerar como una alternativa, pero este elemento no se ve forzosamente afectado por el cuadro de diabetes; es probable que haya elementos ambientales y nutricionales más importantes.
El péptido ghrelina se describió por primera vez en 1999 en una publicación de Kojima et al (11). Lo secretan las células del fondo gástrico, aunque también se ha descrito secreción, en proporciones menores, por páncreas e hipotálamo, y circula unido a proteínas. Estimula la secreción de GH endógeno; participa en la síntesis y utilización de las grasas y en el control de la ingesta alimentaria, en relación con la saciedad; y participaría en el metabolismo de la glucosa y de la insulina. Quizás por este último aspecto ha despertado interés su estudio en pacientes con diabetes. La ghrelina, además, aumenta los niveles de glicemia, independiente de la secreción de la insulina y de glucagón. Todo lo anterior está demostrado en trabajos experimentales. En el estudio ya mencionado de Bideci et al (9) se estudió a 27 pacientes con DM1 y se compararon con 25 controles y se observó que los niveles de ghrelina en el grupo total no mostraban diferencias significativas versus el grupo control; sólo hubo una tendencia no significativa al alza en los pacientes prepuberales. Los autores concluyeron que la ghrelina no se modifica en pacientes con DM1 y los niveles bajos al momento del diagnóstico se recuperan con terapia insulínica. En DM1, los valores de IGF-1 e IGFBP-3 están disminuidos y muestran correlación negativa con los niveles de ghrelina.
Con estos antecedentes, se puede decir que todavía faltan estudios en esta área.
La leptina tiene correlación directa con el índice de masa corporal (IMC). Participa en el inicio puberal y, secundariamente, en el crecimiento longitudinal. Algunos estudios realizados en DM1 muestran aumento de los niveles de leptina y resistencia a ella, pero otros no encuentran diferencias en ningún estadio puberal en DM1, en relación con los controles. En un artículo publicado por Myers et al (12) se estudió a 24 pacientes con DM1 post luna de miel y se observó que la leptina se correlacionaba con el IMC en DM1, en ambos sexos. Los niveles de leptina fueron más altos en las mujeres que en los hombres, a igual IMC, sin diferencia entre DM1 y controles en los distintos estadios de Tanner. No hubo correlación entre leptina y HbA1c.
En el estudio ya descrito de Soriano-Guillen et al (8) se estudió a 22 pacientes con debut de DM1 (días 0 y 2, mes 1 y 4) y se observó que la ghrelina estaba disminuida y que se mantenía significativamente más baja en los pacientes con DM1 versus los controles (Fig. 4). En cuanto a leptina, el autor también observó que los niveles estaban más bajos al momento del debut, pero se recuperaron con el tratamiento insulínico (Fig. 5).
Figura 4. Representación esquemática de los niveles promedio (± DE) de ghrelina (Pediatr Res 2004).
Figura 5. Representación esquemática de los niveles promedio (± DE) de leptina (Pediatr Res 2004).
Clark et al (13) midieron los componentes del eje GH-IGF-1 y los relacionaron con el control metabólico en DM1 (Tabla I). Los puntos de corte de la HbA1c fueron: < 9%; 9-11,5% y > 11,5%. No encontraron diferencias significativas en los valores de IGF-1 ni IGFBP-3, ni GHBP.
Tabla I. Eje GH-IGF-1 y control metabólico en DM1 (J Pediatr Endocrinol Metab 1998).
Al revisar la literatura disponible, muchas veces se comprueba que los resultados de los trabajos se contradicen unos a otros. Las características del crecimiento en niños con DM1 se pueden analizar en cinco puntos: período previo al diagnóstico; talla al debut; crecimiento hasta la pubertad; estirón puberal; y talla final.
En el estudio de Price et al (14), los autores tenían registrada la talla anterior de los pacientes que debutaron con DM1 y la compararon con un grupo control. El tamaño de la muestra era relativamente reducido: 33, 24, 20 y 16 para cada grupo: más de 3 años; menos de 2,5 años; menos de 1,5 años y menos de 0,5 años antes del diagnóstico de DM1, respectivamente. La talla de los pacientes con DM1 fue más alta en todos los grupos, en comparación con los controles (Fig. 6).
Figura 6. Crecimiento en niños con DM1 previo al diagnóstico (Diabetes Care 1992).
Para explicar este fenómeno se han planteado diferentes hipótesis. Bloom, en 1992, planteó que antes del debut de la diabetes se produce una hiperplasia insular con hiperinsulinemia; sin embargo, aunque se han realizado muchos estudios posteriores, este es el único que ha podido comprobar este hiperinsulinismo. Si se analiza esta hipótesis con los conocimientos actuales, se esperaría que la insulina fuera cada vez menor, principalmente frente a sobrecargas de glucosa.
Una hipótesis mucho más plausible es la que planteó Holl en 1994 y que se ha corroborado con el paso del tiempo. Este autor postuló que existiría una sincronía entre los períodos de estirones menores de la infancia, que son el medio, a los 7 años en hombres y 6,7 años en mujeres; el estirón preescolar, entre los 4,5 a 5 años, en ambos sexos; y el estirón tardío, entre los 8,6 a 9,2 años de edad, y el estirón mayor de la pubertad, que ocurre a los 10 años, con la secreción de GH. Durante estos períodos aumenta la GH, lo que induciría resistencia a la insulina; esta resistencia determinaría, en pacientes con disminución de la capacidad de producción insulínica secundaria al menor número de células beta pancreáticas, que se desencadenen los síntomas y el debut de la diabetes. Esta hipótesis parece mucho más aceptable, dado que el aumento de GH sería el desencadenante de DM1 en pacientes predispuestos que, probablemente, iban a debutar más adelante. Las tablas de crecimiento del NCHS son tablas generales, que no contemplan los diferentes estirones puberales, éstos se ven en las curvas individuales de cada paciente, que muestran que el crecimiento no es lineal, sino que hay períodos de mayor o menor crecimiento y, dentro de ellos, períodos de estirones.
En cuanto a la talla en el momento del debut de la DM1, cabe mencionar el estudio realizado en Austria y la República Checa por Lebl et al (15), principalmente por el gran número de pacientes que participaron. Hubo 7.598 mediciones de talla en 587 diabéticos, realizadas entre 1971 y 1996. De estos niños, 359 tuvieron la talla parental medida y 123 llegaron a la talla final. Los autores describieron promedios de talla inicial para hombres y para mujeres significativamente distintos a los de la población, pero dentro de rangos normales. Lo anterior puede tener valor estadístico, pero el valor biológico puede ser cuestionable. En cambio, Brown (16) comprobó que cuando separaba por grupo etario: menos de 5 años, entre 5 y 10 años y mayor de 10 años, la talla al debut era significativamente mayor sólo en el grupo entre 5 y 10 años, igual que los hermanos (variación genética).
En el estudio realizado por DiLiberti et al (17) se comparó la talla de 451 niños con DM1 con las curvas de su población (Estudio NHANES 10522) y además hicieron un metaanálisis con 38 estudios previos. Observaron que el grupo total de pacientes con DM1 era 0,2 desviaciones estándar (DE) más alto que las curvas patrón para su población (NHANES), fenómeno que ocurrió sólo en los varones menores de 1 año; los niños desde los 3 años hasta pubertad eran 0,3 DE más altos que la población control. Todas estas diferencias desaparecieron al ser ajustadas por talla paterna, principalmente en niños mayores. Este último análisis tiene una ventaja respecto a otros estudios en los cuales no se ajustó por talla paterna.
En un metaanálisis, los autores dividieron los distintos estudios por grupos según si cumplían con todas las exigencias impuestas a un trabajo para ser analizado, tanto desde el punto de vista metodológico, tamaño muestral y análisis de los resultados obtenidos, incluyendo el hecho de que las interpretaciones fuesen correctas. Sólo tres estudios fueron catalogados en categoría número uno, es decir, fueron adecuados desde el punto de vista de la medicina basada en la evidencia: los de Blom, Brown y Holl. En los estudios de Blom y Holl se observó que los niños eran más altos; en cambio, en el estudio de Brown sólo eran más altos los niños con DM1 entre 5 y 10 años. A medida que los estudios cumplen con más criterios para que se les analice desde el punto de vista metodológico, se observa con mayor frecuencia que la talla sería más alta en el momento del debut.
Con respecto a la talla posterior al debut en DM1, al analizar el mismo estudio realizado por Lebl et al (15) en 587 pacientes con DM1 se encuentra que hay un descenso significativo de la talla sólo en varones (P < 0,001), a medida que pasa el tiempo desde el diagnóstico de la diabetes. En las mujeres la diferencia no fue significativa, pero hay una tendencia. Este descenso va entre 0 y –1 DE, es decir, nuevamente se trata de tallas que están dentro del rango normal.
Lebl et al, en el mismo estudio (15), demostraron que la talla final fue normal, tanto en hombres como en mujeres: el promedio en hombres fue 176,5 cm, versus 176,8 cm de talla prevista y 167 cm versus 165,6 cm de talla prevista en mujeres. Algunos autores han descrito diferencias según sexo en los patrones de crecimiento, como en el estudio publicado por Wong (18) en 58 pacientes chinos con DM1, en el que hubo una franca diferencia entre niños y niñas. Los niños son más altos al momento del diagnóstico, con talla final normal; en las niñas, la talla inicial es igual a la del grupo control, pero su talla final es menor que la talla objetivo.
En el estudio publicado por Clarson (19) en 122 niños, con promedio de edad de 13,4 años y promedio de 6,1 años desde el diagnóstico de DM1, se vio que tanto la edad como la talla y la velocidad de crecimiento eran normales en hombres y mujeres. El peso era normal en mujeres, pero se encontró aumentado en hombres. No se observó correlación entre HbA1c y velocidad de crecimiento, índice talla/edad ni peso/talla.
Salerno et al (20) siguieron a 62 pacientes desde el debut de la diabetes hasta que alcanzaron la talla final y comprobaron que al momento del debut la talla para la edad era normal, tanto en hombres como en mujeres y la talla final fue -0,4 en hombres y mujeres, pero mayor que la talla objetivo. El estirón puberal estaba abolido en ambos sexos. La talla final fue independiente de la duración, control metabólico y requerimientos de insulina.
Danne (21), en un estudio en 634 niños con DM1, con edad promedio de debut de 9 años (1 a 15) y promedio de 11 años (1 a 19) de duración de enfermedad, observó que el crecimiento de estos niños era normal hasta la pubertad, con tendencia a crecimiento lento y sobrepeso, más notable en mujeres y en pacientes con tratamiento intensificado. En 169 pacientes que llegaron a la talla final versus la talla prevista al debut, fue menos de 0,5 DE, equivalente en esa población a 2,9 cm en hombre y 2,3 cm en mujer. Hubo una correlación positiva entre edad de inicio de la diabetes y buen control metabólico con la talla final.
La mayoría de los estudios indican que el estirón puberal está abolido, como lo demuestran los trabajos de Dunger (22) y Wise (23), o disminuido, como lo demuestran los estudios de Salerno (20), Danne (24), Eldesten (25) y Du Caju (26). Ahmed et al (27) realizaron un estudio de seguimiento longitudinal de 46 pacientes con DM1, que fueron evaluados cada 3 meses durante 6 años y analizaron la curva de crecimiento individual, no los promedios. Observaron que el estirón puberal en pacientes con DM1, ocurría a la misma edad que en el grupo control; en los varones, el estirón puberal fue a los 9,54 ± 1,54 cm/año, similar a los controles (9,5 ± 1,1cm/año); en mujeres con DM1, el estirón puberal fue 7,71 ± 1,13 cm/año, significativamente menor que el grupo control, que creció 8,4 ± 0,9 cm/año (p<0,05). En este estudio los autores observaron que el peak de velocidad de crecimiento se correlacionó con la HbA1c y que los niveles de IGF-1 se correlacionaron con la dosis de insulina. Al hacer el análisis de regresión múltiple paso a paso, se vio que los principales determinantes del peak de la velocidad de crecimiento eran la HbA1c (p = 0,04), el sexo (p = 0,0007) y la edad ósea (p = 0,01).
Codner et al (28) hicieron un estudio en 4 hospitales de Santiago, Chile, con 100 niñas con DM1 en etapa puberal, comparadas con 576 controles. Las niñas del grupo control mostraron disminución de la DE en talla, fenómeno que no se observó en las diabéticas, pero éstas partieron con valores menores y llegaron a valores más bajos que las pacientes del grupo control. En este estudio, la autora demostró una correlación entre la DE de la talla y el control metabólico.
En resumen, hay gran controversia acerca de las características y fisiopatología del crecimiento en la DM1, pero la mayoría de los estudios señalan que la talla al debut sería mayor, especialmente en el grupo entre 5 a 10 años; que hasta la pubertad el crecimiento es algo menor; que el estirón puberal está al menos disminuido; que hay diferencias en patrón de crecimiento según sexo; y que llegan a talla final dentro de rango normal, pero dicha talla es menor que la talla objetivo.
El crecimiento normal es una meta del tratamiento, por lo que se debe hacer un seguimiento que permita detectar las deficiencias en el crecimiento y estudiar sus posibles causas, como se hace en las demás patologías pediátricas. Siempre hay que descartar alteraciones tiroideas y enfermedad celíaca, que son más frecuentes en pacientes con DM1. La optimización del tratamiento insulínico permitiría un crecimiento normal, aunque persistan alteraciones en el eje GH-IGF-1 debidas, probablemente, a la circulación portal de insulina.




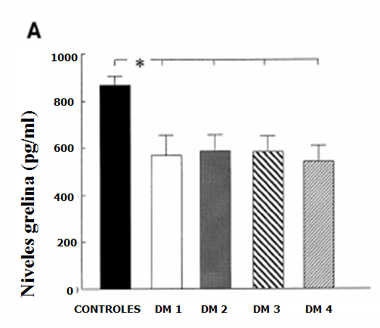 Figura 4. Representación esquemática de los niveles promedio (± DE) de ghrelina (Pediatr Res 2004).
Figura 4. Representación esquemática de los niveles promedio (± DE) de ghrelina (Pediatr Res 2004).


 Tabla I. Eje GH-IGF-1 y control metabólico en DM1 (J Pediatr Endocrinol Metab 1998).
Tabla I. Eje GH-IGF-1 y control metabólico en DM1 (J Pediatr Endocrinol Metab 1998).

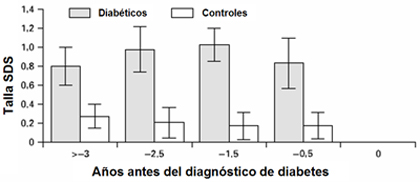 Figura 6. Crecimiento en niños con DM1 previo al diagnóstico (Diabetes Care 1992).
Figura 6. Crecimiento en niños con DM1 previo al diagnóstico (Diabetes Care 1992).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Internacional de Diabetes del Niño y del Adolescente, organizado por la Asociación Latinoamericana de Diabetes entre los días 19 al 21 de abril de 2006. Directora: Dra. Gloria López.
 Expositora:
Francisco Ugarte P.[1]
Expositora:
Francisco Ugarte P.[1]

Citación: Ugarte F. Type 1 diabetes mellitus and growth. Medwave 2007 Mar;7(2):e3422 doi: 10.5867/medwave.2007.02.3422
Fecha de publicación: 1/3/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión