 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 6 de abril y 10 de agosto de 2005. Director: Dr. José Manuel Ojeda.
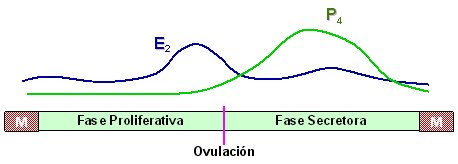
El útero humano, especialmente el compartimiento endometrial, es uno de los tejidos cuya función es principalmente regulada por los esteroides circulantes de origen ovárico. En efecto, durante la fase folicular ovárica (o fase proliferativa en el endometrio), el estradiol (E2) producido por los folículos en desarrollo induce la proliferación celular en el endometrio, y luego de la ovulación, la progesterona (P4) producida por el cuerpo lúteo (fase lútea), promueve la diferenciación de las células endometriales (fase secretora) (Figura 1).
Figura 1. Ciclo ovárico y menstrual humano
Por ello, en situaciones endocrino-metabólicas asociadas a anormalidades en la concentración sanguínea de algunas hormonas y proteínas, como es el caso del Síndrome de Ovario Poliquístico (SOP), los procesos que ocurren en el endometrio y la forma como las células responden a los estímulos biológicos alterados, se pueden ver afectados.
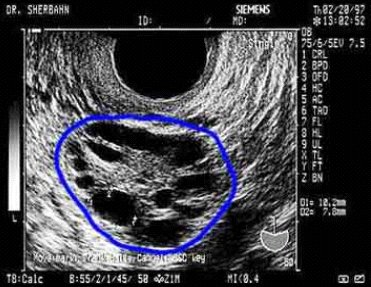
El SOP es una de las patologías más frecuentemente relacionadas con infertilidad y aborto recurrente. Es un trastorno de alta prevalencia en las mujeres en edad fértil, afectando entre 5 y 10% de este grupo de mujeres (1). Se caracteriza por un hiperandrogenismo funcional, además de irregularidades menstruales e hiperinsulinemia asociada a insulinorresistencia, en 50 a 60% de las pacientes con SOP (2). Además, en las pacientes SOP no sólo se encuentran elevados los niveles séricos de andrógenos, sino también los de estrógenos, en tanto que los niveles de P4 se encuentran reducidos (3). La hipersecreción de insulina, junto a la sobreexpresión de la enzima P450cl7 (responsable de la síntesis de andrógenos en las células tecales del folículo ovárico), aumenta los andrógenos intraováricos y se detiene el desarrollo folicular. En consecuencia, se produce la acumulación de pequeños quistes foliculares subcorticales e incrementa el volumen ovárico, lo que le da la imagen ultrasonográfica característica a este síndrome (Figura 2).
Figura 2. Ultrasonografía ovárica de paciente con SOP
A pesar de que el SOP se identificó hace más de 60 años (4), los conocimientos actuales lo muestran como un síndrome con gran heterogeneidad de fenotipos y que presenta múltiples anormalidades; por ello, su etiopatogenia aún no está establecida y podría incluir una combinación de factores genéticos y ambientales. Además, este síndrome constituye un problema de salud mayor para la mujer, con ramificaciones más allá de las anormalidades endocrinas y reproductivas y está relacionado con enfermedades como diabetes tipo 2, hipertensión, función suprarrenal alterada y enfermedades cardiovasculares (2, 3).
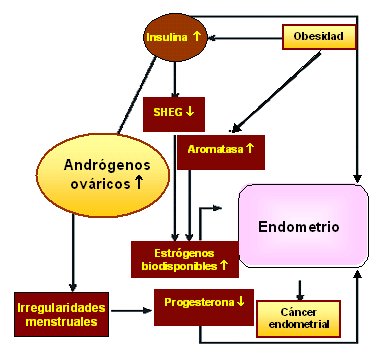
Trabajos anteriores han comunicado que el endometrio de mujeres con SOP se comporta de manera diferente al endometrio de mujeres normales, lo cual se evidencia con un aumento significativo de abortos recurrentes (1%), comparado con la población normal (0,34%) (5, 6). Además, se ha asociado la condición endocrino-metabólica inherente al SOP con mayor probabilidad de desarrollar hiperplasia endometrial (35,7%), como lo señalan estudios que establecen una asociación entre mujeres nulíparas que padecen SOP e hiperplasia endometrial (7, 8), de las cuales, 60, 15 y 25% fueron clasificadas como hiperplasia simple, compleja e hiperplasia con atipia citológica, respectivamente (8). Por otro lado, se ha reportado que la condición SOP presenta mayor riesgo relativo (3,1) de desarrollar cáncer endometrial (9, 10, 11) (Figura 3). La naturaleza multifactorial del SOP y su heterogeneidad hace difícil conocer los factores asociados al SOP que aumentan el riesgo de desarrollo de hiperplasia y cáncer endometrial, pero entre ellos estarían obesidad, acción estrogénica no compensada por P4, nuliparidad, hipertensión, diabetes mellitus tipo 2 e irregularidades menstruales, todas ellas asociadas al SOP (12).
Figura 3. El SOP se asocia a una producción ovárica aumentada de andrógenos, lo cual conduce a irregularidades menstruales y a deficiencia de P4. Por otro lado, el aumento en la adiposidad incrementa la actividad de la aromatasa, lo que se traduce en niveles aumentados de estrógenos biodisponibles. Además de los estrógenos y P4, los altos niveles de insulina característicos de un alto porcentaje de mujeres con SOP también promueven el desarrollo de cáncer endometrial, reduciendo las concentraciones sanguíneas de la globulina que une hormonas esteroidales (SHBG), lo que incrementa los niveles biodisponibles de los estrógenos que pueden difundir al tejido endometrial (Figura modificada de Nature Reviews 4: 579-590, 2004).
Se sabe que las acciones de los esteroides en los tejidos, incluido el endometrio, están mediadas por receptores específicos, que constituyen factores de transcripción importantes para numerosos genes, entre los que destacan aquellos relacionados con la proliferación celular y el control del ciclo celular. La expresión de los receptores está altamente controlada por los esteroides circulantes, por lo que concentraciones plasmáticas alteradas de éstos pueden conducir a una desrregulación de la expresión endometrial de los receptores, con consecuencias negativas sobre la implantación y/o viabilidad y diferenciación de las células endometriales. Por otro lado, en los últimos años se ha establecido que la transcripción mediada por los receptores de estrógenos puede ser estimulada por mecanismos independientes de los ligandos y que involucran vías de segundos mensajeros, como las MAPK, que estimulan la fosforilación en residuos de serina del receptor, las cuales pueden ser tejido-específicas (13).
Receptores endometriales de estrógeno. En condiciones fisiológicas, el efecto de los estrógenos sobre el tejido endometrial se puede realizar a través de las distintas isoformas que presentan los receptores. Se ha demostrado que los estrógenos (fundamentalmente E2) ejercen su acción a través de dos isoformas del receptor, alfa y beta, codificadas por dos genes distintos ubicados en los cromosomas 6 y 14, respectivamente. La expresión de ambos receptores aumenta por acción del estrógeno circulante durante la fase proliferativa del ciclo menstrual normal. Sin embargo, la isoforma alfa es la expresada de preferencia en el endometrio humano normal, en endometrio de pacientes SOP y en cáncer endometrial (14, 15, 16). El predominio de cada una de estas isoformas es tejido-dependiente y, en ciertos casos, se ha descrito una acción opuesta entre los subtipos de receptor al estar unido a su ligando. Además, considerando la capacidad de ambas isoformas para formar no sólo homodímeros sino también heterodímeros, diferencias en la razón alfa/beta, tanto en condiciones normales como patológicas, podrían tener importantes implicaciones funcionales.
Receptores de progesterona en endometrio. El receptor para P4 presenta dos formas, A y B, codificadas por el mismo gen, pero utilizando distintos promotores (17). La isoforma A no posee el dominio de transactivación constituido por 164 aminoácidos. La expresión de las formas A y B tienen variaciones en el endometrio humano durante el ciclo menstrual, siendo la isoforma A detectada de preferencia durante la fase secretora media, sugiriendo una acción sobre la transcripción de genes involucrados en el proceso de implantación. Los estrógenos inducen un aumento en la concentración tisular de la isoforma B, siendo por lo tanto mayor su expresión en la fase proliferativa. Coincidentemente, en cánceres endometriales dependientes de estrógenos se observa un predominio del mRNA para la isoforma B (18). Por otro lado, en los endometrios de mujeres con SOP se ha observado que la presencia de la proteína del receptor de P4 es similar a la de los endometrios normales (19). Al igual que para los receptores de estrógenos, la unión de la P4 a las diferentes formas de su receptor puede provocar respuestas antagónicas, lo que es tejido-dependiente. En este contexto, es importante considerar que la concentración relativa de cada una de las isoformas puede ser importante para evaluar con mayor precisión la acción esteroidal en estos tejidos.
Receptor endometrial de andrógenos. La concentración de andrógenos en el endometrio humano normal excede a la del plasma (20, 21, 22) y, al igual que los estrógenos y P4, los andrógenos tienen una acción importante en la fisiología endometrial. Se ha demostrado que tanto el mRNA como la proteína del receptor de andrógeno experimentan cambios cíclicos durante el ciclo menstrual (23, 24) y que en la fase proliferativa, el receptor de andrógeno es regulado positivamente por E2 (25, 26) y negativamente por P4, en fase secretora (27). Además, estudios ex vivo en endometrios de pacientes SOP sugieren que el hiperestrogenismo es prevalente sobre los altos niveles de andrógenos en inducir la expresión de los receptores esteroidales (19). Probablemente lo que tenga mayor importancia en el SOP sea la condición hiperestrogénica relativa que presentan estas mujeres, lo que genera en ellas un aumento de la acción de los estrógenos, debido al estímulo más prolongado y, como ya se sabe, los estrógenos modulan positivamente la expresión de su propio receptor. Además, en los endometrios de mujeres con SOP los receptores de andrógenos se encuentran elevados, lo que en parte se puede explicar por las concentraciones plasmáticas aumentadas de estrógenos y andrógenos y está de acuerdo con comunicaciones previas (28). No obstante, se ha descrito que en el cáncer endometrial, tanto los niveles del receptor de andrógenos como los del receptor de estrógeno y P4 se encuentran ligeramente disminuidos, en comparación con endometrios normales (29).
Co-reguladores y su acción en endometrio humano. Además de las isoformas de los receptores, la especificidad de la acción de los esteroides está regulada por proteínas denominadas co-reguladoras, las cuales pertenecen a la familia de las proteínas p160, entre otras, y pueden ser co-activadoras o co-represoras de la transcripción génica mediada por los receptores esteroidales (30, 31, 32). Es probable que una sobreexpresión de los co-activadores o de los co-represores en un determinado tejido, conduzca a un aumento o disminución de la sensibilidad de ese tejido a la acción de los esteroides, respectivamente; por esto, es importante considerar la concentración relativa entre estos co-reguladores. La acción co-activadora se produce por estabilización del complejo de pre-iniciación de la transcripción, o bien, por la capacidad de estos co-activadores de reclutar histona-acetiltransferasas, las cuales, por su acción desestabilizadora de las uniones electrostáticas en el DNA, pueden aumentar el acceso de los factores de transcripción al promotor, favoreciendo la transcripción (33). Por otro lado, los co-represores reclutan deacetilasas, las que inducen a la cromatina a adoptar una estructura más compacta, que reprime la transcripción (33).
En los últimos años se han identificado numerosos co-reguladores que modulan la acción de los receptores esteroidales. Estos co-reguladores se expresan en diversos tejidos, incluyendo al endometrio humano. Entre los co-activadores más estudiados se encuentran SRC-1, SRC-2, SRC-3 y ARA70. Cabe destacar que SRC-1 y SRC-3 (34, 35) poseen actividad intrínseca de histona acetiltransferasa y entre los co-represores, el NCoR y el SMRT han sido los más investigados (33). Se ha demostrado que en el endometrio humano la expresión de co-activadores está regulada durante el ciclo menstrual normal; y más aun, recientemente se ha señalado que la expresión del co-activador SRC-3/AIB1 aumenta en endometrios secretores de mujeres SOP tratadas con citrato de clomifeno (36). No obstante, datos de nuestro laboratorio señalan que el citrato de clomifeno per se induce una asincronía en el desarrollo del epitelio y el estroma, alterando parámetros de función endometrial. Lo anterior es de importancia y debería ser considerado al evaluar los modelos experimentales que utilizan este fármaco. A pesar de lo anterior, se infiere que la mayor concentración plasmática de estrógenos y de andrógenos, sumada a la elevada expresión endometrial de los receptores de estrógenos y andrógenos y al aumento de los co-activadores en los endometrios de pacientes con SOP, pudiesen favorecer la respuesta exagerada a la acción de los esteroides en este tejido, conduciendo a alteraciones en la fisiología endometrial.
Dado que el endometrio se encuentra bajo el control de los esteroides sexuales, su homeostasis está regulada por hormonas durante el ciclo menstrual y, por lo tanto, está sujeto a procesos de remodelación, a través de la menstruación, proliferación y diferenciación de las células endometriales. Durante dichos procesos se produce un balance específico entre apoptosis y proliferación, tanto en el epitelio como en el estroma (37, 38) y los cambios en este balance pueden ser fisiológicos, como ocurre durante el ciclo menstrual, pero la acción de los estrógenos no regulada por P4 que es propia de las mujeres con SOP, puede conducir a hiperplasia y cáncer endometrial (39, 40). Sin embargo, también existen otras vías de carcinogénesis endometrial (41, 42).
De los antecedentes expuestos se desprende que los esteroides, especialmente los estrógenos, cumplen funciones cruciales en la regulación de la viabilidad de las células endometriales. También se sabe que la insulina posee una acción mitogénica y, por lo tanto, constituye un regulador de la proliferación celular en diversos tejidos. En este contexto, es importante destacar que en estudios del antígeno nuclear Ki-67, que es un marcador de proliferación celular, se ha observado un aumento de la proliferación en endometrios de pacientes con SOP, en ausencia de apoptosis (43). por lo que parece razonable postular que las pacientes que padecen SOP presentan una desrregulación de su homeostasis endometrial.
Recientemente se ha propuesto reevaluar la asociación entre SOP y cáncer endometrial (2), debido a un trabajo realizado por Hardiman y colaboradores (44), en el cual se establece que no existen estudios epidemiológicos sólidos que señalen esta asociación, debido, principalmente, a que, durante décadas, los distintos grupos a nivel mundial utilizaron diferentes criterios para diagnosticar el SOP. No obstante, una comunicación reciente destaca que las irregularidades menstruales (oligo o amenorrea), la obesidad, la hiperinsulinemia y la disminución de la concentración de SHBG se asocian, tanto al SOP como al cáncer endometrial (45), por lo tanto, estas pacientes, además de padecer trastornos endocrino-metabólicos y problemas reproductivos, tendrían mayor probabilidad de desarrollar hiperplasia y/o cáncer endometrial. Ante esto, es necesario realizar más investigaciones que permitan conocer los mecanismos que controlan el crecimiento y división celular en endometrios de mujeres con SOP, ya que hasta el momento no hay estudios al respecto.
Reguladores de la apoptosis en endometrio humano normal y patológico. El proto-oncogen Bcl-2 codifica para una proteína que, en condiciones fisiológicas, controla la permeabilidad de la mitocondria (46) y del retículo endoplásmico (47) e inhibe la apoptosis, bloqueando la liberación del citocromo C (48, 49, 50). Dicha proteína presenta variaciones cíclicas en el endometrio normal, lo que sugiere una relación con los niveles hormonales (51), y su sobreexpresión se asociaría con transformación neoplásica (52, 53). Se ha descrito que la expresión de Bcl-2 varía durante la transformación celular en varios tumores humanos (54) y que se encuentran sostenidos en la lesiones pre-malignas, disminuyendo cuando se produce el cambio a la malignidad. Además, se ha postulado que E2, unido a su receptor, regula la expresión endometrial de Bcl-2 (55), lo que se relaciona con la expresión aumentada de esta proteína en endometrios de mujeres con SOP, al comparar con endometrios normales (43).
Por otro lado, Bax funciona como un gen supresor de tumores y codifica para una proteína que ejerce un efecto pro-apoptótico (49, 47, 48), a través de la liberación de citocromo C mitocondrial, lo cual activa a caspasas, enzimas efectoras del proceso apoptótico (47). Recientemente se ha encontrado que la expresión de la proteína Bax se encuentra significativamente disminuida en endometrios de pacientes con SOP, con respecto a la expresión de Bcl-2 (43). Por otro lado, se ha comunicado que Bax se expresa en hiperplasia endometrial, mientras que está ausente en 20,7% de los carcinomas endometriales; esta pérdida en la expresión se asocia con mutación en el gen Bax (56).
Moléculas reguladoras del ciclo celular en endometrio humano normal y patológico. Es ampliamente conocido que la proliferación celular normal es regulada por la interacción entre ciclinas, quinasas dependientes de ciclinas (CDKs), inhibidores de las quinasas dependientes de ciclinas (CKIs), y productos de proto-oncogenes y de genes supresores de tumores (57, 58, 59, 60). Además, se han propuesto varios mecanismos por los cuales el E2 regularía a las proteínas involucradas en el ciclo celular y en la proliferación celular, en situación normal; entre éstos se han propuesto: la inducción de la expresión de la ciclina D1; la regulación de la distribución subcelular de los CKIs p21 y p27; la unión de la ciclina D1 al receptor de estrógenos, aumentando su actividad transcripcional y la fosforilación del receptor de estrógenos por la actividad de Cdk2 (61).
En estudios animales, se ha visto que E2 reduce el tiempo en que las células están en fase G1 y promueve la transición G1/S de las células epiteliales uterinas in vivo (62). Por otro lado, los efectos hormonales sobre el ciclo celular son también modulados localmente por factores de crecimiento tanto en endometrio normal como en cáncer endometrial (63). Por otro lado, reportes de la literatura indican que las ciclinas muestran cambios en los endometrios con hiperplasia y cáncer endometrial respecto a los normales; así, se ha descrito que la ciclina A se correlaciona positivamente con la expresión de Ki67 (64). Sin embargo, no se dispone de antecedentes que señalen lo que ocurre con las ciclinas en endometrios de pacientes con SOP.
Se sabe que en fase G1 las ciclinas forman complejos con las CDKs, para unirse a la proteína retinoblastoma (Rb) e inactivarla mediante fosforilación, y que esto conduce a la liberación de la proteína E2F y a la progresión a la fase S del ciclo celular (65). La proteína Rb se expresa normalmente en el endometrio en fase proliferativa y en endometrio con hiperplasia, disminuyendo progresivamente su expresión hacia el cáncer endometrial (66). Sin embargo, aún no se ha estudiado si existe relación entre la expresión de esta proteína y los receptores esteroidales o las concentraciones intracelulares de estrógenos. Por otro lado, la capacidad de los complejos ciclina/CDK para fosforilar Rb es inhibida por inhibidores CKIs, los cuales suprimen la actividad quinasa de los complejos ciclina/CDK, conduciendo a la detención del ciclo celular (59, 67). Interesantemente, en endometrios de pacientes SOP se ha observado una disminución de la expresión nuclear del CKI p27, comparado con endometrios normales, lo cual se asocia al incremento de la expresión nuclear de CDK-2 en estas pacientes (43).
Onco-proteínas y proteínas supresoras de tumores en endometrio humano normal y patológico. La proteína Ras es un producto del proto-oncogen ras y participa en la vía de señalización de insulina y factores de crecimiento. Dichos factores, al unirse a su receptor tirosina quinasa, activan a diversas proteínas, entre las que se encuentra Ras, cuya función está regulada por la unión a GTP y su actividad GTPasa. Ras unido a GTP transmite señales, pero al hidrolizar en GDP + Pi se inactiva. Ras-GTP induce la activación, finalmente, de MAPK, la cual fosforila factores transcripcionales, aumentando la transcripción de ciertos genes que regulan la proliferación celular. En efecto, en 10 a 20% de los carcinomas endometriales dependientes de estrógenos se han reportado mutaciones del proto-oncogen ras, lo que conduce a una señal de proliferación continua en los tejidos. Dado que estas mutaciones se han descrito también en hiperplasia endometrial, se puede pensar que ellas constituyen un evento temprano en el desarrollo del cáncer endometrial (68). Lo anterior es de particular importancia para el presente trabajo, ya que en endometrios de pacientes con SOP, con y sin hiperplasia endometrial, la proteína Ras se encuentra sobreexpresada, lo que no se observa en endometrios obtenidos de pacientes normales (43).
También se han descrito propiedades reguladoras de la proliferación celular en proteínas con acción supresora de tumores, como PTEN (Phosphatase and Tensin homologue deleted on chromosome Ten) (69), que se destaca por su acción reguladora de la proliferación celular y de la adhesión intercelular. Entre los efectos que se han descrito están: disminuir los niveles de ciclina D1; aumentar los del inhibidor p27 (70); y activar moléculas pro-apoptóticas, a través de vías dependientes e independientes de Akt (71). La proteína PTEN posee un dominio de tirosina fosfatasa y también presenta características comunes con la tensina, péptido relacionado con los filamentos de actina e implicado en mecanismos de adhesión intercelular. Por su función fosfatasa, podría contrarrestar la acción de quinasas y regular la proliferación celular; y por su homología con tensina podría servir de puente entre el citoesqueleto y proteínas de membranas, como integrinas o receptores para factores de crecimiento o insulina. Lo importante es que esta interacción está ayudando a que la célula reconozca la matriz extracelular del tejido al cual pertenece.
En las hiperplasias endometriales se han detectado mutaciones en el gen de PTEN (33,3%), lo mismo que en cáncer endometrial (45,8%) y se cree que, al igual que para las mutaciones de Ras, las de PTEN pueden constituir eventos tempranos de la carcinogénesis endometrial (72, 73, 74). Las mutaciones en PTEN conducen a la fosforilación de la proteína Akt, que en estas condiciones ejerce una importante acción anti-apoptótica. Así, se ha observado un aumento de la proteína Akt fosforilada en endometrios de pacientes con SOP, con y sin hiperplasia, lo que coincide con la ausencia de apoptosis y con la disminución en la expresión de p27 en los endometrios de estas pacientes (43).
Es indudable que el metabolismo de los esteroides a nivel del endometrio humano es relevante para lograr una función normal de este tejido, tanto a nivel del proceso reproductivo, como de la proliferación, apoptosis y diferenciación celular, de modo que los endometrios sometidos a microambientes hormonales anormales, como ocurre en el SOP, no cumplen en forma adecuada con la función reproductiva, ya que impiden la implantación del embrión, o bien experimentan descoordinación entre proliferación y apoptosis, constituyendo otro factor que puede conducir al crecimiento inadecuado o patológico del endometrio en las mujeres con este síndrome.
La condición endocrino-metabólica inherente al SOP constituye un excelente ejemplo de la acción anormal de los esteroides sobre los reguladores del ciclo celular. Por ello, es necesario realizar más investigaciones que ayuden a efectuar la identificación de marcadores precoces de hiperplasia y cáncer de endometrio, así como en la localización de blancos terapéuticos, en estas pacientes. Lo anterior adquiere especial relevancia si se piensa que se trata de mujeres en edad fértil que, además de padecer trastornos endocrino-metabólicos y reproductivos, tienen riesgo de desarrollar cáncer endometrial.



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 6 de abril y 10 de agosto de 2005. Director: Dr. José Manuel Ojeda.
 Expositora:
Alejandra Villavicencio Galdeano[1]
Expositora:
Alejandra Villavicencio Galdeano[1]

Citación: Villavicencio A. Polycystic ovary syndrome and endometrial cancer: a bibliographic review. Medwave 2006 Jul;6(6):e3384 doi: 10.5867/medwave.2006.06.3384
Fecha de publicación: 1/7/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Legro RS, Spielman R, Urbanek M, Driscoll D, Strauss JF, Dunaif A. Phenotype and genotype in polycystic ovary syndrome. Recent Prog Horm Res. 1998;53:217-56. | PubMed |
Legro RS, Spielman R, Urbanek M, Driscoll D, Strauss JF, Dunaif A. Phenotype and genotype in polycystic ovary syndrome. Recent Prog Horm Res. 1998;53:217-56. | PubMed | The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril. 2004 Jan;81(1):19-25. | CrossRef | PubMed |
The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril. 2004 Jan;81(1):19-25. | CrossRef | PubMed | Homburg R. Polycystic ovary síndrome-from gynaecological curiosity to multisystem endocrinopathy. Hum Reprod. 1996 Jan;11(1):29-39. | PubMed |
Homburg R. Polycystic ovary síndrome-from gynaecological curiosity to multisystem endocrinopathy. Hum Reprod. 1996 Jan;11(1):29-39. | PubMed | Stein IF, Leventhal ML. Amenorrhea associated with bilateral polycystic ovaries. Am J Obst Gynecol 1935;(29):181-191.
Stein IF, Leventhal ML. Amenorrhea associated with bilateral polycystic ovaries. Am J Obst Gynecol 1935;(29):181-191.  Okon MA, Laird SM, Tuckerman EM and Li T-C. Serum androgen levels in women who have recurrent miscarriages and their correlation with markers of endometrial function. Fertil Steril 69:682-690, 1998 | CrossRef |
Okon MA, Laird SM, Tuckerman EM and Li T-C. Serum androgen levels in women who have recurrent miscarriages and their correlation with markers of endometrial function. Fertil Steril 69:682-690, 1998 | CrossRef | Sagle M, Bishop K, Ridley N, Alexander FM, Michel M, Bonney RC, et al. Recurrent early miscarriage and polycystic ovaries. BMJ. 1988 Oct 22;297(6655):1027-8. | CrossRef | PubMed |
Sagle M, Bishop K, Ridley N, Alexander FM, Michel M, Bonney RC, et al. Recurrent early miscarriage and polycystic ovaries. BMJ. 1988 Oct 22;297(6655):1027-8. | CrossRef | PubMed | Chamlain DL, Taylor HB. Endometrial hyperplasia in young women. Obstet Gynecol. 1970 Nov;36(5):659-66. | PubMed |
Chamlain DL, Taylor HB. Endometrial hyperplasia in young women. Obstet Gynecol. 1970 Nov;36(5):659-66. | PubMed | Cheung AP. Ultrasound and menstrual history in predicting endometrial hyperplasia in polycystic ovary syndrome. Obstet Gynecol. 2001 Aug;98(2):325-31. | CrossRef | PubMed |
Cheung AP. Ultrasound and menstrual history in predicting endometrial hyperplasia in polycystic ovary syndrome. Obstet Gynecol. 2001 Aug;98(2):325-31. | CrossRef | PubMed | Balen A. Polycystic ovary syndrome and cancer. Hum Reprod Update. 2001 Nov-Dec;7(6):522-5. | CrossRef | PubMed |
Balen A. Polycystic ovary syndrome and cancer. Hum Reprod Update. 2001 Nov-Dec;7(6):522-5. | CrossRef | PubMed | Henderson BE, Casagrande JT, Pike MC, Mack T, Rosario I, Duke A. The epidemiologý of endometrial cancer in young women. Br J Cancer. 1983 Jun;47(6):749-56. | CrossRef | PubMed | PMC |
Henderson BE, Casagrande JT, Pike MC, Mack T, Rosario I, Duke A. The epidemiologý of endometrial cancer in young women. Br J Cancer. 1983 Jun;47(6):749-56. | CrossRef | PubMed | PMC | Elwood JM, Cole P, Rothman KJ, Kaplan SD. Epidemiology of endometrial cancer. J Natl Cancer Inst. 1977 Oct;59(4):1055-60. | PubMed |
Elwood JM, Cole P, Rothman KJ, Kaplan SD. Epidemiology of endometrial cancer. J Natl Cancer Inst. 1977 Oct;59(4):1055-60. | PubMed | Coulam CB, Annegers JF, Kranz JS. Chronic anovulation syndrome and associated neoplasia. Obstet Gynecol. 1983 Apr;61(4):403-7. | PubMed |
Coulam CB, Annegers JF, Kranz JS. Chronic anovulation syndrome and associated neoplasia. Obstet Gynecol. 1983 Apr;61(4):403-7. | PubMed | Enmark E, Pelto-Huikko M, Grandien K, Lagercrantz S, Lagercrantz J, Fried G, et al. Human estrogen receptor beta-gene structure, chromosomal localization and expression pattern. J Clin Endocrinol Metab. 1997 Dec;82(12):4258-65. | CrossRef | PubMed |
Enmark E, Pelto-Huikko M, Grandien K, Lagercrantz S, Lagercrantz J, Fried G, et al. Human estrogen receptor beta-gene structure, chromosomal localization and expression pattern. J Clin Endocrinol Metab. 1997 Dec;82(12):4258-65. | CrossRef | PubMed | Fujimoto J, Sakaguchi H, Aoki I, Toyoki H, Tamaya T. Clinical implications of the expression of estrogen receptor-a and -b in primary and metastatic lesions of uterine endometrial cancers. Oncology. 2002;62(3):269-77. | CrossRef | PubMed |
Fujimoto J, Sakaguchi H, Aoki I, Toyoki H, Tamaya T. Clinical implications of the expression of estrogen receptor-a and -b in primary and metastatic lesions of uterine endometrial cancers. Oncology. 2002;62(3):269-77. | CrossRef | PubMed | Villavicencio A, Goyeneche A, Telleria C, Bacallao K, Gabler F, Fuentes A, et al. Potential consequences of steroid environment in the development of endometrial hyperplasia in patients with polycystic ovarian syndrome. Gynecol Oncol. 2009 Oct;115(1):102-7. Epub 2009 Jul 23. | CrossRef | PubMed |
Villavicencio A, Goyeneche A, Telleria C, Bacallao K, Gabler F, Fuentes A, et al. Potential consequences of steroid environment in the development of endometrial hyperplasia in patients with polycystic ovarian syndrome. Gynecol Oncol. 2009 Oct;115(1):102-7. Epub 2009 Jul 23. | CrossRef | PubMed | Kastner P, Krust A, Turcotte B, Stropp U, Tora L, Gronemeyer H, et al. Two distinct estrogen-regulated promoters generate transcripts encoding the two functionally different human progesterone receptor forms A and B. EMBO J. 1990 May;9(5):1603-14. | PubMed | PMC |
Kastner P, Krust A, Turcotte B, Stropp U, Tora L, Gronemeyer H, et al. Two distinct estrogen-regulated promoters generate transcripts encoding the two functionally different human progesterone receptor forms A and B. EMBO J. 1990 May;9(5):1603-14. | PubMed | PMC | Fujimoto J, Ichigo S, Hori M, Nishigaki M, Tamaya T. Expression of progesterone receptor form A and B mRNAs in gynecologic malignant tumors. Tumour Biol. 1995;16(4):254-60. | CrossRef | PubMed |
Fujimoto J, Ichigo S, Hori M, Nishigaki M, Tamaya T. Expression of progesterone receptor form A and B mRNAs in gynecologic malignant tumors. Tumour Biol. 1995;16(4):254-60. | CrossRef | PubMed | Maliqueo M, Clementi M, Gabler F, Johnson MC, Palomino A, Sir-Petermann T, et al. Expression of steroid receptors and proteins related to apoptosis in endometria of women with polycystic ovary syndrome. Fertil Steril. 2003 Sep;80 Suppl 2:812-9. | CrossRef | PubMed |
Maliqueo M, Clementi M, Gabler F, Johnson MC, Palomino A, Sir-Petermann T, et al. Expression of steroid receptors and proteins related to apoptosis in endometria of women with polycystic ovary syndrome. Fertil Steril. 2003 Sep;80 Suppl 2:812-9. | CrossRef | PubMed | Vermeulen-Meiners C, Poortman J, Nabuurs M, Thijssen JH. The endogenous concentration and subcellular distribution of androgens in normal human premenopausal endometrium. Gynecol Endocrinol. 1988 Jun;2(2):121-30. | CrossRef | PubMed |
Vermeulen-Meiners C, Poortman J, Nabuurs M, Thijssen JH. The endogenous concentration and subcellular distribution of androgens in normal human premenopausal endometrium. Gynecol Endocrinol. 1988 Jun;2(2):121-30. | CrossRef | PubMed | Horie K, Takakura K, Imai K, Liao S, Mori T. Immunohistochemical localization of androgen receptor in the human endometrium, deciduas, placenta and pathological conditions of the endometrium. Hum Reprod. 1992 Nov;7(10):1461-6. | PubMed |
Horie K, Takakura K, Imai K, Liao S, Mori T. Immunohistochemical localization of androgen receptor in the human endometrium, deciduas, placenta and pathological conditions of the endometrium. Hum Reprod. 1992 Nov;7(10):1461-6. | PubMed | Kato J, Seto T. Correlation of androgen receptors with histological differentiation in human endometrial carcinomas. Acta Obstet Gynecol Scand. 1985;64(3):209-12 | CrossRef | PubMed |
Kato J, Seto T. Correlation of androgen receptors with histological differentiation in human endometrial carcinomas. Acta Obstet Gynecol Scand. 1985;64(3):209-12 | CrossRef | PubMed | Mertens HJ, Heineman MJ, Koudstaal J, Theunissen P, Evers JL. Androgen receptor content in human endometrium. Eur J Obstet Gynecol Reprod Biol. 1996 Dec;70(1):11-3. | CrossRef | PubMed |
Mertens HJ, Heineman MJ, Koudstaal J, Theunissen P, Evers JL. Androgen receptor content in human endometrium. Eur J Obstet Gynecol Reprod Biol. 1996 Dec;70(1):11-3. | CrossRef | PubMed | Fujimoto J, Nishigaki M, Hori M, Ichigo S, Itoh T, Tamaya T. The effect of estrogen and androgen on androgen receptors and mRNA levels in uterine leiomyoma, myometrium and endometrium of human subjects. J Steroid Biochem Mol Biol. 1994 Aug;50(3-4):137-43. | CrossRef | PubMed |
Fujimoto J, Nishigaki M, Hori M, Ichigo S, Itoh T, Tamaya T. The effect of estrogen and androgen on androgen receptors and mRNA levels in uterine leiomyoma, myometrium and endometrium of human subjects. J Steroid Biochem Mol Biol. 1994 Aug;50(3-4):137-43. | CrossRef | PubMed | Lovely LP, Appa Rao KB, Gui Y, Lessey BA. Characterization of the androgen receptor in a well-differentiated endometrial adenocarcinoma cell line (Ishikawa). J Steroid Biochem Mol Biol. 2000 Nov 15;74(4):235-41. | CrossRef | PubMed |
Lovely LP, Appa Rao KB, Gui Y, Lessey BA. Characterization of the androgen receptor in a well-differentiated endometrial adenocarcinoma cell line (Ishikawa). J Steroid Biochem Mol Biol. 2000 Nov 15;74(4):235-41. | CrossRef | PubMed | Slayden OD, Nayak NR, Burton KA, Chwalisz K, Cameron ST, Critchley HO, et al. Progesterone antagonists increase androgen receptor expression in the rhesus macaque and human endometrium. J Clin Endocrinol Metab. 2001 Jun;86(6):2668-79. | CrossRef | PubMed |
Slayden OD, Nayak NR, Burton KA, Chwalisz K, Cameron ST, Critchley HO, et al. Progesterone antagonists increase androgen receptor expression in the rhesus macaque and human endometrium. J Clin Endocrinol Metab. 2001 Jun;86(6):2668-79. | CrossRef | PubMed | Apparao KB, Lovely LP, Gui Y, Lininger RA, Lessey BA. Elevated endometrial androgen receptor expression in women with polycystic ovary syndrome. Biol Reprod. 2002 Feb;66(2):297-304. | CrossRef | PubMed |
Apparao KB, Lovely LP, Gui Y, Lininger RA, Lessey BA. Elevated endometrial androgen receptor expression in women with polycystic ovary syndrome. Biol Reprod. 2002 Feb;66(2):297-304. | CrossRef | PubMed | Prodi G, Nicoletti G, De Giovanni C, Galli MC, Grilli S, Nanni P, et al. Multiple steroid hormone receptors in normal and abnormal human endometrium. J Cancer Res Clin Oncol. 1980;98(2):173-83. | CrossRef | PubMed |
Prodi G, Nicoletti G, De Giovanni C, Galli MC, Grilli S, Nanni P, et al. Multiple steroid hormone receptors in normal and abnormal human endometrium. J Cancer Res Clin Oncol. 1980;98(2):173-83. | CrossRef | PubMed | Shibata H, Spencer TE, Oñate SA, Jenster G, Tsai SY, Tsai MJ, et al. Role of co-activators and co-repressors in the mechanism of steroid/thyroid receptor action. Recent Prog Horm Res. 1997;52:141-64; discussion 164-5. | PubMed |
Shibata H, Spencer TE, Oñate SA, Jenster G, Tsai SY, Tsai MJ, et al. Role of co-activators and co-repressors in the mechanism of steroid/thyroid receptor action. Recent Prog Horm Res. 1997;52:141-64; discussion 164-5. | PubMed | Torchia J, Glass C, Rosenfeld MG. Co-activators and co-repressors in the integration of transcriptional responses. Curr Opin Cell Biol. 1998 Jun;10(3):373-83. | CrossRef | PubMed |
Torchia J, Glass C, Rosenfeld MG. Co-activators and co-repressors in the integration of transcriptional responses. Curr Opin Cell Biol. 1998 Jun;10(3):373-83. | CrossRef | PubMed | Parker MG. Transcriptional activation by oestrogen receptors. Biochem Soc Symp. 1998;63:45-50. | PubMed |
Parker MG. Transcriptional activation by oestrogen receptors. Biochem Soc Symp. 1998;63:45-50. | PubMed | Kershah SM, Desouki MM, Koterba KL, Rowan BG. Expression of estrogen receptor coregulators in normal and malignant human endometrium. Gynecol Oncol. 2004 Jan;92(1):304-13. | CrossRef | PubMed |
Kershah SM, Desouki MM, Koterba KL, Rowan BG. Expression of estrogen receptor coregulators in normal and malignant human endometrium. Gynecol Oncol. 2004 Jan;92(1):304-13. | CrossRef | PubMed | Spencer TE, Jenster G, Burcin MM, Allis CD, Zhou J, Mizzen CA, et al. Steroid receptor co-activator-1 is a histone acetyltransferase. Nature. 1997 Sep 11;389(6647):194-8. | CrossRef | PubMed |
Spencer TE, Jenster G, Burcin MM, Allis CD, Zhou J, Mizzen CA, et al. Steroid receptor co-activator-1 is a histone acetyltransferase. Nature. 1997 Sep 11;389(6647):194-8. | CrossRef | PubMed | Chen H, Lin RJ,Schiltz RL, Chakravarti D, Nash A, Nagy L et al. Nuclear receptor coactivator ACTR is a novel histone acetyltransferase and forms a multimeric activation complex with P/CAF and CBP/p300. Cell. 1997 Aug 8;90(3):569-80. | CrossRef | PubMed |
Chen H, Lin RJ,Schiltz RL, Chakravarti D, Nash A, Nagy L et al. Nuclear receptor coactivator ACTR is a novel histone acetyltransferase and forms a multimeric activation complex with P/CAF and CBP/p300. Cell. 1997 Aug 8;90(3):569-80. | CrossRef | PubMed | Gregory CW, Wilson EM, Apparao KB, Lininger RA, Meyer WR, Kowalik A, et al. Steroid receptor coactivator expression throughout the menstrual cycle in normal and abnormal endometrium. J Clin Endocrinol Metab. 2002 Jun;87(6):2960-6. | CrossRef | PubMed |
Gregory CW, Wilson EM, Apparao KB, Lininger RA, Meyer WR, Kowalik A, et al. Steroid receptor coactivator expression throughout the menstrual cycle in normal and abnormal endometrium. J Clin Endocrinol Metab. 2002 Jun;87(6):2960-6. | CrossRef | PubMed | Speroff L, Vande Wiele RL. Regulation of the human menstrual cycle. Am J Obstet Gynecol. 1971 Jan 15;109(2):234-47. | PubMed |
Speroff L, Vande Wiele RL. Regulation of the human menstrual cycle. Am J Obstet Gynecol. 1971 Jan 15;109(2):234-47. | PubMed | Tabibzadeh S. The signals and molecular pathways involved in human menstruation, a unique process of tissue destruction and remodeling. Mol Hum Reprod. 1996 Feb;2(2):77-92. | CrossRef | PubMed |
Tabibzadeh S. The signals and molecular pathways involved in human menstruation, a unique process of tissue destruction and remodeling. Mol Hum Reprod. 1996 Feb;2(2):77-92. | CrossRef | PubMed | Bianchini F, Kaaks R, Vainio H. Overweight, obesity, and cancer risk. Lancet Oncol. 2002 Sep;3(9):565-74. | CrossRef | PubMed |
Bianchini F, Kaaks R, Vainio H. Overweight, obesity, and cancer risk. Lancet Oncol. 2002 Sep;3(9):565-74. | CrossRef | PubMed | Sherman ME. Theories of endometrial carcinogenesis: a multidisciplinary approach. Mod Pathol. 2000 Mar;13(3):295-308. | CrossRef | PubMed |
Sherman ME. Theories of endometrial carcinogenesis: a multidisciplinary approach. Mod Pathol. 2000 Mar;13(3):295-308. | CrossRef | PubMed | Boyd J. Estrogen as a carcinogen: the genetics and molecular biology of human endometrial carcinoma. Prog Clin Biol Res. 1996;394:151-73. | PubMed |
Boyd J. Estrogen as a carcinogen: the genetics and molecular biology of human endometrial carcinoma. Prog Clin Biol Res. 1996;394:151-73. | PubMed | Jeyarajah A, Oram D, Jacobs I. Molecular events in endometrial carcinogenesis. Int J Gynecol Cancer 1996;6: 425-438. | CrossRef |
Jeyarajah A, Oram D, Jacobs I. Molecular events in endometrial carcinogenesis. Int J Gynecol Cancer 1996;6: 425-438. | CrossRef | Villavicencio A, Gabler F, Fuentes A, Vega M. Regulators of cell survival in endometrium from patients with polycystic ovarian syndrome. 12th World Congress on Human Reproduction. Venecia, Italia, Marzo 2005.
Villavicencio A, Gabler F, Fuentes A, Vega M. Regulators of cell survival in endometrium from patients with polycystic ovarian syndrome. 12th World Congress on Human Reproduction. Venecia, Italia, Marzo 2005.  Hardiman P, Pillay OC, Atiomo W. Polycystic ovary syndrome and endometrial carcinoma. Lancet. 2003 May 24;361(9371):1810-2. | CrossRef | PubMed |
Hardiman P, Pillay OC, Atiomo W. Polycystic ovary syndrome and endometrial carcinoma. Lancet. 2003 May 24;361(9371):1810-2. | CrossRef | PubMed | American Collegeof Obstetricians and Gynecologists. ACOG Practice Bulletin. Polycystic ovary syndrome. Obstet Gynecol. 2002 Dec;100(6):1389-402. | CrossRef | PubMed |
American Collegeof Obstetricians and Gynecologists. ACOG Practice Bulletin. Polycystic ovary syndrome. Obstet Gynecol. 2002 Dec;100(6):1389-402. | CrossRef | PubMed | Cory S, Vaux DL, Strasser A, Harris AW, Adams JM. Insights from Bcl-2 and Myc: malignancy involves abrogation of apoptosis as well as sustained proliferation. Cancer Res. 1999 Apr 1;59(7 Suppl):1685s-1692s. | PubMed |
Cory S, Vaux DL, Strasser A, Harris AW, Adams JM. Insights from Bcl-2 and Myc: malignancy involves abrogation of apoptosis as well as sustained proliferation. Cancer Res. 1999 Apr 1;59(7 Suppl):1685s-1692s. | PubMed | Borner C, Monney L, Olivier R, Rosse J, Conus S and Fellay I. Bcl-2 and Bax: the good and the bad for the cell survival. Anticancer Res ;18 (Abstr. 15):4521.
Borner C, Monney L, Olivier R, Rosse J, Conus S and Fellay I. Bcl-2 and Bax: the good and the bad for the cell survival. Anticancer Res ;18 (Abstr. 15):4521.  Kroemer G. The proto-oncogen bcl-2 and its role in regulating apoptosis. Nat Med. 1997 Jun;3(6):614-20. | CrossRef | PubMed |
Kroemer G. The proto-oncogen bcl-2 and its role in regulating apoptosis. Nat Med. 1997 Jun;3(6):614-20. | CrossRef | PubMed | Korsmeyer SJ. Bcl-2 gene family and the regulation of programmed cell death. Cancer Res. 1999 Apr 1;59(7 Suppl):1693s-1700s. | PubMed |
Korsmeyer SJ. Bcl-2 gene family and the regulation of programmed cell death. Cancer Res. 1999 Apr 1;59(7 Suppl):1693s-1700s. | PubMed | Yang J, Liu X, Bhalla K, Kim CN, Ibrado AM, Cai J, et al. Prevention of apoptosis by Bcl-2: release cytochrome c from mitochondria blocked. Science. 1997 Feb 21;275(5303):1129-32. | CrossRef | PubMed |
Yang J, Liu X, Bhalla K, Kim CN, Ibrado AM, Cai J, et al. Prevention of apoptosis by Bcl-2: release cytochrome c from mitochondria blocked. Science. 1997 Feb 21;275(5303):1129-32. | CrossRef | PubMed | Lu QL, Poulsom R, Wong L, Hanby AM. Bcl-2 expression in adult and embryonic non-haematopoietic tissues. J Pathol. 1993 Apr;169(4):431-7. | CrossRef | PubMed |
Lu QL, Poulsom R, Wong L, Hanby AM. Bcl-2 expression in adult and embryonic non-haematopoietic tissues. J Pathol. 1993 Apr;169(4):431-7. | CrossRef | PubMed | Chan WK, Mole MM, Levison DA, Ball RY, Lu QL, Patel K, et al. Nuclear and cytoplasmic Bcl-2 expression in endometrial hyperplasia and adenocarcinoma. J Pathol. 1995 Nov;177(3):241-6. | CrossRef | PubMed |
Chan WK, Mole MM, Levison DA, Ball RY, Lu QL, Patel K, et al. Nuclear and cytoplasmic Bcl-2 expression in endometrial hyperplasia and adenocarcinoma. J Pathol. 1995 Nov;177(3):241-6. | CrossRef | PubMed | Hockenbery DM. Bcl-2 in cancer, development and apoptosis. J Cell Sci Suppl. 1994;18:51-5. | PubMed |
Hockenbery DM. Bcl-2 in cancer, development and apoptosis. J Cell Sci Suppl. 1994;18:51-5. | PubMed | Crescenzi E, Palumbo G. Bcl-2 exerts a pRb-mediated cell cycle inhibitory function in HEC1B endometrial carcinoma cells. Gynecol Oncol. 2001 May;81(2):184-92. | CrossRef | PubMed |
Crescenzi E, Palumbo G. Bcl-2 exerts a pRb-mediated cell cycle inhibitory function in HEC1B endometrial carcinoma cells. Gynecol Oncol. 2001 May;81(2):184-92. | CrossRef | PubMed | Otsuki Y, Misaki O, Sugimoto O, Ito Y, Tsujimoto Y, Akao Y. Cyclic Bcl-2 gene expresión in human uterine endometrium during the menstrual cycle. Lancet. 1994 Jul 2;344(8914):28-9. | CrossRef | PubMed |
Otsuki Y, Misaki O, Sugimoto O, Ito Y, Tsujimoto Y, Akao Y. Cyclic Bcl-2 gene expresión in human uterine endometrium during the menstrual cycle. Lancet. 1994 Jul 2;344(8914):28-9. | CrossRef | PubMed | Sakuragi N, Salah-eldin AE, Watari H, Itoh T, Inoue S, Moriuchi T, et al. Bax, Bcl-2 and p53 expression in endometrial cancer. Gynecol Oncol. 2002 Sep;86(3):288-96. | CrossRef | PubMed |
Sakuragi N, Salah-eldin AE, Watari H, Itoh T, Inoue S, Moriuchi T, et al. Bax, Bcl-2 and p53 expression in endometrial cancer. Gynecol Oncol. 2002 Sep;86(3):288-96. | CrossRef | PubMed | Sherr CJ, Roberts JM. Inhibitors of mammalian G1 cyclin-dependent kinases. Genes Dev. 1995 May 15;9(10):1149-63. | CrossRef | PubMed |
Sherr CJ, Roberts JM. Inhibitors of mammalian G1 cyclin-dependent kinases. Genes Dev. 1995 May 15;9(10):1149-63. | CrossRef | PubMed | Nurse P. Ordering S phase and M phase in the cell cycle. Cell. 1994 Nov 18;79(4):547-50. | CrossRef | PubMed |
Nurse P. Ordering S phase and M phase in the cell cycle. Cell. 1994 Nov 18;79(4):547-50. | CrossRef | PubMed | Pestell RG, Albanese C, Reutens AT, Segall JE, Lee RJ, Arnold A. The cyclins and cyclin-dependent kinase inhibitors in hormonal regulation of proliferation and differentiation. Endocr Rev. 1999 Aug;20(4):501-34. | CrossRef | PubMed |
Pestell RG, Albanese C, Reutens AT, Segall JE, Lee RJ, Arnold A. The cyclins and cyclin-dependent kinase inhibitors in hormonal regulation of proliferation and differentiation. Endocr Rev. 1999 Aug;20(4):501-34. | CrossRef | PubMed | Quarmby VE, Korach KS. The influence of 17 beta-estradiol on patterns of cell division in the uterus. Endocrinology 114: 694-702, 1984 | CrossRef | PubMed |
Quarmby VE, Korach KS. The influence of 17 beta-estradiol on patterns of cell division in the uterus. Endocrinology 114: 694-702, 1984 | CrossRef | PubMed | Hata H, Hamano M, Watanabe J, Kuratomo H. Role of estrogen and estrogen-related growth factor in the mechanism of hormone dependency of endometrial carcinoma cells. Oncology. 1998 Dec;55 Suppl 1:35-44. | CrossRef | PubMed |
Hata H, Hamano M, Watanabe J, Kuratomo H. Role of estrogen and estrogen-related growth factor in the mechanism of hormone dependency of endometrial carcinoma cells. Oncology. 1998 Dec;55 Suppl 1:35-44. | CrossRef | PubMed | Kyushima N, Watanabe J, Hata H, Jobo T, Kameya T, Kuramoto H. Expression of cyclin A in endometrial adenocarcinoma and its correlation with proliferative activity and clinicopathological variables. J Cancer Res Clin Oncol. 2002 Jun;128(6):307-12. Epub 2002 Apr 10. | CrossRef | PubMed |
Kyushima N, Watanabe J, Hata H, Jobo T, Kameya T, Kuramoto H. Expression of cyclin A in endometrial adenocarcinoma and its correlation with proliferative activity and clinicopathological variables. J Cancer Res Clin Oncol. 2002 Jun;128(6):307-12. Epub 2002 Apr 10. | CrossRef | PubMed | Weinberg RA. The retinobalstoma protein and cell cycle control. Cell. 1995 May 5;81(3):323-30.
| CrossRef | PubMed |
Weinberg RA. The retinobalstoma protein and cell cycle control. Cell. 1995 May 5;81(3):323-30.
| CrossRef | PubMed | Rubul Quddus M, Latkovich P, Castellano WJ, James Sung C, Steinhoff MM, Briggs RC, et al. Expression of cyclin D1 in normal, metaplasic, hyperplastic endometrium and endometrioid carcinoma suggests a role in endometrial carcinogenesis. Arch Pathol Lab Med. 2002 Apr;126(4):459-63. | PubMed |
Rubul Quddus M, Latkovich P, Castellano WJ, James Sung C, Steinhoff MM, Briggs RC, et al. Expression of cyclin D1 in normal, metaplasic, hyperplastic endometrium and endometrioid carcinoma suggests a role in endometrial carcinogenesis. Arch Pathol Lab Med. 2002 Apr;126(4):459-63. | PubMed | Berchuck A. Biomarkers in the endometrium. J Cell Biochem Suppl. 1995;23:174-8. | CrossRef | PubMed |
Berchuck A. Biomarkers in the endometrium. J Cell Biochem Suppl. 1995;23:174-8. | CrossRef | PubMed | Myers MP, Pass I, Batty IH, Van der Kaay J, Stolarov JP, Hemmings BA,et al. The lipid phosphatase activity of PTEN is critical for its tumor suppressor function. Proc Natl Acad Sci U S A. 1998 Nov 10;95(23):13513-8. | CrossRef | PubMed | PMC |
Myers MP, Pass I, Batty IH, Van der Kaay J, Stolarov JP, Hemmings BA,et al. The lipid phosphatase activity of PTEN is critical for its tumor suppressor function. Proc Natl Acad Sci U S A. 1998 Nov 10;95(23):13513-8. | CrossRef | PubMed | PMC | Weng LP, Brown JL and Eng C. PTEN coordinates G1 arrest by down-regulating cyclin D1 via its protein phosphatase activity and up-regulating p27 via its lipid phosphatase activity in a breast cancer model. Hum Mol Genet. 2001 Mar 15;10(6):599-604. | CrossRef | PubMed |
Weng LP, Brown JL and Eng C. PTEN coordinates G1 arrest by down-regulating cyclin D1 via its protein phosphatase activity and up-regulating p27 via its lipid phosphatase activity in a breast cancer model. Hum Mol Genet. 2001 Mar 15;10(6):599-604. | CrossRef | PubMed | Guzeloglu-Kayisli O, Kayisli UA, Al-Rejjal R, Zheng W, Luleci G, Arici A. Regulation of PTEN (Phosphatase and tensin homolog deleted on chromosome 10) expresión by estradiol and progesterone in human endometrium. J Clin Endocrinol Metab. 2003 Oct;88(10):5017-26. | CrossRef | PubMed |
Guzeloglu-Kayisli O, Kayisli UA, Al-Rejjal R, Zheng W, Luleci G, Arici A. Regulation of PTEN (Phosphatase and tensin homolog deleted on chromosome 10) expresión by estradiol and progesterone in human endometrium. J Clin Endocrinol Metab. 2003 Oct;88(10):5017-26. | CrossRef | PubMed | Tashiro H, Blazes MS, Wu R, Cho KR, Bose S, Wang SI, et al. Mutations in PTEN are frequent in endometrial carcinoma but rare in other common gynecological malignancies. Cancer Res. 1997 Sep 15;57(18):3935-40. | PubMed |
Tashiro H, Blazes MS, Wu R, Cho KR, Bose S, Wang SI, et al. Mutations in PTEN are frequent in endometrial carcinoma but rare in other common gynecological malignancies. Cancer Res. 1997 Sep 15;57(18):3935-40. | PubMed | Yoshinaga K, Sasano H, Furukawa T, Yamakawa H, Yuki M, Sato S, et al. The PTEN, BAX and IGFIIR genes are mutated in endometrial atypical hyperplasia. Jpn J Cancer Res. 1998 Oct;89(10):985-90. | CrossRef | PubMed |
Yoshinaga K, Sasano H, Furukawa T, Yamakawa H, Yuki M, Sato S, et al. The PTEN, BAX and IGFIIR genes are mutated in endometrial atypical hyperplasia. Jpn J Cancer Res. 1998 Oct;89(10):985-90. | CrossRef | PubMed | Maxwell GL, Risinger JI, Gumbs C, Shaw H, Bentley RC, Barrett JC, et al. Mutation of the PTEN tumor suppressor gene in endometrial hyperplasias. Cancer Res. 1998 Jun 15;58(12):2500-3. | PubMed |
Maxwell GL, Risinger JI, Gumbs C, Shaw H, Bentley RC, Barrett JC, et al. Mutation of the PTEN tumor suppressor gene in endometrial hyperplasias. Cancer Res. 1998 Jun 15;58(12):2500-3. | PubMed |