 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 6 de abril y 10 de agosto de 2005. Director: Dr. José Manuel Ojeda.
Ciertos tipos de infecciones virales se han asociado con algunos cánceres en el ser humano y se estima que hasta 20% de los cánceres tendrían una etiología viral. La asociación de infecciones virales con cánceres específicos deriva de diversos estudios que han demostrado las siguientes situaciones: preexistencia de infección viral con respecto al cáncer; mayor prevalencia de cáncer en lugares con mayor prevalencia de algunos virus; mayor nivel de algunos anticuerpos antivirales en pacientes con cáncer; detección de DNA y/o proteínas o antígenos virales en células tumorales; y capacidad de los virus para alterar genéticamente las células del huésped e inducir tumores (1, 2).
Los virus pueden inducir cáncer por un mecanismo directo, mediante la integración total o parcial de un genoma viral en el DNA de una célula, que actuaría como un verdadero oncogen, o por un mecanismo indirecto, a través de la promoción o estabilización del crecimiento celular en una población previamente transformada o alterada genéticamente (1, 2, 3, 4).
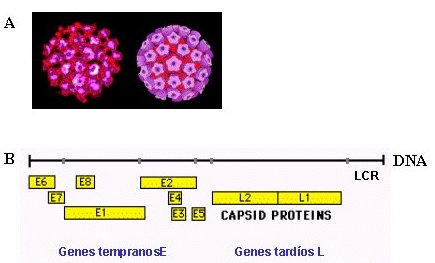
La relación entre el virus papiloma humano (VPH) y el cáncer de cuello uterino se reconoció hace más de quince años. En la Figura 1 se muestra un esquema de la estructura y genoma del VPH, que pertenece a la familia Papovaviridae, formada por virus de doble cadena de DNA circular, con alrededor de 8.000 pares de bases (10 genes). La cubierta proteica que rodea al DNA viral posee una proteína que contiene una región antigénicamente común con otros tipos de virus papiloma. Existen más de 100 tipos diferentes de virus papiloma, según la variación genética existente en cada uno de ellos (5). El VPH tiene genes tempranos o E (E1 a E7), que controlan la replicación y expresión genética viral y genes tardíos o L (L1 y L2) que determinan las proteínas de la cubierta proteica del virus. Existe otra región genética cuya secuencia de nucleótidos no codifica para ninguna proteína (LCR o NCR), pero posee funciones de regulación de la expresión de los genes virales; a esta región se unen proteínas celulares, como factores de transcripción y factores esteroidales (6, 7).
Figura 1. Virus y cáncer: rol del VPH. A: Estructura de los viriones de VPH. B: genoma de VPH
Los factores sexuales tienen un rol consistente y dominante en la etiología del cáncer de cuello uterino (CACU), implicando al VPH como principal agente causal. La responsabilidad directa del VPH en la génesis del cambio neoplásico se apoya en evidencias epidemiológicas, clínicas y de laboratorio; sin embargo, no es el factor único ni imprescindible (8, 9).
Entre 1980 y 2002, la inmunología, la bioquímica y la microscopía electrónica establecieron la presencia del VPH en tejido tumoral (CIS y carcinoma); posteriormente, la biología molecular ha permitido identificar y tipificar el DNA del virus papiloma, reconociendo más de cien genotipos de VPH, de los cuales, alrededor de 40 se han encontrado integrando el DNA de lesiones malignas y benignas de la zona genitoperineal (10).
Se han separado los VPH, según su riesgo oncogénico, en virus de alto riesgo, como los VPH 16, 18, 31, 33, 35, y de bajo riesgo, porque no tienen asociación con lesiones malignas, como el VPH 6 y 11 (10).
Por otra parte, la asociación de VPH y CACU es de las mayores en epidemiología; el DNA del VPH está presente en 99,7% de los casos de CACU. La prevalencia de infección asintomática por VPH es de 5 a 40% de las mujeres sexualmente activas y en la mayoría de los casos, la infección VPH es transitoria o intermitente. El evento decisivo es la integración del DNA viral al genoma de célula huésped, logrando la inactivación de genes supresores de tumores.
El riesgo de infección por VPH, a lo largo de la vida, es muy alto, (50 a 80%), mientras que la prevalencia de lesiones neoplásicas significativas es notablemente menor (2% o menos). Muchas infecciones virales son transitorias, latentes o simplemente desaparecen, pero en una minoría de casos la infección persiste: ¿Respuesta inmunológica permisiva? ¿Influencia de cofactores? Algunas de estas mujeres con infección persistente y con tipos virales de alto riesgo, desarrollan NIE de alto grado.
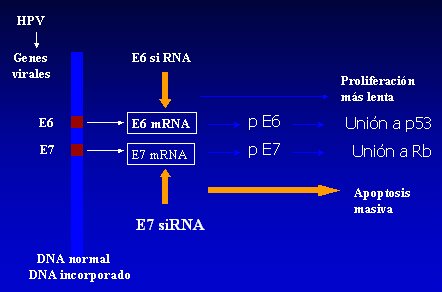
Los productos de los genes tempranos E6 y E7 juegan un rol clave en la carcinogénesis, lo que se ha establecido porque, al analizar células infectadas por VPH, que presentan integración del DNA viral al genoma de las células tumorales, esta integración lleva a la disrupción de varios genes virales, preservándose la acción de E6 y E7, que son transcritos en forma activa; por otra parte, las proteínas E6 y E7son capaces de inducir transformación celular in vitro, confirmándose su rol oncogénico; y finalmente, estudios bioquímicos han demostrado que las proteínas E6 y E7 son capaces de formar complejos estables con proteínas celulares, como P53 y pRb, inactivando su actividad supresora tumoral. La principal característica supresora de tumor de p53 es su capacidad de proteger el genoma celular induciendo apoptosis, mientras que pRb tiene un rol clave en el control del ciclo celular en la transición entre fases G1/S (11) (Figura 2).
Figura 2. Rol del VPH en el cáncer cervicouterino: Interferencia génica
Se ha estado trabajando en las últimas décadas en el desarrollo de estrategias de prevención primaria para evitar que se produzca la infección por VPH. Una de las áreas es el desarrollo de vacunas, preventivas (primaria) y terapéuticas (secundarias), que fue impulsado por las investigaciones in vitro de la inmunogenicidad de las proteínas y DNA viral. Una de las contribuciones más importantes en ésta área la entregaron Zhou y colaboradores en 1991, cuando demostraron que la proteína de la cápside viral L1 (VPH 16), expresada en un sistema recombinante, formaba partículas que llamaron Virus like particles (VPLs), que se asemejan a los viriones nativos. Estas VPLs son altamente antigénicas, sin ser patogénicas.
La respuesta inmune que gatilla el virus papiloma humano en el organismo es pobre, si se la compara con la que provocan otros tipos de virus. El ciclo de la infección por VPH se relaciona estrechamente con el ciclo de su célula huésped, el queratinocito; el VPH penetra las células suprabasales del epitelio del cuello uterino y mantiene un programa de transcripción viral reprimido en sus genes tardíos, L1 y L2, que son los inmunógenos más potentes del VPH. Esta represión permite al virus escapar de la vigilancia y respuesta inmune del huésped. Esto es diferente a lo que ocurre en algunos modelos animales, en los que la infección por VPH es rápidamente erradicada, debido a la expresión de L1 y L2 en todas las capas del epitelio infectado, lo que provoca la llegada de múltiples efectores de la respuesta inmune, como células presentadoras de antígenos y linfocitos T, a la zona de la infección.
La infección por VPH no es lítica y generalmente produce lesiones verrugosas planas o hiperqueratosas del epitelio escamoso, sin inflamación local. Los VPH han evolucionado para evadir la respuesta inmune, y la infección generalmente dura varios años. El ciclo de replicación del VPH se lleva a cabo dentro de los queratinocitos que se descaman; de esta manera, durante la infección hay poca presentación de antígenos virales al sistema inmune por células presentadoras de antígenos, tanto a nivel local como sistémico.
Puesto que la infección por VPH es el principal factor responsable en el cáncer de cuello uterino, la investigación y desarrollo de vacunas profilácticas y terapéuticas que tienen como blanco al VPH han sido motivo de estudio en los últimos años. La respuesta inmune contra los virus está dada tanto por la respuesta inmune humoral como por la celular, y se han realizado muchos estudios para conocer los anticuerpos circulantes contra VPH, pero pocos para conocer la respuesta celular (12, 13).
En VPH se han identificado genes de expresión temprana y tardía, como ya se ha mencionado, los genes tempranos codifican para proteínas relacionadas con la replicación (E1), transcripción (E2), y transformación celular (E6 y E7). Los genes tardíos codifican para proteínas de la cápside (L1 y L2). La proteína principal de la cápside es L1, que comprende más de 90% de las proteínas del virión. Los primeros estudios sobre vacunas contra VPH se realizaron en perros, conejos y bovinos, en ellos se ha podido demostrar que se logra prevenir la infección viral al inmunizarlos con la proteína L1.
En humanos se ha demostrado la presencia de anticuerpos específicos o de reacción cruzada contra partículas parecidas a virus, denominadas VPL (virus like particles). Entre 50 y 60 % de las mujeres infectadas por VPH tienen anticuerpos contra VPH 16 (VLP). En pacientes con NIE 3 por VPH 16 + se detectan anticuerpos contra proteínas de la cápside, sin embargo en cánceres invasores VPH 16 +, en los que se están expresando proteínas tempranas y no viriones, no siempre se detectan anticuerpos contra VLP de VPH. Estudios de serorreactividad contra VLP de los VPH sugieren que los anticuerpos contra la cápside son inducidos durante infecciones graves o persistentes de VPH y se pierden levemente una vez terminada la infección productiva. Los anticuerpos contra la cápside, por lo tanto, no son marcadores confiables de infecciones por VPH 16, recientes o pasadas, en un individuo.
En cuanto a anticuerpos contra proteínas tempranas, las proteínas tempranas de VPH comprenden seis de las proteínas codificadas por estos virus, éstas se expresan en forma coordinada y no se expresan en los viriones maduros (14-17).
Una de las respuestas más efectivas contra los virus es efectuada por la inmunidad celular, que es mediada por células efectoras como macrófagos, células asesinas naturales (NK) y linfocitos T citotóxicos (CD8), cuya acción es regulada principalmente por los linfocitos T CD 4. Las células NK y macrófagos están presentes en la mayoría de las lesiones; sin embargo, células de CACU y líneas celulares de VPH son resistentes a las células NK. En laboratorio se ha identificado la expresión de citoquinas inmunosupresoras producidas por linfocitos T supresores, en biopsias de pacientes portadoras de cánceres invasores avanzados, en los que no se detectó citoquinas que aumenten la actividad antitumoral. Estos resultados sugieren que existen estados de inmunosupresión (HIV, transplantadas renales) susceptibles de ser manejados en el control del cáncer de cuello uterino (18).
En resumen, la infección por VPH carece de los efectos citopáticos e inmunogénicos presentes en otras infecciones virales, por lo que la respuesta inmune natural se ve obstaculizada. El no reconocimiento de la infección por la célula huésped permite la replicación del virus y la persistencia de éste en la célula afectada.
Las vacunas que se han desarrollado para VPH se han enfocado en dos grupos de poblaciones: en primer lugar, aquellas personas no expuestas al virus, en cuyo caso se trata de vacunas profilácticas; y un segundo grupo, el de la población ya infectada por el virus, en cuyo caso son vacunas terapéuticas, que tienen como fin principal evitar la progresión de la infección hacia etapas invasoras.
Las vacunas profilácticas, que tienen como objetivo prevenir la infección por VPH, así como el desarrollo de lesiones en individuos infectados por el virus, mediante la producción de anticuerpos neutralizantes contra proteínas estructurales L1 y L2 de la cápside viral, han sido impulsadas principalmente por el desarrollo de VLPs y su alta inmunogenicidad. El uso de proteínas de L1 y L2 induce la formación de anticuerpos neutralizantes, los cuales son capaces de prevenir infecciones por VPH y las proteínas que han dado mejores resultados son las sintéticas.
Otra estrategia para producir respuesta inmune neutralizante contra las proteínas de la cápside viral ha sido la producción, mediante ingeniería genética, de proteínas ensambladas incapaces de infectar por sí mismas a una célula viva (VPL), las que están compuestas sólo por las proteínas externas de membrana L1 o L2. La proteína L1 puede ser producida en células eucarióticas por recombinación de DNA, usando diferentes vectores, como bacterias, virus o levaduras. Las VLP son altamente inmunogénicas. La formación de proteínas L1 en sistemas heterólogos (levaduras), genera partículas parecidas a los virus (VLP) no infecciosas que se asemejan a los viriones VPH.
En el estudio de Koutsky, que comparó placebo con la vacuna VPH 16 L1 VLP, en el grupo vacunado se logró una protección de 100% en relación a la prevención de NIE provocadas por VPH 16, a los 17 meses después de administrada la vacuna, en pacientes VPH 16 negativas. Posteriormente, otros estudios también demostraron una alta inmunogenicidad de las vacunas VPH 11 y 18 L1 VPH.
Falta conocimiento acerca de los factores implicados en la progresión hacia la enfermedad clínica, y debido a la gran cantidad de tiempo que se necesita para que ésta se desarrolle, la vacunación profiláctica es menos atractiva para CACU que para infecciones por VPH no oncogénicas, que desarrollan lesiones rápidamente. Hay varias consideraciones respecto a la utilización de este tipo de vacunas, ya que no está claro si la infección se debe a partículas virales libres o a partículas que permanecen encerradas en las células escamosas, que las protegen de la acción de los anticuerpos. También se deberán desarrollar vacunas dirigidas contra VPH específicos o contra un grupo de virus, ya que hay casos de infecciones mixtas, además de que la mayoría de las infecciones por VPH son asintomáticas y/o clínicamente no detectables.
La identificación de individuos para la aplicación de vacunas profilácticas se realiza principalmente por análisis serológicos, pero es difícil identificar a los verdaderos seronegativos, ya que hay varios factores que influyen en estos resultados; más aun, debido a que estas infecciones son a nivel de mucosas, es necesario producir vacunas que induzcan inmunidad de tipo IgA, pero que a la vez sea una inmunidad persistente, en virtud de que es necesaria la persistencia de la infección del VPH para que se desarrolle cáncer invasor.
El objetivo principal de este tipo de vacunas es inducir inmunidad celular específica, que permita la regresión de lesiones establecidas o, aún, la regresión de tumores malignos. Para lograr esto, se debe atacar a los estados más avanzados de la infección viral, ya sea afectando a las proteínas tempranas o al DNA ya integrado.
Las vacunas terapéuticas que se han utilizado se han basado en varios vectores, como VLPs, virus recombinantes, DNA viral, proteínas, péptidos y otros. En las primeras se utilizan vectores virales, tales como el virus vaccinia, que tiene una gran capacidad de inserción genética y promueve la producción de grandes cantidades de proteínas recombinantes. Las vacunas tumorales consisten en la transfección de células tumorales con genes como MHC-I, moléculas coestimuladoras, citocinas como el INF-g, y factores de crecimiento. En cuanto a las vacunas basadas en péptidos, en sistemas murinos se han evaluado péptidos que contienen epítopos para CTL, los que protegen de la producción de tumores dirigidos contra VPH-16. En humanos ya se han identificado péptidos específicos de E6 y E7 restringidos a CTL y presentados por los alelos HLA-A más comunes.
La continua búsqueda de transportadores eficientes y epítopos importantes para MHC-I y MHC-II ayudará al futuro desarrollo de vacunas con péptidos específicos (19-21).
Las vacunas representan una importante medida para la prevención de múltiples enfermedades y su relación costo/beneficio es muy valiosa. Las vacunas para VPH tendrían los beneficios potenciales de disminuir la incidencia de lesiones precursoras e invasoras de cáncer de cuello uterino, disminuir la aparición de verrugas genitales y otros cánceres relacionados con el virus VPH, como los de vulva, vagina, pene y ano (22).
Los estudios epidemiológicos sugieren que la inmunidad para virus VPH es tipo específica, es decir, cada virus VPH genera la aparición de anticuerpos neutralizantes diferentes; los virus VPH son, entonces, excelentes candidatos para ser controlados con una vacuna específica para cada serotipo. Los estudios más importantes involucran las VLP, proteínas de la cápside viral que inducen inmunidad específica. Las vacunas basadas en VLP tiene la propiedad de ser altamente inmunogénicas y no tóxicas (23). Actualmente existen dos estudios fase 2 completados y un estudio fase 3 para VPH 16, 18, 6 y 11 en curso (24).
La primera interrogante que se debe aclarar al pensar en una vacuna para VPH a base de VLP, es si realmente entregan una inmunidad activa. Fife y colaboradores demostraron que la aparición de anticuerpos específicos para virus VPH 11 era muy importante luego de administrar la vacuna del serotipo mencionado y que esta respuesta inmunitaria permanecía en el tiempo (25).
En el primer trabajo que se describirá se utilizó la vacuna VPH 16 VLP en 2.392 mujeres, de las cuales, 1.533 se incluyeron en el análisis. El rango de edad estaba entre 16 y 23 años, no estaban embarazadas al inicio del estudio, no tenían antecedente de citología alterada, habían tenido cinco o menos parejas sexuales y se incluyeron pacientes sin actividad sexual, que consultaban para solicitar métodos contraceptivos. Las mujeres se signaron en forma aleatoria a dos grupos, uno de los cuales recibiría vacuna en el día 0 y a los 2 y 6 meses, y el otro recibiría placebo intramuscular, en las mismas fechas. El objetivo principal del estudio fue evaluar la persistencia de la infección por VPH, definida como la detección de DNA de VPH 16 en dos controles o visitas seguidas, o la positividad al término del estudio. La tolerancia a la vacuna se consideró como objetivo secundario (26). La dosis empleada de la vacuna para VPH 16 fue de 40 ug por dosis; recibieron vacunación 768 mujeres y placebo, en dosis de 225 ug por dosis de aluminio adyuvante, 765 mujeres.
Se encontró persistencia viral en 41 casos en el grupo placebo y en ninguno en el grupo vacunado; se detectaron 9 lesiones precursoras en el grupo placebo y ninguna en el grupo vacunado; y las infecciones transitorias fueron mucho menores en el grupo vacunado (6 versus 68). La evaluación de estas pacientes a los cuatro años también dio resultados prometedores, ya que se encontraron 111 casos de persistencia en el grupo sin vacuna y sólo 7 en el grupo vacunado. Al observar los casos de lesiones preinvasoras nuevamente hubo diferencias importantes, con 24 casos en el grupo placebo y ninguno en el grupo vacunado. Lo anterior demuestra que la eficacia de la vacuna alcanza a 94% en el período de cuatro años (26).
El segundo estudio fase 2 en humanos se realizó con una vacuna bivalente para VPH 16 y 18, que también se fabrica con VLP. En este trabajo se incluyeron 1.113 mujeres de 15 a 25 años y los criterios de inclusión fueron los mismos del trabajo para VPH 16. Se hicieron dos grupos, en forma aleatoria; un grupo recibió vacuna para VPH 16 y 18, en dosis de 20 ug (n=560) y al grupo placebo (n=553) se le administró aluminio hidróxido como adyuvante. Ambos grupos recibieron las dosis por vía intramuscular en el día 0 y a los 1 y 6 meses. El objetivo principal del trabajo fue estudiar la eficacia de la vacuna en la prevención de la infección persistente por los virus en estudio y el objetivo secundario fue evaluar la eficacia en la prevención de lesiones precursoras del cuello uterino y la tolerancia de la vacuna (27).
El estudio demostró una excelente eficacia de la vacuna VPH 16-18 VLP L1 en la prevención de la infección persistente. Al analizar las pacientes que recibieron todas las dosis en forma adecuada y en los tiempos correctos, se logró 100% de prevención de la infección persistente y 91,6% de la infección transitoria. Al analizar la intención de tratar, que es la situación más real, en pacientes que no recibieron todo el protocolo o la vacuna se administró en tiempos diferentes a lo programado, la eficiencia siguió siendo muy buena, con 95,1% de eficacia en la infección persistente, que es la que tiene estrecha relación con el CACU. En este grupo también se logró una alta eficacia en la disminución de citologías anormales (92,9%). La vacuna fue muy bien tolerada y no hubo efectos adversos (27).
El último trabajo se realizó con una vacuna tetravalente con VLP 1 para virus VPH 6, 11, 16 y 18. Este estudio, realizado por Villa y colaboradores, fue un trabajo doble ciego, aleatorizado y con diferentes dosis de vacuna, cuyos objetivos fueron: determinar la capacidad de producir respuesta inmune de los cuatro componentes de la vacuna; evaluar la eficacia y seguridad de la fórmula empleada en la vacunación; y establecer las dosis a utilizar en un estudio fase 3. Se incluyeron mujeres entre 16 y 23 años, no embarazadas, sin alteraciones citológicas previas, con historia de cuatro o menos parejas sexuales y mujeres sin relaciones sexuales previas, que consultaron por anticoncepción. Se ingresaron 1.158 mujeres, que fueron asignadas aleatoriamente a cuatro grupos; los primeros tres recibieron diferentes dosis de la vacuna tetravalente, para determinar la capacidad inmunogénica de cada una de ellas y determinar las dosis a usar en el estudio fase 3. El cuarto grupo recibió placebo.
En el primer grupo vacunado entraron 277 mujeres y en el grupo placebo, 275. Ambos grupos recibieron las dosis intramusculares en el día 0 y en el mes 6 y 8 y el seguimiento se realizó con un mínimo de treinta meses. Los objetivos específicos de este estudio fueron: evaluar la infección persistente por VPH con cualquiera de las vacunas empleadas; determinar la frecuencia de verrugas genitales, lesiones precursoras y cánceres invasores en los diferentes grupos; y estudiar la presencia de DNA de VPH en biopsias de lesiones. Durante el estudio, toda paciente con alteración citológica se evaluó de acuerdo a las normas de la sociedad americana de colposcopía y patología cervical (ASCCP) y al término del estudio a todas se les realizó una colposcopía y se tomaron biopsias, en caso de cualquier lesión sospechosa y detección de VPH.
Los resultados del análisis de protocolo indican que hubo 100% de prevención de la infección por VPH 6 y 86 y 89%, respectivamente, para VPH 16 y 18. Los resultados continuaron siendo muy buenos al analizar la intención de tratar, ya que la eficacia en la prevención de la infección persistente por VPH fue de 88%. Los autores encontraron un 100% de eficacia en la prevención de lesiones relacionadas con VPH.
Las conclusiones más importantes del estudio con vacuna tetravalente fueron que: esta vacuna tiene una alta efectividad en la reducción de infección persistente por VPH; tiene una eficiencia de 100%, al considerar las lesiones clínicas de VPH 6, 11, 16 y 18; la vacuna posee una capacidad inmunogénica importante, induciendo títulos altos de anticuerpos para cada tipo de VPH; y que la tolerancia a la vacuna es muy buena.
Actualmente se está realizando un estudio fase 3 cuyos objetivos son determinar la eficacia, capacidad de inducir respuesta inmune y seguridad de la vacuna tetravalente para VPH 6, 11, 16 y 18. Este estudio incluirá 11.500 mujeres entre 19 y 23 años y los resultados estarán disponibles después de un seguimiento de 5 años.
Se ha probado que la vacuna contra VPH es altamente efectiva en la prevención y reducción de la infección persistente, lo que se debería asociar a una reducción de la incidencia de alteraciones citológicas, lesiones precursoras y cáncer de cuello uterino, además de otras patologías, como verrugas genitales y cánceres genitales.
La implementación de programas de vacunación contra VPH requiere no sólo de los estudios realizados hasta hoy, sino también de la disponibilidad de las vacunas y lograr que sean aceptadas en los diferentes ámbitos sociales, culturales, y políticos. Por ahora, se debe seguir reforzando la educación a nivel de prevención y screening citológico, que son efectivos en la prevención y reducción de lesiones precursoras y de cáncer de cuello uterino.


 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Teórico y Seminarios de Oncología Básica, organizado por el Centro de Oncología Preventiva de la U. de Chile entre el 6 de abril y 10 de agosto de 2005. Director: Dr. José Manuel Ojeda.
 Expositor:
Rodrigo Arriagada Demetrio[1]
Expositor:
Rodrigo Arriagada Demetrio[1]

Citación: Arriagada R. Viral oncogenesis: HPV and cervical cancer. Medwave 2006 Jun;6(5):e3383 doi: 10.5867/medwave.2006.05.3383
Fecha de publicación: 1/6/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Collier L. Viruses and cancer in humans. Human Virology 2000:49-56.
Collier L. Viruses and cancer in humans. Human Virology 2000:49-56.  Facultad de Medicina Norte. Apuntes de virología médica. Universidad de Chile.
Facultad de Medicina Norte. Apuntes de virología médica. Universidad de Chile.  zur Haussen H. Viruses and human cancer. Science. 1991 Nov 22;254(5035):1167-73. | CrossRef | PubMed |
zur Haussen H. Viruses and human cancer. Science. 1991 Nov 22;254(5035):1167-73. | CrossRef | PubMed | Schiffman M, Kjaer SK. Chapter 2: Natural history of anogenital human papillomavirus infection and neoplasia. J Natl Cancer Inst Monogr. 2003;(31):14-9. | CrossRef |
Schiffman M, Kjaer SK. Chapter 2: Natural history of anogenital human papillomavirus infection and neoplasia. J Natl Cancer Inst Monogr. 2003;(31):14-9. | CrossRef | Douglas RJ. Prophylactic human papillomavirus vaccines. Nat Cancer Inst Monogr 2003; (31): 111-6
Douglas RJ. Prophylactic human papillomavirus vaccines. Nat Cancer Inst Monogr 2003; (31): 111-6  Stoler M. The Impact of Human Papillomavirus Biology on the Clinical Practice of Cervical Pathology. Pathology Case Reviews. May/June 2005; 10(3) | CrossRef |
Stoler M. The Impact of Human Papillomavirus Biology on the Clinical Practice of Cervical Pathology. Pathology Case Reviews. May/June 2005; 10(3) | CrossRef | IARC Working Group VPH.Human papillomavisruses. En: IARC Monogr carcinogenic risk to human. Vol 64. Lyon: 1995.
IARC Working Group VPH.Human papillomavisruses. En: IARC Monogr carcinogenic risk to human. Vol 64. Lyon: 1995.  Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide J Pathol. 1999 Sep;189(1):12-9. | CrossRef |
Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide J Pathol. 1999 Sep;189(1):12-9. | CrossRef | Muñoz N, Bosch FX, de Sanjosé S, Herrero R, Castellsagué X, Shah KV, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med. 2003 Feb 6;348(6):518-27. | CrossRef | PubMed |
Muñoz N, Bosch FX, de Sanjosé S, Herrero R, Castellsagué X, Shah KV, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med. 2003 Feb 6;348(6):518-27. | CrossRef | PubMed | Jiang M, Milner J. Selective silencing of viral gene expression in HPV-positive human cervical carcinoma cells treated with siRNA, a primer of RNA interference. Oncogene. 2002 Sep 5;21(39):6041-8. | CrossRef | PubMed |
Jiang M, Milner J. Selective silencing of viral gene expression in HPV-positive human cervical carcinoma cells treated with siRNA, a primer of RNA interference. Oncogene. 2002 Sep 5;21(39):6041-8. | CrossRef | PubMed | de Villiers EM. Heterogeneity of the human papillomavirus group. J Virol. 1989 Nov;63(11):4898-903. | PubMed | PMC |
de Villiers EM. Heterogeneity of the human papillomavirus group. J Virol. 1989 Nov;63(11):4898-903. | PubMed | PMC | Van Ranst M, Kaplan JB, Burk RD. Phylogenetic classification of human papillomaviruses: correlation with clinical manifestations. J Gen Virol. 1992 Oct;73 (Pt 10):2653-60. | CrossRef | PubMed |
Van Ranst M, Kaplan JB, Burk RD. Phylogenetic classification of human papillomaviruses: correlation with clinical manifestations. J Gen Virol. 1992 Oct;73 (Pt 10):2653-60. | CrossRef | PubMed | Jansen KU, Rosolowsky M, Schultz LD, Markus HZ, Cook JC, Donnelly JJ, et al. Vaccination with yeast-expressed cottontail rabbit papillomavirus (CRPV) virus-like particles protects rabbits from CRPV-induced papilloma formation. Vaccine. 1995 Nov;13(16):1509-14. | CrossRef |
Jansen KU, Rosolowsky M, Schultz LD, Markus HZ, Cook JC, Donnelly JJ, et al. Vaccination with yeast-expressed cottontail rabbit papillomavirus (CRPV) virus-like particles protects rabbits from CRPV-induced papilloma formation. Vaccine. 1995 Nov;13(16):1509-14. | CrossRef | Kirnbauer R, Chandrachud LM, O'Neil BW, Wagner ER, Grindlay GJ, Armstrong A,et al. Virus-like particles of bovine papillomavirus type 4 in prophylactic and therapeutic immunization. Virology. 1996 May 1;219(1):37-44. | CrossRef | PubMed |
Kirnbauer R, Chandrachud LM, O'Neil BW, Wagner ER, Grindlay GJ, Armstrong A,et al. Virus-like particles of bovine papillomavirus type 4 in prophylactic and therapeutic immunization. Virology. 1996 May 1;219(1):37-44. | CrossRef | PubMed | Yamada T, Wheeler CM, Halpern AL, Stewart AC, Hildesheim A, Jenison SA. Human papillomavirus type 16 variant lineages in United States populations characterized by nucleotide sequence analysis of the E6, L2, and L1 coding segments. J Virol. 1995 Dec;69(12):7743-53. | PubMed | PMC |
Yamada T, Wheeler CM, Halpern AL, Stewart AC, Hildesheim A, Jenison SA. Human papillomavirus type 16 variant lineages in United States populations characterized by nucleotide sequence analysis of the E6, L2, and L1 coding segments. J Virol. 1995 Dec;69(12):7743-53. | PubMed | PMC | Abbas K. Cellular and molecular immunology. W.B. Sanders, 1991.
Abbas K. Cellular and molecular immunology. W.B. Sanders, 1991.  Feltkamp MC, Smits HL, Vierboom MP, Minnaar RP, de Jongh BM, Drijfhout JW, et al. Vaccination with cytotoxic T lymphocyte epitope-containing peptide protects against a tumor induced by human papillomavirus type 16-transformed cells Eur J Immunol. 1993 Sep;23(9):2242-9. | CrossRef | PubMed |
Feltkamp MC, Smits HL, Vierboom MP, Minnaar RP, de Jongh BM, Drijfhout JW, et al. Vaccination with cytotoxic T lymphocyte epitope-containing peptide protects against a tumor induced by human papillomavirus type 16-transformed cells Eur J Immunol. 1993 Sep;23(9):2242-9. | CrossRef | PubMed | Gao L, Chain B, Sinclair C, Crawford L, Zhou J, Morris J, et al. Immune response to human papillomavirus type 16 E6 gene in a live vaccinia vector. J Gen Virol. 1994 Jan;75 (Pt 1):157-64. | CrossRef | PubMed |
Gao L, Chain B, Sinclair C, Crawford L, Zhou J, Morris J, et al. Immune response to human papillomavirus type 16 E6 gene in a live vaccinia vector. J Gen Virol. 1994 Jan;75 (Pt 1):157-64. | CrossRef | PubMed | Meneguzzi G, Cerni C, Kieny MP, Lathe R. Immunization against human papillomavirus type 16 tumor cells with recombinant vaccinia viruses expressing E6 and E7. Virology. 1991 Mar;181(1):62-9. | CrossRef |
Meneguzzi G, Cerni C, Kieny MP, Lathe R. Immunization against human papillomavirus type 16 tumor cells with recombinant vaccinia viruses expressing E6 and E7. Virology. 1991 Mar;181(1):62-9. | CrossRef | Lowy RD, Frazer HI. Prophylactic human papillomavirus vaccines. J Natl Cancer Inst Monogr 2003:31:1 1 1-116.
Lowy RD, Frazer HI. Prophylactic human papillomavirus vaccines. J Natl Cancer Inst Monogr 2003:31:1 1 1-116.  Mandic A, Vujkov T. Human papillomavirus vaccine as a new way of preventing cervical cancer: a dream or the future. Annals of Oncology 15: 197–200, 2004 | CrossRef | PubMed |
Mandic A, Vujkov T. Human papillomavirus vaccine as a new way of preventing cervical cancer: a dream or the future. Annals of Oncology 15: 197–200, 2004 | CrossRef | PubMed | Schiller JT, Davies P. Delivering on the promise: HPV vaccines and cervical cancer. Nat Rev Microbiol. 2004 Apr;2(4):343-7. | CrossRef | PubMed |
Schiller JT, Davies P. Delivering on the promise: HPV vaccines and cervical cancer. Nat Rev Microbiol. 2004 Apr;2(4):343-7. | CrossRef | PubMed | Fife KH, Wheeler CM, Koutsky LA, Barr E, Brown DR, Schiff MA, et al Dose-ranging studies of the safety and immunogenicity of human papillomavirus Type 11 and Type 16 virus-like particle candidate vaccines in young healthy. Vaccine. 2004 Jul 29;22(21-22):2943-52. | CrossRef | PubMed |
Fife KH, Wheeler CM, Koutsky LA, Barr E, Brown DR, Schiff MA, et al Dose-ranging studies of the safety and immunogenicity of human papillomavirus Type 11 and Type 16 virus-like particle candidate vaccines in young healthy. Vaccine. 2004 Jul 29;22(21-22):2943-52. | CrossRef | PubMed | Koutsky LA, Ault KA, Wheeler CM, Brown DR, Barr E, Alvarez FB, et al. A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med. 2002 Nov 21;347(21):1645-51. | CrossRef | PubMed |
Koutsky LA, Ault KA, Wheeler CM, Brown DR, Barr E, Alvarez FB, et al. A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med. 2002 Nov 21;347(21):1645-51. | CrossRef | PubMed | Harper DM, Franco EL, Wheeler C, Ferris DG, Jenkins D, Schuind A, et al. Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomised controlled trial. Lancet. 2004 Nov 13-19;364(9447):1757-65. | CrossRef |
Harper DM, Franco EL, Wheeler C, Ferris DG, Jenkins D, Schuind A, et al. Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomised controlled trial. Lancet. 2004 Nov 13-19;364(9447):1757-65. | CrossRef | Villa LL, Costa RL, Petta CA, Andrade RP, Ault KA, Giuliano AR, et al. Prophylactic quadrivalent human papillomavirus (types 6, 11, 16, and 18) L1 virus-like particle vaccine in young women: a randomised double-blind placebo-controlled multicentre phase II efficacy trial. Lancet Oncol. 2005 May;6(5):271-8. | CrossRef |
Villa LL, Costa RL, Petta CA, Andrade RP, Ault KA, Giuliano AR, et al. Prophylactic quadrivalent human papillomavirus (types 6, 11, 16, and 18) L1 virus-like particle vaccine in young women: a randomised double-blind placebo-controlled multicentre phase II efficacy trial. Lancet Oncol. 2005 May;6(5):271-8. | CrossRef |