 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso de Genética, organizado por el Instituto de Ciencias Biomédicas de la Universidad de Chile entre los meses de marzo y julio de 2004.
Edición Científica: Prof. Laura Walker Bozzo, Profesora Encargada de Curso; Prof. Luisa Herrera Cisterna, Coordinadora de Curso.
Los cánceres de mama y de ovario se desarrollan como efecto de la proliferación descontrolada de las células epiteliales que revisten los conductos o lobulillos de la mama o de las células epiteliales del ovario, respectivamente (1).
Los síntomas más frecuentes de tumor ovárico son inflamación abdominal o sangrado vaginal después de la menopausia. A menudo no se presentan síntomas en las etapas tempranas, pero se pueden encontrar tumores durante exámenes ginecológicos regulares o por ocurrencia de eventos no regulares, como sangrado vaginal postmenopáusico y aumento del volumen abdominal sin aumento de peso.
En el caso del cáncer de mama a veces se detectan tumores por simple autoexploración mamaria o de los ganglios linfáticos y se diagnostican a través de la biopsia de un nódulo detectado por mamografía o palpación (2).
El cáncer de mama es una enfermedad dependiente de hormonas sexuales femeninas. Por esta razón, la proporción entre mujeres y varones que padecen esta enfermedad es de aproximadamente de 150:1. La mayoría de los tumores epiteliales malignos presentan una relación directa con la edad, relación que disminuye después de la menopausia.
Las tres fechas de la vida de la mujer que ejercen un impacto importante sobre la incidencia de cáncer de mama son: la edad de la menarquia, la edad del primer embarazo a término y la edad de la menopausia. Así, la duración de la vida menstrual, en especial de la fracción anterior a la primera gestación a término, es un componente sustancial del riesgo total de cáncer de mama. Este factor puede ser responsable del 70 % a 80% de la variabilidad de la frecuencia del cáncer de mama que se observa en diferentes países.
Alrededor del 5% de los cánceres de mama y de ovario epitelial corresponden a cánceres de tipo hereditario determinados en forma autosómica dominante.
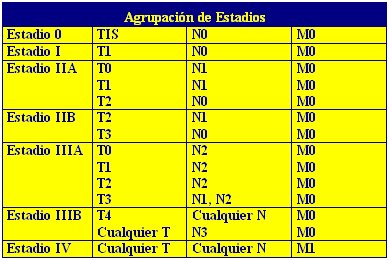
La determinación del estadio de un tumor no sólo permite un pronóstico exacto, sino que en muchos casos determina las decisiones terapéuticas a seguir. Los criterios de clasificación de los estadios del cáncer de mama se presentan en la Tabla I y los del cáncer de ovario aparecen en la Tabla II.
Tabla I. Clasificación de las etapas del cáncer de mama, basado en el sistema TNM (Tumor, Nódulo, Metástasis) (Harrison, Principios de Medicina Interna (2)) .
Tumor Primario (T)
T0 : Ausencia de signos de tumor primario
TIS : Carcinoma in situ
T1 : Tumor menor o igual a 2cm
T2 : Tumor mayor de 2cm y menor o igual a 5cm
T3 : Tumor mayor a 5 cm
T4 : Extensión a la pared torácica, inflamación, lesiones satélite, ulceraciones
Ganglios Linfáticos Regionales (N)
N0 : Ausencia de tumor en los ganglios regionales
N1 : Metástasis móviles en los ganglios homolaterales
N2 : Metástasis en conglomerado o fijas en los ganglios homolaterales
N3 : Metástasis en los ganglios mamarios internos homolaterales
Metástasis a distancia (M)
M0 : Ausencia de metástasis a distancia
M1 : Metástasis a distancia (comprende la diseminación a los ganglios supraclaviculares homolaterales).
Tabla II. Etapas del Cáncer de Ovario (Harrison, Principios de Medicina Interna) .
Mediante análisis de ligamiento, se han descubierto dos genes supresores de tumor, de alta penetrancia, BRCA-1 y BRCA-2, asociados a una predisposición genética a los cánceres de mama y de ovario. La mayor parte de estos cánceres está asociado con mutaciones en el gen BRCA-1 (100 Kb), localizado en el brazo largo del cromosoma 17 (17q21), y una fracción menor de ellos está asociada con mutaciones en el gen BRCA-2 (70 Kb), localizado en el brazo largo del cromosoma 13 (13q 12-13).
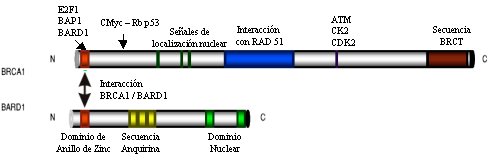
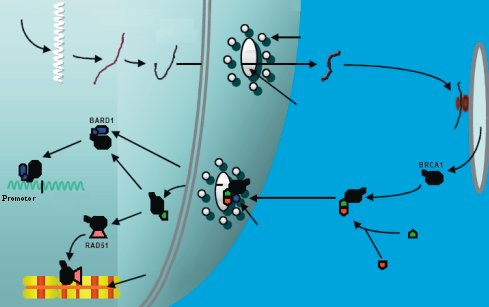
El gen BRCA-1 (Breast Cancer-1) codifica para una proteína de aproximadamente 220 Kd, compuesta de 1863 aminoácidos y con una secuencia homóloga a la familia de proteínas graninas. Esta proteína se encarga de regular el proceso de reparación del DNA. La proteína BRCA-1 se localiza en focos subnucleares durante las fases S y G2 del ciclo celular. Después de la ocurrencia de un daño en el DNA, la proteína se hiperfosforila y se mueve desde su foco nuclear nativo a sitios de síntesis de DNA, formando un complejo multiproteico con las proteínas BRCA-2, BARD-1 y Rad51, encargadas de reparar el daño en el DNA asociado a la replicación. Para esto BRCA1 posee en su estructura dominios de interacción con otras proteínas y una señal de localización nuclear, que permite su transporte al núcleo después de ser sintetizada en los ribosomas citoplasmáticos (véase Figuras 1 y 2). La proteína BRCA-1 también puede regular el ciclo celular, en este caso en forma negativa, por activación transcripcional del inhibidor de las CDK p21 (3).
Figura 1. Sitios de interacción de BRCA-1 con otras proteínas. La proteína BRCA-1 activa la transcripción de diversos genes, formando un heterodímero con la proteína BARD-1, mientras que la unión con Rad51 participa en la reparación del DNA. (Modificado de Breast cancer genetics. BRCA1 and BRCA2: The main susceptibility genes).
Figura 2. Funciones del gen BRCA-1. La proteína BRCA-1 es sintetizada en el retículo endoplásmico y pasa al núcleo uniéndose a dos importinas. (Modificado de Breast cancer genetics. BRCA1 and BRCA2: The main susceptibility genes).
El gen BRCA-2 (Breast Cancer-2) codifica para una proteína de aproximadamente 380 Kd compuesta por 3418 aminoácidos, que al igual que la proteína codificada por el gen BRCA-1, está involucrada en el proceso de reparación del DNA. Esta proteína forma un complejo multiproteico en asociación con Rad 51, BARD-1 y BRCA-1 (3).
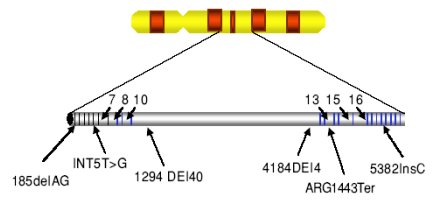
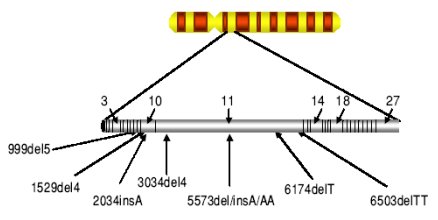
Se han identificado numerosas mutaciones en los genes BRCA-1 y BRCA-2. Estas mutaciones tienen distintos grados de penetrancia y variabilidad, características que influyen en la frecuencia con que aparecen los cánceres de mama, de ovario, o ambos. Para el gen BRCA-1 se han descrito más de 600 mutaciones diferentes (véase Figura 3), de las cuales más de 75% dan origen a una proteína trunca. La mutaciones del gen BRCA-1 se relacionan con un incremento en el riesgo de presentar cáncer de mama (40 -50 años), cáncer de ovario (70 años), cáncer de próstata y cáncer de colon. Para el gen BRCA-2 se han descrito aproximadamente unas 450 mutaciones (véase Figura 4).
Figura 3. Mutaciones más frecuentes encontradas en el gen BRCA-1, localizado en el cromosoma 17. Se han descrito cientos de mutaciones a lo largo de la secuencia del gen, algunas de ellas se presentan con mayor frecuencia en las distintas poblaciones, como la 185delAG, más frecuente en judíos asquenazíes. (Tomado de Breast cancer genetics. BRCA1 and BRCA2: The main susceptibility genes).
Figura 4. Mutaciones más frecuentes encontradas en el gen BRCA-2, localizado en el cromosoma 13. Se han descrito más de 100 mutaciones a lo largo de la secuencia codificante del gen. El gen BRCA-2 es un gen supresor de tumor que ejerce una función coordinada con el gen BRCA-1. (Tomado de Breast cancer genetics. BRCA1 and BRCA2: The main susceptibility genes).
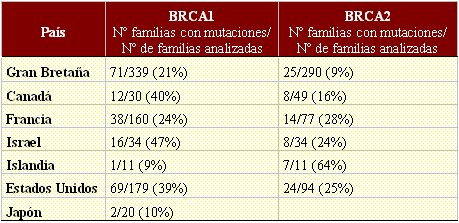
Las mutaciones del gen BRCA-2 se asocian a un aumento del riesgo de aparición de cánceres de diversos tipos: mamario femenino y masculino, ovario, vejiga, próstata, páncreas y laringe. Las frecuencias de las distintas mutaciones de los genes BRCA-1 y BRCA-2 varían en las distintas poblaciones, como se muestra en la Tabla III.
Tabla III. Familias con cáncer de mama y de ovario con mutaciones en los genes BRCA-1 y BRCA-2, en distintos países (Breast cancer genetics. BRCA1 and BRCA2: The main susceptibility genes) .
Las mujeres que heredan una mutación en el gen BRCA-1 o en el gen BRCA-2 no nacen con cáncer, sino que presentan una predisposición hereditaria para desarrollarlo. Una mutación que afecte un alelo de uno de esos genes, es decir el estado de heterocigosidad para cualquiera de esos genes, no es condición suficiente para que se desarrolle el cáncer. Se necesita de una segunda mutación que afecte al otro alelo del gen BRCA-1 y/o del gen BRCA-2, además de mutaciones en otros genes para el desarrollo de un tumor maligno.
La mutación que afecta al segundo alelo determina la pérdida de la heterocigosidad del alelo normal, generalmente por una deleción o por ocurrencia de mecanismos tales como segregación anormal de cromosomas durante la mitosis, recombinación mitótica entre cromátidas homólogas o hipermetilación del promotor del gen. Debido a la alta frecuencia con que el segundo alelo de BRCA-1 y de BRCA-2 pierden su función, las familias que en la línea germinal tienen un alelo de estos genes mutado, presentan herencia autosómica dominante para esta neoplasia.
Para llegar a la transformación maligna de las células, además de la pérdida de función de los genes BRCA-1 o BRCA-2, se necesita que ocurran otras mutaciones adicionales (1, 3 y 4). Aumentan el riesgo de cáncer de mama y ovario hereditario, las mutaciones en los genes codificantes para receptores de andrógenos. Específicamente se ha demostrado que aumentan el riesgo de cáncer de mama hereditario: las mutaciones en el gen supresor de tumor p53 (17p13.1) en el síndrome de Li-Fraumeni; el gen mutado ATM (11 q 22-23) en la ataxia-telangiectasia; el gen mutado PTEN (10 q 23) en el síndrome de Cowden; un alelo infrecuente de un locus microsatelital adyacente al gen HRAS-1 (11p15.5), y probablemente muchos otros genes que aún no se han identificado.
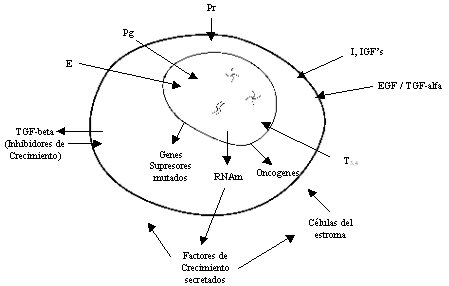
El normal crecimiento y desarrollo de la glándula mamaria y del ovario es regulado por la interacción compleja de muchas hormonas y factores de crecimiento, actuando en conjunto con los respectivos receptores (Figura 5). Por esto no resulta sorprendente que las células malignas aparecidas desde el tejido normal también expresen receptores para estas hormonas y puedan presentar algún grado de dependencia hormonal. El potencial maligno del cáncer pareciera depender del balance entre estimuladores e inhibidores de crecimiento producidos por el tumor.
Figura 5. Regulación del crecimiento del cáncer de mama y de ovario por hormonas y factores de crecimiento. E = Estrógenos; Pg = progesterona; Pr = prolactina; I = insulina; IGF's = Factores de Crecimiento parecidos a Insulina; EGF = Factores de Crecimiento Epitelial; TGF-alfa = Factor de Crecimiento Transformador alfa; T3,4, Hormonas Tiroideas; TGF-beta = Factor de Crecimiento beta. (Modificado de Cancer Medicine, 5ta edición) (1).
Se ha demostrado además que las células cancerígenas expresan varios oncogenes. Algunos de éstos son miembros de la familia myc y ras (c-myc, Ha-ras-1) , o bcl2 e int-2; otros son miembros de la familia GFR tipo I, incluyendo EGFR o HER1, erb B, erb B-2, HER2, neu, HER3 y HER4. La sobreexpresión de estos oncogenes puede contribuir al inicio y mantención del fenotipo maligno.
El tejido epitelial del ovario y el que reviste los conductos y lobulillos de la mama son tejidos en constante proliferación y recambio, por lo que todos los factores que regulan el ciclo celular, ya sean factores internos, como genes, o externos, como sustancias endocrinas, paracrinas o autocrinas, son importantes en la mantención de sus tasas normales de proliferación celular. Así, el daño de genes claves para la regulación del ciclo celular afecta directamente a las células epiteliales de la mama y del tejido ovárico (3).
También son importantes los cambios en la producción de factores de crecimiento, receptores y hormonas por parte de las células cancerígenas, no sólo en la proliferación misma y en la gravedad del tumor, sino que también inducen un aumento en la irrigación del tumor. Este aumento en la irrigación es crucial para la producción de metástasis tumoral, ya que debe existir una neovascularización para que esto ocurra, de lo contrario el tumor permanece silente en forma indefinida.
El riesgo de herencia del gen BRCA-1 es distinto del que presenta el gen BRCA-2. Cuando ocurre una mutación del gen BRCA-1, el riesgo de desarrollar, a lo largo de la vida, un cáncer de mama es de 85%, el de desarrollar un cáncer de ovario es de 60%, y el riesgo de padecer un cáncer de mama contralateral es de 37%. Cuando ocurre una mutación del gen BRCA-2, el riesgo de desarrollar cáncer de mama en las mujeres es de 88% y es responsable de 30% de los cánceres de mama de origen temprano de transmisión genética y no relacionados con el gen BRCA-1.
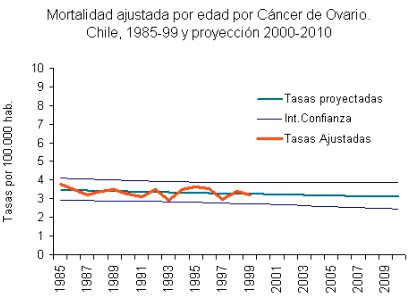
La incidencia de cáncer de mama aumenta con la edad. Se calcula un riesgo de 1 en 20.000 para mujeres menores de 25 años, que se eleva hasta 1 en 9 para mujeres de 85 y más años. En Chile, considerando ambos sexos, el cáncer de mama constituye la tercera causa de muerte, con una tasa de mortalidad de alrededor de 13 x 100.000 mujeres. El cáncer de ovario es la novena causa de muerte por cáncer en la mujer chilena y la segunda entre los cánceres ginecológicos, con una tasa anual de 3,5 x 100.000 habitantes (véase Figura 6).
Figura 6. Mortalidad ajustada por edad para cáncer de ovario. Chile, 1985-1999 y proyección 2000- 2010 (Ministerio de Salud, Chile) (6).
El cáncer de ovario del tipo epitelial también aumenta progresivamente con la edad, alcanzando su máximo en el octavo decenio de la vida, y la probabilidad de aparición de este tipo de cáncer disminuye con los embarazos. Los tumores epiteliales, a diferencia de los de las células germinales y los del estroma, son raros antes de los 40 años. Los tumores de ovario epiteliales malignos suelen aparecer en mujeres de más de 40 años.
Las técnicas utilizadas para diagnosticar mutaciones a nivel de los genes BRCA-1 y BRCA-2 son principalmente tres:
De todas estas metodologías, el SSCP es la más utilizada por su bajo costo y relativa simplicidad, sin embargo el PTT ha dado mejores resultados por su especificidad y sensibilidad, aunque su costo es más elevado.
El hecho de poder conocer el estado de los genes de susceptibilidad al cáncer de mama permite a las mujeres pertenecientes a familias portadoras de alteraciones en dichos genes, conocer la posibilidad estadística de desarrollar la enfermedad a lo largo de sus vidas, e incluso decidir sobre la realización de mastectomías y/o extracciones quirúrgicas profilácticas de sus ovarios.










 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso de Genética, organizado por el Instituto de Ciencias Biomédicas de la Universidad de Chile entre los meses de marzo y julio de 2004.
Edición Científica: Prof. Laura Walker Bozzo, Profesora Encargada de Curso; Prof. Luisa Herrera Cisterna, Coordinadora de Curso.
 Expositores:
José Miguel Acuña Pinochet[1], David H. Aguirre Padilla[1], Jaime Altamirano Villarroel[1]
Expositores:
José Miguel Acuña Pinochet[1], David H. Aguirre Padilla[1], Jaime Altamirano Villarroel[1]

Citación: Acuña JM, Aguirre DH, Altamirano J. Hereditary breast and ovarian cancer: genetic aspects. Medwave 2005 Mar;5(2):e3364 doi: 10.5867/medwave.2005.02.3364
Fecha de publicación: 1/3/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Bast RC, Kufe DW, Pollock RE, Weichselbaum RR, Holland JF, Frei E. Cancer Medicine, 5th ed. Canada: Hamilton; BC Decker Inc, 2000.
Bast RC, Kufe DW, Pollock RE, Weichselbaum RR, Holland JF, Frei E. Cancer Medicine, 5th ed. Canada: Hamilton; BC Decker Inc, 2000.  Braunwald E, Fauci AS, Kasper D, Hauser SL, Longo DL, Jameson JL. Harrison Principios de Medicina Interna. 15º edición. editors Mc Graw Hill, 2002.
Braunwald E, Fauci AS, Kasper D, Hauser SL, Longo DL, Jameson JL. Harrison Principios de Medicina Interna. 15º edición. editors Mc Graw Hill, 2002.  Ruiz-Flores P, Calderón-Garcidueñas AL, Barrera-Saldaña HA. Breast cancer genetics. BRCA1 and BRCA2: the main genes for disease predisposition. Rev Invest Clin. 2001 Jan-Feb;53(1):46-64. | PubMed |
Ruiz-Flores P, Calderón-Garcidueñas AL, Barrera-Saldaña HA. Breast cancer genetics. BRCA1 and BRCA2: the main genes for disease predisposition. Rev Invest Clin. 2001 Jan-Feb;53(1):46-64. | PubMed |