Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Avances en Gastroenterología 2006, organizado por la Sociedad Chilena de Gastroenterología entre los días 8 y 11 de agosto de 2006.
Frente a un cuadro de hepatitis, los tests virológicos permiten: hacer el diagnóstico diferencial del agente etiológico; tomar decisiones terapéuticas; efectuar el monitoreo y seguimiento; evaluar la persistencia, severidad y respuesta a la terapia.
Los tests virológicos son de dos tipos:
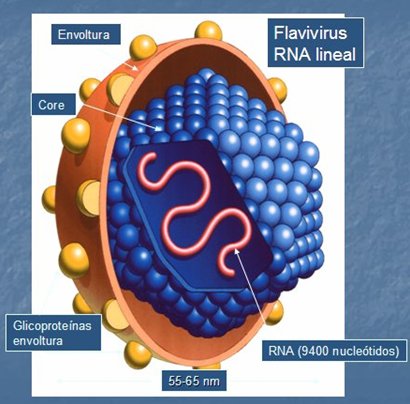
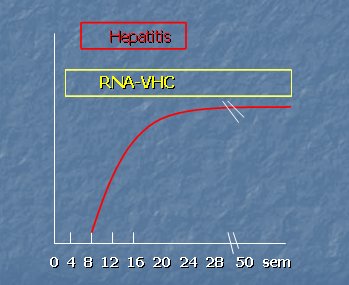
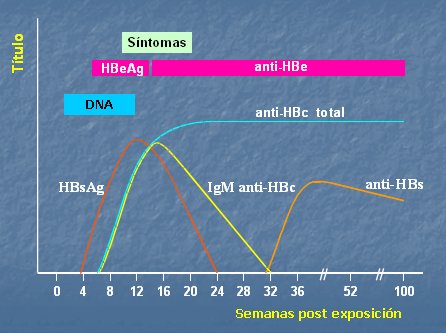
En la Fig. 1 se muestra en forma esquemática la estructura del virus hepatitis C. En la Fig. 2 se muestra la curva serológica que se produce tras la infección; se puede ver que la seroconversión es tardía, por lo que la determinación de anticuerpos no discrimina si la infección es aguda, crónica o activa; además es débil y hasta puede estar ausente en inmunocomprometidos. Puede haber falsos positivos (HMD) e indeterminados y tienen paso transplacentario. Por ende, su presencia sólo indica contacto con VHC.
Figura 1. Estructura del virus hepatitis C (VHC)
Figura 2. VHC: Curva serológica
El diagnóstico de VHC se puede hacer mediante detección de RNA viral; el método de elección es la PCR, que tiene alta sensibilidad (40 copias/ml) e indica que existe viremia circulante. La presencia de RNA positivo para VHC significa que existe una activa replicación viral.
El examen de PCR se indica para: evaluar si hay o no infección activa, cuando se encuentra un anticuerpo anti-VHC positivo; hacer diagnóstico precoz de una infección aguda; resolver problemas en inmunodeprimidos (falsos negativos); resolver casos de anti-VHC dudoso; evaluar la transmisión vertical; monitorizar la respuesta viral sostenida en pacientes en tratamiento; evaluar la reinfección en pacientes trasplantados; en la actualidad, en muchos países se está utilizando la PCR viral para realizar estudios en pool de donantes, debido a su alta sensibilidad.
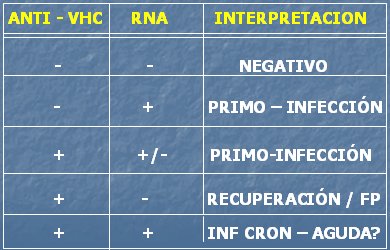
En la Tabla I se observan los patrones serólogicos que se pueden presentar con los dos marcadores, los anticuerpos anti-VHC y el RNA. Si ambos exámenes son negativos, lo más probable es que no exista infección por este virus. Si hay anticuerpo negativo y RNA positivo, lo más probable es que se trate de una primoinfección en etapa previa al período de seroconversión; cabe destacar que la primoinfección puede cursar con viremias intermitentes, de modo que no se puede descartar una infección aguda hasta que, con el tiempo, se defina si la PCR es positiva o negativa. Si hay anticuerpo positivo y RNA negativo, significa que hubo recuperación de la infección, espontánea o mediante tratamiento; o bien, se podría tratar de un falso positivo de anticuerpos. Si ambos son positivos, lo más probable es que se trate de una infección crónica, pero no se puede descartar una infección aguda.
Tabla I. Patrones serológicos comunes en infección por VHC
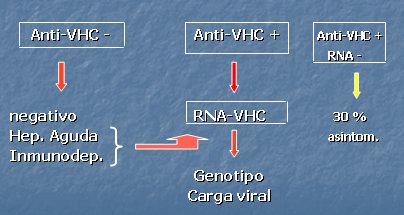
Si la aproximación al diagnóstico de infección por VHC se realiza mediante la presencia de los anticuerpos, se debe utilizar el algoritmo que se muestra en la Fig. 3. Si los anticuerpos son positivos, el paso siguiente es la medición del RNA viral. Cuando son negativos, puede ser un resultado negativo o bien alguna de las otras condiciones que exigen realizar un RNA viral para descartar o confirmar la infección (Fig. 3).
Figura 3. Algoritmo diagnóstico de infección por VHC
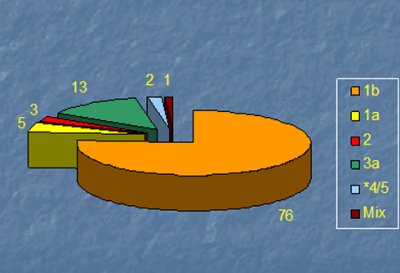
Siempre que se quiera iniciar tratamiento antiviral en los pacientes con RNA positivo, se deben utilizar otros dos elementos diagnósticos: el genotipo y la carga viral. Es importante recordar que en 20% a 30% de los sujetos asintomáticos se puede encontrar anticuerpos positivos y RNA negativo, lo que corresponde a quienes se han recuperado en forma espontánea de la infección. Existen distintos métodos para estudiar los genotipos virales, que van del 1 al 6, con sus diferentes subtipos (a, b, c, etc.). Su distribución es mundial, especialmente en el caso de los genotipos entre 1 y 4; en la Fig. 4 se muestra la distribución de estos genotipos en pacientes chilenos.
Figura 4. Genotipos VHC en pacientes chilenos
Existe una fuerte asociación entre mayor daño y menor respuesta al tratamiento antiviral frente a determinados genotipos, en especial el 1, por lo que su estudio permite determinar el pronóstico y duración de la terapia antiviral. En el estudio DITTO (Dynamically Individualized Treatment of Hepatitis C Infection and Correlates of Viral/Host Dynamics), un estudio de la cinética del RNA viral, se ha encontrado que algunos genotipos responden a la terapia con rapidez, mientras que en otros no se logra obtener un buen resultado al término del tratamiento.
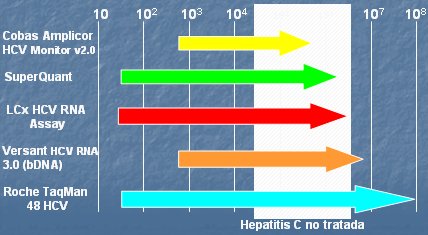
La segunda etapa en el estudio de los pacientes que van a recibir tratamiento es la cuantificación viral. Existen en el mercado diversas alternativas comerciales que permiten estudiar la cantidad de virus circulante, pero hay algunos problemas prácticos debido a que las técnicas disponibles tienen distintos fundamentos: algunas amplifican el genoma y otras amplifican señales, por lo tanto, dichas técnicas tienen diferentes sistemas de detección y distintas unidades de medida, por lo que no son intercambiables ni equivalentes. Últimamente predomina la tendencia a medir todo con la misma unidad: UI/ml. Otra limitante es que estos métodos comerciales tienen diferentes límites de sensibilidad y, además, presentan diferentes rangos de detección. En la mayoría de los casos, los métodos de cuantificación tienen menos sensibilidad que la PCR, excepto cuando se trata de la PCR en tiempo real, que es de muy alta sensibilidad y similar a un RNA cualitativo (Fig. 5).
Figura 5. Rangos de cuantificación de RNA viral disponibles en el mercado (UI/ml)
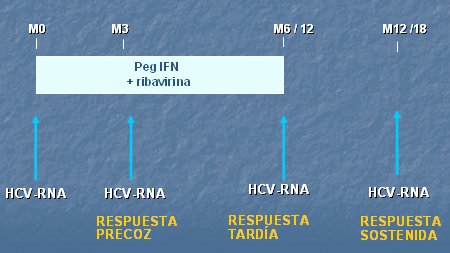
El estudio de cuantificación se indica para monitorizar la respuesta al tratamiento antiviral, ya que es un factor predictor de respuesta viral sostenida en los sujetos tratados, y, en algunos casos, permite definir el punto final de la terapia. Lo habitual es considerar una cuantificación de la carga viral basal y otra al término del tratamiento (24-48 semanas), pero en el último tiempo se ha incorporado una tercera medición, durante el tratamiento (a las 12 semanas), que permitiría evaluar la respuesta viral temprana y tendría un valor predictivo importante de respuesta viral sostenida, cuando el resultado del examen es negativo o muestra una caída mayor de dos logaritmos en relación con la medición basal. Como el objetivo del tratamiento antiviral del VHC es lograr la erradicación del virus, la última evaluación de los pacientes en tratamiento se debe hacer con la técnica más sensible disponible en el mercado, la que hasta el momento sigue siendo la PCR.
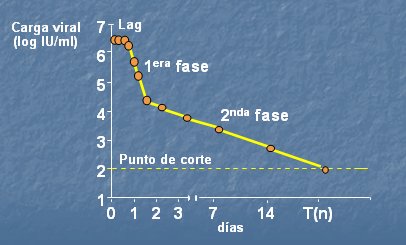
En la Fig. 6 se muestra la cinética del RNA durante el tratamiento antiviral: se observa una primera fase de disminución muy rápida, en un período breve y la segunda fase, que es sostenida y más lenta.
Figura 6. Cinética del VHC (Neumann et al., Science 1998;282:103-7)
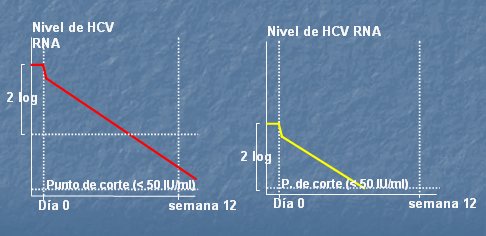
En la Fig. 7 se compara la magnitud de la caída del nivel de RNA viral C en dos pacientes en las 12 primeras semanas; se puede ver que, aunque la magnitud es exactamente igual, el resultado será diferente, ya que en un paciente la carga viral será negativa en el período del examen, mientras que en el otro permanecerá positiva. La tendencia y la magnitud de la caída son similares en ambos casos, lo que justifica que se deba esperar una diferencia de dos logaritmos o más para comprobar un buen pronóstico de respuesta. Por lo tanto, la detección cualitativa o cuantitativa del RNA permite definir el tipo de respuesta a la terapia en estos pacientes, en términos de respuesta temprana, respuesta al término del tratamiento y respuesta sostenida al tratamiento antiviral.
Figura 7. Respuesta virológica temprana: 2-log HCV RNA Drop OR (-) HCV RNA at Week 12
Una vez que se realiza el estudio del genotipo, es tarea del clínico empezar a diseñar un tratamiento específico para cada caso, considerando este resultado. Durante el tratamiento se emplearán técnicas de cuantificación o técnicas cualitativas para evaluar la respuesta y tomar decisiones sobre la mantención o el término del tratamiento, en un momento determinado (Fig. 8).
Figura 8. La determinación cualitativa y cuantitativa del HCV RNA define la respuesta a la terapia
El virus hepatitis B (VHB) es un virus ADN que tiene un antígeno de superficie, un antígeno core y un antígeno soluble, cada uno de los cuales da origen a una respuesta inmune.
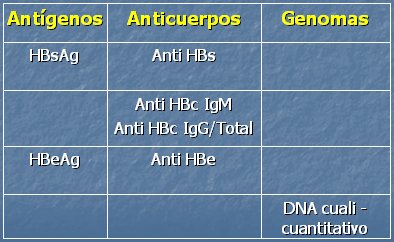
Tabla II. Marcadores VHB
En la actualidad se dispone de las técnicas de ADN cuantitativo y cualitativo como apoyo en el estudio de esta infección; cada uno de estos marcadores define un concepto preciso y entrega información bastante exacta. La presencia o detección del antígeno de superficie siempre indicará infección por VHB. El antígeno core no se encuentra en la circulación, pero se puede encontrar en el tejido hepático. El antígeno e es un excelente indicador de replicación y de alta infectividad viral, tanto así que se podría decir que cuando hay antígeno e positivo hay infección crónica activa en los pacientes crónicos; en cambio, un antígeno e negativo permitiría definir una infección crónica inactiva. El anticuerpo IgM es indicador de infección aguda, pero puede aparecer y volverse positivo en pacientes crónicos que están en fase de reactivación y alta replicación. El anti-HBs permitirá decir que hay recuperación o inmunidad; el anti core total, una infección pasada o una infección crónica, cuando el antígeno de superficie es superior a seis meses. La seroconversión permite decir que el antígeno e se ha hecho indetectable y aparece el anticuerpo correspondiente. Siempre que se detecte un ADN positivo, se dirá que hay replicación viral. Actualmente se describen en la literatura hepatitis crónicas con antígeno e negativo, las que consisten en mutaciones del VHB que tienen alta replicación, pero con ausencia de antígeno e (Tablas III y IV).
Tabla III. Nomenclatura en infección por VHB
Tabla IV. Nomenclatura en infección por VHB (continuación)
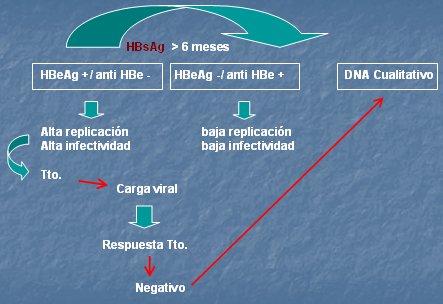
Entonces, para el diagnóstico de infección aguda se utilizarán los primeros marcadores, que corresponden al antígeno de superficie, anti core e IgM; para el control de la evolución se usará el antígeno de superficie más los marcadores de replicación viral; para la recuperación se utilizará el anti-HBs y para la monitorización de la infección crónica se utilizarán los tres marcadores y se medirá, además, la carga y ADN viral (Fig. 9).
Figura 9. Monitorización de la infección crónica por VHB
El uso de los marcadores depende del estado en que esté el individuo: agudo, crónico o período de ventana, que se puede considerar una recuperación, puesto que ya se ha eliminado el antígeno de superficie (Figs. 10 y 11). La mayoría de los pacientes pasarán de un patrón a otro, para llegar finalmente a la etapa de recuperación; un porcentaje menor de pacientes pasarán al estado crónico. En los agudos o crónicos en quienes se quiera evaluar el daño que se está produciendo y ver el nivel de replicación, se utilizará el sistema HBeAg/anti HBe, cuya importancia radica en que la positividad o negatividad del antígeno se correlaciona bastante bien con los niveles de carga viral, lo que ha permitido definir la presencia de una infección crónica activa con más de 100.000 copias o una infección inactiva, con menos de esa cifra.
Figura 10. Infección aguda por VHB
Figura 11. Infección crónica por VHB
El límite de 100.000 copias es arbitrario y algunos autores han planteado que el límite entre activo e inactivo podría ser de 30.000 copias. En un estudio que se está realizando en nuestro laboratorio para comparar la carga viral detectada por PCR de alta sensibilidad con la positividad y negatividad del antígeno e (HBeAg), se ha encontrado que entre los sujetos con antígeno e negativo el valor más alto de carga viral es de 35.000 copias, a diferencia de los sujetos con antígeno e positivo, en quienes el valor promedio de carga viral es de 9 millones de copias, aunque el valor más bajo entre los sujetos positivos fue de 52.000 copias. Hay una superposición entre los sujetos con antígeno e positivo y negativo, por lo que el valor de corte de 100.000 copias podría ser adecuado como primera aproximación.
En los pacientes crónicos siempre se monitorizará con el sistema HBeAg/anti HBe para evaluar la replicación. En los sujetos que serán sometidos a tratamiento se utilizará la carga viral para evaluar la respuesta, sin olvidar que si esta carga viral se hace negativa se deberá emplear el elemento más sensible para comprobar la erradicación del virus. El objetivo del tratamiento no es la erradicación, sino la conversión de HBeAg a anti-HBe.
Para la cuantificación, los exámenes disponibles tienen las mismas limitaciones que los exámenes para el VHC. La cuantificación de VHB permitirá seleccionar y monitorizar la terapia más adecuada y detectar en forma precoz la resistencia a la terapia. El valor significativo para decir que existe buena respuesta al tratamiento antiviral puede ser entre 1 ó 2 logaritmos, aunque no hay consenso al respecto, pero en el laboratorio hay diferencias de alrededor de 0,2 a 0,5 logaritmos solamente en el método, repitiéndolo en la misma muestra, además de las diferencias en la variación del método. El ADN viral se utilizará sólo para resolver dudas diagnósticas y para el diagnóstico precoz. El ADN es el primer marcador que aparece en la infección aguda y el primero que desaparece en la infección aguda; en los casos crónicos permanece positivo.
La edición y publicación de esta conferencia han sido posibles gracias al auspicio de Schering Plough
Medwave Año VII, No. 4, Mayo 2007 Derechos Reservados.


















 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Avances en Gastroenterología 2006, organizado por la Sociedad Chilena de Gastroenterología entre los días 8 y 11 de agosto de 2006.
 Expositora:
Gabriela Muñoz[1]
Expositora:
Gabriela Muñoz[1]

Citación: Muñoz G. Virological and serological diagnosis of hepatitis C and B. Medwave 2007 May;7(4):e3330 doi: 10.5867/medwave.2007.04.3330
Fecha de publicación: 1/4/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión