Este texto completo es la transcripción editada y revisada de una conferencia dictada en el curso Lesiones Tumorales y Pseudotumorales del Sistema Musculoesquelético, organizado en Santiago por el Departamento de Ortopedia y Traumatología de la Universidad de Chile del 12 al 16 de mayo de 2003.
Director: Dr. Miguel Sepulveda H.
Introducción
Las metástasis constituyen más de 90% de las neoplasias óseas y son una causa importante de morbilidad; sin embargo, las metástasis óseas de origen desconocido son poco frecuentes. Además, por lo general son asintomáticas y se presentan en los estados avanzados del cáncer, o bien permanecen a nivel intramedular. Un ejemplo es el cáncer de tiroides, que avanza lentamente y da metástasis muy pequeñas, sin manifestaciones clínicas.
Patogenia
La invasión ósea generalmente se produce por vía hematógena, de modo que las metástasis se distribuyen selectivamente en ciertas regiones anatómicas, especialmente en el esqueleto axial; es decir, se ubican preferentemente en columna dorsal y lumbar, pelvis, costillas, cráneo y fémur proximal.
El osteoblasto es la célula encargada de incorporar las sales de calcio (matriz inorgánica o cristalina) a la matriz orgánica (colágeno). La remodelación ósea se caracteriza por la formación y destrucción ósea mediada por osteoblastos y osteoclastos, respectivamente, y está regulada por los mecanismos generales y locales que se resumen a continuación:
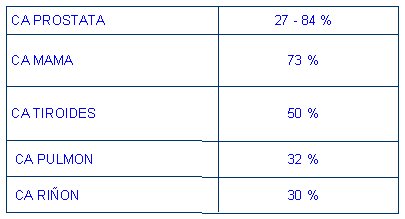
En la tabla I se muestra la frecuencia relativa del origen de la metástasis, determinado por necropsia. Encabezan la lista los cánceres de próstata, mama, tiroides, pulmonar y renal.
Tabla I. Frecuencia de metástasis óseas en necropsias.
Metástasis y oncogenes
La transformación neoplásica y la diseminación metastásica se deben a la activación de proto-oncogenes o inactivación de anti-oncogenes. Los mecanismos por los que estos procesos se producen son amplificación, mutación, translocación e inserción de retrovirus en el genoma.
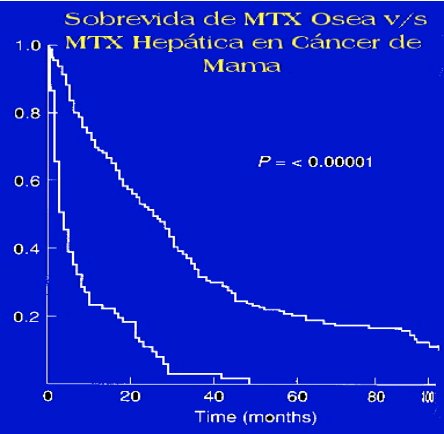
La sobrevida, en pacientes con cáncer de mama que presentan metástasis óseas, comparada con la de pacientes con el mismo tipo de cáncer y metástasis viscerales, especialmente hepáticas, es claramente distinta.
En la figura 1 se puede ver que, en el caso de la metástasis hepática, el promedio de vida es cercano a un año, mientras que en la metástasis ósea alcanza a 36 meses.
Figura 1. Sobrevida de metástasis ósea comparada con metástasis hepática en cáncer de mama.
Clínicamente, la metástasis ósea se caracteriza por dolor localizado, de ahí la norma que dice que “todo dolor óseo, en un paciente con cáncer, es metástasis, mientras no se demuestre lo contrario”. También se puede presentar el fenómeno de “articulación congelada”, síntomas derivados de la compresión medular o cauda equina y mieloptisis.
En el laboratorio puede haber hipercalcemia y alteraciones de fosfemia, fosfatasas ácidas y alcalinas, antígeno carcinoembrionario y antígeno prostático específico.
Radiología de la metástasis ósea
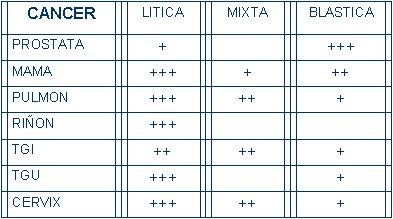
En general, el cáncer de próstata produce metástasis blásticas y el de mama da metástasis osteolíticas, aunque se puede producir cualquier tipo de combinación. El cáncer de pulmón y el de riñón prácticamente siempre tienden a ser osteolíticos (Tabla II).
Los cánceres del tracto gastrointestinal pueden tener cualquier presentación, los del tracto genitourinario tienden a ser osteolíticos y los de cuello uterino son osteolíticos, pero también presentan con frecuencia lesiones blásticas o mixtas.
Tabla 2. Radiología de las metástasis óseas.
Las metástasis pueden ser múltiples o únicas; en este caso, si no existe un primario reconocible, se puede tratar de un tumor óseo. El tamaño de las metástasis pequeñas fluctúa entre 1 y 3 centímetros; las mayores se ubican en la pelvis y la extensión extraósea de estas lesiones es infrecuente.
El diagnóstico diferencial se plantea con las neoplasias hematológicas, en especial el mieloma múltiple, y menos frecuentemente con leucemia, linfoma, enfermedad de Paget y sarcomas óseos.
En general, frente a un paciente mayor de cuarenta años, con dolor óseo, se debe pensar como causa oncológica en el mieloma múltiple o el carcinoma metastásico; entre ellos, los más frecuentes son el de próstata y el de mama, cuando hay un tumor primario conocido; en caso contrario, se debe pensar en cáncer de riñón o pulmón.
Se debe realizar una buena anamnesis, preguntar por los antecedentes familiares y la existencia de neoplasia previa, y hacer un examen físico detallado, con examen de mama, de ganglios linfáticos, etc.
El estudio de laboratorio básico comprende hemograma, VHS, electrolitos, perfil bioquímico (calcemia, fosfemia), fosfatasas alcalinas y ácidas, antígeno carcinoembrionario, electroforesis de proteínas para descartar mieloma y antígeno prostático específico para descartar metástasis de próstata.
En cuanto a imágenes, en muchos casos, la radiografía de tórax demuestra la presencia de un nódulo pulmonar. El cintigrama óseo permite determinar si la lesión es única o múltiple, y el escáner de tórax, abdomen y pelvis también pueden aportar datos importantes.
La mamografía no se realiza de rutina, ya que el cáncer de mama no es una causa frecuente de MOD. Cuando este cáncer da metástasis al hueso, ya es de gran tamaño y es evidente en el examen físico.
Con todos estos elementos, se logra un diagnóstico causal en 80% a 85% de los pacientes que presentan metástasis ósea.
Estudio clínico en relación con la biopsia
Antes de efectuar biopsia, el equipo de tumores del Instituto Nacional del Cáncer realiza un estudio completo para tratar de establecer el diagnóstico, por varias razones:
O sea, el mejor diagnóstico preoperatorio se logra mediante el estudio de imágenes apropiadas y confiables, y el mejor diagnóstico patológico y quirúrgico se logra cuando la biopsia se apoya en el estudio preoperatorio; en este último caso, la estabilización de una fractura inminente se realiza en el mismo procedimiento.
La biopsia se indica con los siguientes objetivos:
Las MOD corresponden a 5%, aproximadamente, de los cánceres (0,5%-9%), o sea, tienen baja incidencia, pero el tumor primario suele ser de rápida diseminación, a pesar de ser de pequeño tamaño.
El diagnóstico del tumor primario se realiza por clínica, en 27% de los casos, y por autopsia, en 57%; en el 16% restante, se trata de un primario desconocido.
Es importante considerar que, cuando la enfermedad está diseminada, sólo se obtiene respuesta en un grupo limitado de enfermos, por lo que el estudio clínico se debe racionalizar y enfocar hacia los pacientes que se van a beneficiar con el tratamiento, recordando que el principal objetivo de éste es mejorar la calidad de vida.
El paciente que se va a someter a estudio debe tener algún tipo de sobrevida a corto plazo, o sea, es indispensable que haya alguna esperanza para él. Un paciente postrado, por ejemplo, no se beneficiará con el tratamiento.
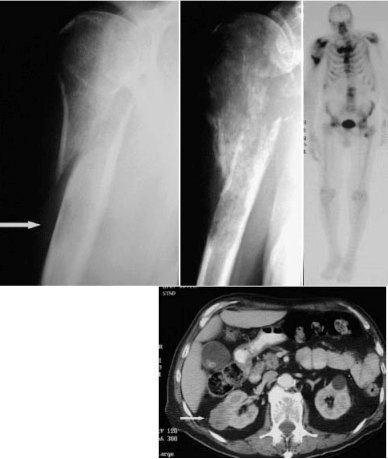
En la figura 2 se muestra el caso de un paciente con fractura de húmero que se inmovilizó con yeso. En el control se apreció un aumento de volumen, por lo que fue sometido a biopsia, la que señaló la presencia de una metástasis de carcinoma. El estudio posterior demostró compromiso vertebral y un carcinoma de células renales como tumor primario. Esta historia no es infrecuente.
Figura 2. Fractura en hueso patológico diagnosticada en segunda instancia.
El estudio inmuno e histopatológico de la biopsia es fundamental. El patólogo debe entregar la mayor cantidad posible de informaciones, ya que la radiografía de tórax, el cintigrama óseo, los marcadores tumorales y el test de hemorragias ocultas forman parte del estudio, pero es el informe patológico lo que va a orientar la decisión de realizar TC de abdomen, pelvis, torácico, ecografía, mamografía o endoscopía.
El estudio endoscópico digestivo no se realiza de rutina, porque en general los pacientes que presentan cánceres digestivos tienen sobrevida corta, cuando presentan metástasis óseas, y los estudios radiológicos de contraste se solicitan sólo en ciertos casos.
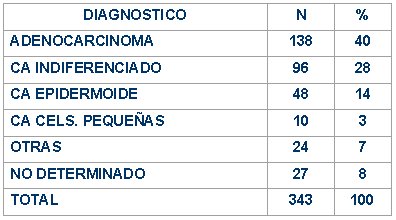
En la tabla III se puede ver que el adenocarcinoma es el cáncer más frecuente, seguido del carcinoma indiferenciado y el epidermoide. Otros tumores, como sarcoma, melanoma, sarcoma de partes blandas y linfoma, son infrecuentes.
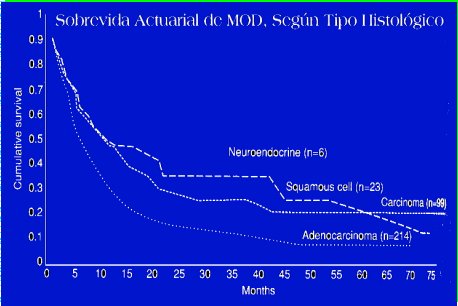
Según el tipo histológico, los adenocarcinomas presentan menos sobrevida, igual que los carcinomas epidermoides o los tumores neuroendocrinos (Figura 3).
Tabla III. Metástasis de origen desconocido. Anatomía patológica.
Figura 3. Sobrevida actuarial en MOD según tipo histológico.
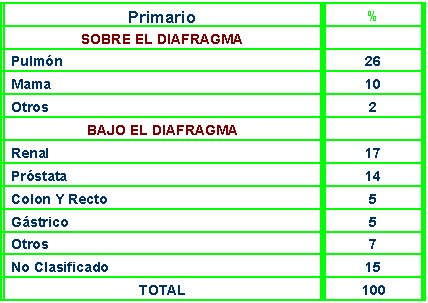
Cuando el primario está por encima del diafragma, la causa más frecuente de MOD es el cáncer pulmonar, seguido por el mamario; en cambio, cuando está por debajo del diafragma el primario más frecuente es el cáncer renal, seguido por el cáncer de próstata, colon y recto, gástrico y otros menos frecuentes (Nystrom JS y cols. Semin Onc. 4:53, 1977) (Tabla IV).
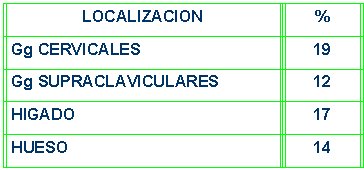
En relación con los sitios de diseminación de un primario desconocido, los más frecuentes son los ganglios cervicales, supraclaviculares, hepáticos y óseos, respectivamente (Tabla V).
Tabla IV. Distribución del primario según localización de MOD.
Tabla V. Sitios de diseminación de un primario desconocido.
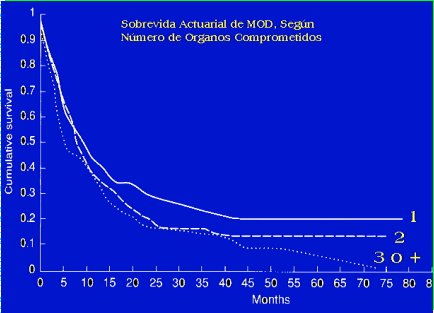
Cuando la metástasis es única, la sobrevida es mucho mejor e incluso puede haber esperanza de curación, la que, en algunos estudios, llega hasta 30%. En cambio, cuando hay dos o más órganos comprometidos la sobrevida disminuye en forma importante (Figura 4).
Como en todos los cánceres, a los fumadores corresponde un porcentaje importante de los casos.
Figura 4. Sobrevida actuarial de MOD según número de órganos comprometidos.
Alternativas de tratamiento disponibles
El cáncer de cabeza y cuello es susceptible de tratamiento locorregional con cirugía y radioterapia. Algunos tumores podrían curarse con terapia sistémica, como los de células germinales, la enfermedad de Hodgkin, el linfoma no Hodgkin y los tumores trofoblásticos, aunque éstos son de baja frecuencia entre los tumores desconocidos.
Se ha demostrado que el melanoma sólo responde a cirugía. Corresponde a 3% de los cánceres de piel, el primario no se detecta en menos de 2% de los casos y los sitios comprometidos son pulmón, tejido subcutáneo, encéfalo e hígado.
Algunos tumores responden bien a hormonoterapia y mejoran la calidad y el tiempo de sobrevida; entre ellos están el cáncer de próstata, mama y endometrio.
En otros casos, se dispone de una quimioterapia eficaz, es decir que se puede lograr una respuesta parcial con más de 50% de inhibición tumoral. Esto ocurre en el cáncer de mama y ovárico, en el cáncer pulmonar de células pequeñas y en el cáncer de cabeza y cuello, pero el paciente puede tener respuestas completas por un par de años y luego presentar una recidiva.
Los objetivos generales del tratamiento son mejorar la calidad de vida y aumentar el tiempo de sobrevida.
Los objetivos específicos son aliviar el dolor, disminuir las complicaciones y la probabilidad de nuevas metástasis, reducir la osteolisis y tratar la hipercalcemia y la fractura patológica.
Cirugía
Entre las intervenciones disponibles están la osteosíntesis compuesta, el reemplazo hemiarticular, la resección segmentaria, la criocirugía y la amputación
La cirugía contempla los siguientes principios y pasos:
La fijación profiláctica se realiza en los siguientes casos:
Radioterapia postoperatoria
Después de la cirugía se realiza radioterapia (RT), idealmente con equipos de alta energía, para evitar mayor daño en los tejidos intersticiales y óseos.
La RT tiene por objeto aliviar el dolor, mejorar la deambulación y detener el crecimiento tumoral.
La planificación del tratamiento es fundamental; considera el tipo de tumor, el compromiso de partes blandas, la extensión del tumor, la distribución que tiene la médula ósea en el organismo y la eficacia de la quimioterapia que se puede usar en forma simultánea.
En 80 a 90% de los casos, los pacientes sometidos a RT logran alivio efectivo del dolor. La mitad de los pacientes evolucionan sin dolor, posteriormente, pero el efecto no es inmediato; el inicio de la respuesta demora entre diez y quince días, la respuesta máxima se logra en dos a tres meses.
Cuando el paciente está en RT y refiere aumento del dolor, se debe pensar en fractura patológica y derivarlo a tratamiento quirúrgico. No hay diferencia en la respuesta según tipo histológico, pero los cánceres de próstata y mama responden mejor a largo plazo.
Irradiación hemicorporal
La técnica de irradiación hemicorporal se utiliza como alternativa en los casos de metástasis múltiples y sintomáticas.
Esta técnica logra alivio parcial, en 75% de los pacientes, y total en 20%. El control del dolor se consigue en alrededor de 48 horas con 60 a 80 centigrays (cgy) en monodosis.
Sólo se administra en pacientes que tienen una breve esperanza de sobrevida, porque las monodosis altas causan mayores complicaciones a largo plazo.
Radioisótopos sistémicos
Otra posibilidad de radioterapia es el uso de radioisótopos sistémicos. El yodo 131, que es el tratamiento estándar en casos de cáncer de tiroides, es muy eficaz, pero el fóforo 32 y el estroncio 59, que se utilizaron mucho en cáncer de próstata y mama, han quedado desplazados por el uso de bifosfonatos, porque aquellos isótopos pueden producir dolor y compresión medular debido al gran componente inflamatorio.
La RT altera la estructura ósea normal y su remodelación. La reosificación se puede ver cuando hay erradicación tumoral (15 % a 66 %) y ocurre con mayor frecuencia cuando se usan dosis de 250 a 300 cgy. Se obtendrían mejores resultados con fraccionamientos de 270 cgy en 15 fracciones ó 300 cgy en 10 fracciones. Las dosis únicas se considerarán en los casos de gran compromiso del estado general del paciente.
Después del tratamiento quirúrgico o la radioterapia, o ambos, algunos tumores primarios casi nunca se consolidan, como el cáncer pulmonar, el melanoma y el cáncer de colon. Otros se consolidan con mayor frecuencia, como el mieloma y el cáncer de mama y de riñón; en este último caso, alrededor de un tercio de ellos se consolidan si se usa radioterapia sola. Cuando se efectúa cirugía (fijación interna más polimetilmetacrilato) y radioterapia se obtiene un mejor resultado.
Las complicaciones de la radioterapia durante el tratamiento son: vómitos, diarrea y complicaciones hematológicas, como la neutropenia, que se presenta más bien en pacientes con metástasis de extremidad superior.
Hormonoterapia
Algunos tumores responden bastante bien a la hormonoterapia, como el cáncer de mama premenopáusico (se realiza ablación con radio y quimioterapia más pdn) y posmenopáusico, que se trata con tamoxifeno y aminoglutetimida, en cuyo caso la respuesta ósea se acerca a 30% y depende del nivel de receptores hormonales.
En cáncer de próstata hay distintos elementos para realizar el ataque hormonal al tumor, como la castración subalbugínea y la administración de etinilestradiol, flutamida y análogos de LHRH, que, en términos de eficacia, son más o menos similares. La diferencia está en el precio y en la comodidad del paciente; por ejemplo, los análogos de LHRH pueden costar entre 200 y 400 mil pesos mensuales.
Dos tercios de los pacientes con metástasis óseas responden con estos métodos y la terapia analgésica, con ellos, es bastante eficaz. En el caso del melanoma, hay respuestas hasta de 50%, pero las lesiones líticas persisten, a pesar del control de la enfermedad. También se utiliza la hormonoterapia en el cáncer pulmonar de células no pequeñas.
Quimioterapia
La quimioterapia (QT) se debe considerar como paliativa en estos enfermos, ya que afecta la arquitectura ósea.
En el cáncer de mama, la QT logra respuestas de alrededor de 40%. La droga más eficaz es la doxorrubicina, pero en general se usan asociaciones de ciclofosfamida y 5-fluoruracilo.
En los tumores de células germinales, la poliquimioterapia es muy eficaz, aunque no es frecuente el compromiso óseo en estos casos; si se presenta, lo hace asociado con un importante compromiso del estado general.
En el melanoma se logran respuestas en alrededor de 50% de los casos, pero, cuando se analiza la sobrevida, se ve que la QT y la inmunoterapia no la modifican. En estos casos, la cirugía se mantiene como el tratamiento más eficaz.
Inhibidores de la reabsorción ósea
Las metástasis blásticas o líticas aumentan la actividad osteoclástica del hueso; los inhibidores de la reabsorción ósea disminuyen la osteolisis total, protegen la producción ósea de los mediadores sistémicos de la reabsorción y disminuyen la frecuencia de nuevas metástasis.
Esto último es más bien teórico, porque no se ha logrado demostrar, pero sí está claro que se alivia el dolor y hay menos frecuencia de hipercalcemia y de fractura patológica.
En la actualidad, los fármacos siguientes se utilizan como inhibidores de la reabsorción ósea:
La radiografía no es buen método para evaluar la respuesta a tratamiento, porque no todas las lesiones se reosifican. El cintigrama óseo serviría si disminuyera la actividad, pero hay metástasis óseas tratadas con hormonoterapia que inicialmente presentan una buena respuesta y que, al disminuir la cantidad de tumor, empiezan a generar hueso nuevo, lo que en el cintigrama se ve como un empeoramiento en vez de una mejoría.
Los mejores métodos, por costo, sensibilidad y precocidad, son los bioquímicos: hidroxiprolina urinaria (mayor reabsorción o formación ósea), fosfatasas alcalinas, osteocalcina, calcio, relación calcio/creatinina y fosfatasas ácidas.
El uso de marcadores tumorales ayuda cuando existe el antecedente de un tumor con marcadores tumorales elevados, que disminuyen con el tratamiento.
Hipercalcemia
Es la complicación metabólica más frecuente en estos pacientes y tiene riesgo vital. Se presenta en aproximadamente 15 a 20 por 100.000 habitantes y es más frecuente en los cánceres de mama y mieloma (40%-50%).
Los síntomas son variados:
El tratamiento ambulatorio consiste en hidratación oral, dieta adecuada, fosfatos orales, corticoesteroides y antiinflamatorios no esteroidales.
En el paciente hospitalizado se efectúa hidratación intravenosa, medición de electrolitos plasmáticos, administración de calcitonina, corticoesteroides, bifosfonatos intravenosos, mitramicina, nitrato de galio, diálisis, etc.
Los criterios de hospitalización en hipercalcemia son la presencia de niveles mayores de 12 mg/dL o de deshidratación, obnubilación, presencia de íleo adinámico, insuficiencia renal y arritmia importante. También en caso de que el paciente esté solo o tenga mala asistencia.
Compresión de médula ósea
Presente en 5 % de las autopsias por cáncer, el estado neurológico inicial es el signo pronóstico más importante. Es más frecuente la compresión extradural que la intradural.
Clínicamente, se caracteriza por dolor localizado o irradiado, disfunción autonómica, retención urinaria, constipación, paresia, pérdida sensitiva (en especial la propiocepción), espasticidad y signo de Babinsky positivo.
La radiología es positiva en 75% de los casos. No hay diagnóstico histológico.
El tratamiento médico consiste en corticoides en dosis altas, más radioterapia, más cirugía. Puede haber progresión con la radioterapia o recurrencia post radioterapia.
Se observa recuperación en 40% a 60% de los pacientes ambulatorios previos, en 25% de los pacientes postrados y en 10% de los pacientes parapléjicos.
La cirugía se efectúa en 30 % de los pacientes ambulatorios, post tratamiento. Tiene 9% de mortalidad y 12% de los pacientes empeoran.
Resumen
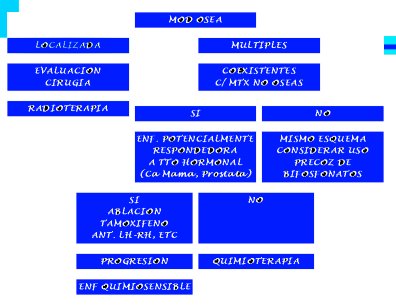
La figura 5 resume la conducta que se debe seguir frente a un paciente con una metástasis ósea de etiología desconocida. Si la metástasis está localizada, se debe hacer una evaluación y, si es necesario, ir a cirugía seguida de radioterapia.
Si las metástasis óseas son múltiples, se debe determinar si coexisten metástasis viscerales y, si es así, hay que evaluar las posibilidades de tratamiento. En cáncer de mama o de próstata, se puede administrar terapia hormonal; en otros se puede utilizar fármacos coadyuvantes, etc.
Si hay progresión, se debe utilizar quimioterapia si el tumor es quimiosensible. Si el tumor no responde a estos tratamientos (hormonoterapia, etc.), irá directamente a quimioterapia.
En los pacientes con metástasis óseas múltiples, que no tienen metástasis viscerales asociadas, se administran rápidamente los bifosfonatos.
Figura 5. Enfrentamiento de la MOD.
Otros conceptos que conviene recordar:
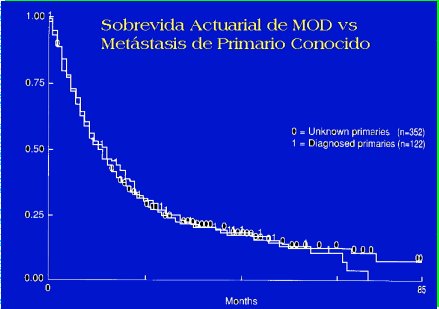
Si bien es cierto que la expectativa de sobrevida es mala, puede llegar a varios meses e incluso a años, por lo que se debe ofrecer algún tratamiento a los pacientes (Figura 6).
Figura 6. Sobrevida actuarial de la MOD comparada con la metástasis de tumor primario conocido.











 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el curso Lesiones Tumorales y Pseudotumorales del Sistema Musculoesquelético, organizado en Santiago por el Departamento de Ortopedia y Traumatología de la Universidad de Chile del 12 al 16 de mayo de 2003.
Director: Dr. Miguel Sepulveda H.
 Expositor:
Cristian Trujillo[1]
Expositor:
Cristian Trujillo[1]

Citación: Trujillo C. Bone metastases: surgical management of tumor of unknown primary location. Medwave 2004 Mar;4(2):e3279 doi: 10.5867/medwave.2004.02.3279
Fecha de publicación: 1/3/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión